Российские нанотехнологии, 2024, T. 19, № 2, стр. 169-177
3D-моделирование клеток дыхательной системы человека для исследования прооксидантных, проапоптотических и профиброгенных эффектов углеродных нанотрубок
Л. М. Фатхутдинова 1, *, Г. Ф. Габидинова 1, Г. А. Тимербулатова 1, Е. В. Валеева 1, И. В. Косыева 1, Е. В. Убейкина 1, А. А. Саягфарова 1
1 Казанский государственный медицинский университет
Казань, Россия
* E-mail: liliya.fatkhutdinova@kazangmu.ru
Поступила в редакцию 10.11.2023
После доработки 04.12.2023
Принята к публикации 07.12.2023
Аннотация
При оценке токсичности широкое распространение получила концепция “3Rs”, или концепция “меньше животных–меньше болезненных процедур–применение альтернативных методов”. Клеточные 3D-модели являются дальнейшим развитием традиционных двумерных моделей. Разработаны клеточные 3D-модели дыхательной системы человека, состоящие из клеток бронхиального эпителия BEAS-2B и фибробластов легких MRC5-SV40. Результаты исследования токсичности углеродных нанотрубок (УНТ) на разработанных 3D-моделях продемонстрировали отсутствие проапоптотических и профиброгенных эффектов на концентрациях, соответствующих референтному уровню воздействия. Однако начиная с концентрации УНТ 20 мкг/мл, значительно превышающей концентрации, соответствующие референтному уровню воздействия, в клеточных моделях обнаружены признаки окислительного стресса. 3D-сокультуры демонстрировали меньшую чувствительность к УНТ по сравнению с 3D-монокультурами. Клеточные 3D-модели могут быть рекомендованы в качестве более объективного скринингового метода для оценки токсичности УНТ при переходе от традиционных экспериментов in vitro к исследованиям in vivo.
ВВЕДЕНИЕ
Внедрение наноматериалов в различные отрасли промышленности и медицины представляет собой актуальную и перспективную задачу, однако для обеспечения успешного и безопасного использования необходимо проводить всестороннюю оценку воздействия на окружающую среду и здоровье человека. Углеродные нанотрубки (УНТ), обладающие уникальными физико-химическими свойствами, являются объектом повышенного интереса исследователей и индустрии. Эти материалы имеют хорошие перспективы для применения в различных областях, включая производство композитных материалов, строительство, электронику и нанобиотехнологии [1–3]. Одна из ключевых проблем гигиенического сопровождения производственных процессов, связанных с синтезом и применением УНТ, – возможное токсическое воздействие на клетки дыхательной системы, так как ингаляционный путь поступления в данных обстоятельствах является основным.
Современные стандарты тестирования наночастиц (НЧ) для оценки острой и хронической токсичности и потенциальной опасности для человека основаны на исследованиях in vivo, требующих значительных ресурсов и позволяющих провести лишь ограниченное количество исследований за единицу времени. В настоящее время при оценке токсичности широкое распространение получила концепция “3Rs” (Refinement, Reduction and Replacement), или концепция “меньше животных–меньше болезненных процедур–применение альтернативных методов” [4], предполагающая применение культур клеток [5, 6]. Результаты, полученные с использованием 2D-систем in vitro, имеют ограничения при экстраполяции на условия in vivo. Клеточные 3D-модели являются развитием 2D-моделей, обладая рядом существенных преимуществ.
В [7–13] утверждалось, что по сравнению с обычными 2D-системами моделирования и in vivo-моделями на животных 3D-платформы in vitro более точно воспроизводят физиологию человека и могут рассматриваться в качестве перспективной эффективной стратегии в многоуровневой системе тестирования токсичности наноматериалов [4, 14–16]. Системы 3D-культивирования более близки к архитектурным и функциональным свойствам тканей in vivo. В них клетки подвергаются воздействию различных концентраций питательных веществ, факторов роста, кислорода или цитотоксических агентов в зависимости от локализации и коммуникации клеток. 3D-архитектура, особенно при сокультивировании разных типов клеток, изменяет физиологические, биохимические и биомеханические свойства клеточной системы, что может влиять на рост и выживание клеток, дифференцировку и морфогенез, миграцию клеток, свойства эпителиально-мезенхимального перехода, механические реакции и резистентность к терапии [7–13].
Разработка и тестирование 3D-моделей дыхательных путей человека, восполняющих пробел между традиционными клеточными культурами in vitro и лабораторными животными, развиваются с начала 2000-х гг. [7–9, 14]. В ранних протоколах для создания клеточных моно- и 3D-сокультур использовались дендритные клетки, макрофаги и эпителиальные клетки дыхательных путей человека. Коммерческая 3D-культура EpiAirwayTM (MatTek Corporation, США) состоит из клеток бронхиального эпителия и фибробластов человека [17], другая коммерческая система MucilAirTM (Epithelix Sàrl, Швейцария) разработана на основе первичных бронхиальных клеток и имеет вариации сокультур с фибробластами и макрофагами [18]. Обе коммерческие модели дыхательных путей культивируются на разделе границ воздух–жидкость. Также известен ряд более современных лабораторных (“in home”) 3D-систем [15, 16, 19].
В последнее десятилетие клеточные 3D-модели стали тестироваться и для изучения токсических свойств углеродсодержащих наноматериалов. В [20] использовали сокультуру бронхиальных эпителиальных клеток человека 16HBE14o-, макрофагов и дендритных клеток, полученных из моноцитов крови человека, для оценки токсических эффектов одностенных и многостенных углеродных нанотрубок (ОУНТ, МУНТ). В [21] для изучения токсичности МУНТ применяли совместную культуру клеток человека, состоявшую из клеток альвеолярного эпителия легких А549 в сочетании с дендритными клетками и макрофагами, полученными из периферической крови человека. В [15] использовали 3D-монокультуру фибробластов человека WI38-VA13, которую подвергали воздействию шести типов УНТ и кристаллического диоксида кремния. В [16] получили 3D-модель ткани легких человека при сокультивировании легочных фибробластов IMR-90, эпителиальных клеток BEAS-2B и дифференцированных до макрофагов клеток TNP-1, на которой провели изучение токсичности сажи, МУНТ и асбеста. Похожая модель, состоявшая из трех клеточных линий человека – альвеолярных эпителиальных клеток A549, фибробластов MRC5 и дифференцированных до макрофагов клеток THP-1, была разработана в [19] для изучения токсичности двух типов МУНТ – MУНТ-7 (MITSUI & CO., LTD, Япония) и Nanocyl-7000 (Nanocyl SA, Бельгия).
Основными эффектами УНТ, которые тестировались на клеточных 3D-моделях, были цитотоксичность [14, 19–21], провоспалительные [16, 19, 21] и профибротические [15, 16, 19] реакции, в некоторых случаях – окислительный стресс [20, 21]. В доступной нам литературе практически отсутствуют исследования по изучению на 3D-моделях маркеров апоптоза как одного из факторов инициации повреждения клеточной ДНК, а также генотоксичности УНТ. В [22] отмечено, что в отличие от моделей кожи, достигших продвинутого уровня валидации после более 10 лет исследований, изучение генотоксичности на основе 3D-моделей дыхательных путей является многообещающим, но находится на ранней стадии разработки.
Цель настоящего исследования – разработка 3D-моделей клеток дыхательной системы человека для изучения прооксидантных, проапоптотических и профиброгенных эффектов как потенциальных факторов инициации повреждения клеточной ДНК при экспозиции трех типов УНТ российского производства.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве клеточных линий для 3D-культивирования были выбраны клетки бронхиального эпителия BEAS-2B (Cell Applications, Inc., США) и фибробласты легких человека MRC5-SV40 (клеточная культура предоставлена Б.В. Черняком, НИИ ФХБ им. А.Н. Белозерского МГУ).
Клетки подвергали воздействию очищенных и неочищенных от металлических примесей УНТ российского производства: ОУНТ TUBALLTM (группа-компания OCSiAl, г. Новосибирск) и МУНТ Таунит-М (ООО “НаноТехЦентр”, г. Тамбов). Исследуемые УНТ различались по физико-химическим характеристикам. Два типа ОУНТ TUBALL™ различались между собой наличием металлических включений: содержание железа 14 ± 1% для неочищенных ОУНТ и менее 1% у очищенных ОУНТ; в остальном физико-химические свойства ОУНТ были схожи: длина >5 мкм, средний диаметр ~1.6 ± 0.4 нм. У МУНТ длина составила >2 мкм, средний диаметр ~8–15 нм, содержание кобальта менее 5%. Суспензии УНТ готовили по ранее описанному протоколу [23]. Исследовали четыре концентрации УНТ (50, 20, 0.03, 0.0006 мкг/мл), концентрация УНТ 0.0006 мкг/мл, выбранная для исследования, соответствовала рекомендуемому референтному уровню воздействия [24].
Изучение механизмов генотоксичности углеродных нанотрубок проводили в трех 3D-моделях: моноклеточной сфероидной 3D-модели клеток бронхиального эпителия BEAS-2B, моноклеточной сфероидной 3D-модели фибробластов легких MRC5-SV40 и совместной сфероидной 3D-модели клеток бронхиального эпителия и фибробластов легких BEAS-2B+MRC5-SV40.
Культивирование клеточных линий проводили в СО2-инкубаторе (LAMSYSTEMS ИЛМ-170, Миасс, Россия) при стандартных условиях: 37°С, 5% CO2, постоянная влажность. Монослойные клеточные культуры эпителиальных клеток и фибробластов культивировали в чашках Петри с использованием культуральной среды DMEM (ПанЭко, Россия) с добавлением 10% эмбриональной телячьей сыворотки (BioSera, Франция) и готовой смеси антибиотиков пенициллина (25 000 ЕД) и стрептомицина (25 000 мкг) (ПанЭко, Россия). По достижении 80–90% конфлюэнтности клеточного монослоя на третьем–пятом пассаже проводили пересев клеток; кондиционированную культуральную среду полностью отбирали пипеткой, промывали чашку 4 мл фосфатно-солевого раствора Дульбекко (ПанЭко, Россия) и трипсинизировали из расчета 1 мл раствора трипсина-ЭДТА 0.25% (ПанЭко, Россия) на чашку в течение 3–5 мин при 37°С. Далее добавляли культуральную среду для нейтрализации ферментативной реакции трипсина-ЭДТА и проводили автоматический подсчет жизнеспособных клеток после окрашивания трипановым синим (Bio-Rad, США) с использованием счетчика клеток (C100, RWD Life Science, Китай). Для дальнейших экспериментов использовали образцы клеток с жизнеспособностью не менее 70%.
Для формирования клеточных 3D-культур был выбран способ культивирования сфероидов с применением планшетов с поверхностью с низкой клеточной адгезией. Принцип формирования сфероидов основан на тенденции адгерентных клеток к агрегации. Сфероиды культивировали с использованием 96-луночных планшетов с круглым дном и поверхностью с низкоадгезионными свойствами (Cell Floater, SPL Lifesciences, Корея), культуральной среды DMEM с добавлением 10% эмбриональной телячьей сыворотки. 96-луночные планшеты дают возможность проводить высокопроизводительный анализ, например, с помощью планшетных ридеров, что позволяет использовать способ для скрининговых токсикологических тестов in vitro. Визуализировали сфероиды с помощью конфокального лазерного микроскопа Zeiss LSM 780 (Zeiss, Германия) и окрашивания с использованием набора реактивов “LIVE/DEAD™ BacLight™” (Thermo Fisher Scientific, США), при этом живые клетки приобрели зеленое, а мертвые – красное свечение.
В моноклеточных и совместной 3D-моделях, подвергшихся воздействию всех типов исследуемых УНТ в концентрации 0.0006 мкг/мл в течение 72 ч, оценивали уровень мРНК генов BAX, BCL2, P53 и TGFB1. Предварительно все сфероиды из 96-луночного планшета собирали в центрифужную пробирку, центрифугировали при 1000 об./мин в течение 3 мин, из полученного осадка выделяли суммарную РНК с использованием реагента TRIzolTM (Invitrogen, США). Хранили полученные образцы мРНК при –20°C. Качество и количество выделенной РНК оценивали спектрофотометрическим методом на приборе Nanodrop Lite (ThermoFisher, США) с расчетом соотношения оптических плотностей при длинах волн 260 и 280 нм. Для дальнейшего анализа использовали образцы, для которых соотношение A260/A280 находилось в рекомендуемых пределах 1.8–2.2 [25]. Синтез кДНК проводили с использованием набора MMLV RT kit (Евроген, Россия) согласно инструкции фирмы-производителя. Уровень мРНК оценивали методом ПЦР в реальном времени.
В качестве референсного гена был выбран ген GAPDH (прямой 5'-GACCACAGTCCATGCCATCA-3', обратный 5'-CCCGGAGGAAGTCCAGTGTC-3'). Использовали последовательности олигонуклеотидных праймеров для исследуемых генов, которые синтезировала компания “Евроген” (Россия): BAX (прямой 5'- GGGTGGTTGCCCTTTTCTACT-3', обратный 5'-CCCGGAGGAAGTCCAGTGTC-3'), BCL2 (прямой 5'-ATGGGGTGAACTGGGGGATTG-3', обратный 5'-TTCCGAATTTGTTTGGGGCAGGTC-3'), P53 (прямой 5'-GACGGTGACACGCTTCCCTGGATT-3', 5'-GGGAACAAGAAGTGGAGAATGTCA-3'), TGFB1 (прямой 5'-GCTGAGGTATCGCCAGGAAT-3', обратный 5'-TACCTGAACCCGTGTTGCTC-3'). Амплификацию кДНК проводили с использованием готовой реакционной смеси для ПЦР “5x qPCRmix-HS SYBR” (Евроген, Россия) и термоциклера CXF96 (BioRad, США) при условиях первой денатурации – 96°C в течение 3 мин; далее 40 циклов, включающих в себя денатурацию при 96°C в течение 10 с, отжиг и визуализацию согласно подобранным температурам отжига для каждого отдельного праймера – 56°C для BAX, BCL2, P53, 55.5°C для TGFB1, 63°C для GAPDH, и мелтинг для оценки пройденной реакции. Каждый образец исследовали в трех повторах. Расчет оценки уровня мРНК генов проводили методом 2–∆∆Ct [26] относительно контроля для каждой клеточной линии с использованием формулы
(1)
${\text{ОУЭГ}} = {{2}^{{ - \left( {\left( {С{{t}_{{{\text{ГИИО}}}}} - C{{t}_{{{\text{GAPDH\;ИО}}}}}} \right) - \left( {C{{t}_{{{\text{ГИКО}}}}} - C{{t}_{{{\text{GAPDH\;КО}}}}}} \right)} \right)}}},$Для количественной оценки активных форм кислорода (АФК) в образцах живых клеток использовали набор для анализа АФК “DCFDA – Cellular Reactive Oxygen Species Assay Kit” (Abcam, Великобритания). Исследовали четыре концентрации УНТ (50, 20, 0.03, 0.0006 мкг/мл) в трех типах клеточных 3D-моделей после 72-часовой экспозиции. В соответствии с инструкцией производителя указанного выше аналитического набора для проведения положительного контроля из раствора трет-бутилгидропероксида в концентрации 55 ммоль получали раствор в концентрации 250 мкмоль и наслаивали на сфероиды в количестве 100 мкл на лунку за 4 ч до измерения уровня АФК. В качестве отрицательного контроля использовали клетки без воздействия. Сфероиды культивировали в 96-луночном планшете, перед измерением уровня АФК наслаивали 100 мкл раствора DCFDA в концентрации 50 мкмоль, инкубировали 40 мин при 37°C. Флуоресценцию измеряли при 485/535 нм на микропланшетном ридере Varioskan LUX (ThermoFisher Scientific, Германия). Уровень окислительного стресса выражали в виде кратного увеличения относительно отрицательного контроля.
Полученные данные обрабатывали с помощью программы Microsoft Excel 2016 и пакета R [26]. Для оценки достоверности различий изучаемых выборок применяли t-критерий Стьюдента. При р < 0.05 различия считали статистически значимыми, при p < 0.1 результат рассматривали как тенденцию. Полученные результаты представлены в виде среднего арифметического значения ± стандартное отклонение.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для разработки протокола культивирования моноклеточных 3D-моделей клеток бронхиального эпителия и фибробластов легких с подбором подходящей засевной концентрации был проведен ряд экспериментов, в ходе которых в лунку планшета добавляли 100 мкл клеточной суспензии в среде DMEM, содержащей 0.005 × 105, 0.01 × × 105, 0.02 × 105, 0.03 × 105, 0.04 × 105, 0.05 × 105 клеток на лунку (500, 1000, 2000, 3000, 4000, 5000 клеток на лунку). Оценивали время формирования сфероидов, их морфологические свойства, продолжительность их жизни до формирования некротического ядра. Одним из важных условий культивирования сфероидных клеточных моделей является подбор засевной концентрации, при которой клетки смогут расти достаточно долго для проведения токсикологических экспериментов in vitro без появления некротического ядра из-за гипоксии и недостатка нутриентов для клеток в центре сфероида. В связи с этим изучали изменения морфологии сфероидов во временном промежутке до 120 ч культивирования, что является достаточной продолжительностью жизни клеточной модели, используемой для токсикологических экспериментов, при условии добавления изучаемых веществ на первый–второй день культивирования и анализа экспозиции до 72 ч. При засевной концентрации 3000 клеток на лунку клеточные культуры BEAS-2B и MRC5-SV40 через 24 ч культивирования формируют подобные сфероиду скопления клеток, контакты между которыми уплотняются уже к 48 ч (рис. 1, 2).
Рис. 1.
Конфокальная микроскопия моноклеточного сфероида BEAS-2B в засевной концентрации 3000 клеток на лунку через 48 ч культивирования.
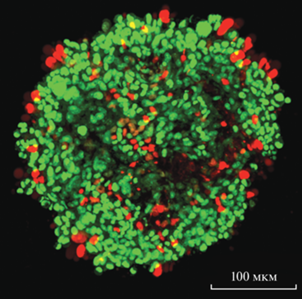
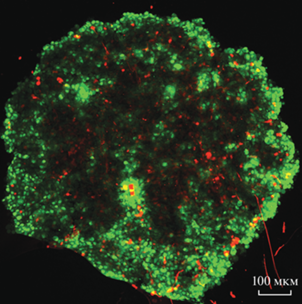
Рис. 2.
Конфокальная микроскопия моноклеточного сфероида MRC5-SV40 в засевной концентрации 3000 клеток на лунку через 48 ч культивирования.
На следующем этапе была проведена разработка совместной 3D-культуры, состоящей из двух клеточных линий BEAS-2B+MRC5-SV40. Для первичного подбора засевной концентрации были выбраны условия с учетом полученных при разработке моноклеточных сфероидов результатов: засевные концентрации – 0.02 × 105, 0.03 × × 105, 0.04 × 105, 0.05 × 105 клеток (2000, 3000, 4000, 5000 клеток на лунку) на 100 мкл культуральной среды DMEM с добавлением 10% эмбриональной телячьей сыворотки, соотношение клеток BEAS-2B и MRC5-SV40 – 1 : 1, культивирование в инкубаторе при условиях 37°С, 5% CO2 и постоянной влажности. Жизнеспособность сфероидов оценивали по количеству живых и мертвых клеток при дифференциальном окрашивании с использованием конфокальной микроскопии через 72 ч культивирования. Результаты показали, что засевная концентрация 5000 клеток на лунку не подходит для поддержания жизнеспособности клеток в совместной сфероидной культуре. При меньшей засевной концентрации, равной 2000 клеток на лунку, процент жизнеспособных клеток оказался выше. По-видимому, изменение соотношения клеток бронхиального эпителия и фибробластов в совместной культуре может улучшить свойства сфероида. В следующем эксперименте была выбрана засевная концентрация в 3000 клеток на лунку и различные соотношения выбранных клеток BEAS-2B и MRC5-SV40: 1 : 5, 1 : 2, 1 : 1, 2 : 1, 5 : 1 соответственно. При преобладании в лунке клеток бронхиального эпителия BEAS-2B по сравнению с фибробластами MRC5-SV40 наблюдали снижение жизнеспособности клеток и образование некротического ядра через 72 ч культивирования. Однако при изменении соотношения клеток в сторону преобладания фибробластов MRC5-SV40 такой картины не наблюдалось. При изменении соотношения клеток BEAS-2B и MRC5-SV40 в сторону уменьшения количества клеток бронхиального эпителия в совместной сфероидной культуре картина практически не менялась.
Таким образом, подходящими условиями для культивирования сфероидов двух клеточных культур BEAS-2B и MRC5-SV40 в 96-луночных планшетах с поверхностью с низкоадгезионными свойствами являются: засевная концентрация – 3000 клеток на 100 мкл культуральной среды DMEM с добавлением 10% эмбриональной телячьей сыворотки, соотношение клеток – 1 : 2 (1000 клеток BEAS-2B и 2000 клеток MRC5-SV40), культивирование в инкубаторе при условиях 37°С, 5% CO2 и постоянной влажности (рис. 3). При проведении токсикологических экспериментов добавление изучаемых веществ или материалов может быть осуществлено на первый–второй день культивирования со временем экспозиции до 72 ч.
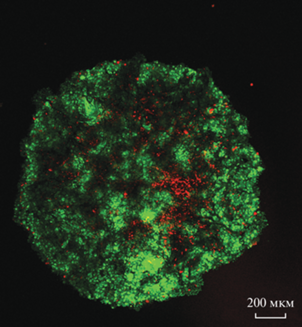
Рис. 3.
Конфокальная микроскопия сфероидов совместной клеточной культуры BEAS-2B и MRC5-SV40 через 72 ч культивирования в засевной концентрации 3000 клеток в соотношении 1 : 2.
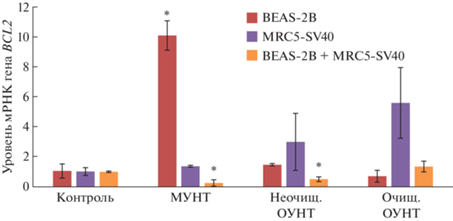
В 3D-монокультуре клеток бронхиального эпителия BEAS-2B, подвергшихся воздействию всех исследуемых УНТ, уровни экспрессии генов P53 и BAX по сравнению с контролем не повышались (рис. 4, 5). При этом после экспозиции с МУНТ в концентрации 0.0006 мкг/мл наблюдалось повышение экспрессии антиапоптотического гена BCL2 (рис. 6). В 3D-монокультуре легочных фибробластов MRC5-SV40, инкубированных в течение 72 ч с 0.0006 мкг/мл очищенных ОУНТ, относительный уровень экспрессии гена P53 был статистически значимо выше, чем в контроле (рис. 4), что можно рассматривать как развитие проапоптотического эффекта при низких концентрациях, соответствующих рекомендуемому референтному уровню [28]; при этом экспрессия гена BAX не изменялась и наблюдалась тенденция к повышению уровня экспрессии антиапоптотического гена BCL2 (рис. 5, 6). Однако в 3D-сокультуре клеток бронхиального эпителия BEAS-2B и легочных фибробластов MRC5-SV40 признаков апоптоза при экспозиции к каждому из изучавшихся типов УНТ обнаружено не было (рис. 4–6). Таким образом, результаты, полученные с применением 3D-сокультуры клеток бронхиального эпителия BEAS-2B и легочных фибробластов MRC5-SV40, не подтверждают данные, полученные с применением 2D-культур [29] и 3D-монокультур в отношении проапоптотических эффектов при низких дозах.
Рис. 4.
Относительный уровень экспрессии гена P53 в 3D-клетках BEAS-2B, MRC5-SV40 и BEAS-2B+MRC5-SV40 после 72-часовой экспозиции с исследуемыми материалами: среднее значение ± стандартное отклонение. * – p < 0.05 в сравнении с контролем.
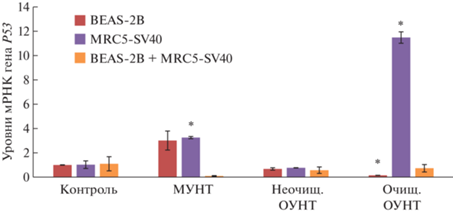
Рис. 5.
Относительный уровень экспрессии гена BAX в 3D-клетках BEAS-2B, MRC5-SV40 и BEAS-2B+MRC5-SV40 после 72-часовой экспозиции с исследуемыми материалами: среднее значение ± стандартное отклонение. * – p < 0.05 в сравнении с контролем.
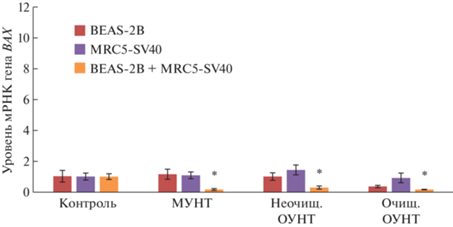
Рис. 6.
Относительный уровень экспрессии гена BCL2 в 3D клетках BEAS-2B, MRC5-SV40 и BEAS-2B+MRC5-SV40 после 72-часовой экспозиции с исследуемыми материалами: среднее значение ± стандартное отклонение. * – p < 0.05 в сравнении с контролем.
Аналогично в клеточных 3D-системах (как в монокультурах, так и в сокультуре) относительный уровень экспрессии гена TGFB1 при воздействии всех типов УНТ от контроля не отличался (рис. 7). рис. 7, 8
Рис. 7.
Относительный уровень экспрессии гена TGFB1 в 3D-клетках BEAS-2B, MRC5-SV40 и BEAS-2B+MRC5-SV40 после 72-часовой экспозиции с исследуемыми материалами: среднее значение ± стандартное отклонение. * – p < 0.05 в сравнении с контролем.
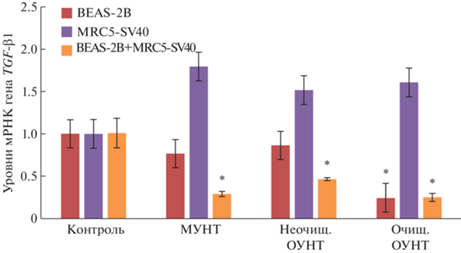
Рис. 8.
Уровень АФК (по данным теста DCFDA) после 72-часовой экспозиции с исследуемыми материалами в cфероидных культурах: а – BEAS-2B, б – MRC5-SV40, в – BEAS-2B + MRC5-SV40. * – p < 0.05 по сравнению с контролем.
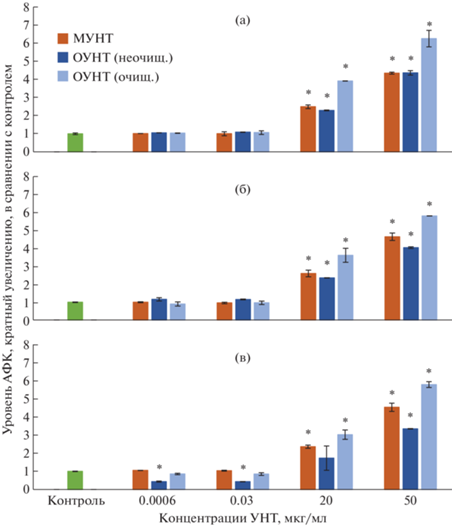
Тем не менее клеточные 3D-системы показали высокую чувствительность в отношении прооксидантных эффектов УНТ. Уровень АФК значимо повышался по сравнению с контролем практически для всех типов изучавшихся УНТ начиная с концентрации 20 мкг/мл (рис. 8). В 2D-культурах клеток бронхиального эпителия BEAS-2B и легочных фибробластов MRC5-SV40 статистически значимое повышение АФК также происходило начиная с 20 мкг/мл [29].
Ранее были описаны более выраженные цитотоксические, провоспалительные и профибротические эффекты в клеточных 2D-системах по сравнению с 3D-системами. В [14] впервые показано, что ОУНТ не оказывают токсического действия на клеточную 3D-модель моноцитов человека THP-1 после 24-часовой экспозиции. Напротив, в клеточной 2D-культуре ОУНТ проявили значительную цитотоксичность, а также повысили уровни секреции цитокинов IL-6 и TNF-α. И в [21] в 3D-сокультуре клеток альвеолярного эпителия A549 и двух типов иммунных клеток (дендритные клетки и макрофаги) не выявили цитотоксичности или изменений в морфологии клеток, а также значительного увеличения провоспалительных маркеров при воздействии МУНТ. В [20] показано отсутствие цитотоксичности в ответ на воздействие МУНТ и ОУНТ как в 2D-культурах бронхиальных эпителиальных клеток 16HBE14o-, макрофагов и дендритных клеток, так и в 3D-сокультуре этих клеток. Во всех типах исследованных in vitro систем наблюдалось статистически значимое дозозависимое увеличение выработки фактора некроза опухоли TNF-α после воздействия УНТ в концентрациях до 0.02 мг/мл, но для 3D-сокультуры эффект был менее выражен, чем для 2D-монокультур тех же клеток. Кроме того, в 3D-сокультуре был отмечен значительно более высокий, чем в 2D-монокультурах, уровень активации антиоксидантной защиты, оцениваемой по содержанию восстановленного глутатиона, при экспозиции как с ОУНТ, так и МУНТ в диапазоне концентраций 0.005–0.02 мг/мл. Аналогично в [19] на сокультуре альвеолярных эпителиальных клеток A549, фибробластов MRC5-SV40 и макрофагов, дифференцированных из THP-1, подвергшейся воздействию двух типов МУНТ на границе раздела воздух–жидкость с использованием системы VITROCELL® Cloud с учетом реалистичных производственных доз, выявили только начало провоспалительной реакции, но не цитотоксические эффекты или явную профибротическую реакцию. Тем не менее в [16] показано, что МУНТ-7 (MITSUI & CO., LTD, Япония) вызывают высвобождение воспалительных и профибротических медиаторов, а также гистопатологические изменения в 3D-модели легких. Разработанная в настоящем исследовании клеточная 3D-система проявила достаточно высокую чувствительность к прооксидантным эффектам УНТ. Аналогичная тенденция, хотя и статистически незначимая, была отмечена [21] – в клеточной 3D-системе, неоднократно подвергавшейся воздействию МУНТ в течение трех дней, показано снижение уровня глутатиона. Необходимо обратить внимание на возможность использования монокультуры фибробластов человека для изучения отдельных аспектов фиброгенной токсичности. В настоящем исследовании обнаружили проапоптотическую реакцию 3D-монокультуры легочных фибробластов. В [15] было показано, что только 3D-монокультура фибробластов человека WI38-VA13 позволила увидеть кластеризацию миофибробластов, отложение и перестройку коллагена, деление клеток и сокращение матрикса в ответ на экспозицию с УНТ, т.е. обнаружить процессы, критически важные для фиброза in vivo. Отметим, что в большинстве упомянутых исследований [15, 16, 19–21] использовались концентрации значительно выше, чем в данной работе.
ЗАКЛЮЧЕНИЕ
Разработаны 3D-модели клеток дыхательной системы человека, включающие в себя моноклеточную сфероидную 3D-модель клеток бронхиального эпителия BEAS-2B, моноклеточную сфероидную 3D-модель фибробластов легких MRC5-SV40 и совместную сфероидную 3D-модель клеток бронхиального эпителия BEAS-2B и фибробластов легких MRC5-SV40.
Полученные данные свидетельствуют о том, что традиционные клеточные 2D-модели могут демонстрировать заниженные или завышенные оценки токсичности материалов. Результаты исследования токсичности УНТ на разработанных 3D-моделях продемонстрировали отсутствие проапоптотических и профиброгенных эффектов при концентрациях, соответствующих референтному уровню воздействия. Однако начиная с концентрации УНТ 20 мкг/мл, значительно превышающей концентрации, соответствующие референтному уровню воздействия, в клеточных моделях были обнаружены признаки окислительного стресса. 3D-сокультуры демонстрировали меньшую чувствительность к УНТ по сравнению с 3D-монокультурами. Отметим, что в некоторых случаях при работе с УНТ не исключено наличие концентраций УНТ в воздухе рабочей зоны, превышающих рекомендуемый уровень воздействия, что диктует необходимость изучения потенциальных факторов инициации повреждения клеточной ДНК в широком диапазоне концентраций УНТ.
Клеточные 3D-модели могут быть рекомендованы в качестве более объективного скринингового метода для оценки токсичности УНТ при переходе от традиционных экспериментов in vitro к исследованиям in vivo.
Авторы выражают благодарность Междисциплинарному центру аналитической микроскопии Казанского федерального университета за помощь в проведении исследований.
Исследование выполнено при поддержке Российского научного фонда (грант № 22-25-00512, https://rscf.ru/project/22-25-00512/).
Список литературы
Eatemadi A., Daraee H., Karimkhanloo H. et al. // Nanoscale Res. Lett. 2014. V. 9. № 1. P. 393. https://doi.org/10.1186/1556-276X-9-393
Nurazzi N.M., Asyraf M.R.M., Khalina A. et al. // Polymers (Basel). 2021. V. 13. № 7. P. 1047. https://doi.org/10.3390/polym13071047
Liu Z., Tabakman S., Welsher K., Dai H. // Nano Res. 2009. V. 2. № 2. P. 85. https://doi.org/10.1007/s12274-009-9009-8
NANoREG. Grant Agreement № 310584. Deliverable D 2.06. Validated protocols for test item preparation for key in vitro and ecotoxicity studies. Actual submission date: 24.03.2016.
Chetyrkina M.R., Fedorov F.S., Nasibulin A.G. // RSC Adv. 2022. V. 12. № 25. P. 16235. https://doi.org/10.1039/d2ra02519a
Макарова М.Н., Макаров В.Г. // Лабораторные животные для научных исследований. 2022. № 1. С. 52. https://doi.org/10.29296/2618723X-2022-01-07
Rothen-Rutishauser B.M., Kiama S.G., Gehr P. // Am. J. Respir. Cell. Mol. Biol. 2005. V. 32. № 4. P. 281. https://doi.org/10.1165/rcmb.2004-0187OC
Rothen-Rutishauser B., Mueller L., Blank F. et al. // ALTEX. 2008. V. 25. № 3. P. 191. PMID: https://doi.org/10.14573/altex.2008.3.19118841315
Lehmann A., Brandenberger C., Blank F. et al. Methods in bioengineering: Alternative technologies to animal testing. Artech House, 2010. P. 239.
Suarez-Martinez E., Suazo-Sanchez I., Celis-Romero M. et al. // Cell Biosci. 2022. V. 12. P. 39. https://doi.org/10.1186/s13578-022-00775-w
Daunys S., Janonienė A., Januškevičienė I. et al. // Adv. Exp. Med. Biol. 2021. V. 1295. P. 243. https://doi.org/10.1007/978-3-030-58174-9_11
de Dios-Figueroa G.T., Aguilera-Marquez Jd.R., Camacho-Villegas T.A., Lugo-Fabres P.H. // Biomedicines. 2021. V. 9. № 6. P. 602. https://doi.org/10.3390/biomedicines9060602
Kronemberger G.S., Carneiro F.A., Rezende D.F., Baptista L.S. // Artif Organs. 2021. V. 45. № 6. P. 548. https://doi.org/10.1111/aor.13880
Movia D., Prina-Mello A., Bazou D. et al. // ACS Nano. 2011. V. 5. № 11. P. 9278. https://doi.org/10.1021/nn203659m
Hindman B., Ma Q. // Arch Toxicol. 2018. V. 92. P. 11. P. 3291. https://doi.org/10.1007/s00204-018-2306-9
Kabadi P.K., Rodd A.L., Simmons A.E. et al. // Part Fibre Toxicol. 2019. V. 16. № 1. P. 15. https://doi.org/10.1186/s12989-019-0298-0
EpiAirway 3D in vitro Microtissues. MatTek Life Sciences. https: //www.mattek.com/mattekproduct/epiairway/
MucilAir™ (MA): In vitro 3D human upper airway epithelium. https: //www.epithelix.com/products/mucilair
Barosova H., Karakocak B.B., Septiadi D. et al. // Int. J. Mol. Sci. 2020. V. 21. № 15. P. 5335. https://doi.org/10.3390/ijms21155335
Clift M.J., Endes C., Vanhecke D. et al. // Toxicol Sci. 2014. V. 137. № 1. P. 55. https://doi.org/10.1093/toxsci/kft216
Chortarea S., Clift M.J.D., Vanhecke D. et al. // Nanotoxicology. 2015. V. 9. № 8. P. 983. https://doi.org/10.3109/17435390.2014.993344
Pfuhler S., van Benthem J., Curren R. et al. // Mutat. Res. Genet. Toxicol. Environ. Mutagen. 2020. V. 850–851. P. 503135. https://doi.org/10.1016/j.mrgentox.2020.503135
Тимербулатова Г.А., Димиев А.М., Хамидуллин Т.Л. и др. // Российские нанотехнологии. 2020. Т.15. № 4. С. 461. https://doi.org/10.1134/S1992722320040160
Тимербулатова Г.А., Дунаев П.Д., Димиев А.М. и др. // Казанский медицинский журнал. 2021. Т. 102. № 4. С. 501. https://doi.org/10.17816/KMJ2021-501
Wilfinger W.W., Mackey K., Chomczynski P. // Biotechniques. 1997. V. 22. № 3. P. 474. https://doi.org/10.2144/97223st01
Livak K.J., Schmittgen T.D. // Methods. 2001. V. 25. P. 402. https://doi.org/10.1006/meth.2001.1262
The R Project for Statistical Computing. https: //www.R-project.org/
NIOSH Current intelligence bulletin 65. Occupational exposure to carbon nanotubes and nanofibers. https: //www.cdc.gov/niosh/docs/2013-145/pdfs/2013-145.pdf?id=10.26616/NIOSHPUB2013145
Фатхутдинова Л.М., Габидинова Г.Ф., Димиев А.М. и др. // Гигиена и санитария. 2023. Т. 102. № 11. С. 1216. https://doi.org/10.47470/0016-9900-2023-102-11
Дополнительные материалы отсутствуют.
Инструменты
Российские нанотехнологии


