Нефтехимия, 2019, T. 59, № 2, стр. 207-213
Синтез и применение солей и комплексов на основе аллилового эфира нефтяных кислот в качестве ингибиторов углекислотной коррозии
Н. А. Мамедова 1, *, С. А. Мамедханова 1, А. Г. Шахмамедова 1
1 Азербайджанский Государственный Университет нефти и промышленности
Баку, Азербайджан
* E-mail: n.a.mamedova@inbox.ru
Поступила в редакцию 23.11.2017
После доработки 15.10.2018
Принята к публикации 09.04.2018
Аннотация
Изучена реакция этерификации природных нефтяных кислот с аллиловым спиртом в присутствии ионной жидкости – N-метилпирролидон гидросульфата. Получен аллиловый эфир природной нефтяной кислоты, на основе которого синтезированы нитропроизводные, а также соли и комплексы нефтяных кислот, которые были испытаны в качестве ингибиторов кислотной коррозии. Показано, что калиевая соль и моноэтаноламинный комплекс, полученные на основе нитропродукта природных нефтяных кислот, дают наивысший эффект защиты (98.4 и 98.9%, соответственно) при концентрации 300 ррm и могут быть предложены в качестве ингибиторов СО2-коррозии.
Известно, что в бакинских нефтях содержится достаточное количество нефтяных кислот и наличие их в нефтепродуктах создает серьезные проблемы. Поэтому эти кислоты обрабатывают слабым раствором гидрооксида натрия и извлекают в виде соли, которую затем обрабатывают серной кислотой, получая смесь природных нефтяных кислот (ПНК) [1]. ПНК являются ценным нефтехимическим сырьем и применяются в различных отраслях в качестве пластификаторов, модификаторов, поверхностно-активных веществ, присадок к топливам и маслам, а также в качестве ингибиторов коррозии стали [2–5].
Защита металлических оборудований – одна из актуальных проблем в нефтегазовой промышленности. Наиболее эффективным методом защиты является использование ингибиторов. Известно, что углекислотную коррозию, как самостоятельный раздел науки о коррозии, выделили сравнительно недавно. Поэтому и ассортимент ингибиторов для торможения этого вида поражения металлов сравнительно невелик, в том числе и применительно к условиям нефтеперерабатывающей и нефтегазовой промышленности. В настоящее время идут интенсивные исследования в области синтеза ингибиторов СО2-коррозии [6–8]. Главная цель влияния ингибиторов, используемых для защиты от углекислотной коррозии при добыче нефти и газа, – органические азотсодержащие соединения с длинными углеводородными цепями, амины, амиды и азотсодержащие гетероциклические соединения, четвертичные аммониевые соли. Такие ингибиторы действуют преимущественно на анодный процесс растворения железа. Таким образом, одним из эффективных направлений в борьбе с СО2-коррозией является использование органических ингибиторов, эффективно тормозящих катодный процесс [9–11].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы и материалы. В качестве объекта исследования выбрана нефтяная кислота, выделенная из керосино-газойлевых фракций Бакинских нефтей и очищенная с помощью бинарных растворителей. В качестве бинарных растворителей были использованы: смеси ацетон–петролейный эфир, ацетон–бензол и метилэтилкетон (МЭК), а также легкий бензин [12, 13]. В качестве реагента использовали аллиловый спирт, который предварительно перед использованием подвергали вакуумной перегонке и определяли его физико-химические показатели (табл. 1). Катализатор в реакции этерификации – протонная ионная жидкость – N-метилпирролидон гидросульфат.
Таблица 1.
Физико-химические показатели исходных соединений
| Показатели | Природная нефтяная кислота (ПНК) RCOOH | Аллиловый спирт  |
Аллиловый эфир ПНК RCOOCH2CH=CH2 |
|---|---|---|---|
| Ткип, °С | 120–190/6.65 × 10–4 МПа | 97 | 120–185/3.99 × 10–4 МПа |
| n$_{D}^{{20}}$ | 1.4592 | 1.4132 | 1.4580 |
| d$_{4}^{{20}}$, г/см3 | 0.9544 | 0.7580 | 0.9256 |
| Кч, мг КОН/г | 272.5 | – | 0.03 |
| Вязкость, мм2/с | 18.40 | – | 2.75 |
| Тзаст, °С | –45 | – | >–60°С |
| Молекулярная масса, г | 205.5 | 58 | 245.5 |
Приготовление катализатора. Катализатор был получен в лабораторных условиях с использованием N-метилпирролидона и 98%-ной серной кислотой. Реакцию проводили в трехгорлой колбе, снабженной термометром, капельной воронкой, механической мешалкой и холодильником в ледяной бане. В течение часа в стехиометрическом количестве к N-метилпирролидону добавляли по каплям 98%-ную серную кислоту при температуре 0°С, а затем проводили реакцию в течение 24 ч при перемешивании при комнатной температуре. Полученный катализатор промывали этилацетатом и высушивали под вакуумом в течение 24 ч при давлении 2 мм рт. ст. [14, 15].
Методика проведения реакции этерификации. Этерификацию ПНК аллиловым спиртом проводили в трехгорлой колбе, снабженной механической мешалкой, обратным холодильником и водоотделителем (насадкой Дина–Старка), улавливающей азеотропную смесь бензола с водой. В колбу загружали ПНК с аллиловым спиртом (мольное соотношением компонентов 1 : 1.2) в присутствии азеотропобразующего растворителя – бензола (100–150 мл). Катализатор – ионная жидкость N-метилпирролидон гидросульфат в количестве 3 мол. % от кислоты. Условия реакции: температура 80–90°С, продолжительность реакции 2 ч; завершение реакции этерификации определяется прекращением выделения реакционной воды и постоянством определяемого кислотного числа:
где R – нафтеновый радикал, R1 – .
.
Полученный эфир освобождали от не вступившей в реакцию кислоты промыванием слабым раствором 2%-ного едкого калия, а затем водой до нейтральной реакции (по фенолфталеину). После отгонки растворителя из реакционной смеси проводили вакуумную перегонку, при 6.65 × 104 МПа. Выход полученного сложного эфира составил 85–90 мас. %.
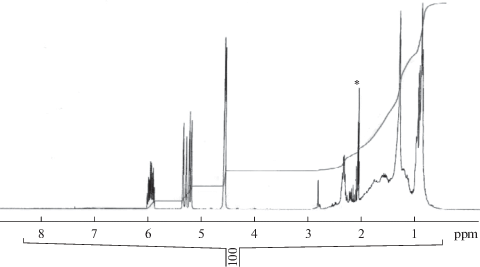
Идентификацию химического строения аллилового эфира ПНК проводили на приборе ИК-Фурье спектрометре ALPHA (фирма BRUKER Германия) в диапазоне волновых частот 600–4000 см–1 на кристалле SeZn. Спектры 1Н и 13С ЯМР регистрировали на приборе Bruker WP-300 (300 МГц), растворитель – CD3COCD3, химические сдвиги приведены относительно ТМС. На рис. 1, 2 представлены спектры ИК и 1Н ЯМР аллилового эфира природной нефтяной кислоты.
Как видно, спектры полностью подтверждают предложенную структуру аллилового эфира природной нефтяной кислоты. В ИК-спектре аллилового эфира ПНК имеются следующие полосы поглощения: 2924, 1455 см–1 характерная для С–Н-связи СН2-групп; 2862, 1375 см–1 для С–Н-связи СН3-групп; 988, 926 см–1 для С=С-связи (в α положении); 3086, 1648 см–1 для СН2-групп при С=С-связи, 1239, 1162 см–1 для С–О; 1736 см–1 для С=О-связи сложного эфира.
1Н ЯМР спектр аллилового эфира ПНК, (δ, м.д., CD3COCD3): протоны нафтеновых циклов проявляются в области от 0.897 до 2.804 м.д., сигналы группы (ОСН2) проявляются в виде дублета с химическими сдвигами при 4.57 м.д., сигналы протонов группы =СН2 имеют вид два дуплета с химическими сдвигами в области 5.181–5.343 м.д., сигнал протона в СН-группе наблюдаются в виде мультиплета в области 5.958 м.д.
Методика проведения реакции нитрования. Для получения нитропроизводных синтезированного аллилового эфира ПНК эфир подвергали нитрованию [16] в реакторе при атмосферном давлении и температуре 80°С в течении 11 ч в присутствии инициатора NaNО2 и азотной кислоты. Полученный нитропродукт темно-коричневого цвета обладает следующими физико-химическими свойствами: MW = 335; $d_{4}^{{20}}$ = 1.0329; $n_{D}^{{20}}$ = 1.4808; иодное число 0.06.
НА рис. 3 представлены ИК-спектры нитроаллилового эфира ПНК. Сравнивая ИК-спектры аллилового эфира ПНК и его нитроаллилового эфира можно заключить, что в спектре последнего появляется полоса поглощения при 1557.7 см–1, характерная валентным ассиметричным колебаниям NO-связи в группе NO2. Кроме того, в спектре наблюдается уменьшение интенсивности полос поглощения при 988.86, 930.45 см–1 ответственные за С=С-связи в α-положении. Рассчитаны оптические плотности (D) полос поглощения С=С-связи в α-положении. Полученные данные представлены в табл. 2.
Таблица 2.
Оптические плотности полученных образцов
| Название образцов | D928 (C=C) | D988 (C=C) |
|---|---|---|
| Аллиловый эфир природной нефтяной кислоты | 0.130 | 0.150 |
| Нитроаллиловый эфир природной нефтяной кислоты | 0.070 | 0.075 |
Приготовление солей и комплексов. Были приготовлены 20%-ные растворы натриевых, калиевых солей и комплексов в 50%-ном водном растворе изопропилового спирта синтезированных нитропроизводных. Для получения нитропродуктов (НП) соответствующих солей (НПNa-1, НПK-2), были взяты NaOH, КОН, а для нитропродуктов моноэтанол- и диэтаноламинных комплексов (НП МЭА-3, НП ДЭА-4) моноэтаноламин (МЭА) и диэтаноламин (ДЭА) с нитропроизводными ПНК. Были сняты ИК-спектры полученных растворов (рис. 4, 5). На ИК-спектрах наблюдаются наложение областей поглощения натриевых и калиевых солей, поэтому они были показаны на одном рисунке (рис. 4), а на рис. 5 даны полосы поглощения ИК-спектров для моноэтаноламин и диэтаноламинных комплексов, так как их спектры тоже почти идентичны.
Методика для исследования кинетики коррозии. Для исследования кинетики процесса СО2-коррозии применялся прибор ACMGL. Процесс проводили при температуре 50°С с участием электрода из малоуглеродистой стали С1018 в течении 20 ч. В этот период измеряли ток коррозии, потерю металла и автоматически рассчитывали скорость коррозии (мм/год) каждые 15 мин.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЯ
В представленной работе в присутствии катализатора протонной ионной жидкости гидросульфата N-метилпирролидона [8] была осуществлена реакция этерификации ПНК с аллиловым спиртом. Следует отметить, что обычно в реакциях этерификации используются традиционные кислотные катализаторы, такие как H2SO4 и КУ-2; в работе [12] нами тоже были использованы вышеуказанные катализаторы. Использованный же в данной работе ионно-жидкостной катализатор N-метилпирролидон гидросульфат способствует наименьшей продолжительности реакции и высокому выходу эфира.
На основе синтезированного нитропродукта ПНК были получены соли и комплексы, которые были испытаны, а затем предложены в качестве ингибиторов СО2-коррозии:
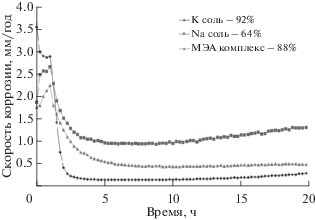
Было исследовано влияние растворов этих соединений на кинетику коррозионного процесса по известной методике [2] и была изучена кинетика скорости коррозии стали С1018 синтезированными соединениями. На рис. 6 и 7 показано влияние солей и комплексов нитропродукта ПНК в 50%-ом водном растворе изопропилового спирта на кинетику СО2-коррозии в 1%-ном водном растворе NaCl, насыщенном СО2.
Как видно из рис. 6 и 7, наибольшее влияние на кинетику СО2-коррозии в 1%-ном водном растворе NaCl, насыщенном СО2, оказывает калиевая соль (100 ррm – 53%, 200 ррm – 92%). Самые низкие показатели были выявлены у ДЭА, который с целью повышения эффекта влияния на кинетику СО2-коррозии был заменен натриевой солью. Остальные 2 опыта проводили с использованием калиевой, натриевой солей и МЭА- комплекса. Как видно из рис. 6 при концентрации 100 ррm комплекс моноэтаноламина, обеспечивает 83% защиты, а комплекс диэтаноламина проявил защиту всего на 9,5%; с другой стороны, комплекс моноэтаноламина по сравнению с калиевой солью обладает высоким эффектом защиты. При повышении концентрации 220 ррm ингибитора эффект защиты меняется. Способность защиты меняется по нижеследующему порядку: калиевая соль нитропродукта аллилового эфира ПНК > моноэтаноламинный комплекс нитропродукта аллилового эфира ПНК > диэтаноламинный комплекс нитропродукта аллилового эфира ПНК. Эффект защиты калиевой соли, моноэтаноламинного и диэтаноламинного комплексов с нитропродуктом нефтяной кислоты при концентрации 200 ррm составляет соответственно 92.88 и 58%.
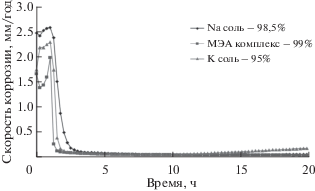
Как видно из рис. 8 калиевая соль нитропродукта аллилового эфира ПНК оказывает наиболее сильное влияние на кинетику СО2-коррозии в 1%-ном водном растворе NaCl, насыщенном СО2, чем натриевая соль и МЭА-комплекс. Среди растворов солей и комплексов более эффективными являются МЭА-комплекс и калиевая соль, так как при концентрации, равной 300 ррm, степень защиты составляет 95 и 99% (рис. 9). Одновременно без добавки ингибиторов была изучена скорость коррозии стали С 1018, которая составляла 3.43 мм/год.
В табл. 3 показаны данные влияния солей и комплексов на кинетику коррозионного процесса в среде 1%-ного водного раствора NaCl насыщенного СО2.
Таблица 3.
Влияние солей и комплексов на кинетику коррозионного процесса в среде 1%-го водного раствора NaCl насыщенного СО2
| Наименование растворов |
Ток коррозии, мA/c |
Скорость коррозии, мм/год | Потеря металла, г | Степень перекрывания поверхности, θ | Степень защиты, z, % |
|---|---|---|---|---|---|
| НПNa-1 | 0.005020 | 0.058168 | 0.000588 | 0.984 | 98.5 |
| НПNК-2 | 0.015067 | 0.174612 | 0.000519 | 0.949 | 95 |
| НП МЭА-3 | 0.004156 | 0.0399 | 0.000182 | 0.989 | 99 |
| НП ДЭА-4 | 0.131283 | 1.5216 | 0.003669 | 0.564 | 56 |
Таким образом, можно сделать вывод, что моноэтаноламинный комплекс и калиевая соль, полученные из нитропродукта аллилового эфира ПНК при концентрации 300 ррm дают наивысший эффект защиты от коррозии по требованиям международных стандартов (99 и 98.5% соответственно). По результатам проведенных исследований эти соединения могут быть предложены в качестве ингибиторов СО2-коррозии.
Список литературы
Аббасов В.М., Зейналов Э.Б., Велиев М.Г., Мустафаев С.А., Мамедова Н.А., Эфендиева Л.М, Шахмамедова А.Г. Природные нефтяные кислоты и производные на их основе: происхождение, структура и свойства, синтетические и прикладные аспекты. Монография. Баку: Эльм, 2014. 232 с.
Аббасов В.М. Коррозия. Б: Эльм, 2007. 355 с.
Аббасов В.М., Мурсалов Н.И., Алиева Л.И., Абдуллаева Э.Г., Махмудова Л.А. // Процессы нефтехимии и нефтепереработки. Баку. 2007. № 3 (30) (спец. выпуск). С. 19.
Абдуллаева Э.Г., Алиева Л.И., Аббасов В.М., Мамедова С.Е., Джабраилзаде Ш.З. // Процессы нефтехимии и нефтепереработки. Баку. 2011. № 12 (45). С. 49.
Вигдорович В.И., Шель Н.В., Ульянов В.Ф., Земсков А.Е. // Практика противокоррозионной защиты. 2000. № 3 (17). С. 47.
Коррозионная стойкость оборудования химических производств. Нефтеперерабатывающая промышленность. Справ. издат. // Под ред. Ю.И. Арачакова, А.М. Сухотина. Л.: Химия, 1990. 302 с.
Куренко С.Б., Куренко А.Б. // Практика противокоррозионной защиты. 2005. № 3 (37). С. 24.
d’Ischia M., Rega N., Barone V. // Tetrahedron. 1999. V. 55. P. 9297.
Lopez D.A., Perez T., Simison S.N. // Mater. Des. 2003. V. 24. P. 561.
Maqsood Ahmad Malik, Mohd Ali Hashim, Firdasa Nabi, Shaeel Ahmed AL-Thabaiti, Zaheer Khan // Int. J. Electrochem. Sci. 2011. V. 6. P. 1927.
Abbasov V.M., Hany M. Abd EL-Lateef, Aliyeva L.I., Ismayilov I.T., Mai M.Khalaf // Science Ia-Fand. Science. 2012. V. 42. № 2 X. P. 176.
Мамедова Н.А. Автореф. дис. ... канд. хим. Баку: Институт нефтехимических процессов, 2000. 23 с.
Мустафаев С.А. Автореф. дис. ... дoкт. хим. наук. Баку: Институт нефтехимических процессов, 2007. 39 с.
Freemantle M. Eyes on Ionic Liquids // Chem. and Engin. News. 2000. V. 78. № 20. P. 37.
Мамедова Н.А., Аббасов В.М., Ахмедова С.З., Талыбов А.Г., Рзаева Н.Ш., Керимов П.Н, Шахмамедова А.Г. // Мир нефтепродуктов. Вестник нефтяных компаний. 2015. № 8. С. 26.
Степанов А.В., Веселовский В.В. // Успехи химии. 2003. Т. 72. № 4. С. 363.
Дополнительные материалы отсутствуют.