Нефтехимия, 2019, T. 59, № 2, стр. 214-221
Аминсодержащие ацетиленовые соединения норборненового ряда – перспективные бактерициды для нефтедобычи
М. И. Шатирова 1, *, М. М. Мовсумзаде 2, У. Ш. Джафарова 2, Я. Г. Авдеев 3, **
1 Институт полимерных материалов НАН Азербайджана
Сумгаит, Азербайджан
2 Институт химии присадок им. А.М. Кулиева НАН Азербайджана
Баку, Азербайджан
3 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Россия
* E-mail: mshatirova@mail.ru
** E-mail: avdeevavdeev@mail.ru
Поступила в редакцию 24.04.2017
После доработки 15.10.2018
Принята к публикации 27.06.2018
Аннотация
Исходя из бицикло[2.2.1]гепт-5-ен-2-илметиламина синтезирован ряд производных пропаргиламина обладающих бактерицидными свойствами в отношении сульфатвосстанавливающих бактерий. Показано, что при взаимодействии аминсодержащего норборнена с пропаргилбромидом в зависимости от мольного соотношения образуются соответствующие аддукты норборненового ряда, содержащие в боковой цепи терминальную ацетиленовую связь и аминогруппу. Синтезированный N-пропаргилбицикло[2.2.1]гепт-5-ен-2-ил-метиламин является весьма реакционноспособным соединением и может вступать в различные реакции, в частности, по аминогруппе или двойной связи с образованием новых производных. Установлено, что все синтезированные вещества полностью подавляют рост сульфатвосстанавливающих бактерий при их содержании 500 мг/л.
Наибольшую коррозионную опасность при добыче и переработке нефти и природного газа представляют технологические среды, содержащие сероводород [1–3]. При добыче нефти (пластовой жидкости, содержащей смесь нефти, воды и газа) одной из основных технологических проблем для нефтяников является постоянное поддержание полной герметичности всей системы сбора, подготовки и транспорта добываемой продукции. Утечка токсичных продуктов нефтепереработки в окружающую среду – основная причина всех экологически отрицательных воздействий продукции нефтедобычи на природу и человека. Систематическое нарушение герметичности действующих систем нефтедобычи происходит, в основном, на поздних стадиях разработки месторождений из-за воздействия на металлические конструкции, в первую очередь, водной фазы пластовой жидкости в которой появляется сероводород, как результат жизнедеятельности сульфатвосстанавливающих бактерий (СВБ). Присутствие сероводорода существенно повышает коррозионную агрессивность пластовой жидкости в отношении металлических конструкций, что, без специальных мер защиты, за короткий срок приводит к выходу из строя объектов нефтедобычи. Наличие сероводорода в пластовой воде не только резко ускоряет общую коррозии металлического оборудования, но и вызывает существенное наводороживание стальных конструкций, сильно ухудшая их прочностные характеристики. В связи со вступлением многих месторождений, находящихся на территории бывшего СССР, в позднюю стадию разработки и резким изменением коррозионной обстановки давно эксплуатируемых месторождений нефтяники и специалисты в области коррозии вносят существенные коррективы в технологию применения традиционных методов защиты от коррозии (ингибиторы, защитные покрытия, коррозионностойкие материалы), а также в применение нетрадиционных методов (бактерициды, поглотители сероводорода, дегазация нефти) [3].
Наиболее распространенным методом подавления жизнедеятельности СВБ в условиях нефтедобычи является применение химических реагентов органической природы – бактерицидов [3–6]. С нашей точки зрения, такой способ борьбы с сероводородной коррозией наиболее перспективен, поскольку он действует не на само явление, а на его причину. Спектр бактерицидов, применяемых для подавления жизнедеятельности СВБ, в нефтедобывающей сфере достаточно ограничен и уступает широко применяемым для защиты металлических конструкций “классическим” ингибиторам сероводородной коррозии [3, 6]. Следовательно, актуально расширение ассортимента бактерицидных реагентов, эффективно подавляющих развитие СВБ.
В этом плане представляют интерес норборнены, содержащие в боковой цепи ацетиленовый фрагмент и аминную группы. Благодаря наличию в структуре этих соединений активных реакционноспособных центров, на их основе могут быть получены многочисленные биологически и физиологически активные вещества, ингибиторы коррозии, присадки к маслам и т.д. [7–15].
В данной работе приведены результаты по синтезу и изучению бактерицидного действия по отношению к СВБ функционально замещенных аминсодержащих ацетиленовых соединений норборненового ряда, тем более, что карбоксипроизводные норборнена известны в качестве эффективных антимикробных препаратов [6].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все обсуждаемые в статье синтезированные ацетиленовые соединения норборненового ряда являются новыми. Ниже представлены формулы этих соединений (см. таблицу) и методики их синтеза.
Таблица 1.
Формулы синтезированных норборненов, содержащих ацетиленовый фрагмент и аминную группу (I–XII), и степень подавления ими сульфатвосстанавливающих бактекрий (СВБ)
| № пп | Бактерицид | Концентрация бактерицида, мг/л | Концентрация H2S, мг/л | Активность бактерицида, z, % |
|---|---|---|---|---|
| I |  |
0 | 340 | – |
| 50 | 46 | 86 | ||
| 100 | 16 | 95 | ||
| 200 | 0 | 100 | ||
| 500 | 0 | 100 | ||
| II | 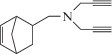 |
0 | 280 | – |
| 50 | 44 | 84 | ||
| 100 | 25 | 91 | ||
| 200 | 0 | 100 | ||
| 500 | 0 | 100 | ||
| III |  |
0 | 270 | – |
| 50 | 61 | 77 | ||
| 100 | 16 | 94 | ||
| 200 | 0 | 100 | ||
| 500 | 0 | 100 | ||
| IV |  |
0 | 270 | – |
| 50 | 10 | 96 | ||
| 100 | 0 | 100 | ||
| 200 | 0 | 100 | ||
| 500 | 0 | 100 | ||
| V |  |
0 | 260 | - |
| 50 | 67 | 74 | ||
| 100 | 43 | 83 | ||
| 200 | 4 | 98 | ||
| 500 | 0 | 100 | ||
| VI |  |
0 | 220 | – |
| 50 | 13 | 94 | ||
| 100 | 5 | 98 | ||
| 200 | 0 | 100 | ||
| 500 | 0 | 100 | ||
| VII | 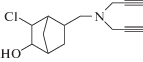 |
0 | 220 | – |
| 50 | 95 | 57 | ||
| 100 | 81 | 63 | ||
| 200 | 30 | 86 | ||
| 500 | 0 | 100 | ||
| VIII |  |
0 | 260 | – |
| 50 | 52 | 80 | ||
| 100 | 19 | 93 | ||
| 200 | 0 | 100 | ||
| 500 | 0 | 100 | ||
| IX |  |
0 | 200 | – |
| 50 | 75 | 63 | ||
| 100 | 60 | 70 | ||
| 200 | 19 | 91 | ||
| 500 | 0 | 100 | ||
| X | 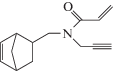 |
0 | 270 | – |
| 50 | 67 | 75 | ||
| 100 | 41 | 85 | ||
| 200 | 4 | 99 | ||
| 500 | 0 | 100 | ||
| XI | 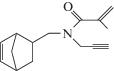 |
0 | 280 | – |
| 50 | 67 | 76 | ||
| 100 | 36 | 87 | ||
| 200 | 10 | 96 | ||
| 500 | 0 | 100 | ||
| XII | 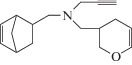 |
0 | 200 | – |
| 50 | 76 | 62 | ||
| 100 | 60 | 70 | ||
| 200 | 13 | 94 | ||
| 500 | 0 | 100 |
Чистоту синтезированных соединений контролировали методами ТСХ и ГЖХ. ТСХ-анализы проводили на пластинах Silufol-254 с закрепленным слоем силикагеля с проявлением в парах иода. Элюентом служила двухкомпонентная система – бензол : эфир (3 : 2) и гептан : эфир (3 : 1). ГЖХ-анализы проведены на приборах Crom-3 и ЛХМ-8 МД с пламенно-ионизационным детектором и катарометром.
N-Пропаргилбицикло[2.2.1]гепт-5-ен-2-ил-метиламин (I). В реакционную колбу помещали 8.0 г (0.2 моль) едкого натра, 8 мл воды, 11.4 г (0.2 моль) бицикло[2.2.1]гепт-5-ен-2-ил-метиламина и при энергичном перемешивании прикапывали 6 г (0.05 моль) пропаргилбромида в течение 20 мин. Через 2 ч органический слой отделяли и перегонкой получали соединение (I): Ткип 83–84°С, $n_{D}^{{20}}$ 1.4807, $d_{4}^{{20}}$ 0.9377, выходом 79.3%, Rf 0.36. ИК-спектр, ν, см–1: 3325, 3295, 2125, 1615. Спектр ЯМР 1Н, δ, м.д.: 2.60–2.80 м (Н1, Н4), 5.75–6.15 м (Н2, Н3), 2.85 м (Н5), 0.50 м (Н6), 2.05–2.30 м (Н6'), 1.10–1.50 м (Н7,7), 2.33–2.45 м (СН2N), 1.70 с (NН), 3.41 д, 3.82 д (СН2С≡), 2.25 т (≡СН).
Аналогичным способом из бицикло[2.2.1]гепт-5-ен-2-ил-метиламина и пропаргилбромида синтезировано соединение (II):
Из соединения (I) и 2-замещенных аллилхлоридов (или акрил- и метакрилоилхлоридов) получены вещества (III–V, X, XI), которые характеризуются следующими константами: $n_{D}^{{20}}$, $d_{4}^{{20}}$:
II. Ткип 110–111°С (1 мм рт. ст.), 1.4932, $d_{4}^{{20}}$ 0.9457, Rf 0.68. ИК-спектр, ν, см–1: 3330, 3305, 2835, 2120, 1605. Спектр ЯМР 1Н, δ, м.д.: 2.65–2.90 м (Н1, Н4), 5.70–6.15 м (Н2, Н3), 2.80 м (Н5), 0.55 м (Н6), 2.00–2.25 м (Н6'), 1.15–1.45 м (Н7,7), 2.30–2.50 м (СН2N), 3.40 д, 3.80 д (СН2С≡), 2.20 т (≡СН);
III. Ткип 92–93°С (1 мм), $n_{D}^{{20}}$ 1.4762, $d_{4}^{{20}}$ 0.8890, Rf 0.64. ИК-спектр, ν, см−1: 3320, 3292, 2830, 2115, 1640, 1620. Спектр ЯМР 1Н, δ, м.д.: 2.60–2.80 м (Н1, Н4), 5.65–6.15 м (Н2, Н3), 2.85 м (Н5), 0.50 м (Н6), 2.05–2.25 м (Н6'), 1.15–1.40 м (Н7,7), 2.32–2.55 м (СН2N), 3.45 д, 3.75 д (СН2С≡), 2.26 т (≡СН), 4.86–5.35 м (СН2=С), 5.56–6.05 м (С=СН), 2.70–3.05 м (СН2);
IV. Ткип 98–99°С (0.5 мм рт. ст.), $n_{D}^{{20}}$ 1.4791, $d_{4}^{{20}}$ 0.8734, Rf 0.67; ИК-спектр, ν, см−1: 3326, 3300, 2820, 2120, 1645, 1625. Спектр ЯМР 1Н, δ, м.д.: 2.56−2.82 м (Н1, Н4), 5.60–6.16 м (Н2, Н3), 2.87 м (Н5), 0.62 м (Н6), 2.01–2.22 м (Н6'), 1.12–1.37 м (Н7,7), 2.34–2.52 м (СН2N), 3.42 д, 3.73 д (СН2С≡), 2.23 т (≡СН), 4.80 с, 4.95 с (СН2=С), 1.86 с (СН3), 2.86 с (СН2);
V. Ткип 119–120°С (0.5 мм рт. ст.), $n_{D}^{{20}}$ 1.4936, $d_{4}^{{20}}$ 1.0321, Rf 0.71; ИК-спектр, ν, см–1: 3330, 3295, 2822, 2130, 1640, 1620. Спектр ЯМР 1Н, δ, м.д.: 2.53–2.80 м (Н1, Н4), 5.63–6.17 м (Н2, Н3), 2.88 м (Н5), 0.60 м (Н6), 1.98–2.20 м (Н6'), 1.10–1.35 м (Н7,7), 2.31–2.50 м (СН2N), 3.41 д, 3.72 д (СН2С≡), 2.26 т (≡СН), 5.20 с, 5.56 с (СН2=С), 3.10 с (СН2);
X. Т кип 118–119°С (0.5 мм рт. ст.), $n_{D}^{{20}}$ 1.4785, $d_{4}^{{20}}$ 0.8823, Rf 0.56; ИК-спектр, ν, см–1: 3325, 3300, 2786, 2125, 1720, 1650, 1610. Спектр ЯМР 1Н, δ, м.д.: 2.54–2.80 м (Н1, Н4), 5.65–6.10 м (Н2, Н3), 2.83 м (Н5), 0.65 м (Н6), 2.15–2.30м (Н6'), 1.12–1.40 м (Н7,7), 2.31–2.46 м (СН2N), 3.38–3.75 м (СН2С≡), 2.23 т (≡СН), 5.54–6.42 м (СН2=С), 5.60–6.05 м (С=СН);
XI. Т кип 123–124°С (0.5 мм рт. ст.), $n_{D}^{{20}}$ 1.4814, $d_{4}^{{20}}$ 0.8698, Rf 0.64. ИК-спектр, ν, см–1: 3328, 3290, 2787, 2130, 1743, 1645, 1610. Спектр ЯМР 1Н, δ, м.д.: 2.50–2.70 м (Н1, Н4), 5.70–6.15 м (Н2, Н3), 2.82 м (Н5), 0.63 м (Н6), 2.12–2.33 м (Н6'), 1.11–1.30 м (Н7,7), 2.30–2.42 м (СН2N), 3.35 д, 3.70 м (СН2С≡), 2.22 т (≡СН), 6.10 с, 5.70 с (СН2=С), 1.90 с (СН3).
Встречный синтез соединения (II). К смеси 35 мл абсолютного этилового спирта и 2 г КОН при интенсивном перемешивании в течение 30 мин. добавляли 4.5 г (0.048 моль) соединения (V). После кипячения в течение 6 ч реакционную смесь обрабатывали водой и эфиром, эфирный слой высушивали безводным сульфатом магния. После перегонки выделяли (II) с идентичными физико-химическими константами: Ткип 110–111°С (1 мм рт. ст.), $n_{D}^{{20}}$ 1.4935, $d_{4}^{{20}}$ 0.9460, выход 75.6%.
N-Пропаргил-2-гидрокси-3-хлорбицикло[2.2.1]-гепт-5-ен-2-ил-метиламин (VI). Опыты проводили в термостатированной (с точностью ±0.2°С) установке, состоящей из колбы, снабженной гидрозатвором, холодильником и механической мешалкой. В колбу при заданной температуре (50–55°С) загружали 0.2–0.4 моль 6–10%-ного водного раствора HCl и 0.2 моль соединения (I). При перемешивании реакционной массы через капельную воронку вводили 0.22 моль 26–30%-ного водного раствора пероксида водорода (скорость подачи 10 г ч–1). Перемешивание продолжали в течение 6–8 ч. Реакцию завершали после полного расхода H2O2, наличие HOCl контролировали перманганатометрическим и иодометрическим методами. Органический слой отделяли от водного, водный слой экстрагировали эфиром (2 × 50 см3). Эфирные вытяжки объединяли с органическим слоем, нейтрализовывали 10%-ным раствором Na2CO3, сушили сульфатом магния и после перегонки эфира выделяли индивидуальный галогенгидрин (VI): Ткип 103–104°С (1 мм рт. ст.), $n_{D}^{{20}}$ 1.5411, $d_{4}^{{20}}$ 1.4486, выход 72.3%, Rf 0.32. ИК-спектр, ν, см–1: 3326, 3300, 2819, 2135. Спектр ЯМР 1Н, δ, м.д.: 1.53 т (Н1), 2.13 д (Н2), 3.48 д (Н3), 2.31 м (Н4), 2.15 м (Н5), 0.80 м (Н6), 1.40–1.65 м (Н6’), 1.12–1.35 м (Н7,7), 2.31–2.42 м (СН2N), 1.70 с (NН), 3.40 д, 3.81 д (СН2С≡), 2.22 т (≡СН), 4.80 с (ОН).
Аналогичным способом из соединения (II) получали аддукт (VII) с Ткип 150–151°С (0.5 мм рт. ст.), $n_{D}^{{20}}$ 1.5540, $d_{4}^{{20}}$ 1.4560, Rf 0.45. ИК-спектр, ν, см–1: 3328, 3005, 2786, 2130. Спектр ЯМР 1Н, δ, м.д.: 1.50 т (Н1), 2.16 д (Н2), 3.40 д (Н3), 2.33 м (Н4), 2.15 м (Н5), 0.75 м (Н6), 1.42–1.61 м (Н6'), 1.10–1.30 м (Н7,7), 2.35–2.45 м (СН2N), 4.75 с (ОН), 3.50 д, 3.85 д (СН2С≡), 2.20 т (≡СН).
N-Пропаргил-2,3-эпоксибицикло[2.2.1]гепт-5-ен-2-ил-метиламин (VIII). К смеси 35 мл абсолютного этилового спирта и 2 г КОН при интенсивном перемешивании в течение 30 мин добавляли 10.2 г (0.048 моль) соединения (VI). После кипячения в течение 6 ч реакционную смесь обрабатывали водой и эфиром, эфирный слой высушивали безводным сульфатом магния. После перегонки выделяли соединение (VIII) с Ткип 98–99°С (3 мм рт. ст.), $n_{D}^{{20}}$ 1.5032, $d_{4}^{{20}}$ 0.9872; выход 79.1%, Rf 0.34. ИК-спектр, ν, см–1: 3330, 3295, 3065, 2789, 2125, 1255, 915. Спектр ЯМР 1Н, δ, м.д.: 1.54 т (Н1), 3.65 д (Н2), 3.88 д (Н3), 2.35 м (Н4), 2.75 м (Н5), 1.32 м (Н6), 2.09 т (Н6'), 1.50–1.70 м (Н7,7), 2.37−2.55 м (СН2N), 1.85 с (NН), 3.55 д, 3.80 д (СН2С≡), 2.19 т (≡СН).
Аналогичным способом из соединения (VII) был получен аддукт (IX) с Ткип 132–133°С (1 мм рт. ст.), $n_{D}^{{20}}$ 1.5112, $d_{4}^{{20}}$ 0.9997; выход 76.5%, Rf 0.25. ИК-спектр, ν, см–1: 3330, 3290, 3067, 2820, 2120, 1260, 915. Спектр ЯМР 1Н, δ, м.д.: 1.55 т (Н1), 3.63 д (Н2), 3.89 д (Н3), 2.35 м (Н4), 2.70 м (Н5), 1.30 м (Н6), 2.10 м (Н6'), 1.50–1.65 м (Н7,7), 2.38–2.60 м (СН2N), 3.50 д, 3.75 д (СН2С≡), 2.22 т (≡СН).
Встречный синтез соединения (VIII). К перемешиваемому раствору 0.185 моль соединения (III) в 25 мл абсолютного диэтилового эфира при 15–20°С добавляли 21.7 мл 45%-ной надуксусной кислоты. Через 3 ч в реакционную смесь добавляли 50 мл 5%-го водного раствора бикарбоната натрия, промывали водой, высушивали сульфатом натрия и отгоняли растворитель. Перегонкой в вакууме выделили 78.5% соединения (VIII) с идентичными данными.
N-Метилдигидропиранил-N-пропаргилбицикло[2.2.1]гепт-5-ен-2-ил-метиламин (XII). Смесь 8.5 г (0.05 моль) соединения (III), 2.8 г (0.05 моль) акролеина, 10 мл толуола в присутствии 0.05 г гидрохинона нагревали в запаянной ампуле при 175–180°С в течение 8 ч. После обработки и двукратной разгонки выделяли соединение (XII) с Ткип 92–93°С (3 мм рт. ст.), $n_{D}^{{20}}$ 1.5032, $d_{4}^{{20}}$ 0.9872; выход 65.5%, Rf 0.36. ИК-спектр, ν, см−1: 3330, 3295, 2786, 2125, 1615. Спектр ЯМР 1Н, δ, м.д.: 2.53–2.69 м (Н1, Н4), 5.60–6.16 м (4 Н, Н2, Н3, СН=СН в цикле), 2.80 м (Н5), 0.65 м (Н6), 2.10–2.30 м (Н6'), 1.10–1.26 м (Н7,7), 2.28–2.45 м (СН2N), 3.40–3.70 м (СН2С≡), 2.21 т (≡СН), 2.85–3.05 м (СН в цикле), 3.12–3.38 м (4Н, СН2СН2).
Определение бактерицидной активности. Испытание полученных соединений норборненового ряда (I–XII) на бактерицидную активность против СВБ проводили по стандартной методике [7, 16]. Накопительные культуры СВБ выделяли из пластовой воды. Основу полученной накопительной культуры составляли бактерии вида Desulfovibrio desylfuricans. Исследуемую культуру многократными пересевами очищали от сопутствующих микроорганизмов и использовали в период наибольшей активности (после 3–4 сут). В качестве питательной среды использовали среду “Постгейта В”. Пробирки, содержащие исследуемые вещества, питательную среду и культуру СВБ, выдерживали в термостате при 32°C 10–12 сут. Для каждой концентрации проводили три параллельных опыта, после чего иодометрическим титрованием определяли количество образовавшегося биогенного сероводорода. В качестве контрольных использовали пробы без добавок бактерицида.
Бактерицидную активность оценивали по степени подавления роста СВБ по формуле: $z = \frac{{{{C}_{1}} - {{C}_{2}}}}{{{{C}_{1}}}} \times 100\% $, где C1 и C2 – содержание сероводорода соответственно в контролируемой и исследуемых пробах, мг/л.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В результате проведенных исследований показано, что при взаимодействии аминосодержащего норборнена с пропаргилбромидом в зависимости от мольного соотношении образуются соответствующие аддукты норборненового ряда, содержащие в боковой цепи терминальную ацетиленовую связь и аминную группу (соединения I, II). Строение синтезированных соединений подтверждены данными ИК- и ПМР-спектров. В ИК-спектрах соединений (I, II) имеются полосы поглощения при 1180, 2100, 3270−3290 и 3360 см–1, характерные для терминальной ацетиленовой (≡СН, С≡С), вторичной N−Н- и С−N-связей. В спектрах ПМР соединений (I, II) пропаргильная группа проявляется в виде триплета при δ = 2.30 м.д. (1Н, ≡СН, J = = 2.5 Гц), дублетом при δ = 4.30 м.д. (2Н, NСН2С≡, J = 2. 5 Гц) и синглета при δ =1.70 м.д. (1Н, NН).
Установлено, что синтезированный норборнен, содержащий в боковой цепи аминную группу и пропаргильный фрагмент (I), вступает в реакцию с аллил-, металлил- и 2,3-дихлорпропенами, с образованием соответствующих аминсодержащих норборненов (III–V), включающих в свой состав одновременно аллильную и пропаргильную группы.
В дальнейшем хлорзамещенное производное (V), подвергается дегидрохлорированию в присутствии едкого калия с образованием аминсодержащего норборнена с двумя терминальными ацетиленовыми фрагментами (II):
В ИК-спектрах соединений (III–V) наряду с полосами поглощения свойственными для терминальной ацетиленовой связи, обнаружены также полосы при 3090 и 1640 см–1, харак-терные для CH2=CX-групп. В спектрах ПМР соединений (III–V) аллильный фрагмент проявляется в виде мультиплета δ = 5.10 м.д. (2Н, СН2), 5.85 м.д. (1Н, СН=), дублетом при δ = 4.30 м.д. (2Н, NСН2 С≡, J = 2.5 Гц).
Установлено, что норборнены ацетиленового ряда (I, II) легко реагируют при 50–55°С с HOCl в момент их образования (in situ) в индуцированной системе HCl + H2O2 с образованием соответствующих хлоргидринов (VI, VII) по реакциям:
В ИК-спектрах соединений (VI, VII) обнаружены полосы поглощения в областях 3360–3460, 2235–2250, 760–600 см–1, характерные для связей O–H, C≡C и C–Cl соответственно. Наряду с этим отсутствуют полосы поглощения валентных колебаний связи С=С в области 1635–1650 см–1.
Установлено, что хлоргидрин норборнанового ряда (VI), содержащий в боковой цепи ацетиленовую связь и аминную группу, легко дегидрохлорируется в присутствии порошкообразного гидроксида кали, образуя при этом соответствующий эпоксид (VIII) с выходом 85.4%:
Строение полученного эпоксида (VIII), наряду с физико-химическими показателями, было доказано также встречным синтезом: эпоксидированием соответствующего норборнена (I) с помощью пероксиуксусной кислоты. Выход целевого продукта при этом составлял 78,8%.
В ИК-спектре соединения (VIII) присутствие оксиранового цикла подтверждается наличием полос поглощения при 915, 3065, 1260–1240 см−1, обусловленных колебаниями связей C–H метиновой и метиленовой группы эпоксидного цикла. Протекание реакции по оксирановому циклу подтверждено исчезновением в ИК-спектрах соединения (VIII) полосы поглощения, характерной для оксиранового цикла. В ЯМР1Н-спектре соединений (VIII) в области сильных полей проявляется мультиплетный сигнал с химическим сдвигом при δ 1.32 м.д., отвечающий эндо-протону при атоме C6, а в слабом поле при δ 2.09 м.д. проявляется триплетный сигнал протона C6Нэкзо. Протон C5Нэкзо дает мультиплетный сигнал при δ 2.75 м.д. Из значений констант спин-спинового взаимодействия (КССВ) (J6,6' 12.2–12.5 Гц, J5,6 эндо 5.0–5.3 Гц, J5,6 экзо 9.5–9.7 Гц) следует об эндо-конфигурация полученного аддукта. В области сильных полей при δ 1.70 м.д. проявляются протоны ${\text{H}}_{{а н т и }}^{7}$ и ${\text{H}}_{{с и н }}^{7}$. Сигналы протонов при атомах С2 и С3 проявляются при δ 3.65 м.д. и δ 3.88 м.д. Величина вицинальной КССВ этих атомов J2, 3 равна 4.5–4.7 Гц.
Установлено, что как хлоргидрин диацетиленового ряда, соединение (VII) легко дегидрохлорируется в присутствии порошкообразного едкого калия, образуя при этом соответствующий оксиран (IX) (85.5%) по реакции:
Присутствие оксиранового цикла в молекуле соединения (IX) подтверждается наличием в ИК-спектре полосы поглощения при 915, 3060 см–1 и 1260–1235 см–1, обусловленных колебаниями C–H-связей метиновой и метиленовой группы эпоксидного кольца.
При взаимодействии аминсодержащего норборнена (I) с акрил- и метакрилоил хлоридами реакция протекают по аминнной группе и образуются аминсодержащие непредельные кетоны норборненового ряда (IX, X):
В ИК-спектрах соединений (IX, X) наряду с полосами поглощения, принадлежащие для терминальной ацетиленовой (3300, 2125 см–1) и двойной С=С-связи (1645 см–1) обнаружены также полосы при 1220, 1743 см–1, характерные для валентным колебаниям С–N- и C=О-связи соответственно.
Установлено, что N-аллил-N-пропаргилбицик-ло[2.2.1]гепт-5-ен-эндо-2-ил-метиламин (III), вступает в гетеродиеновую конденсацию с акролеином при 175–180°С с образованием дигидропиран производного (XII) с выходам 65.6% по схеме:
Чистота синтезированного соединения (XII) подтверждена данными ТСХ и ГЖХ, а строение – ЯМР 1Н и ИК-спектроскопией. В ЯМР 1Н-спектре соединений, найдены химические сдвиги при 4.93 с (1H, CH), 1.86 м (4Н, 2СН2), 4.66 д (1Н, СН=С), 6.06 с (1Н, С=СН), свойственные атомами водорода дигидропиранового цикла.
Усредненные результаты бактерицидного действия синтезированных веществ (I−XII) в отношении СРБ представлены в таблице. Как видно из результатов испытаний все синтезированные реагенты обеспечивают полное подавления роста СВБ при содержании 500 мг/л. Наиболее интересен N-(2-метилпроп-2-ен-1-ил)-N-пропаргилбицикло[2.2.1]гепт-5-ен-эндо-2-ил-метиламин (IV) для которого полное подавление роста СВБ начинается при содержании 100 мг/л. Для соединений (I–III, VI, VIII) этот эффект проявляется при содержании 200 мг/л. Полученные данные показывают, что для синтезированных соединений сложно проследить корреляцию их строения с бактерицидными свойствами в отношении СВБ. По-видимому, их бактерицидная активность является результатом комплексного воздействия активных групп молекул на СВБ.
ЗАКЛЮЧЕНИЕ
Разработаны методики синтеза 11 функционально замещенных пропаргиламинов – производных норборнена. Полученные соединения обладают бактерицидным действием в отношении СВБ бактерий. Все синтезированные соединения при содержании в растворе 500 мг/л способны полностью подавлять деятельность этих микроорганизмов. Наиболее эффективный – N-(2-метилпроп-2-ен-1-ил)-N-пропаргилбицикло[2.2.1]гепт-5-ен-эндо-2-ил-метиламин (IV) проявляет этот эффект уже при 100 мг/л. Разработанные нами ацетиленовые соединения расширяют ассортимент бактерицидов для подавления роста сульфатвосстанавливающих бактерий и могут быть рекомендованы в качестве ингибиторов микробиологической коррозии металлов.
Список литературы
Кашковский Р.В., Игошин Р.В., Саяпин А.О. // Коррозия: материалы, защита. 2018. № 8. С. 25.
Фролова Л.В., Кузнецов Ю.И., Андреев Н.Н. // Коррозия: материалы, защита. 2017. № 1. С. 31.
Рахманкулов Д.Л., Бугай Д.Е., Габитов А.И., Гоник А.А., Ахияров Р.Ж., Калимуллин А.А. Ингибиторы коррозии. Т. 4. Теория и практика противокоррозионной защиты нефтепромыслового оборудования и трубопроводов. М.: Химия, 2007. 300 с.
Резяпова И.Б. Сульфатвосстанавливающие бактерии при разработке нефтяных месторождений. Уфа: Гилем, 1997. 151 с.
Каменщиков Ф.А., Черных Н.Л. Борьба с сульфатвосстанавливающими бактериями на нефтяных месторождениях. Ижевск: Издательство “ИКИ”, 2007. 412 с.
Базунова М.В., Назаров А.М., Аминова Г.К. // Вестник Башкирского ун-та. 2006. № 3. С. 40.
Смородин А.Е., Агаев Н.М., Гусейнов М.М., Антропов Л.И., Велиев М.Г., Аллахвердиева А.В. // Защита металлов. 1983. Т. 19. № 3. С. 471.
Mazumder M.A.J., Al-Muallem H.A., Faiz M., Ali S.A. // Corrosion Science. 2014. V. 87. P. 187.
Ali S.A., Al-Muallem H.A., Saeed M.T., Rahman S.U. // Corrosion Science. 2008. V. 50. P. 664.
Шатирова М.И., Авдеев Я.Г. // Коррозия: материалы, защита. 2016. № 11. С. 34.
Шатирова М.И., Джафарова У.Ш., Авдеев Я.Г. // Коррозия: материалы, защита. 2018. № 4. С. 15.
Кухарев Б.Ф., Станкевич В.К., Клименко Г.Р., Лобанова Н.А., Ковалюк Е.Н., Баранов А.Н. // Журн. прикл. химии. 2000. Т. 73. № 1. С. 161.
Маретина И.А. // Успехи химии. 1991. Т. 60. № 1. С. 103.
Frignani A., Monticelli C., Zucchi F., Trabanelli G. // Int. J. Corros. Scale Inhib. 2014. V. 3, № 2. P. 105.
Авдеев Я.Г., Кузнецов Ю.И. // Успехи химии. 2012. Т. 81. № 12. С. 1133.
Романенко В.И., Кузнецов С.И. Экология микроорганизмов пресных водоемов. М.: Наука, 1974. 193 с.
Дополнительные материалы отсутствуют.









