Нефтехимия, 2019, T. 59, № 3, стр. 261-270
Влияние природы носителя на стабильность никелевых и никель-кобальтовых катализаторов кислородной и углекислотной конверсии метана в синтез-газ
А. Г. Дедов 1, 2, 4, А. С. Локтев 1, 2, 4, *, **, И. Е. Мухин 1, А. Е. Баранчиков 2, В. К. Иванов 2, М. А. Быков 3, Е. В. Солодова 1, И. И. Моисеев 1, 2, 4
1 Российский государственный университет нефти и газа (НИУ) имени И.М. Губкина
Москва, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова РАН
Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова
Москва, Россия
4 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
* E-mail: al57@rambler.ru
** E-mail: genchem@gubkin.ru
Поступила в редакцию 19.11.2018
После доработки 01.12.2018
Принята к публикации 10.12.2018
Аннотация
Показано, что природа носителя (цеолит структуры MFI, алюмомагниевый гидроталькит, стабилизированный оксид церия, оксид неодима) существенно влияет на стабильность Ni- и Ni–Co-катализаторов в реакции кислородной конверсии метана и в меньшей степени – на стабильность катализаторов углекислотной конверсии метана в синтез-газ. Алюмомагниевый гидроталькит оказался предпочтительным носителем для никелевого катализатора, обеспечивающим стабильно высокий выход синтез-газа в процессах кислородной и углекислотной конверсии метана, тогда как цеолит структуры MFI проявил себя как стабильный и селективный носитель Ni–Co-катализаторов углекислотной конверсии метана.
ВВЕДЕНИЕ
Получение синтез-газа (СГ, смесь CO и H2) – ключевая, но и высокозатратная стадия в производстве продуктов нефтехимии и экологически чистого топлива – водорода из метансодержащего сырья [1–8]. Перспективные процессы получения СГ – кислородная конверсия метана (ККМ) и углекислотная конверсия метана (УКМ) – обладают рядом достоинств по сравнению с действующими процессами получения СГ, основанными на паровой конверсии метана. ККМ – экзотермический, менее энергозатратный процесс, позволяющий получать СГ состава H2/CO = 2, удобный для синтеза метанола и углеводородов (УВ) по Фишеру–Тропшу. Процесс УКМ (H2/CO = = 1) позволяет утилизировать основной парниковый газ – диоксид углерода, а также может базироваться на переработке возобновляемого сырья – биогаза.
В качестве альтернативы широко известным катализаторам ККМ и УКМ [1–7], нами разработаны высокоэффективные катализаторы, содержащие никель или никель и кобальт на оксидных носителях различной химической природы. В таблице приведена выборка лучших результатов, полученных на данных катализаторах. Условия проведения экспериментов описаны в [9–12].
Данные таблицы показывают, что при диспергировании активного компонента в матрице оксида неодима, стабилизированного оксида церия или цеолита MFI (известного также как ZSM-5), результаты ККМ и УКМ улучшаются при совместном присутствии никеля и кобальта. Исключение составил носитель на основе алюмомагниевого гидроталькита, при использовании которого дополнительное введение кобальта ухудшило результаты ККМ и УКМ. При использовании в качестве носителя стабилизированного оксида церия, выступающего в роли поставщика активного решеточного кислорода, результаты ККМ и УКМ оказались недостаточно высокими, но их удалось улучшить за счет дополнительного введения марганца.
Для обоснования выбора катализатора ККМ и УКМ, перспективного для практического использования, необходимо сопоставить стабильность их каталитического действия.
Цель настоящей работы – исследование стабильности разработанных нами катализаторов при длительной эксплуатации в периодическом режиме. Установление факторов, влияющих на стабильность катализаторов ККМ и УКМ – важная научная и практическая задача, решение которой необходимо для практической реализации этих процессов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методики синтеза и исследования физико-химических свойств испытанных нами катализаторов описаны в [9–12].
Фазовый состав катализаторов после использования в ККМ и УКМ определяли на дифрактометре Rigaku MiniFlex 600 (Япония), детектор с графитовым монохроматором и медным антикатодом, CuKα излучение, λ = 1.54187 Å. При определении фазового состава использовали базу данных международного центра дифракционных данных (International Center for Diffraction Data – ICDD).
Структурные особенности поверхности катализаторов изучали при помощи растрового электронного микроскопа (РЭМ) Carl Zeiss NVision 40 при увеличении до 200 000х с использованием детекторов вторичных (SE или InLens; ускоряющее напряжение 7 кВ) и обратно рассеянных (ESB; ускоряющее напряжение 1 кВ) электронов.
Исследование каталитических свойств образцов в реакциях ККМ и УКМ проводили в обогреваемом кварцевом реакторе проточного типа с карманом для термопары; конец термопары располагался в центре слоя катализатора. Свободный объем реактора при проведении ККМ заполняли кварцевой крошкой. Масса загруженного в реактор катализатора с размером гранул 0.5–1 мм составляла 0.2 г. В реактор подавали неразбавленные инертным газом смеси CH4 с O2 или CO2, производства ОАО “Московский газоперерабатывающий завод” (чистота 99.9%). Соотношение CH4/O2 = 2; CH4/CO2 = 1; скорость потока для каждого из катализаторов выбирали индивидуально на основании результатов ранее проведенных экспериментов. Катализатор разогревали в течение 1 ч до заданной температуры в токе смеси CH4 с O2 или CO2, анализ состава продуктов проводили методом ГЖХ по методике, описанной в [9]. Катализатор испытывали в течение 5–6 ч, после чего охлаждали и на следующий день повторно разогревали до рабочей температуры. Время пробега катализатора не включало время, затраченное на охлаждение и разогрев катализатора, а учитывало только время его работы после достижения заданной температуры.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
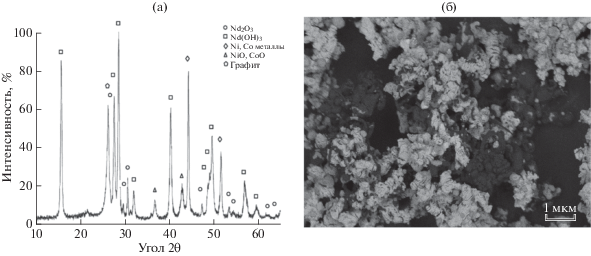
На рис. 1 приведены результаты испытаний в ККМ катализатора NdNiCoO4. По данным рентгеновской дифрактометрии, в условиях ККМ катализатор образует композит, содержащий металлические никель и кобальт, их оксиды и оксид неодима. Видно, что катализатор работает нестабильно и через 50 ч наблюдается заметное уменьшение выхода синтез-газа. Потеря активности может быть связана как с формированием стабильной фазы Co2NiO4, рефлексы которой фиксируются на дифрактограмме порошка катализатора после выгрузки из реактора (рис. 2а), так и наблюдаемое на дифрактограмме (фаза графита) и РЭМ-микрофотографии (рис. 2б) существенное зауглероживание катализатора.
Рис. 1.
Результаты испытаний стабильности катализатора NdNiCoO4 в ККМ (920°С; CH4/O2 = 2; W = 17 л/г катализатора в ч).
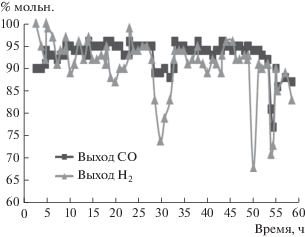
Рис. 2.
Дифрактограмма порошка (а) и РЭМ-микрофотография (б) катализатора NdNiCoO4 после катализа ККМ.
Результаты испытаний в ККМ катализатора 3.6%Ni0.9%Co0.5%Mn/CeO2 приведены на рис. 3. Предшественник катализатора характеризовался развитой мезопористой структурой. Данный катализатор работает более стабильно, не проявляя выраженной тенденции к уменьшению выхода синтез-газа на протяжении 60 ч. На дифрактограмме порошка катализатора после ККМ фиксируются интенсивные рефлексы CeO2, а также следовые количества MnO2, Co3O4 и металлических никеля, кобальта и марганца. РЭМ- микрофотография (рис. 4) показывает, что катализатор после 60 ч пробега в ККМ сохраняет развитую мезопористую структуру и подвержен незначительному зауглероживанию. Однако данный катализатор показал недостаточно высокий выход водорода, связанный с повышенной окислительной активностью компонентов катализатора – поставщиков активного решеточного кислорода.
Рис. 3.
Результаты испытаний стабильности катализатора 3.6%Ni0.9%Co0.5%Mn/CeO2 в ККМ (920°С; CH4/O2 = 2; W = 9 л/г катализатора в ч).
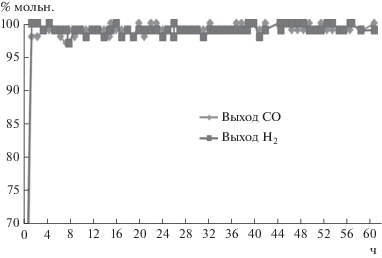
В ряду разработанных нами катализаторов образцы на основе алюмомагниевого гидроталькита, в отличие от прочих, проявляли высокую селективность по синтез-газу лишь при отсутствии добавок кобальта. В то же время известно, что никелевые катализаторы конверсии метана в синтез-газ подвержены сильному зауглероживанию, а никелевые частицы способствуют росту углеродных волокон, дезактивирующих катализатор. В связи с этим представляло интерес исследовать стабильность катализатора 2%Ni/алюмомагниевый гидроталькит как в ККМ, так и в УКМ. В [11] методом РФА было показано, что после ККМ и УКМ в катализаторе присутствуют фазы MgO и шпинелей, содержащих наряду с алюминием магний или никель. Ввиду малого содержания никеля зафиксировать образование металлического никеля не удалось.
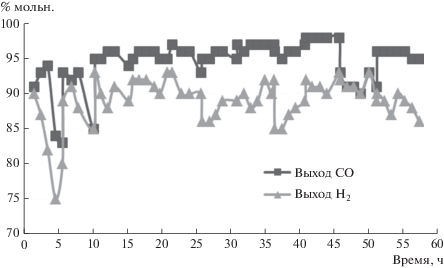
Результаты ККМ на катализаторе 2%Ni/алюмомагниевый гидроталькит (рис. 5) показывают, что данный катализатор после кратковременного разогрева до 950°С продолжает стабильно работать 50 ч при 900°С, демонстрируя высокий (более 90%) выход синтез-газа. На РЭМ-микрофотографиях отсутствуют признаки зауглероживания катализатора.
Рис. 5.
Результаты испытаний стабильности катализатора 2%Ni/алюмомагниевый гидроталькит в ККМ (900°С; CH4/O2 = 2; W = 12 л/г катализатора в ч).
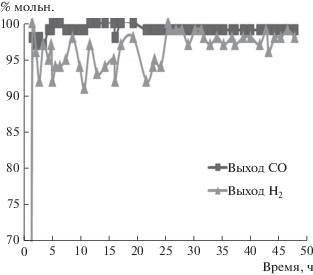
На рис. 6 приведены результаты УКМ на этом же катализаторе. Видно, что катализатор стабильно работает на протяжении 60 ч и показывает высокий (более 95%) выход синтез-газа. Методом РЭМ показано (рис. 7), что на поверхности катализатора 2%Ni/алюмомагниевый гидроталькит после катализа УКМ фиксируются фрагментарные скопления частиц никеля или его оксида, а также связанные с ними незначительные углеродные отложения, видимо, не влияющие на стабильность катализатора в УКМ. Рентгенограммы порошков катализатора после ККМ и УКМ идентичны и позволяют зафиксировать лишь образование фаз MgO и шпинелей, содержащих наряду с алюминием магний или никель и кобальт. Вероятной причиной стабильности в ККМ и УКМ катализатора на основе 2%Ni/алюмомагниевого гидроталькита можно считать малые размеры формируемых никелевых частиц, не дающих рефлексов на рентгенограммах. Это согласуется с данными работы [13], в которой изучали УКМ на содержащих 10% никеля алюмомагниевых гидроталькитных катализаторах. Было установлено, что при размерах частиц никеля менее 15 нм закоксовывание катализатора прекращается.
Рис. 6.
Результаты испытаний стабильности катализатора 2%Ni/алюмомагниевый гидроталькит в УКМ (900°С; CH4/СO2 = 1; W = 16 л/г катализатора в ч).
При использовании в качестве носителя цеолита структуры MFI с кремнеземным модулем 40, синтезированного гидротермально-микроволновым методом, более селективным по синтез-газу оказался никель-кобальтовый катализатор 1%Ni1%Co/MFIмв (см. табл. 1).
Таблица 1.
Результаты кислородной и углекислотной конверсии метана в синтез-газ на исследованных катализаторах
| Катализатор | Реакция | T, °C | Выход, % | Ссылка | |
|---|---|---|---|---|---|
| Н2 | СО | ||||
| NdNiCoO4 (18%Ni18%Co) |
ККМ | 852 | 99 | 95 | [9] |
| ККМ | 926 | 98 | 98 | ||
| УКМ | 867 | 97 | 96 | ||
| УКМ | 902 | 98 | 98 | ||
| Nd2Ni2O5 (36%Ni) |
ККМ | 864 | 91 | 91 | [9] |
| ККМ | 925 | 94 | 98 | ||
| УКМ | 851 | 97 | 98 | ||
| УКМ | 890 | 98 | 99 | ||
| 1%Ni1%Co/MFIмв* | ККМ | 800 | 86 | 89 | [10] |
| ККМ | 900 | 97 | 97 | ||
| УКМ | 800 | 72 | 88 | ||
| УКМ | 900 | 91 | 96 | ||
| 2%Ni/MFIмв* | ККМ | 800 | 92 | 92 | [10] |
| ККМ | 900 | 97 | 97 | ||
| УКМ | 800 | 58 | 76 | ||
| УКМ | 900 | 83 | 90 | ||
| 1%Ni1%Co/алюмомагниевый гидроталькит |
ККМ | 800 | 6 | 3 | [11] |
| ККМ | 950 | 15 | 7 | ||
| УКМ | 850 | 79 | 81 | ||
| УКМ | 950 | 81 | 83 | ||
| 2%Ni/алюмомагниевый гидроталькит |
ККМ | 900 | 89 | 89 | [11] |
| ККМ | 950 | 90 | 90 | ||
| УКМ | 850 | 89 | 89 | ||
| УКМ | 950 | 95 | 97 | ||
| 4%Ni1%Co/CeO2** | ККМ | 800 | 84 | 88 | [12] |
| ККМ | 920 | 95 | 97 | ||
| УКМ | 840 | 60 | 86 | ||
| УКМ | 950 | 80 | 96 | ||
| 5%Ni/CeO2** | ККМ | 890 | 17 | 18 | [12] |
| ККМ | 956 | 75 | 76 | ||
| УКМ | 850 | 55 | 69 | ||
| УКМ | 954 | 64 | 79 | ||
| 3.6%Ni0.9%Co0.5%Mn/CeO2** | ККМ | 900 | 89 | 89 | Статья в печати |
| ККМ | 950 | 90 | 90 | ||
| УКМ | 800 | 80 | 80 | ||
| УКМ | 950 | 96 | 96 | ||
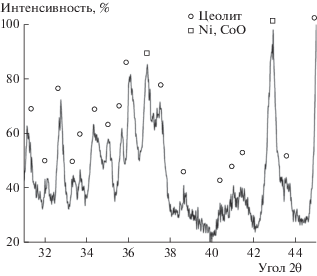
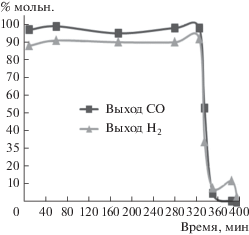
Испытания катализатора в ККМ неожиданно выявили нестабильность его работы в периодическом режиме (рис. 8). После 5.5 ч пробега, последующего охлаждения и повторного разогрева катализатор оказался полностью неактивным в ККМ. Дифрактограмма порошка катализатора после ККМ (фрагмент приведен на рис. 9) содержит интенсивные рефлексы цеолита MFI (обозначены как ZSM-5) и слабые рефлексы смешанного оксида кобальта и никеля.
Рис. 8.
Результаты испытаний стабильности катализатора 1%Ni1%Co/MFIмв в ККМ (900°С; CH4/O2 = 2; W = 12 л/г катализатора в ч).
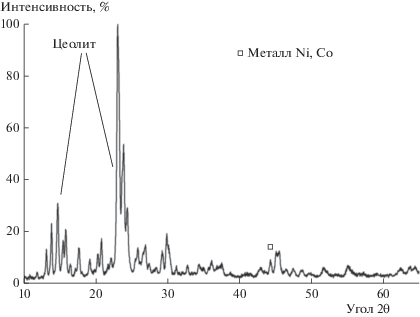
Была предпринята попытка повысить стабильность катализатора за счет увеличения содержания никеля и кобальта до 8 мас. %. Результаты испытаний в ККМ катализатора 8%Ni8%Co/MFIмв показаны на рис. 10.
Рис. 10.
Результаты испытаний стабильности катализатора 8%Ni8%CoMFIмв в ККМ (900°С; CH4/O2 = 2; W = 12 л/г катализатора в ч).
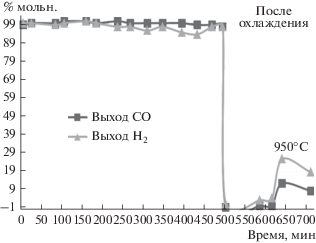
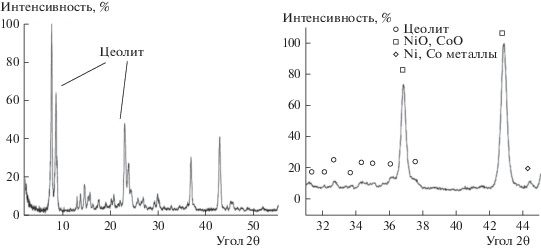
Катализатор демонстрировал высокий выход синтез-газа на протяжении 8 ч. Однако после охлаждения и повторного разогрева до 900–950°С его активность также не восстановилась. На дифрактограмме порошка катализатора после ККМ (рис. 11) наблюдаются интенсивные рефлексы цеолита MFI (обозначены как ZSM-5), слабые рефлексы смешанного оксида кобальта и никеля и крайне незначительные фрагменты, соотнесенные с металлическими частицами никеля и кобальта.
Возможной причиной потери активности никель-кобальтовых катализаторов, диспергированных в матрице цеолита MFI, может являться образование при охлаждении в кислородсодержащей смеси оксидов никеля и кобальта, преимущественно локализованных в цеолитной матрице и за счет этого устойчивых к восстановлению при повторной высокотемпературной обработке метан-кислородной смесью. Кроме того, присутствие в структуре цеолита значительного количества диоксида кремния может способствовать формированию на поверхности оксидов никеля и кобальта их силикатов, которые, согласно [14], препятствуют их восстановлению даже при использовании водорода.
В то же время, можно было ожидать, что при использовании катализаторов NiCoMFI в процессе УКМ, т.е. при отсутствии кислорода в газовом потоке, можно предотвратить формирование устойчивых к восстановлению форм оксидов никеля и кобальта.
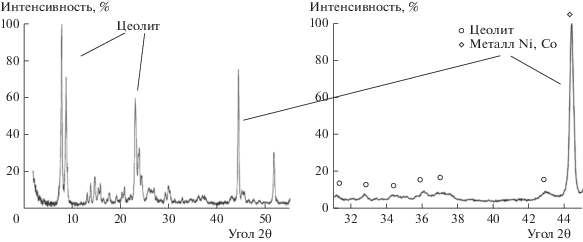
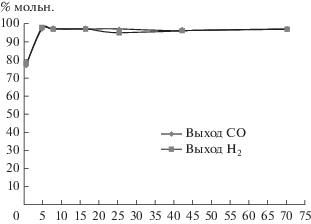
Результаты испытаний в УКМ катализаторов 1%Ni1%Co/MFIмв и 8%Ni8%Co/MFIмв, показанные на рис. 12, 13, подтвердили это предположение. Видно, что в отличие от опытов по ККМ, катализаторы сохраняют стабильность и показывают высокий выход синтез-газа. Дифрактограммы порошков катализаторов после УКМ (рис. 14, 15) указывают на присутствие металлических частиц – активных центров УКМ, при отсутствии заметных количеств оксидов никеля и кобальта.
Рис. 12.
Результаты испытаний стабильности катализатора 1%Ni1%CoMFIмв в УКМ (900°С; CH4/СO2 = 1; W = 15 л/г катализатора в ч).
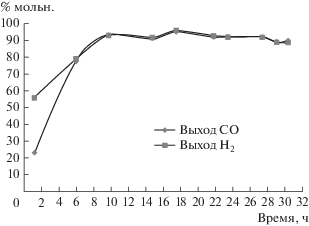
Рис. 13.
Результаты испытаний стабильности катализатора 8%Ni8%Co/MFIмв в УКМ (900°С; CH4/СO2 = 1; W = 15 л/г катализатора в ч).
Таким образом, цеолит MFI, синтезированный гидротермально-микроволновым методом, предпочтителен в качестве носителя для никель-кобальтового катализатора в процессе УКМ, но неэффективен при проведении длительных экспериментов по ККМ в периодическом режиме. В то же время, можно ожидать, что непрерывные длительные испытания катализаторов NiCoMFI в процессе ККМ также не приведут к его дезактивации, однако это предположение требует экспериментального подтверждения.
ЗАКЛЮЧЕНИЕ
Проведены сравнительные испытания стабильности каталитического действия в реакциях ККМ и УКМ, не содержащих металлов платиновой группы Ni- и Ni–Co-катализаторов на носителях различной природы. Показано, что природа носителя (цеолит структуры MFI, алюмомагниевый гидроталькит, стабилизированный оксид церия, оксид неодима) существенно влияет на стабильность в реакции кислородной конверсии метана.
Ni−Co-катализатор, диспергированный в матрице оксида неодима, подвержен дезактивации в результате формирования неактивных оксидов никеля-кобальта и графитоподобных углеродных отложений.
Ni–Co–Mn-катализатор, диспергированный в матрице стабилизированного оксида церия, более стабилен, но не позволяет достичь высокого выхода водорода ввиду наличия компонентов – поставщиков активного решеточного кислорода.
Цеолит структуры MFI проявил себя как стабильный и селективный носитель Ni–Co-катализаторов в углекислотной конверсии метана. Однако при использовании в периодическом процессе кислородной конверсии метана происходит его дезактивация путем формирования оксидов никеля и кобальта, устойчивых к восстановлению в процессе ККМ.
Алюмомагниевый гидроталькит оказался предпочтительным носителем для никелевого катализатора, обеспечивающим стабильно высокий выход синтез-газа в процессах и кислородной, и углекислотной конверсии метана. Этот катализатор может быть рекомендован для практической реализации указанных процессов.
Работа выполнена при поддержке Российского научного фонда (грант 14-13-01007П, синтез катализаторов, каталитические эксперименты), Президиума РАН, программа № 33 “Углеродная энергетика: химические аспекты” (исследование свойств катализаторов) и Минобрнауки России (государственное задание “Ведущие исследователи на постоянной основе”, проект 4.6718.2017/6.7, анкета № 1422).
Список литературы
Holmen A. // Catal. Today. 2009. V. 142. P. 2.
Enger B.C., Lødeng R., Holmen A. // Appl. Cat. A. 2008. V. 346. P. 1.
Zeng S., Zhang X., Fu X., Zhang L., Su H., Pan H. // A-ppl. Cat. B. 2013. V. 136–137. P. 308.
Bertau M., Offermanns H., Plass L., Schmidt F., Wernicke H.-J. (Eds). Methanol: The Basic Chemical and Energy Feedstock of the Future. Asinger’s Vision Today. Heidelberg: Springer, 2014. 677 p.
Rodrigues L.M.T.S., Silva R.B., Rocha M.G.C., Bargiela P., Noronha F.B., Brandão S.T. // Catal. Today. 2012. V. 197. P. 137.
Арутюнов В.С. Окислительная конверсия природного газа. М.: КРАСАНД, 2011. 640 с.
Chalupka K.A., Jozwiak W.K., Rynkowski J., Maniukiewicz W., Casale S., Dzwigaj S.// Appl. Catal. B. 2014. V. 146. P. 227.
Dedov A.G., Loktev A.S., Komissarenko D.A., Parkhomenko K.V., Roger A.-C., Shlyakhtin O.A., Mazo G.N., Moiseev I.I. // Fuel Processing Technology. 2016. V. 148. P. 128.
Дедов А.Г., Локтев А.С., Иванов В.К., Быков М.А., Мухин И.Е., Лиджиев М.М., Рогалева Е.В., Моисеев И.И. // ДАН. 2015. Т. 461. № 4. С. 426 [Doklady Physic. Chemistry. 2015. V. 461. № 2. P. 73].
Дедов А.Г., Локтев А.С., Данилов В.П., Краснобаева О.Н., Носова Т.А., Мухин И.Е., Тюменова С.И., Баранчиков А.Е., Иванов В.К., Быков М.А., Моисеев И.И. // Нефтехимия. 2018. Т. 58. № 3. С. 314 [Petrol. Chemistry. 2018. V. 58. № 5. P. 418].
Дедов А.Г., Локтев А.С., Мухин И.Е, Караваев А.А., Тюменова С.И., Баранчиков А.Е., Иванов В.К., Маслаков К.И., Быков М.А., Моисеев И.И. // Нефтехимия. 2018. Т. 58. № 2. С. 154 [Petrol. Chemistry. 2018. V. 58. № 3. P. 203].
Zagaynov I.V., Loktev A.S, Mukhin I.E., Dedov A.G., Moiseev I.I. // Mendeleev Commun. 2017. V. 27. P. 509.
Hou Z., Yashima T. // Applied Catalysis A: General 2004. V. 261. P. 205.
Андерсон Дж. Р. Структура металлических катализаторов. Пер. с англ. М.: Мир, 1978. 482 с.
Дополнительные материалы отсутствуют.