Нефтехимия, 2019, T. 59, № 3, стр. 271-281
Паровая конверсия метана и его смесей с пропаном в мембранном реакторе с промышленным никелевым катализатором и фольгой из сплава Pd–Ru
Л. П. Диденко 1, *, Л. А. Семенцова 1, П. Е. Чижов 1, Т. В. Дорофеева 1
1 Институт проблем химической физики РАН
Черноголовка, Россия
* E-mail: ludi@icp.ac.ru
Поступила в редакцию 11.08.2018
После доработки 01.10.2018
Принята к публикации 10.12.2018
Аннотация
Изучена паровая конверсия метана и его смесей, содержащих 5 и 10% пропана, в мембранном реакторе с промышленным никелевым катализатором марки НИАП-03-01 и мембраной в виде фольги толщиной 30 мкм из Pd–Ru-сплава. При Т = 823 K и объемной скорости сырья 1800 ч–1 происходит практически полная конверсия метана, селективность образования СО2 составляет более 50%, а из реакционной смеси отводится около 80% Н2. Высокая конверсия СН4 в мембранном реакторе в мягких условиях позволяет проводить паровой риформинг его смесей с С2+-алканами в едином процессе, что показано на примере модельных смесей, содержащих С3Н8. При выбранных условиях (Т = 773, 823 K; объемная скорость сырья 1800, 3600 ч–1, соотношение пар/метан 3 и 5, давление атмосферное) наблюдается практически полная конверсия С3Н8. Основной “нежелательной” реакцией является метанирование, приводящее к снижению показателя конверсии СН4. В исследуемой системе СН4 образуется при увеличении объемной скорости сырья. При соотношении пар/сырье = 3 метанирование происходит в результате гидрокрекинга С3Н8, а с увеличением указанного соотношения до 5 – при гидрировании СО2. Оптимальными условиями паровой конверсии смесей метана, содержащих до 10% С3Н8, являются Т = 823 K, соотношение пар/сырье = 5 и объемная скорость сырья 1800 ч–1. В этих условиях при вакуумировании пермеата наблюдается полная конверсия сырья, селективность образования СО2 составляет 50%, а из реакционной смеси отводится более 70% Н2.
ВВЕДЕНИЕ
Водород является наиболее перспективным экологически чистым энергоносителем, получаемым из природного сырья. В связи с быстрым развитием водородной энергетики спрос на это сырье возрастает. Особенно велика потребность в водороде высокой чистоты, который необходим, например, для низкотемпературных топливных элементов с полимерными протонообменными мембранами, где концентрация СО не должна превышать 10 ppm [1]. Основным промышленным методом получения Н2 является паровая конверсия метана на никелевых катализаторах, при которой одновременно происходят следующие реакции:
(1)
$\begin{gathered} {\text{С }}{{{\text{Н }}}_{4}} + {{{\text{Н }}}_{2}}{\text{О }} \leftrightarrow {\text{С О }} + 3{{{\text{Н }}}_{2}} \hfill \\ \Delta Н _{{_{{298}}}}^{0} = {\text{ }}206{\text{ к Д ж /м о л ь }}, \hfill \\ \end{gathered} $(2)
$\begin{gathered} {\text{С О }} + {{{\text{Н }}}_{2}}{\text{О }} \leftrightarrow {\text{С }}{{{\text{О }}}_{2}} + {{{\text{Н }}}_{2}} \\ \Delta Н _{{298}}^{0} = --41{\text{ к Д ж /м о л ь }}, \\ \end{gathered} $(3)
$\begin{gathered} {\text{С }}{{{\text{Н }}}_{4}} + 2{{{\text{Н }}}_{2}}{\text{О }} \leftrightarrow {\text{С }}{{{\text{О }}}_{2}} + 4{{{\text{Н }}}_{{2\quad}}} \\ \Delta Н _{{298}}^{0} = {\text{ }}165{\text{ к Д ж /м о л ь }}{\text{.}} \\ \end{gathered} $Типичный промышленный процесс получения Н2 включает высокотемпературную стадию паровой конверсии сырья (1), за которой следуют две стадии паровой конверсии СО по реакции водяного газа (2), протекающие при более низкой температуре и последующая стадия очистки Н2, которую в большинстве случаев осуществляют методом адсорбции при переменном давлении. Выход продуктов реакции ограничен термодинамическим равновесием и, вследствие высокой эндотермичности реакций (1) и (3), для достижения высокой конверсии метана требуются температуры выше 973 K. Например, конверсия метана более 80% может быть получена при температурах выше 1123 K. В качестве сырья в паровой конверсии используют природный газ, содержащий, помимо метана, 3–7 об. % С2+-углеводородов. Конкретный состав природного газа зависит от месторождения. Например, природный газ Уренгойского месторождения в России имеет следующий состав, %: метана – 87, этана – 6.2, пропана – 3.4, бутана – 1.98, пентана – 0.76, диоксида углерода – 0.12, азота – 1.1 [2]. Кроме природного газа, в качестве углеводородного сырья могут быть использованы попутные нефтяные газы (ПНГ), содержащие в среднем, %: 50–70 СН4, 5–10 С2Н6, 5–15 С3+, 1–10 N2, 1–10 СО2. Однако это ценное сырье используются крайне неэффективно. В России сжигается в факелах около 15.7 биллионов м3/год ПНГ, что составляет около 24% от общего количества и наносит существенный вред окружающей среде [3]. Паровая конверсия смеси метана с С2+-углеводородами в едином процессе невозможна, так как при высоких температурах из гомологов метана с высокой скоростью образуются углеродные отложения, дезактивирующие катализатор. Скорость этой реакции возрастает с температурой и увеличением количества атомов углерода в С2+-углеводороде. В связи с этим необходимо удалять С2+-углеводороды из сырья. В промышленном процессе с этой целью используют стадию предриформинга, в которой происходит паровая конверсия гомологов метана на никелевых катализаторах при температурах 673–773 K с образованием смеси метана, водорода и оксидов углерода [4, 5]. Для предотвращения образования углеродных отложений предриформинг проводят при соотношении пар/метан 2.5–4. Процесс включает необратимые реакции парового риформинга гомологов метана (СnHm, n ≥ 2):
(4)
$\begin{gathered} {{{\text{С }}}_{n}}{{{\text{H}}}_{m}} + n{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to n{\text{CO}} + (m{\text{/}}2 + n){{{\text{H}}}_{2}} \\ \Delta Н _{{298}}^{0} > 0, \\ \end{gathered} $(5)
$\begin{gathered} {{{\text{C}}}_{n}}{{{\text{H}}}_{m}} + 2n{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to n{\text{C}}{{{\text{O}}}_{2}} + (m{\text{/}}2 + 2n){{{\text{H}}}_{2}} \\ \Delta Н _{{298}}^{0} > 0. \\ \end{gathered} $Эти реакции сопровождаются реакцией водяного газа и обратимыми экзотермическими реакциями метанирования:
(6)
$\begin{gathered} {\text{С О }} + 3{{{\text{Н }}}_{2}} \leftrightarrow {\text{С }}{{{\text{Н }}}_{4}} + {{{\text{Н }}}_{2}}{\text{О }} \\ \Delta Н _{{298}}^{0} = --205.9{\text{ к Д ж /м о л ь }}, \\ \end{gathered} $(7)
$\begin{gathered} {\text{С }}{{{\text{О }}}_{2}} + 4{{{\text{Н }}}_{2}} \leftrightarrow {\text{С }}{{{\text{Н }}}_{4}} + 2{{{\text{Н }}}_{{\text{2}}}}{\text{О }} \\ \Delta Н _{{298}}^{0} = --164.7{\text{ к Д ж /м о л ь ,}} \\ \end{gathered} $(8)
$\begin{gathered} {{{\text{С }}}_{n}}{{{\text{H}}}_{m}} + (2n--m{\text{/}}2){{{\text{H}}}_{2}} \to n{\text{C}}{{{\text{H}}}_{4}} \\ \Delta Н _{{298}}^{0} < 0. \\ \end{gathered} $Реакция предриформинга может быть использована для получения Н2 и такую возможность активно исследуют [6–9]. Показано, что температура и соотношение пар/углеводород сходным образом влияют на конверсию этана, пропана и бутана на родиевом катализаторе и селективность образования продуктов [9]. Конверсия смеси, содержащей 86.7% СН4, 8.1% С2Н6, 2.0% С3Н8 и 0.4% С4Н10, происходит в 2-х температурных областях: ниже 673–723 K этан, пропан и бутан почти полностью превращаются в смесь Н2 и оксидов углерода, а конверсия СН4 происходит при дальнейшем увеличении температуры [9]. В принципе, для проведения паровой конверсии смеси метана и его ближайших гомологов в едином процессе необходимо снизить температуру превращения метана. С этой целью можно использовать мембранную технологию, объединяющую реакционный процесс и отвод Н2 через мембрану. В результате этого смещается равновесие термодинамически ограниченной реакции паровой конверсии метана, что позволяет достигать высокой конверсии при более низких температурах. Помимо снижения температуры реакции, одновременная конверсия СН4 и его ближайших гомологов в мембранном реакторе позволяет исключить такие стадии традиционного процесса паровой конверсии природного газа, как предриформинг, доокисление СО по реакции водяного газа и тонкая очистка Н2 от СО. В целом, это значительно упростит технологическую схему и снизит энергозатраты. Эта актуальная проблема является предметом исследования в данной работе.
Представленные в литературе данные показывают, что в мембранном реакторе возможно достичь высокой конверсии метана при температурах 723–873 K [10–12]. Наиболее часто в реакции используют Ni-катализатор, что обусловлено его высокой активностью, доступностью и низкой ценой. Кроме Ni, в реакции также активны Ru, Rh, Ir, Pt. В качестве водородселективного мембранного материала наиболее перспективны палладиевые сплавы, что обусловлено уникальными свойствами палладия – каталитической поверхностью, на которой молекулы Н2 диссоциируют на атомы, диффундирующие с высокой скоростью в металлической решетке, а также способностью палладия поглощать большой объем водорода, превышающий в 600 раз его собственный объем. Для получения водорода высокой чистоты наиболее подходят плотные палладиевые мембраны (фольги), обладающие 100% водородоселективностью. Они уступают композиционным палладиевым мембранам по водородопроницаемости из-за более высокой толщины, но имеют такие существенные преимущества, как простота изготовления, легкость соединения с конструктивными элементами мембранного модуля и регенерации. Увеличение производительности палладиевой фольги может быть достигнуто в результате использования сплавов Pd с некоторыми легирующими добавками, повышающими Н2-проницаемость, например, 93%Pd–7%Y, 60%Pd–40%Cu, 94%Pd–6%Ru, 93.5%Pd–6%In-0.5%Ru [13, 14]. Получение тонкой (до 7 мкм) конденсированной фольги из таких сплавов с использованием метода магнетронного распыления позволит достичь дальнейшего увеличения водородопроницаемости [15–17].
Принципиальная возможность паровой конверсии смесей СН4 с С2+-гомологами в мембранном реакторе показана в работе [18]. Авторы представили мембранный риформер для получения водорода высокой чистоты паровой конверсией природного газа при температурах 768–813 К. В работе использовали природный газ постоянного состава, содержащий 88.5% СН4, 4.6% С2Н6, 5.4% С3Н8 и 1.5% С4Н10 и не исследовали влияние изменения состава сырья на показатели мембранного процесса. Вместе с тем, содержание С2+ в сырье может изменяться в зависимости от месторождения, что может влиять на конверсию сырья и селективность образования продуктов паровой конверсии в мембранном реакторе.
В данной работе в качестве модельных выбраны смеси метана, содержащие 5 и 10% С3Н8. Исследована паровая конверсия смесей при варьировании температуры, объемной скорости сырья и соотношения пар/метан.
Цель работы – оптимизировать условия мембранного процесса для получения максимальной конверсии в реакции паровой конверсии смесей метана с пропаном.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Мембранный реактор. Фольга толщиной 30 мкм из сплава Pd–6%Ru предоставлена сотрудниками лаборатории № 12 Института металлургии и материаловедения РАН (ИМЕТ РАН, МОСКВА). Заготовки под фольгу получали плавкой в электродуговой печи в инертной атмосфере. Фольгу заданной толщины получали холодным прокатом с промежуточными вакуумными отжигами. Мембрана из фольги имела форму диска диаметром 56 мм (эффективная площадь поверхности 15.2 см2). Для поддержания механической прочности ее помещали между сетками тонкого плетения из нержавеющей стали. Мембранный реактор включал отделения подвода сырья (ретантат) и отвода Н2 (пермеат), между которыми помещали мембрану. Конструкция реактора подробно описана в [19]. В отделении ретантата поддерживали атмосферное давление. Движущую силу для отвода Н2 из реакционной смеси через мембрану создавали, снижая парциальное давление Н2 в отделении пермеата. С этой целью в отделение пермеата противотоком сырью с заданной скоростью (150 см3/мин) подавали отводящий газ – азот. В некоторых экспериментах для отвода Н2 из отделения пермеата использовали вакуумирование.
Изучение паровой конверсии углеводородного сырья. В качестве сырья использовали как 100%-ный СН4, так и его смеси, содержащие 5 и 10 об. % С3Н8. В отделение ретантата помещали 2 см3 (3.35 г) промышленного никелевого катализатора паровой конверсии природного газа марки НИАП-03-01 (производитель ООО “НИАП-КАТАЛИЗАТОР”, г. Новомосковск). Сырье смешивали с водяным паром в требуемом соотношении и подавали с заданной скоростью на катализатор через отверстия, расположенные по периферии отделения ретантата, а образующиеся продукты отводили через центральное отверстие и пропускали через холодильник для конденсирования непрореагировавшей воды. Объемную скорость “сухих” газов, содержащих непрореагировавший СН4, Н2, СО, СО2, на выходе из реактора измеряли, используя пенный расходомер, и подавали в хроматограф. Состав продуктов анализировали в режиме реального времени с использованием хроматографа “Кристалл-5000” с ПИД и детектором по теплопроводности. Содержание Н2 в продуктах реакции определяли на колонке с молекулярными ситами 13Х (2 мм × 2 м, 50°С, газ-носитель – аргон). Углеводородный состав продуктов определяли на колонке НР-Al/KCl (0.5 мм × 30 м, 80°С, газ-носитель – гелий). Содержание СО и СО2 определяли на колонке с активированным углем (2 мм × 2 м, 100°С, газ-носитель − гелий). Для расчета содержания продуктов использовали метод абсолютной калибровки.
Расходы газовых потоков контролировали регуляторами расхода газа РРГ-12 (“Элточприбор”, г. Зеленоград). Нагрев реактора осуществляли электрической печью. Для контроля за температурой в реакторе и в печи использовали хромель-алюмелевые термопары.
Конверсию метана (α, %), селективность образования продуктов (S, %) и отвод Н2 через мембрану (${\varphi }$, %) рассчитывали по формулам:
Катализатор, используемый в виде зерен фракции 0.2–0.4 мм, предварительно обрабатывали непосредственно в реакторе смесью (60% Н2–40% Ar) – пар в течение 60 мин при температуре эксперимента (предварительные эксперименты показали, что изменение температуры предварительной обработки катализатора в интервале 773–973 К не влияет на его активность).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Эксперименты с 100%-ным метаном
Первоначально эксперименты выполняли в отсутствие С3Н8. Их цель – установить условия реакции, позволяющие максимально снизить температуру, сохранив высокие показатели конверсии метана в мембранном реакторе. Влияние отвода Н2 через мембрану на конверсию метана и селективность образования продуктов устанавливали на основании сравнения с экспериментами без отвода Н2 (“немембранная” реакция), в которых вместо мембраны устанавливали газонепроницаемую перегородку из нержавеющей стали. В большинстве представленных в литературе исследований используют повышенное давление в отделении ретантата мембранного реактора. Несмотря на неблагоприятное влияние на положение термодинамического равновесия исследуемой реакции, повышение давления позволяет увеличить скорость потока Н2 через мембрану, что, в целом, положительно влияет на конверсию сырья. Однако, атмосферное давление более предпочтительно, если рассматривать применение паровой конверсии углеводородного сырья в мелкомасштабных установках с топливными элементами для получения электроэнергии, где проблематично применение компрессорных установок высокого давления [20]. С учетом этого в данной работе реакцию исследовали при атмосферном давлении.
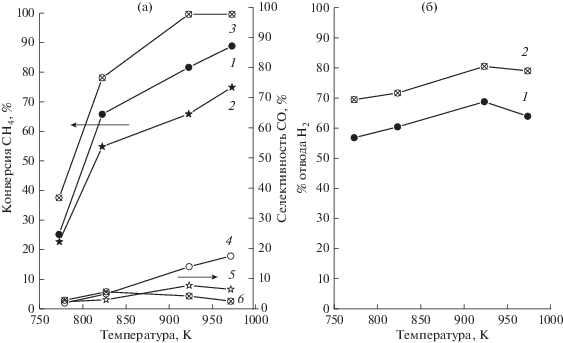
Влияние температуры. Влияние температуры на конверсию метана и селективность образования СО при объемной скорости сырья 3600 ч–1 и соотношении пар/метан = 3, показано на рис. 1 а. Можно видеть, что с увеличением температуры конверсия СН4 и селективность образования СО возрастают (кривые 1, 4) и превышают соответствующие показатели “немембранной” реакции, представленные кривыми 2, 5. Эти зависимости отражают благоприятное влияние температуры как на эндотермическую реакцию (1), так и на скорость потока Н2 через мембрану. По сравнению с экспериментами без отвода Н2 конверсия метана при 973 K увеличивается на 15.5%. При уменьшении температуры возрастание конверсии относительно “немембранной” величины становится меньше, а при 773 K его нет вовсе. Это может быть обусловлено снижением отвода Н2 через мембрану при уменьшении температуры. Например, он составляет 64–68% при 923–973 K и 57% при 773 K (рис. 1 б, кривая 1). Причиной более низкого отвода Н2 может быть уменьшение его парциального давления в реакционной смеси при уменьшении температуры. Увеличить отвод Н2 можно, откачивая его из отделения пермеата с использованием вакуумного насоса, что позволяет снизить давление Н2 в пермеате до 3 мм рт.ст. Можно видеть, что при вакуумировании отвод Н2 возрастает до 79–80% в интервале 923–973 К, а при 773 K составляет 70% (рис. 1 б, кривая 2). Вследствие увеличения отвода Н2 конверсия метана в температурном интервале 923–973 K возрастает до 100%, а при 773 K – до 38% (рис. 1 а, кривая 3).
Эти результаты отражают особенность протекания мембранного процесса, в котором условием максимального увеличения конверсии в мембранном реакторе является близость скоростей образования Н2 и его отвода через мембрану, что экспериментально показано во многих работах, например, [21–24]. По-видимому, в исследуемой системе при использовании отводящего газа указанный баланс скоростей не достигается, что в наибольшей мере проявляется при 773 К, где увеличения конверсии метана относительно “немембранного” значения вообще не наблюдается (рис. 1а, кривые 1, 2). В экспериментах с вакуумированием пермеата скорость отвода Н2 из реакционной смеси возрастает, что приводит к увеличению конверсии метана во всем температурном интервале. Селективность образования СО выше “немембранного” значения и с увеличением температуры это различие увеличивается (рис. 1а, кривые 4, 5), что объясняется снижением его расхода по экзотермической реакции (2) водяного газа. При вакуумировании пермеата селективность СО2 увеличивается, а СО значительно снижается (рис. 1а, кривая 6) вследствие его расходования по реакции водяного газа.
Рис. 1.
(а) Зависимость конверсии метана (кривые 1, 2, 3) и селективности образования СО (кривые 4, 5, 6) от температуры. Объемная скорость сырья 3600 ч–1; пар/метан = 3. 1, 4 – с отводом Н2 (расход отводящего газа 150 см3/мин); 2, 5 – без отвода Н2,3, 6 – вместо отводящего газа использовали вакуумирование пермеата. (б) Влияние температуры на отвод Н2 через мембрану. Для отвода Н2 использовали: 1 – отводящий газ; 2 – вакуумирование пермеата.
Влияние объемной скорости сырья. Влияние объемной скорости метано-паровой смеси на конверсию метана и селективность образования СО и СО2 при 823 К и соотношении пар/метан = 3 показано на рис. 2а. Можно видеть, что конверсия метана увеличивается при снижении объемной скорости сырья от 8.0% при 9600 ч–1 до 78% при 1800 ч–1 (кривая 1). Это обусловлено возрастанием как времени контакта сырья с катализатором, так и отвода Н2 от 40% при 9600 ч-1 до 70% при 1800 ч–1.
Рис. 2.
Зависимость конверсии метана (1), селективности образования СО2 (2) и СО (3) от объемной скорости сырья при соотношении пар/метан 3 (а) и от соотношения пар/метан при объемной скорости 3600 ч–1 (б). Т = 823 К.
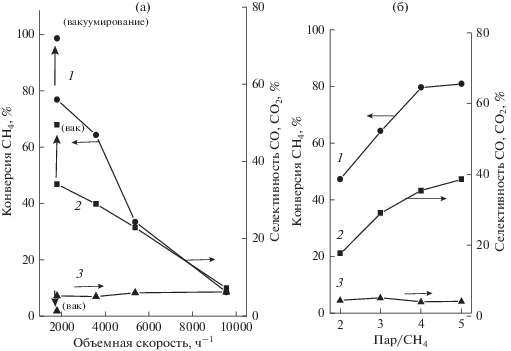
Селективность образования СО2 возрастает от 7% при 9600 ч–1 до 34% при 1800 ч–1 (кривая 2). При этом селективность СО изменяется незначительно – в интервале 7.1–6.2% (кривая 3). При увеличении отвода Н2 путем вакуумирования пермеата селективность СО2 увеличивается до 50% при 1800 ч–1, а конверсия метана до 100% (показано стрелками на кривых 1 и 2). СО2 образуется в результате расходования СО, селективность которого снижается (показано стрелкой на кривой 3). Эти данные показывают, что на селективность образования СО2 по реакции 2 водяного газа значительно влияет возрастание скорости отвода Н2 через мембрану. Даже при увеличении температуры до 973 K, что неблагоприятно для экзотермической реакции 2, при низких объемных скоростях сырья, составляющих 1800 и 3600 ч–1, вакуумирование пермеата приводит к снижению селективности СО вследствие его расходования на образование СО2 (рис. 3).
Влияние соотношения пар/метан. Реакцию паровой конверсии метана обычно проводят при соотношении пар/метан, превышающем стехиометрическое. Во-первых, это необходимо для увеличения конверсии СН4 и, во-вторых, для предотвращения образования углеродных отложений. Возможность использования более низкой температуры в мембранном реакторе позволяет в значительной мере снизить выход углеродных отложений, вследствие чего можно применять более низкое соотношение пар/метан. Однако, для увеличения селективности образования СО2 требуется более высокое соотношение. Поэтому существует оптимум, составляющий 2.0–4.0, который обычно используют в мембранном процессе. Влияние соотношения пар/метан на конверсию метана и селективность образования оксидов углерода в мембранном реакторе при Т = 823 K и объемной скорости метано-паровой смеси 3600 ч–1 показано на рис. 2б. Можно видеть, что с увеличением соотношения от 2 до 5 конверсия метана увеличивается от 45 до 80% (кривая 1), селективность образования СО незначительно снижается от 5.0 до 4.7% (кривая 3), а СО2 возрастает от 20 до 40% (кривая 2). Несмотря на то, что при увеличении избытка пара происходит разбавление реакционной смеси и парциальное давление Н2 снижается, увеличивающаяся конверсия метана компенсирует негативное влияние разбавления и поэтому в целом, отвод Н2 возрастает от 45% при соотношении 2–3 до 50% при соотношении 4–5.
В целом, представленные результаты показывают, что в исследуемой каталитической системе в мягких условиях (атмосферное давление и 823 K) в мембранном реакторе можно достичь 80%-ной конверсии метана при расходах метано-паровой смеси 1800–3600 ч–1. Увеличение скорости потока Н2 через мембрану при вакуумировании пермеата приводит к практически полной конверсии СН4 и селективности образования СО2 около 50%. С учетом этого, исследование смесей метана с пропаном выполнено при температурах 773 и 823 K, объемных скоростях сырья 1800 и 3600 ч–1 и соотношениях пар /сырье 3 и 5.
Эксперименты со смесями метана и пропана Паровая конверсия С2+-алканов, а также их смесей с метаном исследована преимущественно в “немембранных” реакциях. Основное влияние на конверсию алкана и селективность образования продуктов оказывают температура и соотношение пар/сырье. При низком соотношении (0.39–0.58) в температурном интервале 423–598 K, наряду с реакцией паровой конверсии алкана, происходят представленные выше реакции (6) и (7), приводящие к образованию СН4 [25]. При конверсии смеси, содержащей 17 об. % С3Н8, 34 об. % СН4 и 49 об. % Н2О, на никелевом катализаторе НИАП-18 в температурном интервале 523–723 К происходят как паровая конверсия пропана, так и гидрокрекинг по реакции (8), приводящий к увеличению содержания СН4, причем, селективность образования СН4 возрастает с уменьшением температуры [26]. Полная конверсия С2+-алканов при взаимодействии с паром наблюдается в температурном интервале 723–773 К, то есть реакция практически необратима. Однако, одновременно с паровой конверсией происходят реакции гидрирования оксидов углерода с образованием СН4, которые ограничены термодинамическим равновесием, что препятствует достижению высокой конверсии С2+-алкана. Поэтому, целесообразно проводить эти реакции в мембранном реакторе, где отвод Н2 через мембрану позволяет снизить вклад этих реакций и, таким образом, увеличить конверсию алкана и выход Н2. Это подтверждено в работе [28], где представлены результаты изучения паровой конверсии пропана в мембранном реакторе с кипящим слоем никельсодержащего промышленного катализатора RR-212 (производитель Haldor Topsoe) и мембраной в виде фольги из Pd77Ag23-сплава при температурах 723–823 K и показано значительное увеличение конверсии пропана по сравнению с “немембранной” реакцией. Реакцию исследовали при низком расходе сырья, составляющем 0.595 мл/мин, и температуре 798 K. В этих условиях выход Н2 составил 9.26 молей, что близко к теоретически возможному максимуму, равному 10 молей на моль пропана. Однако в ходе исследований Н2-селективность мембраны снижалась из-за появления дефектов. В данной работе паровую конверсию смесей метана с пропаном в мембранном реакторе изучали при значительно более высоких объемных скоростях сырья, составляющих 1800 ч–1 и 3600 ч–1, и температурах 773 и 823 K, выбранных в результате описанных выше результатов экспериментов с 100%-ным СН4. В табл. 1 и 2 представлены результаты исследования смесей, содержащих 5 и 10% С3Н8, при соотношениях пар/сырье 3 и 5 соответственно. Для отвода Н2 из реакционной смеси через мембрану использовали как отводящий газ, так и вакуумирование пермеата. Можно видеть, что при всех условиях наблюдается практически полная конверсия С3Н8.
Таблица 1.
Показатели паровой конверсии метана и его смесей с пропаном при соотношении пар/сырье 3
| Смесь | Содержание в ретантате, % (в расчете на сухой остаток) | Конверсия, % | Селективность, % | Отвод Н2, % | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| СН4 | СО | СО2 | Н2 | СН4 | С3Н8 | СО | СО2 | ||||||
| отв. газ | вакууми-рование | отв. газ |
отв. газ | вакууми-рование | отв. газ | вакууми-рование | отв. газ | вакууми-рование | |||||
| Т = 773 К, объемная скорость сырья 3600 ч–1 | |||||||||||||
| 100% СН4 | 38.0 | 2.2 | 24.5 | 37.6 | 27.4 | 37.6 | – | 2.1 | 5.1 | 24.0 | 30.0 | 57.8 | 68.1 |
| + 5% С3Н8 | 40.9 | 2.6 | 22.3 | 35.0 | 30.9 | 65.7 | 99.8 | 2.5 | 1.9 | 21.5 | 34.6 | 61.0 | 68.1 |
| + 10% С3Н8 | 39.1 | 4.0 | 20.4 | 36.0 | 34.8 | 68.2 | 100 | 4.0 | 2.5 | 21.3 | 32.5 | 65.2 | 61.7 |
| Т = 773 К, объемная скорость 1800 ч–1 | |||||||||||||
| 100% СН4 | 18.2 | 3.2 | 30.7 | 50.3 | 43.6 | 80.8 | – | 2.8 | 1.0 | 28.7 | 43.2 | 59.4 | 78.9 |
| + 5% С3Н8 | 14.2 | 2.6 | 32.1 | 51.5 | 58.4 | 74.8 | 99.9 | 2.4 | 3.0 | 30.0 | 47.0 | 54.6 | 76.8 |
| + 10% С3Н8 | 18.4 | 2.5 | 34.2 | 44.6 | 63.2 | 91.4 | 99.8 | 2.5 | 1.1 | 34.3 | 51.4 | 69.3 | 77.6 |
| Т = 823 К, объемная скорость 3600 ч–1 | |||||||||||||
| 100% СН4 | 16.4 | 6.9 | 26.3 | 51.8 | 64.4 | 78.4 | – | 6.2 | 11.0 | 23.6 | 44.0 | 51.9 | 73.6 |
| + 5% С3Н8 | 20.0 | 7.9 | 25.6 | 47.8 | 60.7 | 92.4 | 99.3 | 7.5 | 2.7 | 22.7 | 40.2 | 65.9 | 77.3 |
| + 10% С3Н8 | 26.0 | 8.4 | 22.0 | 44.8 | 56.8 | 60.8 | 99.9 | 8.0 | 9.9 | 20.8 | 26.3 | 62.8 | 73.7 |
| Т = 823 К, объемная скорость 1800 ч–1 | |||||||||||||
| 100% СН4 | 6.9 | 5.5 | 35.0 | 52.8 | 77.2 | 98.8 | – | 5.3 | 1.4 | 34.3 | 49.8 | 54.4 | 76.9 |
| + 5% С3Н8 | 5.7 | 4.8 | 36.4 | 53.1 | 84.0 | 97.5 | 100 | 4.7 | 2.8 | 35.8 | 57.9 | 62.1 | 75.1 |
| + 10% С3Н8 | 7.5 | 5.3 | 34.9 | 52.0 | 80.2 | – | 100 | 5.4 | – | 36.2 | – | 64.1 | – |
Таблица 2.
Показатели паровой конверсии метана и его смесей с пропаном при соотношении пар/сырье 5
| Смесь | Содержание в ретантате, % (в расчете на сухой остаток) | Конверсия, % | Селективность, % | Отвод Н2, % | |||||||||
| СН4 | СО | СО2 | Н2 | СН4 | С3Н8 | СО | СО2 | ||||||
| отв. газ | вакууми-рование | отв. газ |
отв. газ | вакууми-рование | отв. газ | вакууми-рование | отв. газ | вакууми-рование | |||||
| Т = 773 К, объемная скорость сырья 3600 ч–1 | |||||||||||||
| 100% СН4 | 12.0 | 1.3 | 26.5 | 58.8 | 60.5 | – | – | 1.4 | – | 29 | – | 42.3 | |
| + 5% С3Н8 | 14.7 | 2.5 | 26.0 | 55.9 | 59.7 | 75.1 | 99.7 | 2.4 | 2.4 | 28.1 | 39.8 | 63.7 | 68.4 |
| + 10% С3Н8 | 16.1 | 2.4 | 27.7 | 54.9 | 46.9 | 71.9 | 98.7 | 2.2 | 2.2 | 26.1 | 50.2 | 50.3 | 68.8 |
| Т = 773 К, объемная скорость 1800 ч–1 | |||||||||||||
| 100% СН4 | 4.4 | 1.6 | 36.0 | 57.1 | 93.5 | 95.8 | – | 1.8 | 2.7 | 40.0 | 53.6 | 78.9 | 82.5 |
| + 5% С3Н8 | 4.1 | 1.3 | 33.3 | 61.5 | 91.5 | 86.0 | 99.8 | 1.3 | 0.8 | 33.3 | 53.0 | 69.1 | 69.8 |
| + 10% С3Н8 | 5.7 | 1.7 | 39.5 | 53.0 | 84.4 | 97.6 | 100 | 1.8 | 1.2 | 36.0 | 57.0 | 63.3 | 79.9 |
| Т = 823 К, объемная скорость 3600 ч–1 | |||||||||||||
| 100% СН4 | 5.6 | 3.8 | 29.0 | 60.6 | 82.7 | 96.6 | – | 4.0 | 1.4 | 28.0 | 43.1 | 59.3 | 68.4 |
| + 5% С3Н8 | 6.7 | 2.4 | 26.5 | 62.9 | 93.2 | – | 100 | 2.7 | – | 30.1 | – | 41.0 | – |
| + 10% С3Н8 | 12.3 | 8.5 | 28.2 | 53.9 | 62.9 | 91.2 | 99.6 | 8.1 | 5.9 | 26.9 | 53.1 | 54.5 | 75.8 |
| Т = 823 К, объемная скорость 1800 ч–1 | |||||||||||||
| 100% СН4 | 5.1 | 5.6 | 36.6 | 54.2 | 92.4 | 97.0 | – | 5.4 | 6.3 | 35.4 | 50.1 | 81.2 | 80.7 |
| + 5% С3Н8 | 0.6 | 1.8 | 35.0 | 63.2 | 99.1 | 98.5 | 99.9 | 1.9 | 0.6 | 35.7 | 53.1 | 64.1 | 76.6 |
| + 10% С3Н8 | 0.3 | 1.5 | 32.3 | 66.2 | 99.2 | 99.6 | 99.9 | 1.4 | 1.7 | 31.0 | 50.2 | 58.2 | 70.3 |
Как показано выше, в общем виде для алканов СnНm, их взаимодействие с паром может происходить по реакциям (4)–(8). На примере изучения “немембранной” реакции паровой конверсии смеси метана, содержащей 17% С3Н8 и 49% Н2О, в температурном интервале 523–753 К показано, что, в зависимости от температуры, С3Н8 превращается по следующим реакциям [26]:
при температурах менее 623 K:
(5а)
${{{\text{С }}}_{{\text{3}}}}{{{\text{Н }}}_{{\text{8}}}} + 6{{{\text{Н }}}_{{\text{2}}}}{\text{О }} \to 3{\text{С }}{{{\text{О }}}_{{\text{2}}}} + 10{{{\text{Н }}}_{2}},$(8а)
${{{\text{С }}}_{{\text{3}}}}{{{\text{Н }}}_{{\text{8}}}} + 2{{{\text{Н }}}_{2}} \to 3{\text{С }}{{{\text{Н }}}_{{\text{4}}}},$(7а)
${\text{С }}{{{\text{О }}}_{2}} + 4{{{\text{Н }}}_{2}} \leftrightarrow {\text{С }}{{{\text{Н }}}_{4}} + {\text{2}}{{{\text{Н }}}_{{\text{2}}}}{\text{О }}$при температуре выше 623 K преимущественно происходит паровая конверсия С3Н8 с образованием СО и последующие превращения СО по реакциям с Н2 и Н2О:
(4а)
${{{\text{С }}}_{{\text{3}}}}{{{\text{Н }}}_{{\text{8}}}} + 3{{{\text{Н }}}_{{\text{2}}}}{\text{О }} \to 3{\text{С О }} + 7{{{\text{Н }}}_{{\text{2}}}}{\text{О }},$(6а)
${\text{С О }} + 3{{{\text{Н }}}_{2}} \leftrightarrow {\text{С }}{{{\text{Н }}}_{4}} + {{{\text{Н }}}_{{\text{2}}}}{\text{О }},\quad\quad\quad\quad\quad\quad\quad\quad\quad\quad$(2а)
${\text{С О }} + {{{\text{Н }}}_{{\text{2}}}}{\text{О }} \leftrightarrow {\text{С }}{{{\text{О }}}_{2}} + {{{\text{Н }}}_{2}}.$Можно видеть, что схема превращения пропана, наряду с реакциями паровой конверсии (4а), (5а), включает реакции метанирования (6а), (7а), (8а). Образование метана нежелательно, поскольку снижает показатель конверсии. С учетом этого, при анализе данных табл. 1 и 2 основное внимание уделено определению условий, при которых могут происходить эти нежелательные реакции. Влияние С3Н8 устанавливали, сравнивая данные для смесей и 100%-ного СН4 при одинаковых условиях. Представленные в табл. 1 данные показывают, что при соотношении пар/сырье 3 увеличение содержания СН4 в продуктах реакции наблюдается только при Т = 823 К и объемной скорости сырья 3600 ч–1 и это приводит к снижению конверсии метана от 64.4% для 100%-ного СН4 до 56.8% для его смеси, содержащей 10% С3Н8. Увеличение скорости отвода Н2 из продуктов реакции путем вакуумирования пермеата не оказывает заметного влияния на конверсию метана, также при этом мало изменяются селективности образования СО и СО2. Эти данные позволяют предположить, что к образованию СН4 приводит необратимая реакция (8а). По-видимому, в результате снижения времени контакта сырья с катализатором при увеличении объемной скорости сырья превращение С3Н8 происходит не только по реакции паровой конверсии, но по реакции гидрокрекинга. С уменьшением объемной скорости до 1800 ч–1 гидрокрекинг С3Н8 не наблюдается и метан и пропан превращаются по реакциям паровой конверсии и водяного газа, на что указывают близкие составы продуктов и величины конверсии. Результаты аналогичных исследований при соотношении пар/сырье = 5, представленные в табл. 2, показывают, что, как при 773 K, так и при 823 K, более высокое содержание СН4 в продуктах наблюдается также при более высокой объемной скорости сырья, составляющей 3600 ч–1. В результате этого конверсия СН4 из смесей с С3Н8 ниже, чем в отсутствие С3Н8, и составляет 46.9% при Т = 773 K и 62.9% при 823 K.
Рис. 3.
Влияние объемной скорости сырья на конверсию метана (1, 2) и селективность образования СО (3, 4); Т = 973 К, пар/метан = 3. 1, 3 – эксперимент с отводящим газом; 2, 4 – эксперимент с вакуумированием пермеата.
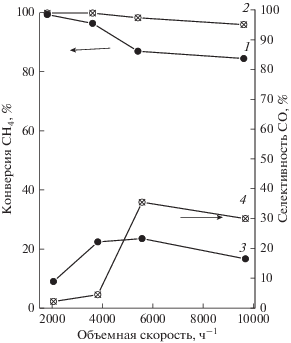
При вакуумировании пермеата эти показатели значительно возрастают, при этом также увеличивается селективность образования СО2. Влияние увеличения скорости отвода Н2, наблюдающееся при вакуумировании пермеата, на конверсию метана указывает на обратимый характер реакции, по которой он может образовываться. Этой реакцией может быть обратимая реакция (7а) гидрирования СО2. В пользу этого предположения свидетельствует возрастание селективности СО2 при увеличении конверсии метана. При объемной скорости 1800 ч–1 состав продуктов и конверсия метана и его смесей с С3Н8 близки, то есть образования СН4 не происходит. Практически полная конверсия СН4 из смеси, содержащей 10% С3Н8, получена при вакуумировании пермеата при 823 К и объемной скорости 1800 ч–1. В этих условиях селективность образования СО2 составляет 53%, а из смеси отводится более 70% Н2.
Стабильность катализатора и мембраны
Каталитические реакции конверсии алканов осложнены образованием углеродных отложений. В мембранном реакторе их выход, как правило, возрастает, что обусловлено уменьшением стабилизирующего действия Н2 при снижении его содержания в реакционной смеси. Углеродные отложения могут накапливаться в слое катализатора, в результате чего снижается его активность. Кроме того, в результате образования углеродных отложений на поверхности мембраны может снижаться ее водородопроницаемость и появляться дефекты, приводящие к снижению Н2-селективности. Стабильность исследуемой каталитической системы в мембранном реакторе изучали с использованием в качестве сырья смеси метана, содержащей 5% С3Н8, при Т = 823 K, объемной скорости 3600 ч–1 и соотношении пар/сырье = 3. Для отвода Н2 использовали отводящий газ. Установлено, что в течение 50 ч конверсия метана изменялась в пределах 60–62%, селективность образования СО и СО2 составляла 7.0–8.5% и 21–23% соответственно, что указывает на устойчивость катализатора к дезактивации углеродными отложениями. Отвод Н2 через мембрану изменяется в пределах 65–67%, то есть водородопроницаемость мембраны постоянна. Согласно хроматографическому анализу, в пермеате содержится только Н2, что свидетельствует об отсутствии дефектов в мембране. Что касается ресурса мембраны, то она сохраняла водородопроницаемость и бездефектность в течение всех экспериментов, результаты которых представлены в данной работе, что составляет около 350 ч.
ЗАКЛЮЧЕНИЕ
Исследована реакция паровой конверсии метана и его смесей, содержащих 5 и 10% С3Н8, на промышленном никелевом катализаторе марки НИАП-03-01, соотношениях пар/сырье 3 и 5, объемных скоростях 1800 и 3600 ч–1. Результаты экспериментов с 100%-ным СН4 показали, что проведение реакции в мембранном реакторе позволяет достичь высокой конверсии сырья в мягких условиях. При атмосферном давлении, Т = = 823 K, объемной скорости сырья 1800 ч–1 и соотношениях пар/метан 3–5 конверсия метана составляет 80−90%. При увеличении скорости отвода Н2 из реакционной смеси вакуумированием пермеата наблюдается практически полная конверсия СН4, селективность образования СО2 составляет более 50%, а из реакционной среды отводится около 80% Н2. Этот результат показывает, что в мембранном реакторе возможно конвертировать смеси метана с ближайшими гомологами, что продемонстрировано на примере модельных смесей, содержащих 5 и 10% С3Н8. Паровая конверсия смесей изучена при атмосферном давлении, температурах 773 и 823 K, объемных скоростях сырья 1800 и 3600 ч–1 и соотношениях пар/сырье 3 и 5. В этих условиях наблюдается полная конверсия пропана. Одновременно с паровой конверсией С3Н8 могут происходить реакции метанирования. Их протекание нежелательно, поскольку приводит к снижению показателя конверсии. Установлено, что при выбранных условиях образование СН4 наблюдается при более высокой объемной скорости сырья, составляющей 3600 ч–1. При соотношении пар/сырье, равном 3, образование СН4 наблюдается при 823 K. Предположено, что в этих условиях СН4 образуется в результате необратимой реакции гидрокрекинга С3Н8. С увеличением указанного соотношения до 5 метан образуется как при 773, так и при 823 K, в результате протекания обратимой реакции гидрирования СО2. С увеличением скорости отвода Н2 путем вакуумирования пермеата вклад этой реакции снижается, что приводит к увеличению конверсии. В целом, представленные результаты показывают, что в мембранном реакторе возможно выполнять паровую конверсию смесей СН4, содержащих до 10% С3Н8. Исследование паровой конверсии смеси метана, содержащей 5% С3Н8, в течение 50 часов при 823 K, соотношении пар/сырье 3 и объемной скорости сырья 3600 ч–1 показало, что каталитическая система не дезактивируется, а мембрана сохраняет Н2 проницаемость и бездефектность. Полученные результаты показывают, что наиболее благоприятными условиями паровой конверсии смесей метана, содержащих до 10% С3Н8, являются температура 823 K, соотношение пар/сырье = 5 и объемная скорость сырья 1800 ч–1. В этих условиях при вакуумировании пермеата наблюдается полная конверсия сырья, селективность образования СО2 составляет 50%, а из реакционной смеси отводится около 70% Н2.
Работа выполнена в рамках Программы фундаментальных научных исследований государственных академий наук на 2013–2020 гг., шифр темы 0089-2014-0032.
Список литературы
Peighambardoust S.J., Rowshanzamir S., Amjjadi M. // J. Hydrogen Energy. 2010. V. 35. P. 9349.
Скрылев С.А. // Энергетическая стратегия. https:// www.syl.ru/article/228523/new_himicheskiy-sostav-prirodnogo-gaza2012. №2. С. 15.
Kozodoev I.V., Kuzin N.A., Amosov Yu.I., Kirillov V.A., Kireenkov V.V. // Industry Ecol. North. 2011. V. 11. P. 40.
Фалькович Г.С., Ростанин Н.Н., Виленскеий Л.М., Немира К.Б., Нефедов Б.К., Топчий В.А. // Катализ в промышленности. 2003. № 3. С. 10.
Арутюнов В.С., Крылов О.В. Окислительные превращения метана. М.: Наука, 1998. С. 26.
Aasberg-Petersen K., Dybkjaer I., Ovesen C.V., Schjodt N.C., Sehested J., Thomsen S.G. // J. Natural Gas Sci. Eng. 2011.V. 3. P. 423.
Yoon S., Bae J. // Catalysis Today. 2010. V. 156. P. 49.
Wang Xu., Zou X., Wang Xi., Lu X., Ding W. // Int. J. Hydrogen Energy. 2011. V. 36. P. 4908.
Schadel B.T., Duisberg M., Deutschmann O. // Catalysis Today. 2009. V. 142. P. 42.
Chen Y., Wang Y., Xu H., Xiong G. // Applied Catalysis B: Environmental. 2008. V. 80. P. 283.
Saric M., Delft Y.C., Sumbharaju R., Meyer D.F, Groot A. // Catalysis Today. 2012. V. 193. № 1. P. 74.
Matsumura J.Y., Tong J. // Top. Catal. 2008. V. 51. № 1–4. P. 283.
Burkhanov G., Gorina N., Kolchugina N., Roshan N. // Platinum Metals Rev. 2011. V. 55. № 1. P. 3.
Didenko L., Savchenko V., Sementsova L., Bikov L. // Int. J. Hydrogen Energy. 2016. V. 41. P. 307.
Иевлев В.М., Солнцев К.А., Донцов А.И., Максименко А.А., С.В. Канныкин С.В. // Журн. технической физики. 2016. Т. 86. № 3. С. 149.
Иевлев В.М., Максименко А.А., Ситников А.И., Солнцев К.А., Чернявский А.С., Донцов А.И. // Материаловедение. 2016. № 2. С. 37.
Иевлев В.М., Бурханов Г.С., Максименко А.А., Белоногов Е.К., Донцов А.И., Рошан Н.Р. // Конденсированные среды и межфазные границы. 2013. Т. 15. № 2. С. 121.
Shirasaki Y., Tsuneki T., Ota Y., Yasuda I., Tachibana S., Nakajima H. // Int. J. Hydrogen Energy. 2009. V. 34. P. 4482.
Диденко Л.П., Семенцова Л.А., Чижов П.Е., Бабак В.Н., Савченко В.И. // Изв. Академии наук. Серия хим. 2016. № 8. С. 1997 [Russian Chem. Bulletin, Intern. Ed. 2016. V. 65. № 8. P. 1997].
Campanari S., Macchi E., Manzolini G. // Int. J. Hydrogen Energy. 2008. V. 33. P. 1361.
Ciavarella P., Casanave D., Moueddeb H., Miachon S., Fiaty K., Dalmon J.-A. // Catalysis Today. 2001. V. 67. P. 177.
L.van Dyk, Miachon S., Lorenzen L., Torres M., Fiaty K., Dalmon J.-A. // Catalysis Today. 2003. V. 82. № 1–4. P. 167.
Miachon S., Dalmon J.-A. // Topics in Catalysis. 2004. V. 29. P. 59.
Диденко Л.П., Савченко В.И., Семенцова Л.А., Чижов П.Е. // Мембраны и мембранные технологии. 2016. Т. 6. № 1. С. 1 [Petrol. Chemistry. 2016. V. 56. № 5. P. 459].
Zyryanova M.V., Snytnikov P.V., Shigarov A.B., Belyaev V.D., Kirillov, Sobyanin V.A. // Fuel. 2014. V. 135. P. 76.
Зырянова М.М., Бадмаев С.Д., Беляев В.Д., Амосов Ю.И., Снытников П.В., Кириллов В.А., Собянин В.А. // Катализ в промышленности. 2013. № 3. С. 22.
Schadel B.T., Duisberg M., Deutschmann O. // Catalysis Today. 2009. V. 142. P. 42.
Rarib M.A., Grace J.R., Lim C.J., Elnashaie S.S.E.H. // Int. J. Hydrogen Energy. 2010. V. 35. P. 6276.
Дополнительные материалы отсутствуют.


