Нефтехимия, 2019, T. 59, № 3, стр. 289-296
Каталитическое разложение метилформиата в присутствии комплексов переходных металлов, фосфиновых лигандов и воды
Д. Н. Горбунов 1, *, В. А. Семернина 1, М. В. Теренина 1, Ю. С. Кардашева 1, А. Л. Максимов 1, 2, Э. А. Караханов 1
1 Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
2 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
* E-mail: suskab_91@mail.ru
Поступила в редакцию 02.11.2018
После доработки 01.12.2018
Принята к публикации 10.12.2018
Аннотация
Изучены закономерности каталитического разложения метилформиата на газообразные компоненты в присутствии комплексов переходных металлов, фосфиновых лигандов и воды. Показано, что на монометаллических и биметаллических Rh/Ru-катализаторах метилформиат может быть превращен в газовые смеси с высоким содержанием водорода. Такие смеси пригодны для использования в реакциях гидроформилирования, гидроаминометилирования и гидроформилирования–ацетализации, что позволяет рассматривать метилформиат как альтернативный источник синтез-газа в оксо-процессах.
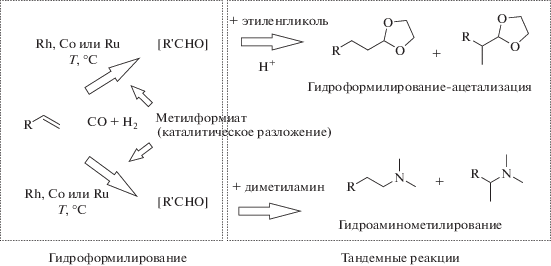
В настоящее время внимание исследователей привлекает использование для проведения различных процессов с участием моноксида углерода альтернативных источников синтез-газа, таких как метилформиат (МФ), формальдегид и муравьиная кислота [1–3]. Известно, что каталитическое разложение метилформиата в присутствии воды (одна из разновидностей реакции водяного сдвига) приводит к образованию смеси газов, основными компонентами которой являются монооксид углерода и водород. Доступность и относительно низкая стоимость МФ делают перспективным более широкое привлечение его в качестве сырья для нефтехимии. Использование МФ для проведения реакций гидроформилирования, а также тандемных реакций гидроформилирования–ацетализации и гидроаминометилирования основано на возможности образования из него монооксида углерода, а при определенных условиях – смеси оксида углерода, диоксида углерода и водорода (рис. 1).
Рис. 1.
Гидроформилирование и тандемные реакции на основе гидроформилирования с использованием метилформиата в качестве альтернативного источника синтез-газа.
В настоящей работе проведено исследование состава газовой смеси, образующейся при разложении МФ в зависимости от условий проведения процесса – состава катализатора, присутствия лигандов и количества воды в реакционной смеси.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Метилформиат, фосфиновые лиганды P(Cy)3, PPh3, P(OPh)3, Xantphos, и TPPTS, а также амины HNEt2 и NEt3 (“Sigma-Aldrich”) были использованы без предварительной подготовки. Подготовка растворителей выполнена по стандартным методикам. Синтез использованных комплексов переходных металлов выполнен согласно описанным в литературе методикам: Rh(acac)(CO)2 [4], Ru3(CO)12, [5], Rh(cod)2BF4 [6], Co(acac)3 [7].
Анализ методом газо-жидкостной хроматографии проводили на хроматографе “HP-6990” с ДИП, капиллярной колонкой длиной 50 м, заполненной фазой SЕ-30 при программировании температуры, газ-носитель – гелий.
ИК-спектры комплексов снимали на ИК-Фурье спектрометре марки “Nicolet IR200” в диапазоне 300–4000 см–1. Образцы таблетировали в бромиде калия (2%).
Анализ методом газовой хроматографии проводили на хроматографе “Chrom-5” с катарометром, набивной колонкой длиной 3 м, заполненной фазой PORAPAK-Q при температуре 25°С, газ-носитель – аргон.
Общая методика разложения метилформиата. Разложение проводили в стальном автоклаве емкостью 7 мл в интервале температур 130–200°С. В автоклав загружали 2.0 мл МФ (32 ммоль) и соответствующее количество металлокомплекса (железа, марганца, никеля, кобальта, рутения, родия и палладия) (0.0156–0.025 ммоль), донорного лиганда (PPh3, PCy3, HNEt2, Xanthos, TPPTS) (0.16–0.4 ммоль), воды (1.6–2.8 ммоль). Затем автоклав закрывали и нагревали до требуемой температуры. Реакцию вели при постоянном перемешивании в течение заданного времени (2 ч). Затем автоклав охлаждали до комнатной температуры и проводили определение состава образующейся газовой смеси методом газовой хроматографии. Процедуру отбора газов проводили с использованием обратного водного затвора. Жидкую фазу анализировали с использованием внутреннего стандарта (этанол).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
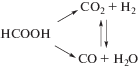
Известно, что при термическом разложении МФ (100–200°С) могут протекать следующие процессы [8–10]:
(1)
${\text{HCOOC}}{{{\text{H}}}_{{\text{3}}}} \to {\text{C}}{{{\text{O}}}_{{\text{2}}}} + {\text{C}}{{{\text{H}}}_{4}},$(2)
${\text{HCOOC}}{{{\text{H}}}_{{\text{3}}}} \to {\text{CO}} + {\text{C}}{{{\text{H}}}_{3}}{\text{OH}},$Термодинамически наиболее выгодно разложение по пути (1), однако этот вариант наименее интересен для проведения других реакций. Самый изученный процесс – распад до монооксида углерода и метилового спирта, т.е. путь (2), декарбонилирование, протекающее в присутствии катализаторов на основе соединений переходных металлов [11–15]. Каталитическое разложение МФ в присутствии воды (одна из разновидностей реакции водяного сдвига), приводит к образованию смеси газов, основными компонентами которой являются монооксид углерода и водород (3). Наличие в реакционной системе воды делает возможным протекание следующих ступеней разложения эфира [16]:
(2)
${\text{HCOOC}}{{{\text{H}}}_{{\text{3}}}} \to {\text{CO}} + {\text{C}}{{{\text{H}}}_{3}}{\text{OH}},$(4)
${\text{CO + }}{{{\text{H}}}_{2}}{\text{O}} \to {\text{C}}{{{\text{O}}}_{{\text{2}}}} + {{{\text{H}}}_{2}},$(5)
${\text{HCOOC}}{{{\text{H}}}_{{\text{3}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{HCOOH}} + {\text{C}}{{{\text{H}}}_{3}}{\text{OH}},$Первая ступень представляет собой декарбонилирование метилформиата и может катализироваться как комплексами металлов, так и основаниями (например, аминами). Генерирование водорода в системе возможно за счет реакции водяного сдвига, катализируемого, в частности, рутениевыми комплексами с донорными фосфиновыми лигандами. Наличие водорода необходимо для осуществления вышеуказанных реакций, в связи с этим, исследование разложения МФ в различных условиях, в том числе и в присутствии реагентов и катализаторов, которые предполагается использовать в гидроформилировании (прежде всего фосфорных лигандов и комплексов металлов), представляется актуальным.
В работе проведено варьирование компонентов каталитической системы и их соотношений, при этом оценивалась конверсия метилформиата, давление, создаваемое в реакторе, и содержание водорода в образующейся газовой смеси.
Установлено, что доля водорода в смесях колеблется от 45 до 90% в зависимости от природы металла и от количества добавленной воды (табл. 1). Так, для рутениевых комплексов доля водорода возрастает с 15 до 54% при небольшом избытке воды и приближается к 81% при высоких содержаниях воды. Уменьшение количества воды, напротив, влечет за собой уменьшение содержания водорода до 46% (строки 1–3 табл. 1). Активность комплексов родия и кобальта существенно ниже в разложении, однако и в этом случае образуются значительные количества водорода. Для комплексов кобальта при высоком содержании воды эта величина достигает даже 90% (строки 5, 6).
Таблица 1.
Разложение метилформиата в присутсвии комплексов и солей переходных металлов без добавления лигандов при различных соотношениях метилформиат/вода
| № | Катализатор | [HCOOCH3]/ [H2O] | Давление при Tкомн, МПа | Конверсия МФ, % | Содержание Н2, % |
|---|---|---|---|---|---|
| 1 | Ru3(CO)12 | 2.28 | 1.0 | 8 | 81 |
| 2 | Ru3(CO)12 | 11 | 3.0 | 21 | 54 |
| 3 | Ru3(CO)12 | 20 | 1.0 | 8 | 46 |
| 4 | Rh(acac)(CO)2 | 11 | <0.5 | 12 | 46 |
| 5* | Co(acac)3 | 2.85 | <0.5 | 2 | 90 |
| 6 | Co(acac)3 | 2.85 | <0.5 | 2 | 90 |
Полученные данные свидетельствуют о том, что в процесс образования водорода вовлекается не только монооксид углерода, но и образующийся метанол. Следует отметить, что сама реакция образования метанола в результате пароводяной конверсии в относительно мягких условиях известна уже давно. Согласно [17] реакция
Нами также была изучена кинетика превращения МФ при различных температурах. Как следует из данных, представленных на рис. 2, разложение протекает с большой скоростью, как в отсутствиe воды, так и в присутствии небольших количеств воды. В этом случае максимальное давление достигается уже за 60–70 мин. Причем увеличение количества катализатора ведет к увеличению общего выхода газообразных продуктов, но скорость нарастания давления несколько снижается. Возможно, это связано с наличием нескольких маршрутов разложения МФ с ростом количества катализатора. Увеличение температуры со 180 до 200°С ведет к резкому росту как скорости реакции, так и конечного давления в системе – оно оказывается почти на четверть выше.
Рис. 2.
Зависимость давления газовой смеси от времени при разложении метилформиата в различных условиях (0.032 моль метилформиата).
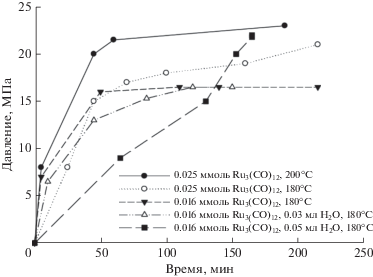
Добавление воды снижает общую величину скорости, нарастание давления происходит медленнее при отношении МФ/вода = 11, чем при отношении МФ/вода = 20. Если в последнем случае кинетическая кривая напоминает по форме кривые, полученные при отсутствии воды, то во втором, скорее речь идет о почти прямолинейной зависимости давления от времени, то есть свидетельствует о нулевом порядке реакции.
По-видимому, в этом случае с ростом количества воды возможно изменение общего маршрута разложения МФ. Первой стадией становится уже не декарбонилирование, а гидролиз МФ до метанола и муравьиной кислоты:
Последняя разлагается до водорода и диоксида углерода на рутениевых катализаторах, и до воды и монооксида углерода под действием температуры. Таким образом, реакция водяного сдвига во многом протекает через дегидрирование муравьиной кислоты.
Кроме того, она может непосредственно катализироваться без образования муравьиной кислоты комплексами рутения. Возможны и другие схемы процесса, предполагающие формирование Ru–H-соединений и отщепление протона от воды. Следует отметить, что согласно литературным данным в реакции по нескольким маршрутам могут участвовать как моноядерные, так и полиядерные комплексы рутения, что существенно осложняет механизм процесса [19–21].
Также нами было изучено влияние ряда параметров на катализируемое кобальтом разложение МФ (табл. 2).
Таблица 2.
Разложение метилформиата в присутствии ацетилацетоната кобальта
| [HCOOCH3]/[H2O] | [HCOOCH3]/[металл] | Конверсия МФ, % | Содержание Н2, % |
|---|---|---|---|
| 2.85 | 2280 | 1 | 90 |
| 2.85 | 1140 | 2 | 90 |
| 2.85 | 760 | 5 | 89 |
| 2.85 | 570 | 10 | 85 |
| 2.85 | 450 | 11 | 70 |
| 3.8 | 450 | 10 | 90 |
| 5.7 | 450 | 10 | 90 |
| 3.8 | 760 | 4 | 65 |
С ростом концентрации катализатора растет конверсия МФ и несколько сокращается доля водорода, хотя последняя оказывается существенно выше, чем характерная по простой стехиометрии доля в 66%. Это свидетельствует о процессах связывания углерода в негазообразные соединения, содержащие несколько атомов кислорода на один атом углерода. Уменьшение количества воды ведет к росту доли водорода, а одновременное уменьшение количества катализатора – к снижению конверсии и снижению доли водорода.
Следует отметить, что с увеличением времени проведения реакции доля водорода в конечной смеси несколько сокращалась, что свидетельствует с одной стороны о его реакции с образованием негазообразных продуктов, а с другой – о росте выделения монооксида и диоксида углерода, не сопровождаемом реакцией водяного сдвига из-за существенного уменьшения имеющейся концентрации воды в системе. Указанная закономерность наблюдается при различных концентрациях катализатора (табл. 3), причем она значительно более ярко выражена при увеличении концентрации катализатора.
Можно предположить, что уменьшение доли водорода связано с образованием большей доли карбонильных комплексов кобальта в системе со временем. Действительно, при использовании нитрата кобальта в качестве источника металла, в системе образуется 45% водорода, а при использовании карбонила кобальта при росте конверсии метилформиата в газовой смеси содержится 20% водорода.
Модификацию предложенных каталитических систем разложения МФ производили добавлением ряда лигандов. Выбор лигандов определялся различной донорной способностью указанных систем и различной степенью стерических затруднений. Данные по разложению МФ в отсутствие дополнительных добавок воды с использованием комплексов родия и рутения приведены в табл. 4.
Таблица 4.
Разложение метилформиата с добавлением лигандов в безводной среде
| № | Катализатор | Лиганд | [L]/[металл] | Давление при Tкомн, МПа | Конверсия МФ, % | Содержание Н2, % |
|---|---|---|---|---|---|---|
| 1 | Ru3(CO)12 | PCy3 | 10.00 | <0.5 | 3 | <1 |
| 2 | Ru3(CO)12 | PPh3 | 10.00 | <0.5 | 0.3 | 2 |
| 3 | Ru3(CO)12 | HNEt2 | 10.00 | <0.5 | 1 | 12 |
| 4 | Rh(acac)(CO)2 | PCy3 | 40.00 | 10.0 | 70 | 35 |
| 5 | Rh(acac)(CO)2 | PPh3 | 40.00 | <0.5 | 1 | 24 |
| 6 | Rh(acac)(CO)2 | HNEt2 | 40.00 | <0.5 | 1 | <5 |
Следует отметить, что добавление лигандов незначительно влияет на количество образующегося водорода. Кроме того, конверсия МФ оказывается небольшой за одним исключением: высокую активность проявил комплекс родия с высокодонорным фосфином – трициклогексилфосфином при значительном избытке указанного фосфина. При этом для указанного комплекса максимальна доля водорода – 35%. Учитывая отсутствие воды, речь в данном случае, скорее всего, может идти о дегидрировании метанола до формальдегида, причем данный процесс, по-видимому, протекает в значительной степени. Как минимум 30% от всего метанола подвергается дегидрированию с последующим декарбонилированием образующегося формальдегида. Эти данные подтверждаются имеющейся в литературе информацией по дегидрированию метанола под действием родиевых комплексов при нагревании.
С уменьшением отношения МФ/вода (табл. 5) наблюдается существенный рост давления конечной газовой смеси, причем при уменьшении такого отношения от 11 до 5.5 происходит резкий скачок давления в системе и, соответственно, многократный рост конверсии МФ.
Таблица 5.
Разложение метилформиата в присутствии комплексов рутения с трифенилфосфином в зависимости от соотношения метилформиат/вода
| [HCOOCH3]/[H2O] | Давление при Tкомн, МПа | Конверсия МФ, % | Содержание Н2, % |
|---|---|---|---|
| 11.00 | – | 4 | 47 |
| 5.50 | 2.0 | 18 | 50 |
| 2.75 | 4.0 | 28 | 75 |
| 1.00 | 7.0 | 48 | 86 |
Следует отметить, что с ростом количества воды также резко растет количество водорода в газовой смеси. Если при отношении равном 5.5 оно соответствует равновесному для разложения МФ и образованию смеси диоксида углерода и водорода, то при отношении близком к единице, в системе имеется уже 86% водорода. Анализ жидкой фазы на метиловый спирт показывает, что общему его количеству должно соответствовать почти в два раза большее конечное давление в системе. Это подтверждает выдвинутое нами предположение о том, что в процессе реакции часть образующегося диоксида углерода связывается в негазообразные соединения, растворимые в воде и (или) метаноле. При этом указанному процессу способствует увеличение количества воды. Как следствие, наблюдается резкое увеличение количества водорода в системе вплоть до 86%, а доля монооксида углерода оказывается не столь велика.
Данные по влиянию избытка лиганда на процесс разложения МФ приведены в табл. 6. Рост отношения лиганд/металл от 10 до 20 ведет к некоторому снижению активности, в особенности при увеличении доли воды в системе. Одновременно наблюдается существенное снижение доли водорода. Если при проведении реакции при отношении лиганд/металл, равном 10, доля водорода составляла 75%, то при проведении реакции с количеством лиганда, увеличенным в два раза – только 55%. По-видимому, при большом избытке фосфина подавляются как реакция водного сдвига, так и реакция дегидрирования метанола. Как следствие, давление и конверсия МФ падают не очень резко, а доля водорода, даже при большом количестве воды, не столь велика. В этом случае часть газа приходится на монооксид, а не диоксид углерода.
Таблица 6.
Разложение метилформиата в присутствии комплексов рутения с трифенилфосфином в зависимости от соотношения лиганд/металл
| [L]/[металл] | [HCOOCH3]/[H2O] | Давление при Tкомн, МПа | Конверсия МФ, % | Содержание Н2, % |
|---|---|---|---|---|
| 10.00 | 11.00 | <0.5 | 4 | 47 |
| 20.00 | 11.00 | <0.5 | 4 | 34 |
| 10.00 | 2.75 | 4.0 | 28 | 75 |
| 20.00 | 2.75 | 3.0 | 21 | 55 |
Интересные данные были получены при исследовании зависимости конверсии и содержания водорода в системе в зависимости от природы используемого лиганда (табл. 7).
Таблица 7.
Разложение метилформиата в присутствии различных комплексов рутения
| Лиганд | [L]/[металл] | [HCOOCH3]/[H2O] | Конверсия МФ, % | Содержание Н2, % |
|---|---|---|---|---|
| PPh3 | 10.00 | 2.75 | 28 | 75 |
| PPh3 | 10.00 | 11.00 | 4 | 47 |
| PCy3 | 10.00 | 2.75 | 30 | 70 |
| PCy3 | 10.00 | 11.00 | 25 | 38 |
| P(OPh)3 | 10.00 | 2.75 | 40 | 87 |
| XANTРHOS | 2.00 | 2.75 | 32 | 77 |
| HNEt2 | 10.00 | 11.00 | 4 | 62 |
| NEt3 | 10.00 | 11.00 | 7 | 26 |
Следует отметить, что высокую активность проявили комплексы с фосфорсодержащими лигандами. Комплексы с аминами продемонстрировали существенно меньшую активность в разложении МФ. Следует также указать на сравнительно высокую активность бидентантного лиганда типа XANTРHOS, который позволяет получать сравнительно высокие конверсии МФ при значительном содержании водорода в смеси.
Данные по использованию родиевых комплексов в реакции разложения МФ в присутствии добавок воды приведены в табл. 8.
Таблица 8.
Разложение метилформиата, катализируемое комплексами родия в присутствии воды
| № | Лиганд | [L]/[металл] | [HCOOCH3]/[H2O] | Давление при Tкомн, МПа | Конверсия МФ, % | Содержание Н2, % |
|---|---|---|---|---|---|---|
| 1* | PCy3 | 40.00 | 11.00 | 2.5 | 19 | 50 |
| 2* | PPh3 | 40.00 | 11.00 | <0.5 | 5 | 45 |
| 3* | NEt3 | 40.00 | 11.00 | 2.0 | 17 | 44 |
| 4* | PPh3 HNEt2 (P/N = 3) |
40.00 | 2.75 | 3.5 | 24 | 76 |
Особый интерес для дальнейших исследований представляло изучение разложения МФ в смешанной системе, содержащей как комплекс родия, так и комплекс рутения (табл. 9). Прежде всего, следует отметить тот факт, что система, содержащая оба металла и трициклогексилфосфин, оказывается существенно активнее, чем аналогичные монометаллические катализаторы. Наблюдается синергетический эффект, когда конверсия МФ возрастает до 38% против 19% для чисто родиевой системы и 30% для рутениевой. При этом наблюдается низкое содержание водорода в смеси – лишь 13% (около 50% в аналогичных условиях для монометаллических систем). Последнее означает, что в системе значительно количество монооксида углерода, что благоприятно для проведения реакции гидроформилирования.
Таблица 9.
Разложение метилформиата в присутствии биметаллической каталитической системы Ru3(CO)12 – Rh(acac)(CO)2
| Лиганд | [HCOOCH3]/[H2O] | Давление при Tкомн, МПа |
Конверсия МФ, % | Содержание Н2, % |
|---|---|---|---|---|
| PCy3 | 11.00 | 5.0 | 35 | 13 |
| PPh3 | 11.00 | <0.5 | 1 | 20 |
| TPPTS | 5.50 | 2.0 | 17 | 75 |
| TPPTS | 2.75 | 4.0 | 28 | 92 |
| P(OPh)3 | 2.75 | 4.5 | 32 | 85 |
| PPh3 + HNEt2 | 2.75 | 4.8 | 34 | 75 |
При использовании водорастворимого лиганда – сульфированного трифенилфосфина – наблюдаются сравнительно высокие конверсии МФ при значительном количестве водорода в системе. В этом случае из-за высокой растворимости лиганда в воде комплексы родия и рутения практически полностью находятся в водной фазе, что ведет к резкому росту скоростей реакции с участием воды и связывания диоксида углерода в водной среде. При отношении МФ/вода равном 2.75 количество образующегося водорода превышает в газовой смеси 90%, в то время как для фосфиновых комплексов при указанном соотношении оно не превышает 75%; при отношении 5.5 доля водорода составляет 75%, а для трифенилфосфиновой рутениевой системы – 50%.
Данные по разложению МФ в смешанной системе в присутствии трифенилфосфинового лиганда представлены в табл. 10. Как и в случае рутениевых систем, рост доли воды ведет к росту доли водорода в газообразных продуктах реакции и росту конверсии МФ.
Таблица 10.
Разложение метилформиата в смешанной системе трифенилфосфин–Ru3(CO)12– Rh(acac)(CO)2
| Лиганд | [HCOOCH3]/[H2O] | Давление при комн. т-ре, МПа | Конверсия МФ, % | Содержание Н2, % |
|---|---|---|---|---|
| PPh3 | 11.00 | <0.5 | 1 | 20 |
| PPh3 | 5.50 | 2.0 | 17 | 55 |
| PPh3 | 2.75 | 3.0 | 21 | 77 |
| PPh3* | 2.75 | 4.5 | 32 | 77 |
Важно также отметить, что рост количества лиганда не ведет, в отличие от рутениевой системы, к падению селективности по водороду и уменьшению конверсии МФ. Напротив, последняя возрастает почти в полтора раза при сохранении высокой доли водорода в системе. По-видимому, этот факт объясняется установлением системы равновесий между фосфиновыми комплексами родия и рутения в системе и различием в активности и селективности этих комплексов в разложении МФ: за селективность по водороду большей частью ответственны комплексы родия, за скорость разложения – рутениевый компонент системы.
ВЫВОДЫ И ДАЛЬНЕЙШИЕ ИССЛЕДОВАНИЯ
Полученные в исследовании экспериментальные данные позволяют утверждать, что наряду с реакциями разложения МФ на метанол и монооксид углерода и реакцией водяного сдвига протекает еще целый ряд процессов, которые существенно усложняют картину разложения и позволяют регулировать состав газообразной смеси. Дальнейшие исследования направлены на изучение возможности использования МФ в качестве альтернативного источника синтез-газа для проведения реакций гидроформилирования, гидроформилирования-ацетализации и гидроаминометилирования.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-33-01227.
Список литературы
Wu L., Liu Q., Jackstell R., Beller M. // Angew. Chem. Int. Ed. 2014. V. 53. P. 6310.
Börner A., Franke R. Hydroformylation: Fundamentals, Processes, and Applications in Organic Synthesis. V. 2. John Wiley & Sons, 2016.
Liu Q., Wu L., Jackstell R., Beller M. // ChemCatChem. 2014. V. 6. P. 2805.
Варшавский Ю.С., Черкасова Т.Г. // Журн. неорг. химии. 1967. Т. 1. № 12. С. 1709.
Bruce M., Jensen C., Jones N. // Inorg. Synth. 1989. V. 26. P. 259.
Schenck T., Downes J., Milne C., Mackenzie P., Boucher H. // Inorg. Chem. 1985. V. 24. P. 2334.
Bryant B., Fernelius W. // Inorg. Synth. 1957. V. 5. P. 188.
Karakhanov E., Maksimov A., Kardasheva Y., Runova E., Zakharov R., Terenina M., Kenneally C., Arredondo V. // Catal. Sci. Technol. 2014. V. 4. P. 540.
Jenner G. // Appl. Catal. A: Gen. 1995. V. 121. № 1. P. 25.
Zahalka H., Alper H., Sasson Y. // Organometall. 1986. V. 5. № 12. P. 2497.
Zahalka H., Alper H. // Tetrahedron Lett. 1987. V. 28. № 20. P. 2215.
Jenner G., Nahmed E. M., Leismann H. // J. Organometall. Chem. 1990. V. 387. № 3. P. 315.
Akuri S., Dhoke C., Rakesh K., Hegde S., Nair S., Deshpande R., Manikandan P. // Catal. Lett. 2017. V. 147. P. 1285.
Tsumoru M., Kiyomi K. // Angew. Chem. Int. Ed. Engl. 2004. V. 43. P. 5580.
Fuat E., Henry L., Alexis T. // J. Mol. Catal.: A. 2008. V. 288. P. 87.
Jenner G., Nahmed E. M., Libs-Kourath S. // J. Mol. Catal. 1991. V. 64. № 3. P. 337.
Morton D., Cole-Hamilton D., Utuk I., Paneque-Sosa M., Lopez-Poveda M. // J. Chem. Soc., Dalton Trans. 1989. № 3. P. 489.
Shinoda S., Itagaki H., Saito Y. // J. Chem. Soc.: Chem. Commun. 1985. № 13. P. 860.
Kang H., Mauldin C., Cole T., Slegeir W., Cann K., Pettit R. // J. Am. Chem. Soc. 1977. V. 99. № 25. P. 8323.
Kaneda K., Hiraki M., Sano K., Imanaka T., Teranishi S. // J. Mol. Catal. 1980. V. 9. № 2. P. 227.
Ryan R., Wilemon G., Dalsanto M., Pittman C. // J. Mol. Catal. 1979. V. 5. № 5. P. 319.
Дополнительные материалы отсутствуют.