Нефтехимия, 2019, T. 59, № 3, стр. 297-303
Биокомпозитные материалы для очистки водных сред, загрязненных углеводородами
Е. А. Иванова 1, *, Е. С. Лобакова 2, Р. К. Идиатулов 3, Т. Н. Шапиро 2, Д. А. Санджиева 1, 4, О. В. Кузнецова 1, Ю. Н. Зайцева 1, Х. С. Джабраилова 1, А. Г. Дедов 1, 4
1 Российский государственный университет нефти и газа (НИУ) имени И.М. Губкина
Москва, Россия
2 Московский государственный университет имени М.В. Ломоносова, Биологический факультет
Москва, Россия
3 АО “Научно-исследовательский институт синтетического волокна с экспериментальным заводом”
Тверь, Россия
4 Институт общей и неорганической химии РАН
Москва, Россия
* E-mail: dedov.a@gubkin.ru
Поступила в редакцию 01.11.2018
После доработки 27.11.2018
Принята к публикации 10.12.2018
Аннотация
Создан биокомпозитный материал на основе полимерной матрицы (сополимер акрилонитрила и метилметакрилата) с инкорпорированными биогенными элементами в виде свекольного жома и иммобилизованными штаммами бактерий или ассоциацией бактерий, выделенных из зараженных нефтепродуктов. Была показана высокая активность созданного материала в процессах очистки модельной морской воды от углеводородов (УВ).
ВВЕДЕНИЕ
Россия занимает одно из первых мест в мире по добыче нефти, однако, в ходе ее добычи, хранения и транспортировки могут происходить аварийные утечки, отравляющие почву и водоемы. Так, по оценкам Greenpeace в России порядка 4.5 млн т нефти в год попадает в окружающую среду в результате ее аварийных разливов [1]. Попадающие в водоемы нефть и нефтепродукты (Н и НП) существенно изменяют условия обитания всех видов живых организмов, а также негативным образом сказываются на здоровье людей, приводя к росту числа онкологических и других хронических заболеваний [2]. К настоящему моменту существует ряд методов ликвидации аварийных разливов Н и НП на акваториях и очистки сточных вод от Н и НП, но все они не являются универсальными и безупречными с экологической точки зрения. Поэтому в лабораториях во всем мире ведется поиск новых методов и разработка материалов для очистки сточных вод и акваторий от Н и НП [3–10].
Одним из путей решения этой проблемы может стать создание биокомпозитных материалов (БКМ) на основе нетканных полимерных матриц, растительных наполнителей и углеводородокисляющих микроорганизмов. Подобные материалы будут способны не просто сорбировать Н и НП из воды, но и биодеградировать их до углекислого газа и воды.
Ранее нами была разработана методология синтеза БКМ [11, 12]. Создание полимерных БКМ сложной иерархической структуры, включает в себя ряд последовательных этапов. На первом этапе выбор химической природы полимерной матрицы позволяет варьировать гидрофильно-гидрофобные свойства синтезируемого БКМ. Вторым этапом синтеза БКМ является обогащение матриц растительным наполнителем, содержащим биогенные элементы (фосфор, азот и др.), необходимыми микроорганизмам для роста и физиологической активности, которые, кроме того, создают для микроорганизмов среду обитания, близкую к естественной. Третий этап – иммобилизация микроорганизмов, обладающих необходимыми полезными свойствами, на наполненной полимерной матрице. Для создания БКМ в соответствии с этой методологией необходимо существенно расширить круг микроорганизмов, обладающих способностью эффективно биодеградировать УВ классов до экологически благоприятных продуктов и способных работать в составе БКМ как в виде индивидуальных штаммов, так и в составе ассоциации микроорганизмов.
Цель данной работы – исследование БКМ на основе штаммов и ассоциаций бактерий, выделенных из микробиологически зараженных нефтепродуктов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез БКМ. В качестве полимерной матрицы был выбран сополимер акрилонитрила и метилметакрилата (СПАН), в качестве растительного наполнителя, инкорпорированного в полимерную матрицу, – свекольный жом (ГОСТ Р 54901-2012). В качестве микроорганизмов для иммобилизации на наполненной полимерной матрице были использованы штаммы бактерий Ochrobactrum sp. и Deinococcus sp., выделенные из микробиологически зараженного реактивного топлива ТС-1.
Материалы на основе СПАН получали методом аэродинамического формования фильерным способом из расплава полимера. Для модификации полимерных волокон биогенными наполнителями использовали свекольный жом. Инкорпорирование осуществляли следующим образом: свекольный жом измельчали, вводили в расплав полимера и перемешивали (концентрация свекольного жома в расплаве полимера составляла 25%). Механические характеристики полученной полимерной матрицы с растительным наполнителем приведены в табл. 1.
Таблица 1.
Механические характеристики полимерной матрицы СПАН с наполнителем – свекольный жом
| Тип | Толщина, мм | Воздухопрони-цаемость, дм3/(м2 с) | Поверхностная плотность, г/м2 | Объемная плотность, г/см3 | Пористость, % | Наполнитель |
|---|---|---|---|---|---|---|
| СПАН | 1.58 | 108.5 | 159 | 0.1 | 91.5 | Жом свекольный |
Выделение и идентификацию штаммов бактерий из зараженного реактивного топлива ТС-1 проводили, как описано ранее [2].
Для получения БКМ использовали одинаковые по площади кусочки полимерной матрицы с растительным наполнителем (3 см2). Иммобилизацию клеток бактерий-деструкторов УВ и ассоциацию бактерий осуществляли адсорбционным методом на поверхность синтезированных матриц. Для этого в каждую колбу со средой с наращенной культурой микроорганизмов (объем 100 мл) помещали матрицы полимера с инкорпорированным свекольным жомом (3 × 3 см). Иммобилизацию проводили на орбитальном шейкере B. Braun RS-1-T (INFORS AG, Германия), скорость вращения 120 об\мин, температуре 24°С в течение 3 сут.
Были синтезированы БКМ на основе СПАН – свекольный жом – Ochrobactrum sp. (БКМ-1) и СПАН – свекольный жом – ассоциация бактерий Ochrobactrum sp. и Deinococcus sp. (БКМ-2).
Методы исследования биодеградации углеводородов в модельной водно-органической смеси (МС) бактериями и БКМ. Эксперименты по биодеградации УВ штаммами бактерий проводили в колбах Эрленмейера: в колбу вносили 100 мл среды Эванса и 1 мл смеси УВ (н-алканы: С15H32, С16H34, С18H38 и триметилбензол), затем в колбы вносили штаммы бактерий Ochrobactrum sp. и (или) Deinococcus sp., выращенные на твердой питательной среде Rich 10, микробиологической петлей (по 2 петли). Эксперименты по биодеградации УВ БКМ проводили в колбах Эрленмейера: в колбу вносили 100 мл искусственной морской воды и 1 мл смеси УВ (н-алканы: С15H32, С16H34, С18H38 и триметилбензол ), затем помещали образцы БКМ размером 9 см2 (3 × 3 см). В обоих случаях колбы помещали на орбитальный шейкер-инкубатор Ika KS 4000I control (IKA, Германия), перемешивание проводили со скоростью 150 об./мин непрерывно в течение 7, 14 и 21 сут при температуре 24–25°С. Состав искусственной морской воды представлен в табл. 2.
Таблица 2.
Состав искусственной морской воды
| Компоненты среды | Концентрация, мг/л |
|---|---|
| NaCl | 1750 (Cl–) |
| K2SO4 | 2500 (${\text{SO}}_{4}^{{2 - }}$) |
| KNO2 | 225 (${\text{NO}}_{2}^{ - }$) |
| KNO3 | 16.5 (${\text{NO}}_{3}^{ - }$) |
| KH2PO4 | 17.5 (${{{\text{H}}}_{2}}{\text{PO}}_{4}^{ - }$) |
Анализ остаточного содержания УВ проводили на 7, 14 и 21 сут эксперимента. В качестве контрольного образца использовали МС без внесенных бактерий или БКМ.
Выделение УВ из МС, осуществляли трехступенчатой экстракцией н-гексаном. Органические вытяжки объединяли, для удаления остаточной воды из экстракта использовали Na2SO4 б/в. Объем экстракта доводили гексаном до 80 мл.
Остаточные УВ из БКМ экстрагировали н-гексаном с использованием ультразвуковой ванны. Экстракцию проводили 3 раза, органические вытяжки объединяли, для удаления остаточной воды из экстракта использовали Na2SO4 б/в. Объем экстракта доводили гексаном до 80 мл.
Анализ массовых концентраций УВ в полученных пробах проводили методом ГЖХ.
Анализ содержания остаточных углеводородов в модельных смесях методом ГЖХ. Для анализа использовали газовый хроматограф YL 6100 с пламенно-ионизационным детектором (YL Instrument, Южная Корея). Разделение УВ проводили на неполярной кварцевой капиллярной хроматографической колонке TR-5MS, длинной 60 м, диаметром 0.25 мм, толщиной слоя неподвижной фазы 0.25 мкм, в качестве газа носителя использовали гелий, скорость потока газа-носителя составляла 3 мл/мин. Сбор и обработка хроматографических данных осуществляли с использованием программы “YL-Clarity”.
Сканирующая электронная микроскопия (СЭМ). Топографию заселения и распределения бактериальных клеток в БКМ-1 и БКМ-2 проводили с помощью сканирующей электронной микроскопии. Для этого образцы БКМ фиксировали в 2%-ном глютаровом альдегиде на кокадилатном буфере в течение 30 мин, затем обезвоживали в спиртах возрастающей концентрации (10–100% в течение 10 мин в каждом растворе) и помещали на ночь в 100%-ный ацетон. Образцы высушивали при критической точке на установке “Dryer HCP-2” (Hitachi, Япония), напыляли золотом с палладием на ионно-напылительной установке “IB-3 IonCoater” (Eiko, Япония) ) и изучали с использованием сканирующего микроскопа Hitachi 405–S (Япония) при ускоряющем напряжении 15 Кв и инструментальном увеличении 60–20000.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование активности бактерий Ochrobactrum sp. и Deinococcus sp. в процессах деструкции углеводородов. Биологическим “инструментом” БКМ являются микроорганизмы, которые должны эффективно перерабатывать УВ до углекислого газа и воды. Источником таких микроорганизмов может служить микробиологически зараженное топливо, приводившее к нештатной работе двигателя. Представляло интерес исследовать активность бактерий, выделенных из этого топлива, в процессах деструкции УВ в водно-органических средах. Нами были выделены штаммы бактерии из зараженного топлива ТС-1 и было проведено исследование их активности в процессах биодеградации УВ [13]. По результатам предварительных опытов для дальнейших исследований были выбраны монокультуры бактерий Ochrobactrum sp. и Deinococcus sp. и их ассоциация. Было показано, что оба вида бактерий проявили высокую активность в процессах биодеградации УВ, причем в обоих случаях конечными продуктами биодеградация УВ были только углекислый газ и вода. Следует отметить, что бактерий Ochrobactrum sp. и Deinococcus sp. проявили близкую активность в процессах биодеградации н-алканов, так биодеградация алканов монокультурами Ochrobactrum sp. и Deinococcus sp. составляла от 43% – для октадекана до 75% – для пентадекана (рис. 1).
Рис. 1.
Биодеградация углеводородов модельной смеси монокультурами Ochrobactrum sp. и Deinococcus sp. и их ассоциацией.
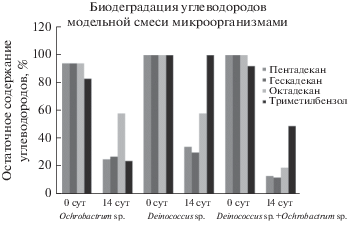
Ароматическое соединение – триметилбензол – биодеградировали только бактерии вида Ochrobactrum sp. (степень биодеградации составляла 75%), бактерии Deinococcus sp. оказались не способны утилизировать ароматические соединения. Наилучшие результаты были достигнуты при использовании ассоциации бактерий, включающей в себя обе культуры. Так, биодеградация алканов ассоциацией бактерий на 14 сут эксперимента составляла более 80%, а для триметилбензола – порядка 50% (рис. 1).
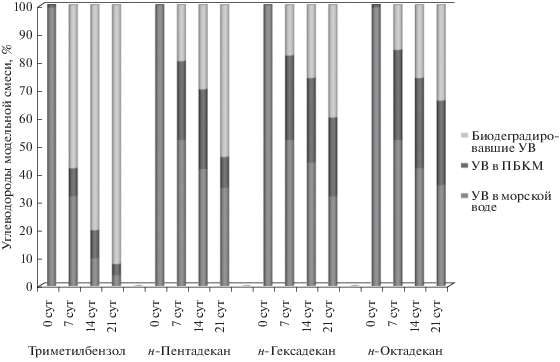
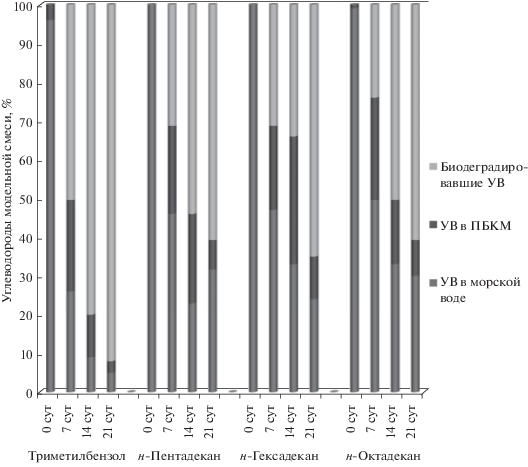
Биодеградация углеводородов в модельных смесях (углеводороды−морская вода) БКМ-1 и БКМ-2. Поскольку физиологические ответы клеточных популяций микроорганизмов в значительной степени зависят от условий их культивирования, для дальнейшего повышения метаболической активности ассоциации проводили иммобилизацию их клеток на полимерную волокнистую матрицу, так как культуры иммобилизованных на носителях клеток характеризуются сниженной скоростью роста при сохранении высокой скорости метаболизма. В качестве наполнителя, инкорпорированного в полимерную матрицу, задачей которого является обеспечение микроорганизмов необходимыми для их жизни биогенными элементами и создания среды обитания, близкой к естественной, мы использовали свекольный жом – промышленно производимый продукт, являющийся отходом сельскохозяйственного производства. Результаты процесса биодеградации УВ модельной смеси БКМ-1 и БКМ-2 представлены на рис. 2 и 3. Как видно на рис. 2 БКМ-1 проявил высокую активность в процессах биодеградации ароматического соединения – триметилбензола. Степень его биодеградации на 7 сут составила почти 60%, на 14 сут – более 80%, а на 21 – 93%. Биодеградация н-алканов БКМ-1 на 7 сут составляла около 20%, на 14 сут – около 30%, а на 21 сут для н-пентадекана – 55%, для н-гексадекана и н-октадекана – порядка 40% (с учетом УВ, находящихся в матрице БКМ-1). При этом содержание н-алканов в морской воде на 7 сут составляло около 50% от исходной концентрации, на 14 сут – около 40%, а на 21 сут – чуть более 30%.
БКМ-2 проявил аналогичную активность в процессах биодеградации триметилбензола, и более высокую – в процессах биодегадации н-алканов (рис. 3). Так, степень биодеградации триметилбензола на 7 сут составила почти 50%, на 14 сут – более 80%, а на 21 – 93%. Биодеградация н-алканов БКМ-2 на 7 сут она составляла около 30%, на 14 сут – около 50%, а на 21 сут – более 60% (с учетом количества УВ, находящихся в матрице БКМ-2). При этом содержание н-алканов в морской воде на 7 сут составляло около 45% от исходной концентрации, на 14 сут – около 30%, а на 21 сут – порядка 5%. Как видно, в составе БКМ бактерии, будучи защищенными полимерной матрицей, способны гораздо более эффективно утилизировать высокотоксичное ароматическое соединение, чем свободноживущие бактерии. Таким образом, синтезированные БКМ проявили высокую активность в очистке загрязненной углеводородами модельной морской воды, сходную с ранее созданными нами БКМ на основе полимерных матриц с растительными наполнителями (Sphagnum, растения семейства Lemnaceae) и ассоциацией бактерий Rodococcus gingshengii и Leicobacter ardicolles.
Исследование особенностей заселения полимерных матриц и развития микроорганизмов в составе БКМ методом СЭМ. При иммобилизации клеток ассоциации на носителях разной природы может меняться соотношение долей микроорганизмов в составе ассоциации получаемого БКМ и, как следствие, происходит изменение его активности. Процесс иммобилизации бактериальных клеток на волокнах полимерной матрицы может быть обусловлен, с одной стороны, эффективностью процесса адсорбции бактериальных клеток на поверхности волокон и, с другой, – отражать активное заселение волокон матрицы и межволоконного пространства вследствие размножения микробных клеток после прикрепления. Последнее может приводить к формированию на поверхности волокон и межволоконном пространстве матриц бактериальных микроколоний, флокул и биопленок вследствие активного деления клеток и (или) секреции или внеклеточного полимерного матрикса.
Модифицированная свекольным жомом волокнистая матрица представляет собой материал, образованный рыхло переплетающимися волокнами разной формы и диаметра: округлыми, диаметром 2–12 мкм и более толстыми уплощенными – шириной 25–30 мкм (рис. 4а). Поверхность волокон неровная имеет небольшие вдавления и желобки. Некоторые волокна имеют утолщения, в которых, по-видимому, локализованы фрагменты свекольного жома (рис. 4а указано стрелками).
Рис. 4.
Особенности распредения бактериальных клеток в БКМ: а – общий вид БКМ-1 (а) – Ochrobactrum sp., 0 сут); (б) – БКМ-2 – одиночные клетки и микроколонии бактерий разного морфотипана на поверхности волокна и многочисленные флокулы в бактериальной ассоциации в межволоконном пространстве; (в) – клетки Ochrobactrum sp. на поверхности волокон БКМ и флокула бактерий в мeжволоконном пространстве БКМ-1 на поверхности волокон матрицы на 1−21 сут); (г) – бактериальная ассоциация Ochrobactrum sp. и Deinococcus sp. БКМ-2 на поверхности образца (клетки Ochrobactrum sp. указаны стрелками); (д) – образование внеклеточного полимерного матрикса (указано стрелками) и формирование микроколоний бактериальной ассоциацией Ochrobactrum sp. и Deinococcus sp., на поверхности волокон матрицы на 14 сут); (е) – углубление в волокне матрицы, заполненное микроколонией ассоциации Ochrobactrum sp. и Deinococcus sp., 21 сут), клетки бактерий интегрированы во внеклеточный полимерный матрикс.
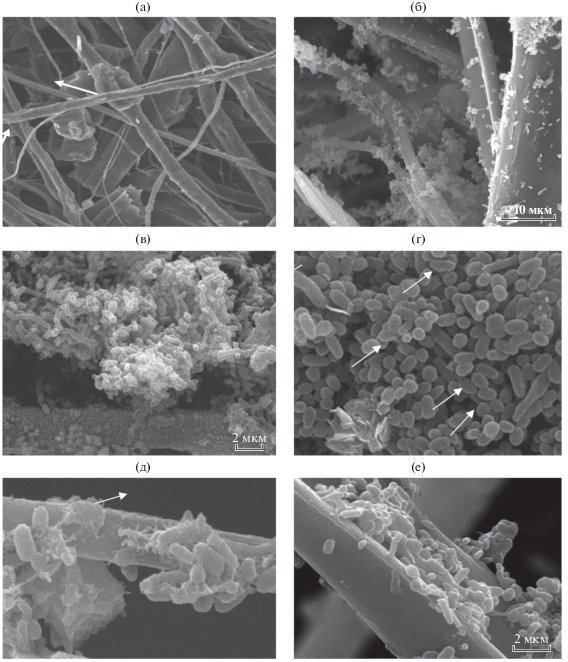
Как на поверхности волокон синтезированных БКМ-1 и БКМ-2, так и в пространстве между волокнами наблюдается присутствие как одиночных бактериальных клеток, так и микроколоний и микрофлокул. В случае БКМ-2 присутствуют бактериальные клетки разных типов: палочки ((1–1.5) × 3 мкм) и кокки (1.5 × 1.5 мкм) (рис. 4б БКМ-2, 14 сут). Одиночные клетки бактерий располагаются свободно, образование слизистого полимерного матрикса не наблюдается.
На 7–21 сут исследования образцов БКМ-1 и БКМ-2 наблюдается активное заселение бактериальными клетками как волокон полимерной матрицы, так и межволоконнного пространства, формирование микроколоний, выделение полимерного матрикса, формирование на поверхности волокон биопленки и образование флокул в межволоконном пространстве. В составе внеклеточного полимерного матрикса бактериальные клетки находятся в контакте друг с другом и способны осуществлять быструю комплексную перестройку субстрата. Внеклеточный полимерный матрикс также является защитой от резких колебаний параметров среды культивирования и способствует сохранению жизнеспособности и метаболической эффективности составляющих ассоциацию бактериальных клеток, то есть обеспечивает функциональную стабильность ассоциации.
На некоторых участках образцов БКМ на 21 сут вся поверхность оказывается покрыта бактериальными клетками. Следует отметить, что в образцах БКМ-2 выявляются бактериальные клетки как коккоидного, так палочковидного морфотипов. Это свидетельствует о том, что популяция бактериальных клеток в составе БКМ формируется двумя разными видами бактерий (рис. 4) и может свидетельствовать о ее стабильности.
Как видно в течение 21 сут происходит активный рост бактериальных клеток, что свидетельствует о том, что свекольный жом на протяжении всего этого периода способен обеспечивать развивающиеся популяции клеток всеми необходимыми биогенными элементами.
ЗАКЛЮЧЕНИЕ
Показано, что штаммы бактерий, выделенные из микробиологически зараженного топлива, Ochrobactrum sp. и Deinococcus sp. могут быть использованы для создания БКМ. Кроме того, возможно применение свекольного жома в качестве биогенного наполнителя при создании БКМ. Синтезированные на основе этих материалов БКМ проявили высокую активность в процессах биодеградации УВ различных классов в водно-органических смесях до углекислого газа и воды. Наилучших результатов удалось достигать при использовании в составе БКМ ассоциации бактерий Ochrobactrum sp. и Deinococcus sp.
Такие материалы в дальнейшем могут стать основой для создания полностью безотходных и безопасных технологий ремедиации акваторий и очистки сточных вод предприятий нефтегазового комплекса.
Работа была выполнена при финансовой поддержке Минобрнауки России в рамках выполнения государственного задания 4.6718.2017/6.7 (Ведущие исследователи на постоянной основе), государственного задания 10.5422.2017/8.9, Российского фонда фундаментальных исследований в рамках реализации научного проекта № 18-29-05067, при поддержке программы Президиума РАН № 34 “Актуальные проблемы физикохимии поверхности и создания новых композитных материалов.
Список литературы
Общественная экологическая организация Гринпис URL: http://www.greenpeace.org/russia/ru/campaigns/oil-spills/. Дата обращения 25.06.2018 г.
Sajna K.V., Sukumaran R.K., Gottumukkala L.D., Pandey A. // Bioresour. Technol. 2015. V. 191. P. 133.
Panneerselvan Logeshwaran, Mallavarapu Megharaja, Sreenivasulu Chadalavada, Mark Bowman, Ravi Naidu // Environmental Technology & Innovation 2018. V. 10. P. 175.
Листов Е.Л., Акопова Г.С., Балакирев И.В. // Защита окружающей среды в нефтегазовом комплексе. 2008. № 8. С. 9.
Скребняк Е. А., Терехова В.А., Федосеева Е.В., Ботвинко И.В., Винокуров В.А. // Экология и промышленность России. 2008. Сентябрь. С. 42.
Серебренникова М.К., Тудвасева М.С., Куюкина М.С. // Вестник Пермского университета. Биология. 2015. Вып. 1. С. 15.
Лейкин Ю.А., Черкасова Т.А., Н.А. Смагина Н.А. // Сорбционные и хроматографические процессы. 2008. Т. 8. Вып. 4. С. 585.
Alvarez Cuenca M, Vezuli J., Lohi A., Upreti S.R. // Bioprocess and Biosystems Engineering. 2006. V. 29. № 1. P. 29.
Alejandro R. Gentilia, María A. Cubitto, Marcela Ferrero, María S. Rodriguéz // Intern. Biodeterioration & Biodegradation. 2006. V. 57. P. 222.
Pirog T.P., Voloshina I.N., Gregirchak N.N., Shevchuk T.A. // Applied Biochemistry and Microbiologie. V. 41. № 1. 2005. P. 51.
Дедов А.Г., Лобакова Е.С., Кащеева П.Б., Иванова Е.А., Идиатулов Р.К., Санджиева Д.А., Васильева С.Г., Бузник В.М., Кирпичников М.П. https://elibrary.ru/item.asp?id=23450740 // Доклады Академии наук. 2015. Т. 462. № 4. С. 435 [Doklady Chemistry. 2015. V. 462. № 2. P. 160].
Lobakova E., Vasilieva S., Dolnikova G., Chekanov K., Kirpichnikov M., Kashcheeva P., Ivanova E., Idiatulov R., Buznik V., Dedov A. // Intern. Biodeterioration & Biodegradation. 2016. V. 108. P. 99.
Шапиро Т.Н., Дольникова Г.А., Немцева Н.В., Санджиева Д.А., Лобакова Е.С. // Журнал микробиологии, эпидемиологии и иммунологии. 2018. № 4. С. 107.
Дополнительные материалы отсутствуют.