Нефтехимия, 2019, T. 59, № 4, стр. 437-444
Алюмосиликаты с различной пористой структурой в синтезе 2-этил-3-метилхинолина
Н. Г. Григорьева 1, *, С. А. Костылева 1, А. Р. Гатаулин 1, А. Н. Хазипова 1, Нама Нарендер 2, Б. И. Кутепов 1
1 Институт нефтехимии и катализа РАН
Уфа, Республика Башкортостан, Российская Федерация
2 CSIR-Индийский институт химической технологии
Хайдарабад, Индия
* E-mail: ngg-ink@mail.ru
Поступила в редакцию 11.09.2018
После доработки 24.02.2019
Принята к публикации 14.03.2019
Аннотация
Исследованы каталитические свойства микропористых цеолитов различного структурного типа (FAU, BEA, MOR, MFI), микро-мезо-макропористого цеолита (H-Ymmm) и мезопористого алюмосиликата ASM в реакции анилина с пропионовым альдегидом. Установлено, что реакция идет с высокой конверсией анилина (90–99% на цеолитах и 71% на алюмосиликате ASM) и образованием двух основных продуктов: 2-этил-3-метилхинолина (2) и 2-этил-3-метил-N-фенил-1,2,3,4-тетрагидрохинолин-4-амина (3). Наиболее селективными катализаторами синтеза хинолина (2) являются цеолиты H-Y (до 64%), H-Ymmm (59%) и алюмосиликат ASM (50%). Показано, что повышению селективности по хинолину (2) способствует увеличение кислотности катализатора, повышение температуры реакции до 160°С, концентрации катализатора до 20 мас. %, мольного соотношения анилин : альдегид до 1 : 2.
Хинолин и его производные широко применяются для получения высокоэффективных лекарственных препаратов, обладающих антибактериальной, фунгицидной, антипаразитарной, противоопухолевой активностью [1–3]. На основе хинолинов производят ингибиторы коррозии, консерванты, растворители для смол, пеногасители в нефтеперерабатывающих предприятиях [4], люминесцентные материалы [5].
Для синтеза хинолинов предложены различные методы: Скраупа, Кнорра, Дебнера–Миллера, Фридлендера, Комба, Пфитцингера, Конрада–Лимпаха [6], однако, большинство их характеризуется использованием в качестве катализаторов кислот или оснований, многостадийностью, жесткими условиями реакции, невысокими выходами. Известно о получении 2-этил-3-метилхинолина (2) (выход 59%) из анилина и пропионового альдегида в присутствии металлокомплексного катализатора – [Rh(норборнадиен)Cl]2 [7].
Работы, в которых для синтеза производных хинолина в качестве катализатора использовали цеолиты, пока еще немногочисленны [8, 9]. Так, сообщалось о синтезе 2- и 4-метилхинолинов реакцией анилина с ацетальдегидом на цеолите H-Beta с суммарным выходом 83% [9]. Авторами [10] разработан метод синтеза замещенных алкилхинолинов с выходом 29–81% из ариламинов и альдегидов на мезопористом материале MCM-41/Cp2ZrCl2.
В связи с этим, поиск и разработка высокоэффективных гетерогенных катализаторов и на их основе способов синтеза алкилхинолинов являются важными и актуальными задачами.
В данной работе приведены результаты исследования активности и селективности различных кристаллических и аморфных алюмосиликатов, отличающихся текстурой, пористостью и кислотными свойствами: микропористых цеолитов (H-Y, H-Beta, H-MOR, H-ZSM-5), микро-мезо-макропористого цеолита H-Ymmm, а также мезопористого алюмосиликата ASM в синтезе 2-этил-3-метилхинолина (2) взаимодействием анилина с пропионовым альдегидом.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и катализаторы. В работе использовали анилин (99.8 мас. %) и пропионовый альдегид (97 мас. %) производства фирмы Acros.
В качестве катализаторов изучены цеолиты структурного типа FAU (H-Y, H-Ymmm), BEA (H-Beta), MFI (H-ZSM-5), морденит (Н-MOR) и аморфный мезопористый алюмосиликат ASM.
Цеолит Na-Y (SiO2/Al2O3 = 5.0) синтезирован по методике, описанной в [11], и переведен в Н-форму трехкратным ионным обменом в растворе NH4NO3 при 70°С до степени декатионирования αNa = 0.80. Образцы цеолитов H-Beta (SiO2/Al2O3 = = 40) и H-ZSM-5 (SiO2/Al2O3 = 50) приготовлены с помощью ионного обмена катионов Na+ на катионы ${\text{NH}}_{4}^{ + }$ в образцах Na-Beta и Na-ZSM-5 (фирма “Zeolyst”) с последующей термообработкой полученной аммонийной формы. Цеолит Na-MOR (SiO2/Al2O3 = 10.0) синтезирован по методике, описанной в [12], и переведен в Н-форму с помощью ионного обмена катионов Na+ на катионы ${\text{NH}}_{4}^{ + }$ с последующей термообработкой полученной аммонийной формы.
Способ приготовления микро-мезо-макропористого цеолита Ymmm в Н-форме (SiO2/Al2O3 = = 7.2) описан в [13] и основан на селективной кристаллизации в растворах силиката натрия при 96–98°С гранул, состоящих из высокодисперсного цеолита Na-Y и аморфного связующего материала (метакаолин). С помощью ионного обмена образца Na-Ymmm приготовлены образцы цеолитов H-Ymmm с αNa, равной 0.5, 0.6, 0.75, 0.95, далее эти образцы обозначены 0.5H-Ymmm, 0.6H-Ymmm, 0.75H-Ymmm, 0.95H-Ymmm.
Аморфный мезопористый алюмосиликат ASM (SiO2/Al2O3 = 20) получали золь-гель синтезом по методике, описанной в [14, 15].
Перед каталитическими испытаниями катализаторы подвергали высокотемпературной обработке в атмосфере осушенного воздуха при 540°С в течение 3–4 ч.
Методы исследования катализаторов. Для исследования физико-химических свойств приготовленных образцов цеолитов и мезопористого алюмосиликата использовали рентгенофлуоресцентный, рентгенофазовый и рентгеноструктурный методы анализа, ВМУ ЯМР-спектроскопию 27Al, сканирующую электронную микроскопию, низкотемпературную адсорбцию и десорбцию азота, термопрограммированную десорбцию аммиака (ТПД NН3). Методы изучения физико-химических свойств исследованных цеолитных катализаторов описаны в работах [13, 16], мезопористого алюмосиликата – в работах [14, 15].
Синтез N-пропиланилина (1), 2-этил-3-метилхинолина (2), 2-этил-3-метил-N-фенил-1,2,3,4-тетрагидрохинолин-4-амина (3). В металлический автоклав загружают анилин 0.25 мл (2.8 ммоль), затем 0.20–0.60 мл (2.8–8.4 ммоль) пропионового альдегида в зависимости от необходимого мольного соотношения, 1 мл хлорбензола и 10–50 мас. % в расчете на исходную смесь исследуемого катализатора, автоклав герметично закрывают и помещают в термостатируемый шкаф. Реакцию проводят при температуре 25–200°С, в течение 6 ч при непрерывном вращении автоклава. После окончания реакции реакционную массу охлаждают до комнатной температуры, отфильтровывают катализатор и хроматографируют на колонке (SiO2, элюент гексан → смесь гексан-этилацетат).
ГЖХ-анализ продуктов реакции проводили на хроматографе Shimadzu GС-9А, пламенно-ионизационный детектор, 3 м насадочная колонка, фаза SE-30, программированный нагрев 50–250°С, газ-носитель гелий.
Спектры ЯМР 1Н и 13С, гомо- и гетероядерные методики COSY, HSQC, HMBC регистрировали на приборах “Bruker Avance-400” (рабочая частота для 1Н – 400.13 МГц; для 13С – 100.62 МГц) и “Bruker Avance III 500 HD Ascend” (рабочая частота для 1Н – 500.17 МГц; для 13С – 125.78 МГц), растворитель – CDCl3.
N-Пропиланилин (1). Выход 2–11% в зависимости от типа катализатора; маслянистая желтая жидкость, т. кип. 96°С/10 мм рт. ст. Спектр 1H ЯМР (500.17 MГц, CDCl3, δ, м. д.): 1.04 (т, J = = 7.3 Гц, 3H), 1.69 (м, 2H), 3.12 (т, J = 7.0 Гц, 1H), 6.70 (д, J = 7.5 Гц, 2H), 6.73 (т, J = 7.3 Гц, 1H), 7.21 (т, J = 7.8 Гц, 2H). Спектр ЯМР 13C (125.78 MГц, CDCl3, δ, м. д.): 11.67, 22.75, 45.83, 112.73, 117.11, 129.24, 129.41, 148.52. Полученные данные соответствуют литературным [17].
2-Этил-3-метилхинолин (2). Выход 23–62% в зависимости от типа катализатора, маслянистая желтая жидкость, т. кип. 97–99°С/2 мм. рт. ст. Спектр ЯМР 1H (500.17 MГц, CDCl3, δ, м. д.): 1.41 (т, J = 7.5 Гц, 3H), 2.48 (с, 3H), 3.01 (к, J = 7.5 Гц, 2H), 7.46 (т, J = 7.5 Гц, 1H), 7.62 (т, J = 8.0 Гц, 1H), 7.70 (д, J = 8.0 Гц, 1H), 7.81 (с, 1H), 8.06 (д, J = = 8.5 Гц, 1H). Спектр ЯМР 13C (125.78 MГц, CDCl3, δ, м. д.): 12.86, 19.11, 29.51, 125.61, 126.71, 127.34, 128.30, 128.54, 129.41, 135.75, 146.67, 163.28. Полученные данные соответствуют литературным [18].
2-Этил-3-метил-N-фенил-1,2,3,4-тетрагидрохинолин-4-амин (3). Выход 5–34% в зависимости от типа катализатора, прозрачные кристаллы, т. пл. 104–106°С. Спектр ЯМР 1H (500.17 M Гц, CDCl3, δ, м. д.): 1.01 (т, J = 9.5 Гц, 3H), 1.11 (д, J = 8.5 Гц, 3H), 1.61–1.67 (м, 2H), 1.88–1.94 (м, 1H), 3.14–3.18 (м, 1H), 3.85 (уш. с, 2H), 4.34 (д, J = 11.5 Гц, 1H), 6.55 (д, J = 10.0 Гц, 2H), 6.62–6.77 (м, 2H), 7.06 (т, J = 8.8 Гц, 1H), 7.19–7.27 (м, 4H). Спектр ЯМР 13C (125.78 MГц, CDCl3, δ, м. д.): 9.12, 15.76, 26.49, 37.39, 56.44, 57.86, 112.50, 113.25, 113.86, 116.85, 117.36, 123.38, 128.05, 128.31, 129.40, 129.45, 144.37, 148.76.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Характеристики катализаторов. Физико-химические свойства исследованных цеолитов H-Y, H-Beta, H-ZSM-5, H-MOR, H-Ymmm с различной αNa и мезопористого алюмосиликата ASM представлены в табл. 1.
Таблица 1.
Физико-химические характеристики катализаторов
| Катализатор | Степень кристаллич-ности, отн. % | SБЭТ, м2/г | Равновесная адсорбционная емкость (20°C и P/Ps = 0.8), см3/г, по парам: | Кислотные свойства | |||
|---|---|---|---|---|---|---|---|
| концентрация кислотных центров/мкмоль г–1* | |||||||
| H2O | C6H6 | СI | CII | С | |||
| Н-Y | 100 | 870 | 0.30 | 0.30 | 610 | 520 | 1130 |
| Н-Вeta | 100 | 625 | 0.12 | 0.32 | 520 | 310 | 830 |
| H-MOR | 100 | 393 | 0.18 | 0.16 | 651 | 349 | 1000 |
| Н-ZSM-5 | 100 | 360 | 0.14 | 0.15 | 270 | 190 | 460 |
| 0.5Н-Ymmm | 93 | – | 0.30 | 0.30 | 450 | 340 | 790 |
| 0.6Н-Ymmm | 93 | – | 0.29 | 0.30 | 460 | 390 | 850 |
| 0.75Н-Ymmm | 93 | – | 0.29 | 0.31 | 480 | 410 | 890 |
| 0.95Н-Ymmm | 93 | 741 | 0.25 | 0.30 | 515 | 460 | 975 |
| ASM | 0 | 640 | – | – | 350 | 120 | 470 |
Согласно данным РФА и значениям адсорбционных емкостей по парам H2O и C6H6, для цеолитов H-Y, H-Beta, H-MOR, H-ZSM-5 характерна степень кристалличности, близкая к 100%, а для образцов цеолита H-Ymmm – 93%, что объясняется неполной кристаллизацией его аморфной составляющей.
По данным низкотемпературной адсорбции-десорбции азота, “кажущаяся” удельная поверхность цеолитов по БЭТ составляет 870 м2/г (Н-Y), 625 м2/г (H-Beta), 360 м2/г (H-ZSM-5), 393 м2/г (H-MOR) и 741 м2/г (H-Ymmm) (табл. 1). Удельная поверхность макропор цеолита H-Ymmm, определенная с помощью ртутной порометрии, составляет 12.1 м2/г. Объемы микро-, мезо- и макропор составляют 0.28, 0.15 и 0.15 см3/г, соответственно.
Детальная информация о текстуре и кислотных свойствах алюмосиликата ASM изложена в работе [15]. Отметим, что образец АSM характеризуется узким распределением мезопор от 2 до 5 нм с объемом 0.70 см3/г.
Кислотные свойства образцов цеолитов и мезопористого алюмосиликата изучали методом ТПД NH3. В спектрах ТПД NH3 микропористых цеолитов наблюдаются два пика: низкотемпературный, имеющий максимум в области 250–300°С, и высокотемпературный пик с максимумом в интервале 410–480°С. Это свидетельствует о присутствии в исследуемых образцах кислотных центров двух типов: “слабых”, которые характеризуются низкотемпературным пиком, и “сильных”, характеризующихся высокотемпературным пиком [19]. В ряду микропористых цеолитов концентрация наиболее важных для каталитических превращений “сильных” кислотных центров уменьшается следующим образом: H-Y > H-MOR > H-Beta > H-ZSM-5. Аналогично изменяется и суммарная концентрация кислотных центров.
В спектрах кислотности образцов цеолита H-Ymmm присутствуют два пика, характеризующие слабые кислотные центры с температурным максимумом в области температур 250–280°С и сильнокислотные центры в области температур 350–420°С. Концентрация “сильных” кислотных центров в цеолите H-Ymmm возрастает с увеличением степени декатионирования.
Мезопористый алюмосиликат ASM, согласно данным, приведенным в табл. 1, обладает самой низкой кислотностью среди исследованных катализаторов, поскольку: а) в нем содержится наименьшее количество сильных кислотных центров (они, как правило, ответственны за протекание реакций); б) сила указанных кислотных центров ниже, чем в цеолитах, о чем свидетельствует смещение высокотемпературного пика в область более низких температур.
Каталитические свойства цеолитов и мезопористого алюмосиликата в реакции анилина с пропионовым альдегидом. Установлено, что основными продуктами реакции анилина с пропионовым альдегидом в присутствии исследованных катализаторов являются 2-этил-3-метилхинолин (2) и 2-этил-3-метил-N-фенил-1,2,3,4-тетрагидрохинолин-4-амин (3) (схема 1 ). Кроме них, в реакционной массе идентифицированы N-пропиланилин (1), продукты конденсации пропионового альдегида, 2,3-диалкилдигидрохинолин. В табл. 2, где приведены результаты изучения каталитических свойств цеолитов и мезопористого алюмосиликата, все продукты реакции, кроме соединений 1−3, суммированы и обозначены “другие”.
Таблица 2.
Взаимодействие анилина с пропионовым альдегидом в присутствии цеолитов и мезопористого алюмосиликата
| Условия синтеза: мольное соотношение анилин : альдегид = 1 : 2; 20 мас. % катализатора; 160°С; раство-ритель – хлорбензол, 6 ч | |||||
|---|---|---|---|---|---|
| Катализатор | Конверсия анилина, % | Селективность образования, % | |||
| (1) | (2) | (3) | Другие | ||
| H-Y | 97 | 5 | 64 | 15 | 16 |
| H-Beta | 99 | 2 | 46 | 20 | 32 |
| H-MOR | 99 | 1 | 32 | 34 | 33 |
| H-ZSM-5 | 90 | 7 | 39 | 28 | 26 |
| 0.95H-Ymmm | 95 | 4 | 59 | 14 | 23 |
| ASM | 71 | 15 | 50 | 7 | 28 |
Схема 1 . Взаимодействие анилина с пропионовым альдегидом.
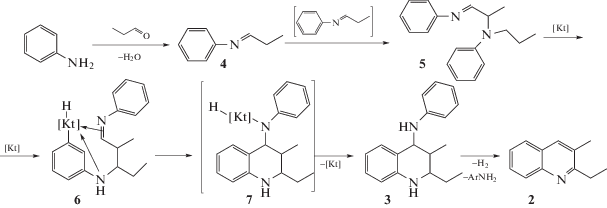
Состав продуктов реакции свидетельствует, что при взаимодействии анилина с пропионовым альдегидом одновременно протекают реакции линейной гомо- и гетероконденсации, циклоконденсации, димеризации, перегруппировки и др. Присутствие в продуктах реакции тетрагидрохинолина (3) подтверждает предложенный в работе [20] механизм образования 2-этил-3-метилхинолина (2), изображенный на схеме 2 . Согласно указанному механизму взаимодействие анилина с альдегидом проходит через основание Шиффа (4), которое далее превращается в N-пропиламин (1) и димер (5). Последний формирует комплекс с катализатором (6), из которого в результате внутримолекулярной циклизации образуется соединение (7). Дальнейшее восстановительное элиминирование катализатора в соединении (7) приводит к тетрагидрохинолину (3), который в результате отщепления анилина превращается в целевой диалкилхинолин (2).
Схема 2 . Предполагаемый механизм образования 2-этил-3-метилхинолина (2).
Реакция анилина с пропионовым альдегидом в присутствии всех исследованных цеолитных катализаторов идет с высокой конверсией анилина (табл. 2): практически полной на цеолитах H-Y, H-Beta и H-MOR и несколько меньшей – 90–95% на цеолитах H-ZSM-5 и H-Ymmm. Самую низкую конверсию анилина (71%) наблюдали на мезопористом алюмосиликате ASM, что обусловлено, по-видимому, низкой кислотностью данного катализатора.
Диалкилхинолин (2) наиболее селективно образуется на цеолитах H-Y и H-Ymmm (64% и 59%, соответственно). Близкой к указанным цеолитам селективностью действия обладает мезопористый алюмосиликат ASM (50%). Остальные катализаторы были менее селективны в отношении образования диалкилхинолина (2). На цеолите H-MOR, проявившем самую низкую селективность по диалкилхинолину (2), получали смесь диалкилхинолина (2) и тетрагидрохинолина (3) в соотношенни ≈ 1 : 1.
Разница в значениях селективности образования хинолина (2), обусловлена, как мы полагаем, различиями пористой структуры катализаторов. Наиболее селективно хинолин (2) образуется на широкопористых катализаторах: цеолите H-Y, имеющем самый большой диаметр входных окон в ряду протестированных цеолитных катализаторов; цеолите H-Ymmm, микропористая структура которого сочетается с мезо- и макропорами; аморфном мезопористом алюмосиликате ASM. Низкая селективность образования хинолина (2), которую демонстрируют цеолиты H-MOR и H-ZSM-5, также, по-видимому, связана со структурными характеристиками их кристаллической решетки. Цеолит H-MOR имеет одномерную канальную структуру, а не трехмерную, как остальные исследованные катализаторы. Эта особенность цеолита H-MOR, также как и наличие узких извилистых каналов в решетке цеолита H-ZSM-5, может привести к затруднению диффузии молекул реагентов и продуктов реакции внутри цеолитного кристаллического каркаса.
Поскольку каталитические свойства цеолитов в Н-форме связывают с присутствием в их полостях и каналах кислотных центров, то представляло интерес изучить влияние концентрации кислотных центров образцов на их активность и селективность в реакции анилина с пропионовым альдегидом (рис. 1). На примере 4-х образцов цеолита H-Ymmm, отличающихся степенью обмена ионов Na+ на Н+ (αNa = 0.5, 0.6, 0.75 и 0.95), показано, что в изученных условиях конверсия анилина мало зависит от αNa и на всех образцах была высокой – 93–95%. В составе продуктов реакции с повышением αNa возрастает содержание хинолина (2) (с 25 до 59%), а содержание тетрагидрохинолина (3) уменьшается. Такой характер изменения концентрации соединения (3) подтверждает, что оно является промежуточным в ходе образования хинолина (2). С повышением αNa концентрация кислотных центров, присутствующих в цеолите H-Ymmm, возрастает (табл. 1), следовательно, для более полного превращения тетрагидрохинолина (3) в хинолин (2) необходима более высокая концентрация кислотных центров.
Рис. 1.
Влияние степени декатионирования αNa цеолита H-Ymmm на конверсию анилина и состав продуктов реакции. А – Катализатор H-Y; Б – 0.5H-Ymmm; В – 0.6H-Ymmm; Г – 0.75H-Ymmm; Д – 0.95H-Ymmm. Условия синтеза: мольное соотношение анилин : альдегид = 1 : 2, 20 мас. % катализатора, 160°С, растворитель – хлорбензол, 6 ч.

Исходя из этого, низкую селективность образования хинолина (2) в присутствии цеолита H-MOR, обладающего достаточно высокой концентрацией кислотных центров, можно объяснить недоступностью активных центров внутри каналов для объемных молекул тетрагидрохинолина (3) и протеканием реакции, в основном, на более слабых поверхностных активных центрах.
На примере цеолита 0.95H-Ymmm изучено влияние температуры, мольного соотношения реагентов, концентрации катализатора на конверсию анилина и селективность образования продуктов.
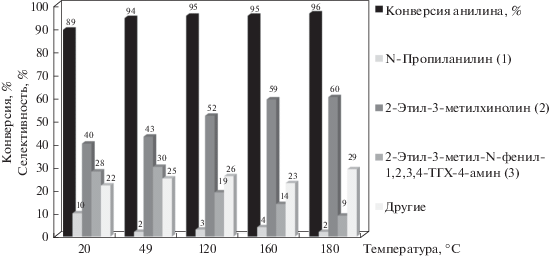
Взаимодействие анилина с пропионовым альдегидом активно проходит уже при 20°С (рис. 2). При этом селективность образования хинолина (2) составляет 40% и в реакционной массе содержится значительное количество тетрагидрохинолина (3) – 28%. Повышение температуры от 20°С до 180°С приводит к повышению конверсии анилина и росту селективности образования хинолина (2), при этом содержание тетрагидрохинолина (3) снижается до 9%.
Рис. 2.
Влияние температуры реакции на выход и состав продуктов. Условия синтеза: мольное соотношение анилин : альдегид = 1 : 2, 20 мас. % катализатора, растворитель – хлорбензол, 6 ч.
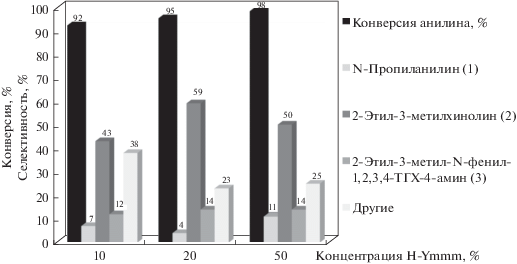
При изучении влияния концентрации катализатора показано, что наиболее селективно хинолин (2) образуется в присутствии 20% цеолита H-Ymmm (рис. 3). Как понижение количества катализатора до 10%, так и повышение до 50% приводит к уменьшению селективности образования хинолина (2). Конверсия анилина в изученном интервале концентраций катализатора составляла 92–97%.
Рис. 3.
Влияние концентрации катализатора на выход и состав продуктов. Условия синтеза: мольное соотношение анилин : альдегид = 1 : 2, 160°С, растворитель – хлорбензол, 6 ч.
Увеличение мольного соотношения анилин:альдегид от эквимольного до 1 : 3 приводит к повышению конверсии анилина (89–97%), однако большой избыток альдегида способствует образованию продуктов конденсации пропионового альдегида, в результате чего селективность образования целевых хинолинов уменьшается. Оптимальное соотношение анилин : альдегид = = 1 : 2 (рис. 4).
Рис. 4.
Влияние мольного соотношения реагентов на выход и состав продуктов. Условия синтеза: 20 мас. % катализатора H-Ymmm, 160°С, растворитель – хлорбензол, 6 ч.

Таким образом, в результате проведенного исследования выявлена взаимосвязь кислотных свойств и характеристик пористой структуры различных цеолитных катализаторов с микропористой (H-Y, H-Beta, H-MOR, H-ZSM-5) и иерархической (H-Ymmm) структурой, а также аморфного мезопористого алюмосиликата ASM с их активностью и селективностью в реакции циклоконденсации анилина с пропионовым альдегидом. Установлено, что основными продуктами реакции в присутствии исследованных катализаторов являются 2-этил-3-метилхинолин (2) и 2-этил-3-метил-N-фенил-1,2,3,4-тетрагидрохинолин-4-амин (3). Наиболее селективно 2-этил-3-метилхинолин (2) образуется на широкопористых катализаторах: цеолите H-Y (64% при 97%-ной конверсии анилина), микро-мезо-макропористом цеолите H-Ymmm (59% при 95%-ной конверсии анилина), на мезопористом алюмосиликате ASM (50% при 71%-ной конверсии анилина). Образовавшийся тетрагидрохинолин-4-амин (3) в ходе реакции превращается в хинолин (2). Протеканию этого процесса на цеолитных катализаторах способствуют открытая трехмерная система широкопористых каналов или полостей, наличие мезо- и макропор, повышение концентрации кислотных центров. Найдены условия получения 2-этил-3-метилхинолина (2) на цеолите H-Ymmm с максимальным выходом: мольное соотношение анилин : альдегид = 1 : 2, 20 мас. % катализатора, 160°С, растворитель – хлорбензол, 6 ч.
БЛАГОДАРНОСТИ
Работа выполнена при финансовой поддержке гранта РНФ-DST 16-43-02010 и государственного задания № АААА-А17-117012610058-4. Структурные исследования соединений (1–3) проведены в Центре коллективного пользования “Агидель” при Институте нефтехимии и катализа УФИЦ РАН.
Список литературы
Desai U., Mitragotri S., Thopate T., Pore D., Wadgaonkarb P. // Arkivoc. 2006. P. 198.
Bawa S., Kumar S., Drabu S., Kumar R. // J. Pharm. BioAllied Sci. 2010. № 2. P. 64.
Jain S., Chandra V., Jain P.K., Pathak K., Pathak D., Vaidya A. // Arab. J. Chem. 2016. P. 1878.
Ebenso E.E., Obot I.B., Murulana L.C. // Int. J. Electrochem. Sci. 2010. № 5. P. 1574.
Całus S., Gondek E., Danel A., Jarosz B., Pokładko M., Kityk A.V. // Mater. Lett. 2007. V. 61. P. 3292.
Kouznetsov V.V., Mendez L.Y., Gomez C.M. // Curr. Org. Chem. 2005. № 9. P. 141.
Watanabe Y., Yamamoto M., Shim S.C., Mitsudo T., Takegami Y. // Chem. Lett. 1979. P. 1025.
Lopez-Sanz J., Perez-Mayoral E., Prochazkova D., Martın-Aranda R.M., Lopez-Peinado A.J. // Top Catal. 2010. V. 53. P. 1430.
Brosius R., Gammon D., Van Laar F., van Steen E., Sels B., Jacobs P. // J. Cat. 2006. V. 239. P. 362.
Guo Q., Liao L., Teng W., Ren S., Wang X., Lin Y., Meng F. // Catal. Today. 2016. V. 263. P. 117.
Хазипова А.Н., Павлова И.Н., Григорьева Н.Г., Кутепов Б.И., Павлов М.Л., Басимова Р.А. // Химические технологии. 2012. № 1. С. 5.
Горшунова К.К. Ахмед Канаан Рамадан, Травкина О.С., Павлова И.Н., Григорьева Н.Г., Павлов М.Л., Кутепов Б.И. // Нефтехимия. 2014. Т. 54. № 2. С. 136.
Кутепов Б.И., Травкина О.С., Павлова И.Н., Хазипова А.Н., Григорьева Н.Г., Павлов М.Л. // Журн. прикладной химии. 2015. Т. 88. № 1. С. 70.
Аглиуллин М.Р., Григорьева Н.Г., Данилова И.Г., Магаев О.В., Водянкина О.В. // Кинетика и катализ. 2015. Т. 56. № 4. С. 507.
Agliullin M.R., Danilova I.G., Faizullin A.V., Amarantov S.V., Bubennov S.V., Prosochkina T.R., Grigor’eva N.G., Paukshtis E.A., Kutepov B.I. // Micropor. Mesopor. Mat. 2016. V. 230. P. 118.
Павлов М.Л., Травкина О.С., Хазипова А.Н., Басимова Р.А., Шавалеева Н.Н., Кутепов Б.И. // Нефтехимия. 2015. Т. 55. № 5. С. 406.
Rice R.G., Kohn E.J. // J. Am. Chem. Soc. 1955. V. 77. P. 4052.
Watanabe Y., Shim S.C., Mitsudo T. // Bull. Chem. Soc. Jpn. 1981. V. 54. P. 3460.
Григорьева Н.Г., Паукштис Е.А., Кутепов Б.И., Галяутдинова Р.Р., Джемилев У.М. // Нефтехимия. 2005. Т. 45. № 6. С. 453.
Khusnutdinov R.I., Bayguzina A.R., Dzhemilev U.M. // J. Organometallic Chem. 2014. V. 768. P. 75.
Дополнительные материалы отсутствуют.