Нефтехимия, 2019, T. 59, № 4, стр. 428-436
Синтез изопрена из формальдегида и изобутилена на цеолитных катализаторах
О. А. Пономарева 1, 2, *, Д. Л. Чистов 1, П. А. Коц 1, И. И. Иванова 1, 2
1 Московский Государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
2 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
* E-mail: oaponomareva@phys.chem.msu.ru
Поступила в редакцию 20.09.2018
После доработки 04.03.2019
Принята к публикации 14.03.2019
Аннотация
Изучен одностадийный газофазный синтез изопрена из формальдегида и изобутилена на цеолитных катализаторах структурного типа MFI, ВЕА и FAU(Y), а также Al-, Zr-, Sn- и Nb-BEA, полученных методами изоморфного замещения. Исследование каталитических свойств показало, что выход изопрена увеличивается в ряду Zr-BEA < Sn-BEA < Nb-BEA < Al-BEA, что коррелирует с содержанием кислотных центров Бренстеда в образцах, тогда как образование основного побочного продукта монооксида углерода, образующегося при разложении формальдегида, растет с увеличением количества льюисовских кислотных центров. Сравнение каталитических свойств цеолитов различной структуры показало, что наиболее селективными по изопрену являются среднепористые цеолиты структуры MFI с диаметром пор 5.5 Å.
ВВЕДЕНИЕ
В настоящее время в промышленности изопрен, являющийся мономером многотоннажных процессов синтеза изопреновых каучуков, получают главным образом из раствора формальдегида и изобутилена в две стадии (диоксановый способ) [1]. На первой стадии происходит образование 4,4-диметил-1,3-диоксана (ДМД) в присутствии серной кислоты; реакция протекает в жидкой фазе при температуре около 100°С и давлении около 20 атм:
Получение изопрена происходит путем расщепления ДМД при температуре 370–390°С на гетерогенном катализаторе:
Недостатки этого процесса –многостадийность; низкая селективность по изопрену; использование серной кислоты в качестве катализатора на первой стадии процесса, ведущее к коррозии оборудования и экологическим проблемам; большое число стадий упаривания и концентрирования, приводящее к очень высоким расходам водяного пара и электроэнергии.
В связи с этим, актуальной задачей является разработка одностадийного процесса получения изопрена с использованием гетерогенных катализаторов. Существует два направления, по которым ведется работа в создании одностадийного процесса получения изопрена. Первый способ – модифицирование существующего двухстадийного процесса, в котором с помощью технологических решений удается получать изопрен уже на первой стадии. Для этого рядом компаний предлагается смещать равновесие за счет отвода изопрена из зоны реакции, например путем использования реакционно-дистилляционной колонны, в верхней части которой отгоняется изопрен, вода, непрореагировавшие вещества и другие низкокипящие компоненты [2].
Другой способ – проведение реакции в газовой фазе с использованием гетерогенных катализаторов:
В качестве кислотных катализаторов одностадийного газофазного процесса в проточных условиях изучали гетерополикислоты [3, 4], оксиды [5, 6], фосфаты [7, 8], сульфаты [9]. Главные недостатки этих систем – их невысокая эффективность в получении изопрена, быстрая дезактивация практически всех из них, отсутствие возможности регенерации. Исключением являются ниобий- и цирконийсодержащие фосфаты, которые, по данным [7], работают стабильно и проведение реакции в течение 30 ч не оказывает сильного влияния на активность этих катализаторов. Авторы [7] объясняют высокую устойчивость катализаторов ZrP и NbP к дезактивации восстановлением in situ кислотных центров Бренстеда непосредственно во время протекания реакции при участии находящейся в зоне реакции воды.
Перспективными гетерогенными катализаторами данного процесса являются цеолиты, которые обладают форм-селективными свойствами, легко регенерируются, а их кислотно-основные свойства могут быть легко модифицированы путем ионного обмена, пропитки, деалюминирования, изоморфного замещения. К сожалению представленные в литературе данные по синтезу изопрена из изобутилена и формальдегида на цеолитах [10–13] получены в импульсном режиме и их сложно сравнивать с данными для других гетерогенных катализаторов, полученными в проточном режиме.
Цель настоящей работы – изучение одностадийного газофазного синтеза изопрена из формальдегида и изобутилена в проточном режиме на цеолитных катализаторах Al-, Zr-, Sn- и Nb-BEA, полученных методами изоморфного замещения, а также на цеолитах различного структурного типа (MFI, ВЕА и FAU(Y)), исследование влияния природы активных центров и структуры цеолитов на физико-химические и каталитические свойства полученных образцов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных образцов были взяты цеолиты фирмы Zeolyst BEA с Si/Al 12.5 и 150, MFI с Si/Al 11.5, FAU с Si/Al 15. Синтез Sn-BEA проводили по методике, представленной в [14], Zr-BEA –в [15], Nb-BEA – в [16]. Для получения Н-формы цеолитов из NH4-формы образцы прокаливали в токе осушенного воздуха при 550°C в течение 6 ч.
Элементный состав всех использованных в работе образцов определяли методом рентгенофлуоресцентного анализа на приборе ThermoScientific ARL PERFORM’X WDXRF с операционной родиевой трубкой и мощностью 2.5 кВт.
Фазовый состав образцов определяли на порошковом дифрактометре D2 PHASER фирмы BRUKER с CuKα-излучением. Обработку дифрактограмм проводили с использованием программного пакета diffrac.EVA от BRUKER. Идентификацию фаз проводили по базе ICDD PDF2.
Изотермы низкотемпературной адсорбции азота получали на автоматическом поромере ASAP2000 (Micromeritics, США). Объем микропор определяли с использованием метода t-plot.
Изучение морфологии синтезированных образцов проводили методом СЭМ на электронном микроскопе Hitachi Tabletop Microscope TM3030Plus. Напряжение на ускоряющем электроде 15 кВ.
Кислотные свойства образцов изучали методом ТПД NН3 на универсальном сорбционном газовом анализаторе УСГА-101. Навеску образца помещали в кварцевый реактор, нагревали в токе гелия до температуры 500°С, прокаливали при этой температуре в течение 1 ч в токе гелия, после чего охлаждали до 60°С. Насыщение аммиаком проводили в токе осушенной смеси NH3/N2 (1 : 9) в течение 15 мин. Удаление физически адсорбированного аммиака проводили при 100°С в токе сухого гелия в течение 1 ч. После этого проводили линейный подъем температуры в реакторе со скоростью 8°C/мин до 800°С. Изменение теплопроводности потока регистрировали катарометром.
ИК-спектры регистрировали на спектрометре Protege 460 (Nicolet) c Фурье-преобразованием, укомплектованном МТС-детектором, в интервале 4000–400 см–1 c разрешением 4 см–1. Образец катализатора массой 20 мг прессовали в диск диаметром 2 см. Удаление воды с образцов проводили на вакуумной установке, оснащенной датчиками абсолютного давления с рабочим вакуумом 5 × 10–4 Па. Таблетку образца помещали в ИК-ячейку, нагревали за 2 ч до 450°С и выдерживали 1 ч при 450°С. Адсорбцию СО проводили при температуре жидкого азота (77 K) путем дозирования газа до полного насыщения. Адсорбцию пиридина (Py) проводили при 150°С в течение 30 мин с последующим вакуумированием при 150°С в течение 1 ч. Обработку полученных ИК-спектров проводили с помощью пакета программ OMNIC ESP версии 7.3.
Реакцию изобутилена с формальдегидом изучали в каталитической установке проточного типа с неподвижным слоем катализатора при температуре 300°С, массовой скорости подачи изобутилена 3.85 г/г ч, формалина 1.09 г/г ч и мольным отношении изобутилен : формальдегид = 5 : 1. Перед экспериментом катализаторы нагревали до 350°С в токе гелия, затем снижали температуру до температуры реакции. Формалин, содержащий 37 мас. % формальдегида, 3 мас. % метанола и 60 мас. % воды, использовали без предварительной очистки.
Хроматографический анализ жидких и газообразных продуктов реакции проводили на газожидкостном хроматографе Кристалл 2000М фирмы “Хроматэк Аналитик”, снабженом пламенно-ионизационным детектором (ПИД) и капиллярной колонкой с неполярной фазой SE-30 длиной 40 м и диаметром 0.32 мм. В жидкие пробы в качестве внутреннего стандарта добавляли диоксан, в газообразеные продукты – метан.
Для определения количества CO газообразные пробы анализировали также на хроматографе Кристалл 2000M, оснащенном детектором по теплопроводности и набивной колонкой с фазой “Porapak-Q” длиной 3 м. Концентрацию формальдегида в жидких пробах определяли титрованием с Na2SO3.
Общую конверсию формальдегида (F), селективность по продуктам (Si), а также съем изопрена (производительность по изопрену, Р) рассчитывали по следующим формулам:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства катализаторов. Для исследования влияния природы активных центров на физико-химические и каталитические свойства в работе изучали металлсодержащие образцы Al-, Sn-, Zr- и Nb-BEA с близким отношением Si/Me, полученные методом изоморфного замещения, а также цеолиты структурных типов BEA, MFI и FAU(Y) с близким отношением Si/Al. Физико-химические характеристики катализаторов представлены в табл. 1.
Таблица 1.
Текстурные и кислотно-основные характеристики образцов
| Me-BEA | Si/Me | Vпор, см3/г | Vмикро, см3/г | Кол-во Me, мкмоль/г | Концентрация кислотных центров, (мкмоль NH3/г) в интервале температур десорбции аммиака, °С | |||
|---|---|---|---|---|---|---|---|---|
| 100–600 | 100–250 | 250–400 | 400–600 | |||||
| Zr-BEA/200 | 205 | 0.28 | 0.19 | 82 | 76 | 40 | 21 | 15 |
| Sn-BEA/200 | 204 | 0.31 | 0.16 | 82 | 88 | 60 | 24 | 4 |
| Nb-BEA/300 | 340 | 0.28 | 0.20 | 49 | 54 | 33 | 19 | 2 |
| Al-BEA/150 | 150 | 0.40 | 0.16 | 110 | 105 | 63 | 30 | 12 |
| BEA | 12.5 | 0.49 | 0.16 | 1248 | 1057 | 514 | 358 | 185 |
| MFI | 11.5 | 0.19 | 0.13 | 1349 | 1538 | 583 | 470 | 485 |
| FAU(Y) | 15 | 0.44 | 0.25 | 1051 | 627 | 199 | 266 | 162 |
Me-BEA, полученные изоморфным замещением. На рис. 1 представлены дифрактограммы металлсодержащих BEA. Все дифракционные пики на них соответствуют структуре ВЕА [17].
По данным РФА степень кристалличности Zr-BEA и Nb-BEA составила 97%, Sn-BEA – 93%, Al-BEA – 82%.
На фотографиях, полученных методом СЭМ (рис. 2), можно видеть, что кристаллы металлсодержащих ВЕА представляют собой усеченные октаэдры, характерные для цеолитов со структурой ВЕА, размером от 0.3 до 12–15 мкм.
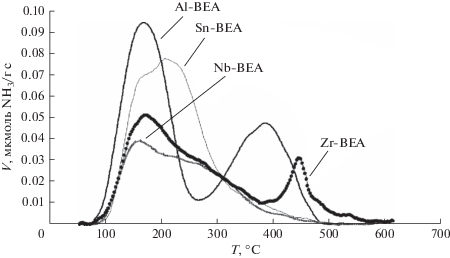
Кривые ТПД NH3 для металлсодержащих ВЕА, полученных изоморфным замещением, приведены на рис. 3.
Кривые десорбции для всех образцов характеризуются наличием пика при 100–250°С, который соответствует слабым кислотным центрам или физически адсорбированным молекулам аммиака. Для олово- и ниобийсодержащих образцов наблюдается пик с температурой максимума 250–300°С, который соответствует центрам средней силы. На кривых десорбции Al-BEA/150 и Zr-BEA/200 присутствуют пики c температурой максимума при 400–450°С, которые соответствуют сильным кислотным центрам. Количество десорбированного аммиака соответствует рассчитанному содержанию металла в Zr-, Sn-, Al- и Nb-содержащих образцах, что свидетельствует о том, что все кислотные центры доступны молекулам аммиака (табл. 1).
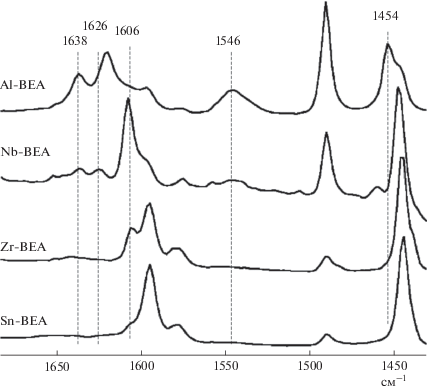
Природу кислотных центров в изоморфнозамещенных ВЕА изучали методом ИК-спектроскопии адсорбированного пиридина (Py) (рис. 4). Полосы 1545 и 1638 см–1 соответствуют адсорбции Ру на бренстедовских кислотных центрах, 1446 и 1606 см–1 – на льюисовских кислотных центрах. В Sn-, Zr-содержащих ВЕА присутствуют только льюисовские кислотные центры, тогда как в Nb-BEA и Al-BEA – как льюсовские, так и бренстедовские кислотные центры.
Таким образом, в изоморфнозамещенных цеолитах количество кислотных центров Бренстеда увеличивается в ряду Sn-BEA ≈ Zr-BEA < Nb-BEA < < Al-BEA, при этом количество кислотных центров Льюиса изменяется в обратной последовательности.
Основные каталитические превращения взаимодействия изобутилена с формальдегидом представлены на схеме 1 [1, 18]. Основной путь реакции связан с реакцией Принса взаимодействия формальдегида с изобутиленом, приводящей к 3-метилбутен-1-олам, дегидратация которых приводит к образованию целевого продукта изопрена. Изомеризация двойной связи 3-метил-2-бутен-1-ола ведет к 3-метил-1-бутен-1-олу, который далее может превращаться в 3-метилбутаналь в ходе кетоенольной таутомерии либо гидратироваться с образованием 3-метил-1,3-бутандиола. Побочными процессами являются разложение формальдегида на монооксид углерода и водород, а также взаимодействие изопрена с самим собой или изобутиленом с образованием конденсированных ароматических систем и терпенов.
Схема 1. Схема каталитических превращений взаимодействия изобутилена с формальдегидом.
Результаты исследований каталитических свойств изоморфнозамещенных образцов представлены в табл. 2.
Таблица 2.
Взаимодействие изобутилена с формальдегидом на металлсодержащих ВЕА (время реакции 3 ч)*
| Катализатор | Zr-BEA | Sn-BEA | Nb-BEA | Al-BEA |
|---|---|---|---|---|
| Конверсия формальдегида, % | 2.8 | 4.6 | 8.4 | 21.3 |
| Производительность,×103 г/г ч | ||||
| Изопрен | 13.9 | 25.5 | 48.5 | 84.1 |
| CO | 238.8 | 185.1 | 45.7 | 79.1 |
| Другие | 83.1 | 34.2 | 43.7 | 49.7 |
Увеличение съема изопрена происходит в ряду Zr-BEA < Sn-BEA < Nb-BEA < Al-BEA и коррелирует с содержанием кислотных центров Бренстеда в образцах. Тогда как количество основного побочного продукта оксида углерода(II) растет с увеличением количества льюисовских кислотных центров в образцах.
Увеличение съема изопрена происходит в ряду Zr-BEA < Sn-BEA < Nb-BEA < Al-BEA и коррелирует с содержанием кислотных центров Бренстеда в образцах. Тогда как количество основного побочного продукта оксида углерода(II) растет с увеличением количества льюисовских кислотных центров в образцах.
Из данных каталитических исследований можно сделать вывод о том, что реакция образования изопрена происходит на бренстедовских кислотных центрах, тогда как кислотные центры Льюиса катализируют реакцию разложения формальдегида до оксида углерода(II), что приводит к более низким показателям селективности по изопрену. Полученные результаты согласуются с данными работы [7]. Однако в литературе существуют и другие точки зрения о природе активных центров, ответственных за формирование изопрена. Так, авторы [3] считают, что реакцию получения изопрена катализируют слабые льюсовские кислотные центры, а кислотные центры Льюиса средней силы приводят к побочным продуктам, тогда как Крживицки с соавторами [8] считают, что изопрен формируется на сильных льюисовских кислотных центрах.
Влияние структуры цеолита. Исходя из полученных данных, для исследования влияния структурного типа цеолита на показатели реакции взаимодействия изобутилена с формальдегидом, были выбраны Al-содержащие цеолиты структурных типов бета (BEA), MFI и фожазит (FAU(Y)).
Цеолиты BEA, MFI и FAU(Y) представляют собой трехмерные структуры с диаметром каналов 7.7, 5.5 и 7.4 Å соответственно. Структура FAU(Y) также содержит полости, диаметр которых составляет 12 Å, которые образованы содалитовыми ячейками, соединенными гексагональными призмами.
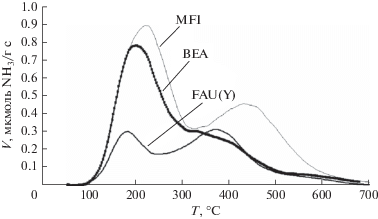
На рис. 5 представлены данные ТПД NH3 для данных цеолитов.
Спектр кислотности цеолитов MFI и ВЕА характеризуется наличием пика при 200°C, который соответствует слабым кислотным центрам или физически адсорбированному аммиаку. В фожазите содержание таких центров мало. Пики десорбции в области температур 350–420°C относятся к кислотным центрам средней силы, при этом в MFI по сравнению с ВЕА и FAU кислотные центры более сильные, так как температура максимума высокотемпературного пика для MFI смещена в область более высоких температур. Отношение количества десорбированного аммиака к количеству атомов алюминия в FAU(Y) составляет 0.6, что свидетельствует о том, что либо не все кислотные центры в этом образце доступны для молекул NH3, либо о том, что часть алюминия не встроена в решетку цеолита (табл. 1). Для остальных цеолитов она близка к 1.0, что говорит о том, что образцы хорошо структурированы.
Результаты каталитических экспериментов представлены в табл. 3.
Таблица 3.
Влияние структуры цеолита на взаимодействие изобутилена с формальдегидом (время реакции 3 ч)
| Катализатор | BEA | MFI | FAU(Y) |
|---|---|---|---|
| Конверсия формальдегида, % | 50.2 | 22.7 | 9.7 |
| Производительность, ×103 г/г ч | |||
| Изопрен | 194.8 | 344.6 | 132.7 |
| CO | 163.7 | 93.8 | 178.1 |
| Другие | 42.2 | 245.7 | 84.4 |
По данным каталитических экспериментов самым неэффективным является цеолит структуры FAU(Y). Вероятно, это связано со строением данного образца. Конверсия формальдегида на нем существенно ниже, чем на MFI и ВЕА, что связано с меньшим количеством кислотных центров в фожазите. Спустя три часа после начала реакции на катализаторе структуры FAU(Y) основными продуктами являются изопрен (21.1 мол. %) и монооксид углерода (68.7 мол. %), суммарно составляющие около 90% продуктов. Высокая селективность по СО на фожазите, вероятно, связана с тем, что в этом образце бо'льшая часть алюминия находится во внерешеточном состоянии, а, следовательно, является льюисовскими кислотными центрами, ответственными за разложение формальдегида до СО и Н2.
Наиболее селективным в образовании изопрена оказался катализатор структуры MFI, что может быть связано с наличием каналов диаметром 5.5 Å в этом цеолите, которые приводят к ограничению образования тяжелых продуктов, предшественников кокса, что подтверждается данными термогравиметрического анализа (табл. 4). На среднепористом цеолите MFI содержание коксовых отложений в два раза ниже, чем на широкопористых BEA и FAU(Y). На цеолите ВЕА селективность образования изопрена ниже (30.1 мол. %), чем на катализаторе структуры MFI (46.4 мол. %), при этом конверсия формальдегида выше. Цеолит ВЕА является широкопористым, поэтому транспортные характеристики такого катализатора значительно лучше, чем у цеолитов
Таблица 4.
Данные ТГА-ДТА для MFI, BEA и FAU(Y)
| Структура | BEA | MFI | FAU(Y) |
|---|---|---|---|
| Масса кокса, % | 28.1 | 14.6 | 26.6 |
| Тмакс на кривой теплового потока, °C | 360; 510 | 380; 520 | 385; 510 |
Таким образом, наиболее эффективным в газофазном одностадийном синтезе изопрена из формальдегида и изобутилена оказался MFI, производительность по изопрену на котором составила 0.344 г/(гч).
ЗАКЛЮЧЕНИЕ
Впервые изучен одностадийный газофазный процесс получения изопрена из изобутилена и формальдегида на цеолитах BEA с разным составом анионного каркаса (Al-BEA, Nb-BEA, Zr-BEA и Sn-BEA) в проточных условиях. Показано, что наиболее эффективными катализаторами этого процесса являются Al- и Nb-содержащие цеолиты. Установлено, что причиной высокой активности Al- и Nb-содержащих цеолитов является наличие кислотных центров Бренстеда; найдена корреляция между концентрацией бренстедовских кислотных центров и производительностью катализаторов по изопрену.
Показано, что наиболее эффективным и селективным по изопрену является среднепористый цеолит MFI с диаметром пор 5.5 Å, производительность по изопрену на котором составила 0.344 г/(гч).
БЛАГОДАРНОСТИ
Исследование выполнено за счет гранта Российского научного фонда (проект № 14-23-00094).
Список литературы
Огородников С., Идлисс Г. Производство изопрена. Л.: Химия, 1973. 296 с.
Ninagawa Y., Yamada O., Renge T., Kyo S., Osaki T., Kushida K. // Patent USA № 4511751 США. 1985. РЖХим. 1986. 15. С. 3.
Yu X., Zhu W., Zhai S., Bao Q., Cheng D., Xia Y., Wang S., Zhan W. // React. Kinet. Mech. Catal. 2016. V. 117. P. 761.
Sushkevich V.L., Ordomsky V.V., Ivanova I.I. // Catal. Sci. Technol. 2016. V. 6. P. 6354.
Ai M. // J. Catal. 1987. V. 106. P. 280.
Ivanova I., Sushkevich V.L., Kolyagin Y.G., Ordomsky V.V. // Angew. Chem. 2013. V. 52. P. 2961.
Sushkevich V. L., Ordomsky V.V., Ivanova I. I. // Appl. Catal. A: General. 2012. V. 441. P. 21.
Krzywicki A., Wilanowicz T., Malinowski S. // React. Kinet. Catal. Lett. 1979. V. 11. P. 399.
Dang Z., Gu J., Yu L., Zhang C. // React. Kinet. Catal. Lett. 1991. V. 43. P. 495.
Dumitriu E., Hulea V., Fechete I., Catrinescu C., Auroux A., Lacaze J.-F., Guimon C. // Appl. Catal. A: General. 1999. V. 181. P. 15.
Dumitriu E., On D.T., Kaliaguine S. // J. Catal. 1997. V. 170. P. 150.
Dumitriu E., Hulea V., Chelaru C., Hulea T. // Stud. Surf. Sci. Catal. 1994. V. 84. P. 1997.
Dumitriu E., Gongescu D., Hulea V. // Stud. Surf. Sci. Catal. 1993. V. 78. P. 669.
Yakimov A.V., Kolyagin Y.G., Tolbor S., Vennestrøm P.N.R., Ivanova I.I. // New J. Chem. 2016. V. 40. P. 4367.
Zhu Y., Chuah G., Jaenicke S. // J. Catal. 2004. V. 227. P. 1.
Corma A., Xamena F. X. L., Prestipino C., Renz M., Valencia S. // J. Phys. Chem. C. 2009. V. 113. P. 11306.
Verified Syntheses of Zeolitic Materials. Third Revised Edition, Mintova S. (Editor). N. Barrier (XRD Patterns). 2016. 405 p.
Misono M. // Stud. Surf. Sci. Catal. 2013. V. 176. P. 97.
Дополнительные материалы отсутствуют.