Нефтехимия, 2019, T. 59, № 4, стр. 453-459
Модифицирование кислотных свойств подложки для катализаторов дегидрирования пропана Pt–Sn/BEA
Г. Г. Иванушкин 1, А. В. Смирнов 1, 2, *, П. А. Коц 1, И. И. Иванова 1, 2
1 Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
2 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
* E-mail: avsmirnov@phys.chem.msu.ru
Поступила в редакцию 01.10.2018
После доработки 23.02.2019
Принята к публикации 14.03.2019
Аннотация
В работе исследованы Pt–Sn-содержащие катализаторы дегидрирования пропана на цеолитной подложке со структурой типа BEA. Наличие на подложке кислотных центров не позволяет добиться высокой селективности по пропилену вследствие протекания побочных реакций. Для снижения кислотности подложки цеолит был деалюминирован без потери кристаллической структуры. При нанесении олова на такую подложку происходит встраивание атомов олова в цеолитный каркас, что подтверждено методом ИК-спектроскопии адсорбированного дейтерированного ацетонитрила. При дальнейшем нанесении платины за счет взаимодействия Pt–Sn обеспечивается высокая селективность по целевому продукту и повышается устойчивость активной фазы к агломерации. На образцах, содержащих 0.5% платины и 0.5–1.0% олова, при температуре реакции 550°С была достигнута конверсия пропана 26–28% при селективности по пропилену до 98.8%.
ВВЕДЕНИЕ
Пропилен является одним из самых востребованных продуктов в нефтехимической промышленности, прежде всего, вследствие его широкого использования в производстве полипропилена и пластиков, а также для получения изопропанола, акрилонитрила, пропиленоксида и других соединений.
Одним из промышленных способов получения пропилена является процесс дегидрирования пропана. На сегодняшний день наиболее эффективными катализаторами дегидрирования считаются платиносодержащие системы [1]. Помимо платины как активного компонента в состав катализаторов вводится промотор, в частности, олово, которое неактивно в дегидрировании, но способствует повышению выхода олефинов и увеличению стабильности работы. При взаимодействии платины и олова могут проявляться, во-первых, геометрические эффекты, заключающиеся в разделении активной поверхности платины атомами промотора на мелкие ансамбли; во вторых, электронные взаимодействия, при которых происходит изменение прочности связи Pt–C при адсорбции реагентов и продуктов. В целом, взаимодействие платины и олова приводит как к подавлению побочных реакций, в первую очередь, гидрогенолиза, так и к существенному уменьшению накопления коксовых отложений на поверхности платины [2–7].
Основным носителем для Pt–Sn-содержащих катализаторов дегидрирования пропана служит оксид алюминия. Присутствующие на такой подложке кислотные центры Льюиса, с одной стороны, способствуют закреплению активной фазы на поверхности, однако, с другой стороны, увеличивают вклад побочных реакций и коксообразования. В связи с этим оптимизации кислотных свойств известных подложек, а также поиску новых носителей для катализаторов уделяется большое внимание.
В роли перспективной замены для алюмооксидной подложки могут выступать цеолиты [7]. Они обладают высокой удельной поверхностью и упорядоченной системой пор, позволяющих создавать и поддерживать высокую дисперсность активной фазы. Протонные кислотные центры, присутствующие в цеолитах, могут быть нейтрализованы путем ионного обмена на катионы щелочных или щелочноземельных металлов. Помимо этого, возможен и другой путь подавления кислотности, заключающийся в удалении из цеолитной структуры атомов алюминия, ответственных за образование кислотных центров.
Цель настоящей работы состояла в синтезе Pt–Sn-содержащих катализаторов дегидрирования пропана на цеолитной подложке со структурой ВЕА, обладающей трехмерной канальной системой с размером пор от 5.6 до 6.7 Å. Была изучена возможность создания некислотной подложки путем деалюминирования исходного цеолита, исследовано влияние количества промотора на каталитические свойства образцов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов. В качестве исходного материала для получения носителя катализатора дегидрирования пропана использовали цеолит ВЕА с отношением SiO2/Al2O3, равным 25 (Zeolyst). Деалюминирование цеолита проводили путем трехкратной обработки в растворе 6М азотной кислоты при перемешивании в течение 24 ч при 80°С с промежуточными промывками дистиллированной водой.
Ионный обмен на Na+ проводили в 0.1 М растворе нитрата натрия (NaNO3, х. ч.) при перемешивании при 80°С на протяжении 24 ч. После ионного обмена образец промывали дистиллированной водой.
Нанесение олова (промотор) и платины (активный компонент) осуществляли методом пропитки по влагоемкости последовательно с промежуточным прокаливанием. В качестве прекурсоров использовали пентагидрат хлорида олова(IV) и гексагидрат гексахлорплатиновой кислоты, соответственно. Пропитку проводили из этанольных растворов, при нанесении олова в раствор дополнительно добавляли 3М раствор HCl в соотношении 1 : 1. Для разложения прекурсоров образцы прокаливали 3 ч при температуре 420°С со скоростью подъема температуры 1°С/мин.
Физико-химический анализ. Рентгенофазовый анализ (РФА) проводили на порошковом дифрактометре D2 PHASER фирмы BRUKER в геометрии θ–θ при 20°С. Режим анода 30 В, 10 А, рентгеновская трубка с медным анодом (λ СuKα1 = = 1.5418 Å). При съемке образец подвергался вращению в горизонтальной плоскости в интервале 2θ 4°–50° с шагом 0.05°, ширина щелей на выходе из трубки 0.6 мм и перед детектором 1.15 мм, время регистрации в точке 3 с. Обработку дифрактограмм выполняли с помощью программного пакета diffrac.EVA. Идентификацию фаз проводили по базе ICDD PDF2.
Термопрограммированную десорбцию аммиака (ТПД NН3) применяли для оценки кислотных свойств образцов. Эксперименты проводили с использованием универсального сорбционного газового анализатора УСГА-101 (“УНИСИТ”). Образец массой 0.10–0.15 г помещали в кварцевый реактор и прокаливали в токе гелия при температуре 550°С в течение 1 ч. Насыщение аммиаком проводили в токе смеси NH3(10%)/N2 в течение 30 мин при 60°С. Физически адсорбированный аммиак удаляли при 100°С в токе гелия в течение 1 ч. Далее при линейном подъеме температуры со скоростью 8°С/мин до 800°С регистрировали выделение аммиака детектором по теплопроводности.
ИК-спектроскопию адсорбированного дейтерированного ацетонитрила проводили на спектрометре Thermo iS-10. Образец массой 0.02 г прессовали в таблетку диаметром 1.6 см, которую помещали в ИК-ячейку, соединенную с вакуумной установкой. Образец прокаливали 1 ч при 400°С, затем охлаждали до комнатной температуры. Далее через калиброванный объем в ИК-ячейку вводили дейтерированный ацетонитрил и регистрировали ИК-спектры.
Каталитический эксперимент. В кварцевый реактор проточной каталитической установки УЛКат-1 (“УНИСИТ”) загружали 300 мг катализатора и нагревали до 550°С со скоростью 3°С/мин в токе водорода (марка А, Air Liquid) 20 мл/мин. По достижении 550°С останавливали подачу водорода и начинали подачу пропана (99.98%) с массовой скоростью подачи WHSV = = 3.5 ч–1. Каталитические эксперименты проводили при атмосферном давлении. Продукты реакции анализировали методом газовой хроматографии на хроматографе Кристалл 5000.2 (СКБ “Хроматэк”) с пламенно-ионизационным детектором, используя для разделения продуктов капиллярные колонки SE–30 (50 м) и PLOT Al2O3/KCl (50 м).
Конверсию пропана K рассчитывали по формуле:
Селективность (массовую) по каждому из продуктов Cпрод рассчитывали по формуле: ${{C}_{{{\text{п р о д }}}}} = {{k}_{{{\text{п р о д }}}}}{{S}_{{{\text{п р о д }}}}} \times 100\% /\left( {\Sigma {{k}_{i}}{{S}_{i}} - {{k}_{{{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{8}}}}}}}{{S}_{{{{{\text{C}}}_{{\text{3}}}}{{{\text{H}}}_{{\text{8}}}}}}}} \right).$
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез катализаторов дегидрирования пропана состоял из трех последовательных этапов: приготовление носителя, нанесение промотора – олова и, наконец, нанесение активного компонента – платины.
Носитель для катализаторов дегидрирования пропана, согласно литературным данным, не должен содержать кислотных центров, которые существенно снижают селективность процесса. В настоящей работе в качестве носителя был использован цеолит ВЕА с исходным отношением SiO2/Al2O3 = 25, прошедший процедуру деалюминирования. Выбор цеолита с высоким исходным содержанием алюминия определялся тем, что в процессе деалюминирования, направленного на снижение кислотности цеолита, должно создаваться большое количество структурных дефектов, способствующих закреплению наносимой активной фазы и препятствующих ее агломерации.
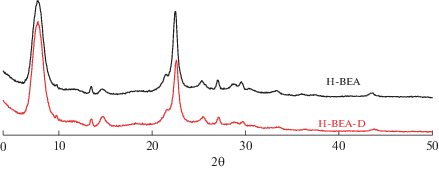
Применяемая методика трехстадийного де-алюминирования приводила к достаточно эффективному удалению алюминия из цеолитной структуры; при этом отношение SiO2/Al2O3 по данным рентгенофлуоресцентного анализа изменилось от 25 до 1480. Контроль за сохранением кристаллической структуры цеолита осуществляли методом РФА, который показал, что существенной потери кристалличности цеолита в ходе деалюминирования не происходит (рис. 1).
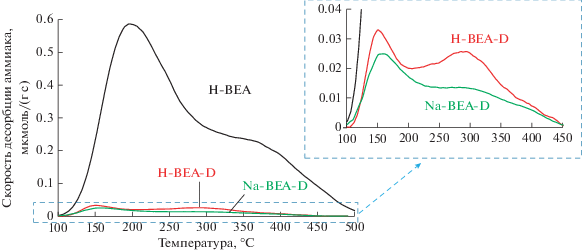
Изменение кислотности цеолита в процессе деалюминирования детектировали методом термопрограммируемой десорбции аммиака (рис. 2). Удаление алюминия из структуры сопровождается уменьшением количества десорбированного аммиака с 745 до 45 мкмоль/г. Вероятнее всего, остаточная кислотность поддерживается атомами алюминия, которые не удается удалить в ходе деалюминирования. Нами была предпринята попытка уменьшения этой величины за счет введения в деалюминированный цеолит ионов натрия путем ионного обмена, после чего количество десорбированного аммиака составило 30 мкмоль/г (рис. 2). Именно этот образец, обозначенный далее как Na-BEA-D, был использован как подложка для приготовления платина-оловянных катализаторов дегидрирования пропана.
Рис. 2.
Кривые ТПД аммиака для исходного (Н-ВЕА), деалюминированного (Н-ВЕА-D) и прошедшего дополнительный ионный обмен (Na-ВЕА-D) образцов.
Стратегия дальнейшего синтеза катализаторов состояла в первоначальном нанесении олова (промотор) на приготовленную нами подложку Na-BEA-D, а затем после промежуточного прокаливания наносилась платина (активный компонент).
Олово вводилось в катализаторы в концентрации 0.5, 1.0 и 2.0 мас. %. При пропитке подложки раствором хлорида олова(IV) пришлось отказаться от использования традиционных водных растворов, так как деалюминированный цеолит, в отличие от исходного, обладал ярко выраженными гидрофобными свойствами. Поэтому для нанесения соли олова использовали этанольный раствор. Кроме того, для снижения гидролиза хлорида олова уменьшали pH раствора путем добавления соляной кислоты. Далее после промежуточного прокаливания наносили платину, используя этанольный раствор гексахлорплатиновой кислоты. Содержание платины во всех образцах составляло 0.5%.
Таким образом, были приготовлены образцы катализаторов, состав которых приведен в табл. 1. В качестве катализатора сравнения был также синтезирован образец, не содержащий олова (Pt/Na-BEA-D), а также катализатор на основе исходного недеалюминированного цеолита (Pt/Sn/H-BEA).
Таблица 1.
Синтезированные катализаторы дегидрирования пропана
| Наименование образца | Носитель | Содержание компонентов, мас. % | |
|---|---|---|---|
| Sn | Pt | ||
| Pt/Sn/H-BEA | H-BEA | 0.5 | 0.5 |
| Pt/Na-BEA-D | Na-BEA-D | – | 0.5 |
| Pt/Sn(0.5)/Na-BEA-D | Na-BEA-D | 0.5 | 0.5 |
| Pt/Sn(1.0)/Na-BEA-D | Na-BEA-D | 1.0 | 0.5 |
| Pt/Sn(2.0)/Na-BEA-D | Na-BEA-D | 2.0 | 0.5 |
Все приготовленные катализаторы показали высокую первоначальную конверсию в процессе превращения пропана (рис. 3). Наиболее активными через 0.5 ч после начала реакции оказались образцы Pt/Sn/H-BEA и Pt/Na-BEA-D, конверсия пропана для которых составила 29 и 32%, соответственно. Однако на этих катализаторах наблюдалась быстрая дезактивация, и через 4 ч конверсия для них упала до 3 и 17%, соответственно. Образцы, содержащие в своем составе 0.5 и 1.0% олова, продемонстрировали высокие и достаточно близкие результаты по конверсии пропана, при этом скорость дезактивации для этих образцов была незначительной. Повышение содержания олова до 2.0% привело к некоторому снижению конверсии пропана для образца Pt/Sn(2.0)/Na-BEA-D и его более быстрой дезактивации.
Такое поведение катализаторов становится понятным при рассмотрении селективности протекания процесса конверсии пропана на этих образцах (табл. 2). Вследствие сильной кислотности подложки на катализаторе Pt/Sn(0.5)/H-BEA основным направлением реакции является ароматизация, селективность по пропилену через 0.5 ч составляет всего около 59%. Быстрая дезактивация этого катализатора, вероятнее всего, связана с образованием конденсированных ароматических соединений, блокирующих каталитически активные центры и поры в целом. Через 4 ч реакции селективность по ароматическим углеводородам падает с 19 до 7%, а по пропилену растет, составляя около 74%. Данный эксперимент подтверждает, что получение эффективного катализатора дегидрирования пропана на кислотных подложках невозможно.
Таблица 2.
Селективность катализаторов
| Катализатор | Конверсия через 0.5/4 ч реакции, % | Селективность через 0.5/4 ч реакции, % | |||
|---|---|---|---|---|---|
| C1–C2 | С3= | C4–C6 | АУ* | ||
| Pt/Sn(0.5)/H-BEA | 29/3 | 13.2/14.6 | 58.6/74.4 | 9.7/4.0 | 18.6/7.2 |
| Pt/Na-BEA-D | 32/17 | 17.7/7.3 | 76.8/90.4 | 2.4/1.3 | 3.1/1.0 |
| Pt/Sn(0.5)/Na-BEA-D | 27/26 | 2.0/0.9 | 96.5/98.6 | 0.5/0.4 | 1.0/0.2 |
| Pt/Sn(1.0)/Na-BEA-D | 28/26 | 1.3/0.7 | 97.5/98.8 | 0.3/0.3 | 0.8/0.2 |
| Pt/Sn(2.0)/Na-BEA-D | 26/21 | 0.7/0.7 | 98.7/98.9 | 0.3/0.3 | 0.2/0.1 |
Активность катализатора Pt/Na-BEA-D, синтезированного на некислотной подложке и не содержащего в своем составе олова, в большей степени обусловлена протеканием другой побочной реакции – гидрогенолиза. Это проявляется в образовании значительных количеств С1–С2-углеводородов, селективность по пропилену через 0.5 ч составляет около 77%. В ходе реакции вместе с падением активности катализатора наблюдается снижение выхода С1–С2-углеводородов и увеличение селективности по пропилену. Вероятнее всего, снижение конверсии пропана связано с быстрой дезактивацией за счет блокировки коксовыми отложениями наиболее активных платиновых центров, отвечающих за гидрогенолиз; кроме того, вероятна агломерация платиновых частиц, приводящая к снижению доступных для реакции активных центров.
Промотирующий эффект олова ярко выражен для всех трех платина-оловянных катализаторов, синтезированных на подложке Na-BEA-D. При конверсии пропана 26–28% уже начальная селективность по пропилену составляет 97–99%. Такое резкое повышение селективности по целевому продукту при добавлении олова свидетельствует об эффективном взаимодействии промотра и активной фазы. Следует также отметить, что, согласно термодинамическим данным, равновесная конверсия пропана в реакции дегидрирования в условиях проведения эксперимента составляет ~30%, поэтому можно говорить о том, что активность катализаторов близка к максимально возможной.
В первый час проведения реакции на образцах с различным содержанием олова селективность несколько различается – с увеличением его концентрации количество побочных продуктов снижается. Однако через 4 ч эксперимента все показатели селективности становятся практически одинаковы. То есть, при малом содержании олова существует незначительное количество центров, ведущих ароматизацию и гидрогенолиз, но они подвержены быстрой дезактивации, как уже наблюдалось для катализаторов Pt/Sn(0.5)/H-BEA и Pt/Na-BEA-D, где такие центры присутствуют в значительных количествах. Далее работают только платиновые центры, промотированные оловом, которые и показывают высокую селективность по пропилену.
Для катализаторов Pt/Sn(0.5)/Na-BEA-D и Pt/Sn(1.0)/Na-BEA-D, как уже отмечалось выше, падения конверсии в ходе реакции практически не происходит. Мы предполагаем, что при содержании олова 0.5–1.0% значительная его часть встраивается в цеолитную структуру в местах дефектов, возникающих в ходе деалюминирования [8]. В дальнейшем такие частицы, закрепленные в порах олова, служат “якорем” для атомов платины, во-первых, обеспечивая промотирующий эффект, необходимый для высокой селективности по пропилену, и, во-вторых, препятствуя агломерации платиновых частиц.
Наличие атомов олова в цеолитной структуре удалось подтвердить методом ИК-спектроскопии адсорбированного дейтерированного ацетонитрила [9, 10]. Результаты приведены на рис. 4 на примере образца, содержащего 1% олова на подложке Na-BEA-D. В ИК-спектрах обнаружены полосы 2316 и 2308 см–1, отвечающие колебанию CD3CN на решеточных льюисовских и бренстедовских центрах, соответственно. Таким образом, значительная часть атомов олова действительно встраивается в цеолитный каркас, образуя так называемые “закрытые” и “открытые” оловянные центры в структуре цеолита [9].
Наиболее выраженная полоса 2283 см–1 относится к колебаниям молекул ацетонитрила, адсорбированных на силанольных группах. Из-за большой интенсивности этой полосы не детектируется полоса 2287 см–1 , которая показывает наличие олова в виде оксида. Однако внерешеточные частицы олова, вероятнее всего, также присутствует в синтезированных нами образцах.
В случае большого количества нанесенного олова значительная его часть должна находиться в виде крупных оксидных частиц на поверхности цеолитных кристаллов, в которых может накапливаться платина; при этом ее дисперсность будет ниже, чем в случае равномерного распределения по объему кристаллов. Кроме того, восстановительная среда реакции способствует подвижности платины и ее агрегации внутри оловянных частиц, что и будет проявляться в снижении активности катализатора в ходе эксперимента. Вероятнее всего, именно этот эффект мы и наблюдаем в ходе дегидрирования пропана на образце Pt/Sn(2.0)/Na-BEA-D.
Таким образом, лучшие результаты по конверсии пропана, селективности по пропилену и устойчивости к дезактивации показали образцы Pt/Sn(0.5)/Na-BEA-D и Pt/Sn(1.0)/Na-BEA-D, полученные на деалюминированной некислотной подложке и содержащие 0.5–1.0% промотирующего компонента – олова.
ЗАКЛЮЧЕНИЕ
Методом деалюминирования цеолита со структурой ВЕА получена не обладающая кислотностью подложка для катализатора дегидрирования пропана. При нанесении олова на такую подложку происходит встраивание атомов олова в цеолитную структуру. При дальнейшем нанесении платины за счет взаимодействия Pt-Sn обеспечивается высокая селективность по целевому продукту и повышается устойчивость активной фазы к агломерации. На наиболее эффективных образцах, содержащих 0.5% платины и 0.5–1.0% олова, при температуре реакции 550°С была достигнута конверсия пропана 26–28% при селективности по пропилену до 98.8%.
Список литературы
Sattler J.J., Ruiz-Martinez J., Santillan-Jimenez E., Weckhuysen B.M. // Chem. Rev. 2014. V. 114. № 20. P. 10613.
Lee M.-H., Nagaraja B.M., Lee K.Y., Jung K.-D. // Catal. Today. 2014. V. 232. P. 53.
Shan Y., Sui Z., Zhu Y., Chen D., Zhou X. // Chem. Eng. J. 2015. V. 278. P. 240.
Gao J., Zhao H., Yang X., Koel B., Podkolzin S. // Angew. Chemie. 2014. V. 53. № 14. P. 3641.
Liwu L., Tao Z., Jingling Z., Zhusheng X. // Appl. Catal. 1990. V. 67. № 1. P. 11.
Padro C.L., de Miguel S.R., Castro A.A., Scelza O.A. // Stud. Surf. Sci. Catal. 1997. V. 111. P. 191.
Zhang Y., Zhou Y., Qiu A., Wang Y., Xu Y., Wu P. // Catal. Commun. 2006. V. 7. № 11. P. 860.
Dijkmans J., Dusselier M., Janssens W., Trekels M., Vantomme A., Breynaert E., Kirschhock C., Sels B.F. // ACS Catal. 2016. V. 6. № 1. P. 31.
Boronat M., Concepcion P., Corma A., Renz M., Valencia S. // J. Catal. 2005. V. 234. P. 111.
Sushkevich V.L., Ivanova I.I., Yakimov A.V. // J. Phys. Chem. C. 2017. V. 121. № 21. P. 11437.
Дополнительные материалы отсутствуют.