Нефтехимия, 2019, T. 59, № 4, стр. 417-422
Разработка катализатора и процесса жидкофазного алкилирования бензола этиленом и этан-этиленовой фракцией пиролиза углеводородов
М. Л. Павлов 1, Р. А. Басимова 1, Д. А. Шавалеев 2, А. С. Эрштейн 1, *
1 ООО “НТЦ Салаватнефтеоргсинтез”,
Салават, Республика Башкортостан, Российская Федерация
2 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
* E-mail: ershteyn@gmail.com
Поступила в редакцию 19.09.2018
После доработки 06.03.2019
Принята к публикации 14.03.2019
Аннотация
Синтезирован базовый катализатор НY-БС, представляющий собой цеолит Y, не содержащий связующих веществ в кислотной Н+-форме, и проведено его модифицирование растворами соляной и лимонной кислот. Показано, что все полученные катализаторы проявляют высокие активность и селективность в реакции жидкофазного алкилирования бензола этиленом. Впервые установлено, что при использовании в качестве алкилирующего агента как гидрированной, так и не гидрированной этан-этиленовой фракции пиролиза вместо этилена полимеризационной чистоты в реакции жидкофазного алкилирования бензола на катализаторе, модифицированном 0.3 н соляной кислотой, концентрация этилбензола в алкилате и селективность образования этилбензола выше.
Основная часть современных исследований в области технологии алкилирования бензола этиленом в этилбензол (ЭБ) связана с созданием и использованием цеолитсодержащих катализаторов представляющих собой твердые пористые системы, содержащие активный компонент и связующее вещество. Активным компонентом служат цеолиты USY, бета, морденит, ZSM-5, ZSM-11, МСМ-22, МСМ-49. Связующее вещество – Al2O3, SiO2 или аморфный алюмосиликат. После смешения активного компонента и связующего вещества из полученной массы формуют гранулы, которые затем высушивают и прокаливают. Иногда затем катализатор подвергают модифицированию. Обычно содержание цеолита в катализаторах составляет от 60 до 80 мас. % [1–9].
Технология жидкофазного алкилирования (ЖФА) бензола этиленом, с использованием гетерогенного катализатора на основе широкопористого цеолита Y (тип FAU), была внедрена в промышленность Lummus/Unocal/UOP в 1989 г. [10]. Процесс протекает при относительно низких температурах 200–260°С, характеризуется высоким выходом ЭБ, отсутствием коррозионно-агрессивной среды и необходимости утилизации стоков, а также низкими инвестиционными и эксплуатационными расходами.
В настоящее время в большинстве процессов получения ЭБ в качестве алкилирующего агента используется этилен полимеризационной чистоты (чистота более 99.9%). Однако известны и технологии производства ЭБ в составе комплекса по получению олефинов (пиролиз). В этом случае, при производстве ЭБ, в качестве алкилирующего агента используется не этилен, а этан-этиленовая фракция (ЭЭФ) пиролиза углеводородов (УВ) [11]. Известно [12], что использование ЭЭФ вместо этилена полимеризационной чистоты в процессе газофазного алкилирования бензола более предпочтительно, так как при этом концентрация ЭБ в алкилате, его выход от теоретического и селективность образования выше.
В 2013 г. в России внедрен и с успехом эксплуатируется процесс жидкофазного трансалкилирования бензола диэтилбензолами, в котором используется отечественный катализатор (КТ-БС-1) – цеолит Н+Y, не содержащий связующих веществ [13].
В связи с вышеизложенным, разработка и внедрение катализаторов, представляющих собой цеолит Y, не содержащий связующих веществ, в кислотной Н+-форме (НY-БС) и использование в качестве алкилирующего агента не этилена, а ЭЭФ пиролиза УВ в реакции ЖФА бензола, является важной и актуальной задачей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для получения катализатора HY-БС синтезированный нами цеолит NаY-БС [14], не содержащий связующих веществ, обладающий мольным отношением SiO2/Al2O3 5.5 и степенью кристалличности, близкой к 100%, переводили в кислотную Н+-форму. Для этого проводили замещение катионов Na+ на ${\text{NH}}_{4}^{ + }$ в три стадии ионного обмена в растворе нитрата аммония с концентрацией 25 г/дм3 (в пересчете на ${\text{NH}}_{4}^{ + }$). Каждую ионообменную обработку осуществляли при температуре 70°C в течение 1.0 ч и соотношении цеолит (г)/раствор (см3), равном 1/7. Обработки чередовали с прокалками в воздушной среде при температуре 600°C в течение 3 ч. После последней аммонийной обработки гранулы промывали деминерализованной водой, высушивали и прокаливали в воздушной среде при температуре 600°C в течение 3 ч.
Модифицирование катализатора НY-БС осуществляли обработкой водными растворами соляной и лимонной кислот для удаления из его состава внерешеточного алюминия, образующегося при частичном деалюминировании цеолита NaY-БС в процессе синтеза НY-БС.
Обработки проводили растворами кислот с концентрацией 0.1; 0.3 н при температуре 90°C, в течение 1 ч и соотношении гранулы (г)/раствор (см3), равном 1 : 7. После обработки образцы промывали деминерализованной водой до рН 6, сушили при температуре 140°C в течение 4 ч и прокаливали в воздушной среде при температуре 600°С в течение 3 ч.
Химический состав образцов анализировали методами комплексонометрического титрования и пламенной фотометрии [15, 16]. Фазовый состав, модуль цеолита и катализаторов определяли на рентгеновском дифрактометре PHILIPS PW 1800 в монохроматизированном CuKα излучении в области углов от 5° до 40° по 2θ с шагом 0.5 град/мин и временем накопления в каждой точке 20 с.
Равновесную адсорбционную емкость катализаторов по парам воды и бензола определяли эксикаторным способом при Р/Рs = 0.8 и температуре 25°С. Кислотные свойства катализаторов исследовали методом термопрограммированной десорбции предварительно адсорбированного аммиака [17].
Каталитические свойства образцов изучали в реакции ЖФА бензола этиленом полимеризационной чистоты (99.9 об. %), а также гидрированной (77.52 об. % этилена и 22.48 об. % этана) и не гидрированной ЭЭФ пиролиза УВ (79.10 об. % этилена, 1.84 об. % ацетилена и 19.06 об. % этана) с получением этилбензола на лабораторной установке, оборудованной реактором проточного типа. Загрузку реактора (диаметр 10 мм и высота 120 мм) проводили в следующей последовательности: в нижнюю часть помещали фарфоровую насадку в количестве 25 см3, далее катализатор – 5 см3. Поверх катализатора насыпали фарфоровую насадку.
Условия проведения испытаний: температура 200°С; давление 2.5 МПа; объемная скорость по бензолу 5 ч–1; мольное соотношение бензол/этилен = 5 : 1. Условия проведения жидкофазного алкилирования бензола ЭЭФ такие же, как и при алкилировании этиленом полимеризационной чистоты. Мольное соотношение бензола к ЭЭФ составляло 3.95 : 1 или в пересчете на 100% этилен 5 : 1.
Продукты реакции анализировали на газовом хроматографе “Кристаллюкс 4000” с пламенно-ионизационным детектором на кварцевой капиллярной колонке размером 60 м × 0.32 мм × 1.0 мкм с неподвижной фазой ZB-1. Обработку результатов проводили на программно-аппаратном комплексе по методу “внутренней нормализации”.
Для характеристики каталитических свойств образцов использовали следующие показатели: конверсия бензола (Б), выход ЭБ от теоретически возможного и селективность образования ЭБ, которые были рассчитаны по формулам (1)–(3).
Конверсия бензола, КБ, %:
(1)
${{{\text{K}}}_{{\text{Б }}}} = \frac{{С _{{{\text{и с х }}}}^{{\text{Б }}} - С _{{{\text{э к с }}}}^{{\text{Б }}}}}{{С _{{{\text{и с х }}}}^{{\text{Б }}}}} \times 100,$Выход ЭБ от теоретически возможного – показатель, характеризующий полноту использования сырья в процессе алкилирования, ХЭБ, %:
(2)
${{X}^{{{\text{Э Б }}}}} = \frac{{С _{{{\text{э к с }}}}^{{{\text{Э Б }}}}}}{{X_{{{\text{т е о р }}}}^{{{\text{Э Б }}}}}} \times 100,$Селективность образования ЭБ – относительная концентрация ЭБ в расчете на продукты реакции ${{{\delta }}^{{\text{Б }}}}$, %:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
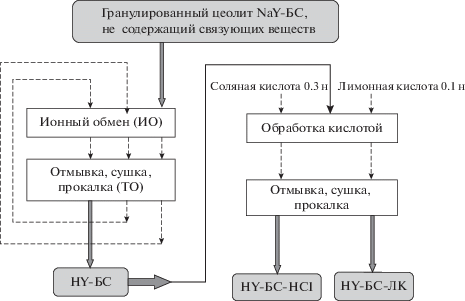
На рис. 1 показана блок-схема получения образцов модифицированных катализаторов алкилирования, а в табл. 1 приведена характеристика их физико-химических свойств.
Таблица 1.
Физико-химические свойства синтезированных катализаторов
| Показатели | HY-БС | HY-БС-HCl | HY-БС-ЛК |
|---|---|---|---|
| Степень кристалличности | 0.98 | 0.98 | 0.98 |
| Мольное отношение SiO2/Al2O3 по данным РФА | 7.1 | 7.1 | 7.1 |
| Содержание Na2O, мас. % | 0.46 | 0.39 | 0.45 |
| Статическая адсорбц. емкость по парам при Т = 25°С, Р/Рs = 0.5, см3/г: | |||
| – воды | 0.26 | 0.26 | 0.26 |
| – бензола | 0.32 | 0.32 | 0.32 |
| Кислотные свойства, мкмоль NH3/г катализатора: | |||
| – “слабые” кислотные центры | 556 | 625 | 544 |
| – “сильные” кислотные центры | 463 | 423 | 398 |
| – общая кислотность | 1019 | 1048 | 942 |
В результате кислотного модифицирования базового катализатора HY-БС из него был удален только внерешеточный алюминий. Об этом свидетельствует то, что мольное отношение SiO2/Al2O3 цеолита по данным рентгенофазового анализа (РФА) у всех трех катализаторов одинаковое. Кроме того, рассмотренные три катализатора обладают одинаковой статической адсорбционной емкостью по парам воды и бензола, а также близкими величинами кислотности и содержания остаточного натрия.
В табл. 2 приведены результаты исследования реакции ЖФА бензола этиленом на синтезированных катализаторах.
Таблица 2.
Результаты исследования ЖФА бензола этиленом
| Показатели | HY-БС | HY-БС-HCl | HY-БС-ЛК |
|---|---|---|---|
| 1. Углеводородный состав, мас. %: | Алкилат | ||
| неароматические УВ | 0.459 | 0.445 | 0.369 |
| бензол | 82.159 | 78.386 | 80.197 |
| толуол | 0.032 | 0.035 | 0.030 |
| этилбензол | 12.770 | 16.292 | 14.661 |
| изо-пропилбензол | 0.077 | 0.051 | 0.081 |
| ксилолы | 0.000 | 0.000 | 0.001 |
| н-пропилбензол | 0.002 | 0.004 | 0.004 |
| этилтолуол | 0.192 | 0.132 | 0.204 |
| м-ДЭБ | 1.061 | 1.417 | 1.205 |
| п-ДЭБ | 0.788 | 0.866 | 0.822 |
| о-ДЭБ | 0.775 | 0.696 | 0.721 |
| С11 и выше (ПАБ) | 1.685 | 1.676 | 1.705 |
| Сумма | 100.000 | 100.000 | 100.000 |
| 2. Конверсия бензола, % | 17.67 | 21.46 | 19.64 |
| 3. Выход ЭБ от теор. возможного, % | 50.37 | 64.27 | 57.40 |
| 4. Селективность по ЭБ, % | 72.27 | 75.92 | 74.65 |
При использовании катализаторов HY-БС-HCl и HY-БС-ЛК конверсия бензола, концентрация ЭБ в алкилате, выход ЭБ от теоретического и селективность образования ЭБ выше, чем на базовом катализаторе HY-БС. По-видимому, это связано с тем, что кислотные центры этих катализаторов в результате постсинтетических обработок соляной или лимонной кислотами, при которых удаляется внерешеточный алюминий, становятся доступнее. Более того, самый активный и селективный, из рассмотренных катализаторов – HY-БС-HCl, обладает самой высокой кислотностью. В изучаемой реакции, по сравнению с базовым катализатором HY-БС, концентрация ЭБ в алкилате увеличивается на 27.6 отн. %, а селективность по ЭБ на 5.1 отн. %.
Изучение реакции алкилирования бензола гидрированной и не гидрированной ЭЭФ проводили на катализаторе HY-БС-HCl (табл. 3).
Таблица 3.
Результаты реакции ЖФА бензола на катализаторе HY-БС-HCl с различным алкилирующим агентом
| Показатели | Алкилирующий агент | ||
|---|---|---|---|
| этилен | ЭЭФ не гидрир. | ЭЭФ гидрир. | |
| 1. Углеводородный состав, мас. %: | Алкилат | ||
| неароматические УВ | 0.445 | 0.445 | 0.217 |
| бензол | 78.386 | 78.503 | 75.760 |
| толуол | 0.035 | 0.026 | 0.034 |
| этилбензол | 16.292 | 16.990 | 18.830 |
| изо-пропилбензол | 0.051 | 0.033 | 0.035 |
| ксилолы | 0.000 | 0.000 | 0.000 |
| н-пропилбензол | 0.004 | 0.002 | 0.003 |
| этилтолуол | 0.132 | 0.092 | 0.093 |
| м-ДЭБ | 1.417 | 1.201 | 1.602 |
| п-ДЭБ | 0.866 | 0.734 | 0.979 |
| о-ДЭБ | 0.696 | 0.589 | 0.787 |
| С11 и выше (ПАБ) | 1.676 | 1.385 | 1.660 |
| Сумма | 100.000 | 100.000 | 100.000 |
| 2. Конверсия бензола, % | 21.46 | 21.34 | 24.09 |
| 3. Выход ЭБ от теор. возможного, % | 64.27 | 67.02 | 74.28 |
| 4. Селективность по ЭБ, % | 75.92 | 79.62 | 78.17 |
Как следует из полученных данных, применение гидрированной и не гидрированной ЭЭФ пиролиза вместо этилена полимеризационной чистоты в реакции ЖФА бензола не только возможно, но и желательно.
Так использование не гидрированной ЭЭФ приводит к увеличению, концентрации ЭБ в алкилате на 4.3 отн. % и селективности его образования на 4.9 отн. %. При этом наблюдается снижение содержания в алкилате вредных примесей, отн. %: этилтолуола на 30.3; изо-пропилбензола на 35.3; побочных продуктов: ДЭБ на 15.3 и ПАБ на 17.4.
Применение в качестве алкилирующего агента гидрированной ЭЭФ приводит к увеличению, отн. %: концентрации ЭБ в алкилате на 15.6 и селективности его образования на 3.0; при одновременном снижении в алкилате, отн. %: содержания вредных примесей: этилтолуола на 29.5; изо-пропилбензола на 31.4, а побочного продукта ПАБ на 1.0. Но содержание ДЭБ увеличивается на 12.9 отн. %.
То, что использование в качестве алкилирующего агента ЭЭФ пиролиза более предпочтительно, чем этилена полимеризационной чистоты в процессе ЖФА бензола, может быть связано с тем, что этан, занимая сильные кислотные центры цеолита, препятствует локализации на них этилена и таким образом предотвращает протекание побочных реакций образования вредных примесей.
Таким образом, первые установлено, что использование в качестве алкилирующего агента как гидрированной, так и не гидрированной ЭЭФ пиролиза вместо этилена полимеризационной чистоты возможно и, более того, благоприятно сказывается на показателях процесса ЖФА бензола на катализаторе HY-БС-HCl. При этом выше: концентрация ЭБ в алкилате, выход ЭБ от теоретического и селективность образования ЭБ. Кроме того концентрация в алкилате нежелательных примесей этилтолуола и изо-пропилбензола, а также побочного продукта – ПАБ меньше.
Список литературы
Degnan T.F., Jr., Smith C.M., Venkat Ch.R. // Appl. Catal. A: General. 2001. V. 221. P. 283.
Perego C, Ingallina P. // Green Chem. 2004. № 6. P. 274.
West M., Abdo S.F. // Patent USA № 5157180. 1992. Union Oil Company of California. 1991. 12 p.
Chen J. // Patent USA № 5866736. 1999. Catalytic Distillation Technologies. 1997. 9 p.
Merrill J.T., Butler J.R. // Patent USA № 5955642. 1999. Fina Technology. Inc. 1996. 14 p.
Timken H.K., Chester A.W, Ardito S.C., Hagemeister M.P. // Patent USA № 6596662. 2003. ExxonMobil Chemical Company. 2001. 10 p.
Timken H.K., Chester A.W, Ardito S.C., Hagemeister M.P. // Patent USA № 6747182. 2004. ExxonMobil Chemical Company. 2001. 9 p.
Campbell C.B., Harris T.V., Tequi P., Le Coent J.-L. // Patent USA № 7109141. 2006. Chevron Texaco Corporation. 2005. 13 p.
Рогов М.Н., Рахимов Х.Х., Ишмияров М.Х., Мячин С.И., Лукъянчиков И.И., Елин О.Л., Прокопенко А.В., Патрикеев В.А., Смирнов В.К., Павлов М.Л., Галяутдинов А.А., Басимова Р.А. // Патент РФ № 2265482. 2004. ООО “Салаватнефтеоргсинтез”. 2004. Бюл. № 34. С. 5.
Gerzeliev I.M., Khadzhiev S.N., Sakharova I.E. // Petrol. Chemistry. 2011. V. 51. № 1. P. 40.
Нетцер Д. // Нефтегазовые технологии. 1999. № 5. С. 75.
Шавалеев Д.А. Дис. ... канд. хим. наук. ИНХС им. А.В. Топчиева РАН. М. 2017.
Хаджиев С.Н., Павлов М.Л., Басимова Р.А., Герзелиев И.М., Алябьев А.С., Кутепов Б.И. // Патент РФ № 2478429. 2013. ИНХС им. А.В. Топчиева РАН, ООО “Научно-технический центр Салаватнефтеоргсинтез”. 2011. Бюл. № 10. 15 с.
Шавалеев Д.А., Павлов М.Л., Басимова Р.А., Шавалеева Н.Н., Эрштейн А.С., Травкина О.С., Кутепов Б.И. // Патент РФ № 2553876. 2015. ООО “Научно-технический центр Салаватнефтеоргсинтез”. 2014. Бюл. № 17. 10 с.
Полуэктов Н.С. Методы анализа по фотометрии пламени. М.: Госхимиздат, 1959. 231 с.
Шарло Г. Методы аналитической химии. М.: Химия, 1965. 976 с.
Хазипова А.Н., Павлова И.Н., Григорьева Н.Г., Кутепов Б.И., Павлов М.Л., Басимова Р.А. // Химическая технология. 2012. № 1. С. 5.
Дополнительные материалы отсутствуют.