Нефтехимия, 2019, T. 59, № 4, стр. 405-409
Влияние локализации кислотных центров на дезактивацию цеолита MFI в процессе олигомеризации легких алкенов
А. Г. Попов 1, *, А. В. Ефимов 1, И. И. Иванова 1, 2
1 Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
2 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
* E-mail: andreygpopov@yahoo.com
Поступила в редакцию 19.10.2018
После доработки 04.03.2019
Принята к публикации 14.03.2019
Аннотация
Посредством ионного обмена получена серия образцов цеолита MFI с одинаковой морфологией, но разной концентрацией бренстедовских кислотных центров. Методами термопрограммированной десорбции аммиака (ТПД NH3) и ИК-спектроскопии адсорбированного 2,6-ди-трет-бутилпиридина показано, что образцы отличаются соотношением кислотных центров в объеме цеолита и на внешней поверхности. Устойчивость образцов к дезактивации определена в реакции олигомеризации бутиленов с применением стадии ускоренной дезактивации в жестких условиях. Показано, что основной вклад в дезактивацию вносят кислотные центры, расположенные на внешней поверхности цеолитных кристаллов.
Олигомеризация легких алкенов – промышленно важный путь получения высокооктановых добавок к бензину, дизельного топлива, пластификаторов, масел и поверхностно-активных веществ [1]. Наилучшие каталитические свойства в олигомеризации проявляют катализаторы на основе цеолитов со средними размерами пор [2–4]. В настоящее время в качестве основы для катализаторов в процессе MOGD (Mobil Olefin to Gasoline and Distillate) используют цеолит структуры MFI (ZSM-5) [5–8], который обладает высокой устойчивостью к коксообразованию благодаря стерическим затруднениям при формировании полиароматических соединений в порах цеолита [9–11].
Несмотря на относительно стабильную работу катализаторов на основе цеолитов со средним размером пор, в настоящее время межрегенерационный пробег промышленных катализаторов составляет не более 30 сут [12]. Поэтому настоящая работa была направлена на изучение кислотных свойств катализатора, влияющих на стабильность его работы.
Ранее в работе [12] было показано, что морфология цеолитных образцов ключевым образом влияет на их каталитическое поведение в олигомеризации. Уменьшение размеров кристаллов цеолитов приводило к увеличению каталитической активности. Одновременно с этим увеличивалась доля коксовых отложений на образцах, предположительно из-за более высокой концентрации кислотных центров на развитой внешней поверхности мелких кристаллов. В работе [13] для серии цеолитов с дезактивированной внешней поверхностью было показано снижение коксообразования при уменьшении концентрации бренстедовских кислотных центров (БКЦ) на внешней поверхности. К сожалению, отравление БКЦ на внешней поверхности требовало внесения в образцы до 15 мас. % SiO2. А это, в свою очередь, изменяло морфологию цеолитных образцов, поскольку SiO2 заполнял транспортные мезопоры. Таким образом, в серии образцов изменялось одновременно отношение БКЦ на внешней поверхности и в объеме цеолита и соотношение микро- и мезопор.
Для того, чтобы более корректно разделить влияние морфологии и локализации кислотных центров на устойчивость катализатора к дезактивации, в настоящей работе предложен подход, связанный с отравлением части БКЦ катионами натрия. Преимуществом этого подхода является то, что он никак не влияет на морфологию цеолитных образцов, поэтому можно будет проследить роль локализации БКЦ в дезактивации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В ходе работ использовали Н-форму цеолита структуры MFI с соотношением Si/Al = 40. Она была получена из коммерчески доступной NH4-формы цеолита производства компании “Zeolyst” (марка CBV8014) прокаливанием при 550°С в течение 3 ч. Серию образцов для последующего изучения получали при помощи ионного обмена катионов водорода на катионы натрия в структуре цеолита. Исходный цеолит в Н-форме (MFI-0) подвергали обработке нитратом натрия, при этом концентрацию раствора нитрата натрия варьировали: 9 ммоль/л (MFI-1); 59 ммоль/л (MFI-2); 147 ммоль/л (MFI-3). Образец MFI-4 получали путем трехкратного ионного обмена раствором нитрата натрия с концентрацией 735 ммоль/л.
Характеристики пористой структуры образцов определяли с использованием метода низкотемпературной адсорбции−десорбции азота. Съемку изотерм проводили по стандартной методике на поромере ASAP 2010 (Micromeritics, США). Расчет характеристик пористой структуры проводили с использованием программного обеспечения прибора.
Химический состав полученных образцов определяли с использованием метода рентгенофлуоресцентного анализа на приборе Thermo Scientific ARL Perform’X с родиевой трубкой 3.5 кВт. Предварительно были приготовлены таблетки с 200–300 мг исследуемого образца и 2–3 г борной кислоты.
Общую концентрацию кислотных центров образцов изучали методом ТПД NH3). Эксперименты проводили на анализаторе хемосорбции УСГА-101 производства компании “УНИСИТ” (Россия). В кварцевый трубчатый реактор помещали 0.15–0.20 г образца; стандартная автоматическая предобработка включала последовательные операции прокаливания образца при 500°C в течение 1 ч в токе гелия, насыщения аммиаком при температуре 60°C в течение 15 мин, удаления физически адсорбированного аммиака в токе гелия при 100°C. Эксперимент по ТПД NH3 проводили в токе гелия (30 мл/мин) со скоростью подъема температуры 8°C/мин, выделяющийся аммиак регистрировали детектором по тепло-проводности.
Кислотные свойства образцов были изучены при помощи метода ИК-спектроскопии адсорбированных молекул-зондов. Для определения концентрации БКЦ на внешней поверхности цеолитных кристаллов в качестве молекулы-зонда использовали 2,6-ди-трет-бутилпиридин (ДТБП). ИК-спектры были получены на приборе Nicolet Protégé 460, оснащенным DTGS детектором с оптическим разрешением 4 см–1 и диапазоном 4000–400 см–1. Образцы цеолитов в виде дисков (D = 1.6 см, ρ ~ 10 мг/см2) активировали в ИК-ячейке при 400°С (скорость нагрева 7.5°С/мин) в течение 2 ч и давлении 10–5 Торр. Адсорбцию молекул-зондов проводили при 150°С и давлении 0.3 Торр в течение 30 мин. По окончании цикла адсорбции проводили десорбцию молекул-зондов при 150°C в течение 15 мин. Для определения БКЦ на внешней поверхности использовали полосу 1615 см–1 адсорбированного ДТБП. Для определения коэффициента экстинкции полосы 1615 см–1 использовали подход, предложенный в работе [14], на основании адсорбции пиридина и ДТБП на образец цеолита структуры BEA.
Каталитические свойства образцов изучали в реакции олигомеризации бутан-бутиленовой фракции (ББФ). Массовый состав ББФ: пропан 0.1%; пропен 0.1%; изо-бутан 4.5%; н-бутан 14.0%; транс-2-бутен 32.9%; 1-бутен 8.9%; изо-бутен 5.5%; цис-2-бутен 31.6%; пентаны 2.4%.
В реактор проточного типа с неподвижным слоем катализатора помещали 0.4 г образца (фракция 0.25–1.00 мм). В режиме ускоренной дезактивации процесс проводили в 3 стадии: при температуре 380°С определяли начальную конверсию бутиленов, затем при температуре 550°С в течение 3 ч проводили ускоренную дезактивацию катализатора в токе сырья, после чего возвращались к температуре 380°С и фиксировали падение конверсии. Давление и массовая скорость подачи сырья в режиме ускоренной дезактивации составляли 1.5 МПа и 16.6 гсырье/(гкат ч). Конверсию бутиленов определяли по превращению суммы бутиленов; при расчете селективности учитывали жидкие и газообразные продукты реакции.
Количество коксовых отложений после экспериментов исследовали методом термогравиметрического и дифференциального термического анализа (ТГА/ДТА) на приборе NETZSCH STA 409 PC/PG. Для анализа использовали 20–30 мг образца. Линейный подъем температуры проводили со скоростью 10°С/мин от комнатной температуры до 800°C в токе сухого воздуха (100 мл/мин).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
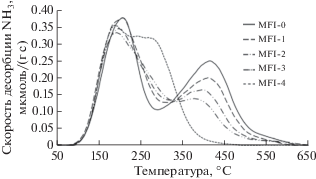
Основные физико-химические свойства серии образцов цеолита MFI с разной степенью ионного обмена представлены в таблице. Содержание натрия варьировалось от менее 0.05 мас. % для исходной протонной формы цеолита до 0.86 мас. % для образца с полным замещением протонов на натрий. На рис. 1 представлены данные ТПД NH3 для серии образцов.
На ТПД-кривой протонной формы цеолита присутствуют два пика десорбции при 200 и 415°С. Низкотемпературный пик соответствует аммиаку на слабых кислотных центрах, а также полиадсорбированному и физисорбированному аммиаку на поверхности цеолита [15], поэтому его интерпретация затруднена. Пик при 415°C отвечает десорбции аммиака с сильных бренстедовских кислотных центров (БКЦ), которые представляют собой мостиковые ОН-группы в микропорах цеолита. Как можно видеть, увеличение степени ионного обмена протонов на катионы натрия приводит к снижению концентрации БКЦ в образцах. Одновременно с этим у низкотемпературного пика 200°С появляется плечо в интервале температур 260–280°С, которое растет с увеличением содержания натрия. Вероятно, появление плеча связано с присутствием на образцах после ионного обмена слабых льюисовских центров – катионов натрия [16]. Для оценки содержания сильных БКЦ в образцах было рассчитано количество аммиака, который десорбировался с образцов при температуре >350°С. Данные по концентрации сильных БКЦ представлены в таблице 1.
Таблица 1.
Свойства образцов цеолитов
| Образец | Содержание Na, мас. % | Na/Al, моль/моль | Концентра-ция сильных БКЦ по данным ТПД NH3, мкмоль/г | Концентра-ция БКЦ по данным адс. ДТБП, мкмоль/г | Начальная конверсия, % | Падение конверсии, % | Содержание кокса, мас. % |
|---|---|---|---|---|---|---|---|
| MFI-0 | <0.05 | – | 235 | 6.9 | 99.4 | 16.4 | 21.3 |
| MFI-1 | 0.15 | 0.17 | 185 | 5.1 | 97.5 | 12.7 | 20.5 |
| MFI-2 | 0.25 | 0.30 | 146 | 5.3 | 97.1 | 12.1 | 20.9 |
| MFI-3 | 0.45 | 0.45 | 111 | 5.8 | 98.4 | 10.6 | 20.6 |
| MFI-4 | 0.86 | 0.89 | 23 | 4.2 | 93.4 | 11.6 | 20.3 |
Для определения концентрации кислотных центров на внешней поверхности цеолитных кристаллов использовали метод ИКС адсорбированного ДТБП. Размер молекул ДТБП не позволяет ему проникать в поры цеолита, поэтому он может взаимодействовать только с БКЦ на внешней поверхности. Данные по концентрации БКЦ на внешней поверхности также представлены в таблице.
Снижение концентрации кислотных центров на внешней поверхности не превышало 40% даже для образца MFI-4 с максимальной степенью ионного обмена, тогда как общая концентрация сильных БКЦ снизилась примерно в 10 раз. Такой интересный эффект, вероятно, связан с тем, что БКЦ на внешней поверхности кристаллов более слабые по сравнению с классическими мостиковыми ОН-группами в микропорах цеолита и поэтому незначительно обмениваются на натрий. Анализ литературных данных позволяет предположить, что слабые БКЦ на внешней поверхности представляют собой силанольные группы, в которых атом кремния связан через кислород с атомом алюминия [17, 18].
Следует отметить, что внесение натрия в количестве 0.15–0.86 мас. % не влияло на пористость цеолитов: общий объем пор для всех образцов составлял 0.24 см3/г. Это связано с тем, что образцы в ходе модифицирования подвергались только ионному обмену.
Таким образом, в серии образцов представлены кристаллы одинаковой морфологии, но они существенно отличаются по соотношению БКЦ на внешней поверхности и в объеме кристаллов. Поэтому эта серия может быть использована для определения вклада БКЦ разной локализации в дезактивацию в реакции олигомеризации бутиленов.
Для определения устойчивости катализаторов к дезактивации использовали метод ускоренной дезактивации. Суть метода заключалась в определении начальной конверсии бутиленов в относительно мягких условиях, проведении стадии ускоренной дезактивации в жестких условиях и возвращении к начальным условиям реакции, чтобы определить, насколько снизилась конверсия после дезактивации.
Результаты каталитических экспериментов представлены на рис. 2 и в таблице. Как можно видеть, начальная конверсия образцов варьировалась в пределах от 99.3% для исходного кислотного образца до 93.4% для образца с максимальным замещением протонов на натрий. Относительно небольшие различия в конверсии, вероятно, связаны с тем, что измерения проводили при высоком уровне конверсии, когда ее увеличение не пропорционально росту концентрации активных центров. Кроме того, как показано в работе [13], олигомеризация бутиленов уже при температуре 300°С проходит в диффузионной области, когда реакция протекает на внешней поверхности кристаллов и в приповерхностном слое. Поэтому существенную роль играет концентрация БКЦ на внешней поверхности, которая близка для наших образцов.
Различия в падении конверсии после стадии ускоренной дезактивации (рис. 2) также незначительны: для серии образцов эти значения отличаются между собой не более, чем в 2 раза (разброс значений от 10.6 до 16.4%). Более того, содержание кокса в образцах после экспериментов также практически одинаковое (табл. 1). В то же время общая концентрация сильных кислотных центров изменяется в 10 раз, и поэтому общая кислотность не является причиной дезактивации и коксообразования. Мы предполагаем, что на устойчивость к дезактивации (и на коксообразование) влияет именно концентрация БКЦ на внешней поверхности, которая для серии образцов изменяется незначительно (от 4.2 до 6.9 мкмоль/г). Таким образом, данные по устойчивости к дезактивации хорошо согласуются с концентрацией БКЦ на внешней поверхности, но не с общей концентрацией БКЦ.
Этот результат подтверждает вывод о роли внешней поверхности, сделанный ранее с помощью селективного отравления БКЦ на внешней поверхности цеолита MFI тетраэтоксисиланом [12]. Причин, почему роль внешней поверхности так важна, по-видимому, две. Во-первых, высокотемпературная олигомеризация протекает в приповерхностном слое цеолитных кристаллов [13], поэтому роль кислотности внешней поверхности возрастает. Во-вторых, на кислотных центрах внешней поверхности коксообразование должно протекать более интенсивно, так как там, в отличие от микропор, отсутствуют стерические затруднения для образования поликонденсированных ароматических соединений – прекурсоров кокса. На связь развитой внешней поверхности и коксообразования указывают, например, в работе [13], где обнаружена хорошая корреляция между размером кристаллов цеолита и содержанием кокса.
Все представленные данные указывают на то, что основную роль в дезактивации катализаторов олигомеризации играют кислотные центры на внешней поверхности цеолитных кристаллов. Поэтому для увеличения устойчивости к дезактивации необходимо разрабатывать методы эффективного снижения кислотности внешней поверхности цеолитов.
БЛАГОДАРНОСТИ
Исследование выполнено за счет гранта Российского научного фонда (проект № 14-23-00094).
Список литературы
O’Connor C.T., Kojima M. // Catalysis Today. 1990. V. 6. № 3. P. 329.
Miller S.J. // Studies in Surface Science and Catalysis. 1988. V. 38. P. 187.
de Klerk A. // Energy & Fuels. 2007. V. 21. P. 3084.
O'Connor C.T. Handbook of Heterogeneous Catalysis. Eds. Ertl G., Knozinger H., Weitkamp J. 2008. V. 1. P. 2854.
Garwood W.E., Caesar P.D., Brennan J.A. // Patent USA № 4150062. 1972.
Garwood W.E., Lee W. // Patent USA № 4227992. 1980.
Quann R.J., Green L.A., Tabak S.A., Krambeck F.J. // Industrial & Engineering Chemistry Research. 1988. V. 27. № 4. P. 565.
Tabak S.A., Krambeck F.J., Garwood W.E. // AIChE J. 1986. V. 32. № 9. P. 1526.
Occelli M.L., Hsu J.T., Galaya L.G. // J. of Mol. Catalysis. 1985. V. 32 № 3. P. 377.
Corma A., Garcia H. // Advanced Synthesis & Catalysis. 2006. V. 348 № 12–13. P. 1391.
Chen N.Y. Shape Selective Catalysis in Industrial Applications. CRC press. 1996. V. 65. P. 168.
Popov A.G., Fedosov D.A., Ivanova I. I., Vedernikov O.S., Kleimenov A.V., Kondrashev D.O., Miroshkina V.D., Abrashenkov P.A., Kuznetsov S.E. // Petrol. Chemistry. 2016. V. 56. № 3. P. 255.
Popov A.G., Pavlov V.S., Ivanova I.I. // J. of Catalysis. 2016. V. 335. P. 155.
Corma A., Fornés V., Forni L., Marquez F., Martınez-Triguero J., Moscotti D. // J. of Catalysis. 1998. V. 179. № 2. P. 451.
Lónyi F., Valyon J. // Microporous and Mesoporous Materials. 2001. V. 47. № 2–3. P. 293.
Xu R., Liu J., Liang C., Jia W., Li F., Guo H. // J. of Fuel Chemistry and Technology. 2011. V. 39. № 6. P. 449.
Bräuer P., Situmorang O., Ng P.L., D’Agostino C. // Physical Chemistry Chemical Physics. 2018. V. 20. № 6. P. 4250.
Trombetta M., Armaroli T., Alejandre A.G., Solis J.R., Busca G. // Applied Catalysis A: General 2000. V. 192. № 1. P. 125.
Дополнительные материалы отсутствуют.