Нефтехимия, 2019, T. 59, № 5, стр. 508-515
Изменение углеводородного состава ашальчинской нефти при ее биодеградации аборигенной почвенной микрофлорой в лабораторных условиях
В. Р. Антипенко 1, *, О. С. Баканова 1, Д. А. Филатов 1
1 Институт химии нефти СО РАН
634055 Томск, Россия
* E-mail: avr@ipc.tsc.ru
Поступила в редакцию 20.09.2018
После доработки 01.02.2019
Принята к публикации 13.05.2019
Аннотация
Показано, что при биодеградации ашальчинской нефти аборигенной почвенной микрофлорой в лабораторных условиях наблюдается глубокая биодеструкция компонентов масел с изменением молекулярного состава алифатических, нафтеновых и ароматических углеводородов (УВ). Установлено, что алканы, три- и тетрациклические ароматические УВ присутствуют в маслах биодеградированной нефти не только в молекулярной форме, но и в виде структурных фрагментов, связанных через эфирный или сульфидный мостики в составе сложных высокомолекулярных образований. Состав О- и S-связанных соединений перечисленных типов в маслах нефти, подвергнутой биодеградации, отличается.
Информация о составе компонентов (масел, смол и асфальтенов) тяжелых высоковязких нефтей и природных битумов необходима для решения проблем их добычи, трубопроводного транспорта, переработки и рационального использования, в частности, при производстве смазочных масел [1, 2]. Актуальной также является проблема рекультивации экосистем, загрязненных такими нефтями. Одним из перспективных направлений снижения концентрации нефтяного загрязнения в экосистемах является биогенное окисление [3–6]. При этом предполагается не только внесение биопрепаратов, содержащих углеводородокисляющие микроорганизмы, но и активация аборигенной микрофлоры загрязненных объектов. Примером такого подхода является работа [7]. В ней в лабораторном эксперименте изучена биодеструкция тяжелой высоковязкой нефти Ашальчинского месторождения аборигенной почвенной микрофлорой грунта на основе низинного торфа и биогумуса. Установлено, что за 180 сут эксперимента утилизация нефти составила 84%. При этом все нефтяные УВ – алканы, нафтены, арены – подверглись окислению на 68–99%. Биодеструкция смол и асфальтенов составила 85.6 и 55.2%, соответственно. Выявлено заметное изменение структурно-групповых характеристик средних молекул смол и асфальтенов. Следует отметить, что в научной литературе [8–26] описаны результаты, подтверждающие биодеградацию нефтяных смолисто-асфальтеновых веществ. В литературе также описаны основные направления изменения состава соединений различных типов в результате биодеградации нефтей в лабораторных и природных условиях [22, 27–52 ]. Основная часть полученных результатов обобщена в [47].
Детальная информация об изменении состава различных типов соединений в маслах ашальчинской нефти при ее аэробной биодеградации в [7] не была представлена. С учетом впервые выявленного в работе [53] факта наличия в маслах нефтей и природных битумов структурных фрагментов, связанных через сульфидные и эфирные мостики в составе сложных высокомолекулярных образований, было бы интересным проанализировать влияние биодеградации на их строение. Тем более, что возможность изменения в результате биодеградации баланса связей (R1–C–O–R2, R1–C–S–R2, R1–CO–O–R2, R1–С–С–R2) между структурными фрагментами молекул смол и асфальтенов допускается в [26].
Цель настоящей работы – получение информации об изменении молекулярного состава масел при лабораторной аэробной биодеградации ашальчинской нефти аборигенной почвенной микрофлорой. Включая информацию о строении и количественном соотношении структурных фрагментов, находящихся в компонентах масел в “связанном” виде.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объектов исследования были выбраны масла природного битума (сверхтяжелой нефти) Ашальчинского месторождения (МАБ), а также масла продуктов его биодеградации (МАБ-БИО) аборигенной почвенной микрофлорой в лабораторных условиях согласно методике, описанной в [7].
Масла выделены из исходной и биодеградированной нефтей по методике, представленной в [54]. Методика селективного разрыва С–О-связи эфирных мостиков в компонентах МАБ и МАБ-БИО состояла в следующем. К предварительно растворенной в минимальном объеме хлороформа навеске масел (0.3 г) добавляли 8 см3 1.6 М раствора BBr3 в хлороформе. Смесь кипятили с обратным холодильником при перемешивании с помощью магнитной мешалки в течение 48 ч. Затем смесь охлаждали и добавляли к ней 16 см3 диэтилового эфира, а после дистиллированную воду (8 см3). Органический слой отделяли, водную фазу экстрагировали хлороформом. Экстракт и органический слой объединяли, отмывали насыщенным водным раствором КCl, сушили от воды сульфатом натрия, растворитель удаляли с использованием роторного испарителя. Оба продукта были подвергнуты реакции восстановления. К 50 см3 тетрагидрофурана добавляли 0.4780 г алюмогидрида лития. В течение 0.5 ч из капельной воронки добавляли 0.1626 г продуктов (бромпроизводных), полученных на предыдущей стадии. Реакцию проводили при температуре 66°C, при постоянном перемешивании в течение 5 ч. По окончании реакции для разложения непрореагировавшего алюмогидрида лития осторожно добавляли абсолютный спирт, затем смесь абсолютного спирта с водой в соотношении 1 : 1. Заканчивали разложение добавлением концентрированной соляной кислоты. Продукты восстановления растворяли в бензоле, отмывали дистиллированной водой от HCl до нейтральной среды. Раствор сушили от воды сульфатом натрия и промывали бензолом. Бензол отгоняли в вакууме. Из полученных продуктов разрушения эфирных мостиков (ПРЭМ) колоночной жидкостно-адсорбционной хроматографией на силикагеле выделена неполярная фракция (ПРЭМ-НФ).
Для разрушения C–S-связи в сульфидных мостиках процесс осуществляли следующим образом. К исходному образцу масел (0.5 г) добавляли NiCl2 (0.5 г), тетрагидрофуран (50 см3) и метанол (50 см3), перемешивали 30 мин. Далее в течение 16 ч добавляли NaBH4 (1.5 г). Затем смесь центрифугировали. Органический слой отделяли, остаток экстрагировали гексаном. Экстракт и органический слой объединяли, отмывали насыщенным водным раствором NaCl, высушивали над Na2SO4, растворитель удаляли на роторном испарителе. Полученные продукты разрушения сульфидных мостиков (ПРСМ) анализировали без дополнительного разделения.
Исходные МАБ, МАБ-БИО, а также продукты их химической модификации согласно методике, описанной выше и в [53] (ПРСМ, ПРЭМ-НФ), были проанализированы с помощью метода хроматомасс-спектрометрии (ГХ-МС), который проводили с использованием прибора “Termo Scientific” DFS (Thermo Electron Corporation, Германия), оснащенного газовым хроматографом Trace GC Ultra. Режим масс-спектрометра: энергия ионизирующих электронов 70 эВ, температура источника 250°С. Сканирование масс-спектров осуществляли в диапазоне массовых чисел m/z 50–500 а. е. м. со скоростью 1с/декаду масс. Режим хроматографа: начальная температура 80°С, термостатирование в течение 2 мин, затем нагрев до 300°С со скоростью 4°С/мин и термостатирование в течение 35 мин. Использовали кварцевую капиллярную колонку TR-5MS длиной 30 м, внутренним диаметром 0.25 мм и толщиной фазы 0.25 мкм. Газ носитель – гелий. Режим сброса – без сброса. Пробу исследуемого образца перед вводом разбавляли гексаном до концентрации ~1 мг/мкл. После регистрации хроматограммы по полному ионному току процедура дальнейшего анализа состояла в следующем: а) реконструкция с помощью программы Xcalibur масс-хроматограмм различных типов углеводородных и гетероатомных соединений по соответствующим характеристическим ионам; б) просмотр масс-спектров соединений, элюируемых в составе хроматографических пиков. В некоторых случаях проводилось вычитание вклада соэлюированных соединений на крыльях пика; в) идентификация соединений с использованием электронной библиотеки масс-спектров NIST 02, а также литературных данных; г) сопоставление молекулярного состава однотипных соединений в маслах исходной и биодеградированной нефти, включая соотношение гомологов и изомеров.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Из литературных данных [22, 27–52 ] следует, что биодеградация нефтей в природе и в лабораторных условиях сопровождается следующими изменениями их углеводородного состава: а) возрастает доля компонентов “горба” – неразделяемой сложной смеси (unresolved complex mixture), которые, как считается [55–58], являются токсичными для сообщества микроорганизмов; б) среди алканов возрастает относительное содержание изопренанов, что приводит к увеличению значения изопреноидного коэффициента; в) среди н-алканов уменьшается доля гомологов С12–С20; г) возрастает относительное содержание стеранов состава С28 и, особенно, С29; д) в составе тритерпанов снижается относительное содержание трициклических структур, среди пентациклических появляются деметилированные структуры – 25-норгопаны; е) меняется групповой и изомерный состав алкилбензолов, нафталинов и фенантренов; ж) наблюдаются изменения и в составе гетероорганических соединений.
В данной статье из перечня изученных УВ (алканов, моно-, три-, тетра- и пентациклических нафтенов, моно-, би-, три- и тетрациклических ароматических УВ) основное внимание уделено описанию соединений, у которых в результате биодеградации наблюдались наиболее яркие изменения состава. Также принималось во внимание, насколько надежно пики в масс-хроматограммах, построенных по характеристическим ионам перечисленных типов соединений, идентифицируются в исходном и биодеградированном образце.
Некоторые особенности углеводородного состава ашальчинской нефти (низкое содержание алканов, повышенное содержанием тритерпанов) по мнению [1] явно свидетельствуют о том, что она была частично биодеградирована в залежи. Полученные нами результаты ГХ-МС-анализа свидетельствуют о том, что при биодеградации ашальчинской нефти аборигенной почвенной микрофлорой в лабораторных условиях наблюдается не только более глубокая биодеструкция компонентов масел, но также заметное изменение молекулярного состава алифатических, нафтеновых и ароматических УВ. Некоторые из выявленных изменений отличаются от тенденций, обнаруженных ранее в лабораторных экспериментах по биодеградации, и перечисленных выше. В частности, как показано на рис. 1а, существенно снижается относительное содержание компонентов “горба”, резко возрастает отношение н-алканы/изопренаны и пристан/фитан (Pr/Ph).
Рис. 1.
Масс-хроматограммы алканов (а, m/z 57) и фенантренов (б, m/z 178 + 192 + 206 + 220 + 234) в маслах исходной (1) и биодеградированной (2) нефти. Цифры соответствуют числу атомов углерода в молекуле н-алканов. Ф – фенантрен, МФ – метилфенантрены, (С2–С4)-Ф – области элюирования гомологов фенантрена.
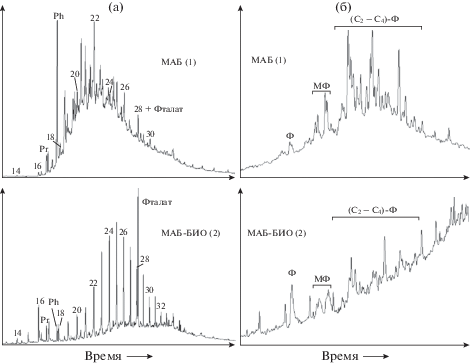
В то же время, за счет уменьшения относительного содержания низкомолекулярных гомологов н-алканов максимум их молекулярно-массового распределения смещается в высокомолекулярную область: от С22 до С25 (рис. 1а).
В составе фенантренов заметно возрастает относительное содержание незамещенного гомолога (рис. 1б), что совпадает с тенденцией, выявленной на нефтях нефтеносного бассейна Ляохе (Liaohe), отличающихся уровнем природной биодеградации [46].
В составе терпанов (рис. 2а) практически полностью исчезают хейлантаны, но относительное содержание 25-норгопанов, как показывает масс-хроматограмма МАБ-БИО по m/z 177, возрастает незначительно. Следует отметить, что и в маслах исходной нефти (МАБ) 25-норгопаны также содержатся в небольшом количестве. Заметных изменений относительного содержания гомогопанов С31–С35 и соотношения S и R эпимеров не наблюдается.
Рис. 2.
Масс-хроматограммы терпанов (а, m/z 191) и стеранов (б, m/z 217 + 218 + 259) в маслах исходной (1) и биодеградированной (2) нефти.

В составе тетрациклических нафтенов исчезают прегнаны (рис. 2б). В пользу С29 меняется соотношение гомологов стеранов состава С27–С29.
Нами впервые показано, что в маслах биодеградированной в лабораторных условиях ашальчинской нефти, алканы, три- и тетрациклические ароматические углеводороды присутствуют не только в молекулярной форме, но и в виде структурных фрагментов, связанных через эфирный или сульфидный мостики в составе сложных высокомолекулярных образований. Об этом свидетельствует заметное изменение масс-хроматограмм соответствующих соединений после проведения реакций разрушения эфирных и сульфидных мостиков в компонентах МАБ-БИО (рис. 3–5). Как видно на рис. 3а, после разрушения эфирных мостиков среди н-алканов резко возрастает относительное содержание гомологов состава С16–С21. Скорее всего, это является причиной снижения отношений Pr/н-C17 и Ph/н-C18. Изменения в молекулярно-массовом распределении алканов после разрушения сульфидных мостиков (рис. 3б) практически не заметны, хотя отношения Pr/н-C17 и Ph/н-C18 также снижаются.
Рис. 3.
Изменение молекулярно-массового распределения алканов (m/z 57) после разрушения эфирных (а) и сульфидных (б) мостиков. Цифры соответствуют числу атомов углерода в молекуле н-алканов.

Рис. 4.
Изменение молекулярно-массового распределения фенантренов (m/z 178 + 192 + 206 + 220 + 234) после разрушения эфирных (а) и сульфидных (б) мостиков. Ф – фенантрен, МФ, (С2–С4) – области элюирования гомологов фенантрена.

Рис. 5.
Изменение молекулярно-массового распределения незамещенных гомологов тетрациклических ароматических углеводородов (m/z 202 + 228) после разрушения эфирных (а) и сульфидных (б) мостиков. Флу – флуорен, (m/z 202); Пир – пирен (m/z 202); Хр – хризен (m/z 228).

Отмеченные изменения свидетельствуют о том, что в МАБ-БИО “связанные” алканы состава С16–С21 находятся преимущественно в O-связанном виде, причем “связанные” н-алканы преобладают над “связанными” изопренанами. Доля S-связанных алканов гораздо меньше, причем “связанные” н-алканы, как и в предыдущем случае, преобладают над “связанными” изопренанами.
Отмеченные изменения свидетельствуют о том, что в МАБ-БИО “связанные” алканы состава С16–С21 находятся преимущественно в O-связанном виде, причем “связанные” н-алканы преобладают над “связанными” изопренанами. Доля S-связанных алканов гораздо меньше, причем “связанные” н-алканы, как и в предыдущем случае, преобладают над “связанными” изопренанами.
Из рис. 4 следует, что среди O- и S-связанных гомологов фенантрена незамещенное соединение преобладает над гомологами.
На рис. 5 видно, что после разрушения эфирных и сульфидных мостиков отношение флуорантена и пирена к хризену возрастает в обоих случаях. Но этот эффект выражен гораздо сильнее после разрушения сульфидных мостиков.
Таким образом, установлено, что при биодеградации сверхтяжелой нефти Ашальчинского месторождения аборигенной почвенной микрофлорой в лабораторных условиях наблюдается не только глубокая биодеструкция компонентов масел, но также изменение молекулярного состава алифатических, нафтеновых и ароматических УВ. В частности, существенно снижается относительное содержание компонентов “горба”, резко возрастает отношение н-алканы/изопренаны и пристан/фитан (Pr/Ph), максимум молекулярно-массового распределения н-алканов смещается в высокомолекулярную область: от С22 до С25.
В составе терпанов практически полностью исчезают хейлантаны, относительное содержание 25-норгопанов возрастает незначительно. Заметных изменений относительного содержания гомогопанов С31–С35 и соотношения S- и R-эпимеров не наблюдается. В составе тетрациклических нафтенов исчезают прегнаны, в пользу С29 меняется соотношение гомологов стеранов состава С27–С29.
В составе фенантренов заметно возрастает относительное содержание незамещенного гомолога.
Показано, что алканы, три- и тетрациклические ароматические УВ присутствуют в маслах биодеградированной нефти не только в молекулярной форме, но и в виде структурных фрагментов, связанных через эфирный или сульфидный мостики в составе сложных высокомолекулярных образований.
Состав О- и S-связанных соединений перечисленных типов в маслах биодеградированной нефти отличается. О-связанные н-алканы преобладают над О-связанными изопренанами и в отличие от S-связанных н-алканов представлены преимущественно низкомолекулярными гомологами. Среди “связанных” фенантренов преобладает незамещенный гомолог. Относительное содержание О- и S-связанных флуорантена и пирена выше, чем “связанного” хризена, Это различие выражено в большей степени в случае S-связанных тетрациклических ароматических УВ.
Список литературы
Каюкова Г.П., Романов Г.В., Муслимов Р.Х., Лебедев Н.П., Петров Г.А. Химия и геохимия пермских битумов Татарстана. М.: Наука, 1999. 304 с.
Каюкова Г.П., Петров С.М., Успенский Б.В. Свойства тяжелых нефтей и битумов пермских отложений Татарстана в природных и техногенных процессах. М.: ГЕОС, 2015. 343 с.
Середин В.В. // Геоэкология. 2000. № 6. С. 525.
Иларионов С.А. Экологические аспекты восстановления нефтезагрязненных почв. Екатеринбург: УрО РАН, 2004. 194 с.
Середина В.П., Бурмистрова Т.И., Терещенко Н.Н. Нефтезагрязненные почвы: свойства и рекультивация. Томск: Изд-во ТПУ, 2006. 270 с.
Оборин А.А., Хмурчик В.Т., Иларионов С.А., Маркарова М.Ю., Назаров А.В. Нефтезагрязненные биоценозы. Пермь: Изд-во ПГУ, 2008. 511 с.
Филатов Д.А., Кривцов Е.Б., Свириденко Н.Н., Головко А.К., Алтунина Л.К. // Нефтехимия. 2017. Т. 57. № 4. С. 386 [Petrol. Chemistry. 2017. V. 57. № 8. P. 649].
Филатов Д.А., Копытов М.А., Алтунина Л.К. // Биотехнология. 2012. № 5. С. 76.
Копытов М.А., Гринько А.А., Филатов Д.А., Алтунина Л.К. // Башкирский хим. журн. 2013. Т. 20. № 3. С. 41.
Филатов Д.А., Кривцов Е.Б., Свириденко Н.Н., Головко А.К., Алтунина Л.К. // Экологический вестник России. 2014. № 9. С. 38.
Копытов М.А., Филатов Д.А., Алтунина Л.К. // Нефтехимия. 2014. Т. 54. № 1. С. 59 [Petrol. Chemistry. 2014. V. 54. № 1. P. 58].
Филатов Д.А., Копытов М.А., Кривцов Е.Б., Гринько А.А., Алтунина Л.К. // Защита окружающей среды в нефтегазовом комплексе. 2014. № 8. С. 32.
Филатов Д.А., Кривцов Е.Б., Свириденко Н.Н., Головко А.К., Алтунина Л.К. // Биотехнология. 2014. № 4. С. 74.
Алтунина Л.К., Филатов Д.А., Копытов М.А., Гулая Е.В., Овсянникова В.С. // Газовая промышленность. 2014. № 4. С. 78.
Копытов, М.А., Филатов Д.А., Ельчанинова Е.А., Стрелец Л.А. // Химия в интересах устойчивого развития. 2017. Т. 25. № 5. С. 509.
Venkateswaran K., Hoaki T., Kato M., Maruyama T. // Can. J. Microbiol. 1995. V. 41. P. 418.
Jenisch-Anton A., Adam P., Michaelis W., Connan J., Hermann D., Rohmer M., Albrecht P. // Geochim. Cosmochim. Acta. 2000. V. 64. P. 3525.
Pineda Flores G., Mestahoward A. // Rev. Lat. Microbiol. 2001. V. 43. P. 143.
Pineda Flores G., Bollarguello G., Mestahoward A. // J. Biodegr. 2004. V. 15. P. 145.
Silva T.F., Azevedo D.A., Rangel M.D., Fontes R.A., Aquino Neto F.R. // Org. Geochem. 2008. V. 39. P. 1249.
Erute M.O, John A.O. // Afr. J. Biotechnol. 2008. V. 7. P. 4291.
Liao Y., Geng A., Huang H. // Org. Geochem. 2009. V. 40. P. 312.
Tavassoli T., Mousavi S.M., Shojaosadati S.A., Salehizadeh H. // Fuel. 2012. V. 93. P. 142.
Lavania M., Cheema S., Sarma P.M., Mandal A.K., Lai B. // J. Biodegr. 2012. V. 23. P. 15.
Jahromi H., Fazaelipoor M.H., Ayatollahi Sh., Niazi A. // Fuel. 2014. V. 117. P. 230.
Pan Y., Liao Y., Zheng Y. // Org. Geochem. 2015. V. 86. P. 32.
Тиссо Б., Вельте Д. Образование и распространение нефти. М.: Мир, 1981. 503 с.
Петров Ал. А. Углеводороды нефти. М.: Наука, 1984. 263 с.
Connan J., Brooks J., Welte D.H. (Ed.). Advances in Petroleum Geochemistry. V. 1. L.: Academic Press, 1984. 299 p.
Volkman J.K., Alexander R., Kagi R.I., Rowland S.J., Sheppard P.N. // Org. Geochem. 1984. V. 6. P. 619.
Wandroper A.M.K., Hoffmann C.F., Maxwell J.R., Barwise N.S., Goodwin N.S., Park P.J.D. // Org. Geochem. 1984. V. 6. P. 605.
Rowland S.J., Alexander R., Kagi R.I., Jones D.M., Douglas A.G. // Org. Geochem. 1986. V. 9. P. 153.
Lu S.N., He W., Huang H.P. // Org. Geochem. 1990. V. 16. P. 437.
Rockne K.J., Strand S.E. // Environmental Science and Technology. 1998. V. 32. P. 3962.
Budzinski H., Raymond N., Nadalig T., Gilewicz M., Garrigues P., Bertrand J.C., Caumette P. // Org. Geochem. 1998. V. 28. P. 337.
Wilkes H., Boreham C., Harms G., Zengler K., Rabus R. // Org. Geochem. 2000. V. 31. № 1. P. 105.
Rockne K.J., Strand S.E. // Water Research. 2001. V. 35. P. 291.
Bost F.D., Frontera-Suau R., McDonald T.J., Peters K.E., Morris P.J. // Org. Geochem. 2001. V. 32. P. 105.
Каширцев В.А., Конторович А.Э., Филп Р.П., Чалая О.Н., Зуева И.Н., Иванова И.К., Меметова Н.П. // Геология и геофизика. 2001. Т. 42. № 11−12. С. 1792.
Watson J.S., Jones D.M., Swannell R.P.J., van Duin A.C.T. // Org. Geochem. 2002. V. 33. P. 1153.
Wenger G.D., Davis C.L., Isaksen G.H. // SPE Reservoir Evaluation and Engineering. 2002. V. 2. P. 375.
Head I.M., Jones D.M., Larter S.R. // Nature. 2003. V. 426. P. 344.
Huang H., Bowler B.F.J., Oldenburg T.B.P., Larter S.R. // Org. Geochem. 2003. V. 34. P. 951.
Попович Т.А., Оценка биодеградации нефтей Сахалина и шельфа. Генезис нефти и газа. М.: ГЕОС, 2003. 260 с.
Туров Ю.П., Гузняева М.Ю. // Нефтехимия. 2004. Т. 44. № 5. С. 393. [Petrol. Chemistry. 2004. V. 44. № 5. P. 363].
Huang H., Bowler B.F.J., Oldenburg T.B.P., Larter S.R. // Org. Geochem. 2004. V. 35. P. 1619.
Peters K.E., Walters C.C., Moldovan J.M., The Biomarker Guide, Biomarkers and Isotopes in Petroleum Systems and Earth History. 2nd Edition. V. 2. Biomarkers and Isotopes in Petroleum Exploration and Earth History. P. 645. Cambridge: Cambridge University Press, 2005.
Bennett B., Larter S.R. // Org. Geochem. 2008. V. 39. P. 1222.
Larter S., Huang H., Adams J., Bennet B., Snowdon L.R. // Org. Geochem. 2012. V. 45. P. 66.
Иванова И.А., Ибрагимов Р.К., Ибрагимова Д.А., Петров С.М. // Вестник технологического университета. 2015. Т. 18. № 20. С. 137.
Филатов Д.А., Ельчанинова Е.А., Овсянникова В.С., Алтунина Л.К. // Нефтехимия. 2016. Т. 56. № 4. С. 425 [Petrol. Chemistry. 2016. V. 56. № 7. P. 657].
Wang X., Cai T., Wen W., Zhang Z. // Fuel. 2018. V. 230. P. 418.
Антипенко В.Р., Чешкова Т.В. // Известия Томского политехнического университета. 2014. Т. 324. № 3. С. 16.
Современные методы исследования нефтей. Справочно-методическое пособие. Под ред. Богомолова А.И, Темянко М.Б., Хотынцевой Л.И. Л.: Недра, 1984. 431 с.
Rowland S., Donkin P., Smith E., Wrage E. // Environmental Science and Technology. 2001. V. 35. № 13. P. 2640.
Reineke V., Rullkotter J., Smith E.L., Rowland S.J. // Org. Geochem. 2006. V. 37. № 12. P. 1885.
Booth A.M., Sutton P.A., Lewis C.A., Lewis A.C., Scarlett A., Chau W., Widdous J., Rowland S.J. // Environmental Science and Technology. 2007. V. 41. № 2. P. 457.
Booth A.M., Scarlett A., Lewis C.A., Belt S.T., Rowland S.J. // Environmental Science and Technology. 2008. V. 42. № 21. P. 8122. C. 60.
Дополнительные материалы отсутствуют.


