Нефтехимия, 2019, T. 59, № 5, стр. 544-551
Влияние процесса восстановления ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ на состояние поверхностного слоя и каталитические свойства в реакции гидроизомеризации смеси н-гептана с бензолом
А. В. Обухова 1, *, Л. И. Кузнецова 1, Е. С. Каскевич 2, П. Н. Кузнецов 1, **, Ю. Л. Михлин 1
1 Институт химии и химической технологии СО РАН,
Федеральный исследовательский центр “Красноярский научный центр СО РАН”
660036 Красноярск, Россия
2 Сибирский федеральный университет
660041 Красноярск, Россия
* E-mail: obuhova.av@icct.krasn.ru
** E-mail: kpn@icct.ru
Поступила в редакцию 07.12.2018
После доработки 15.04.2019
Принята к публикации 13.05.2019
Аннотация
Представлены результаты исследования каталитических свойств платиносодержащего вольфрамированного диоксида циркония в реакции гидроизомеризации смеси н-гептана с бензолом в зависимости от температуры восстановления катализатора в среде водорода. Основными продуктами превращения н-гептана являются его ди- и монометилзамещенные изомеры, бензол в реакции гидрируется до циклогексана с последующей изомеризацией в метилциклопентан. Показано, что с увеличением температуры более 300°С происходит заметное снижение активности катализатора, при этом параметры кристаллической и пористой структуры катализатора сохраняют стабильность. Методом рентгеновской фотоэлектронной спектроскопии (РФЭС) установлено, что с повышением температуры восстановления на поверхности катализатора наблюдается увеличение содержания восстановленных катионов вольфрама и платины в металлическом состоянии.
Производство экологически безопасных моторных топлив является приоритетным направлением современной нефтеперерабатывающей промышленности [1, 2]. К одному из перспективных способов получения высокооктановых экологически безопасных компонентов автобензинов относят процесс гидроизомеризации бензиновой фракции, содержащей ароматические углеводороды (УВ), в том числе бензол [3–5]. В ходе процесса содержащиеся во фракции алкановые УВ подвергаются изомеризации, а ароматические УВ гидрируются до нафтенов с последующим их превращением в изомерные продукты, что способствует компенсации потери октанового числа (ОЧ) жидких продуктов.
Для процесса необходим бифункциональный катализатор, гидрирующая способность которого обеспечит гидрирование ароматических УВ, а кислотные свойства – селективную изомеризацию нафтенов и содержащихся в сырье н-алканов в высокооктановые изомеры. С этой точки зрения представляет интерес платиносодержащий катализатор на основе диоксида циркония, модифицированный вольфрамат-анионами $({{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}})}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}})}}$ [6].
Каталитически активной кристаллической фазой в ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$является твердый раствор катионов вольфрама в тетрагональной модификации диоксида циркония с закрепленными на поверхности платиной и вольфраматными группами [6]. Последние в условиях реакции частично восстановлены и при взаимодействии с поверхностными группами оксидной матрицы образуют бренстедовские и льюисовские кислотные центры [6–12]. Платина увеличивает активность и стабильность работы катализатора в реакции гидроизомеризации ароматических и алкановых УВ [13–18]. Согласно литературным данным [13–15], на поверхности металлической платины (Pt0) происходит диссоциация молекулярного водорода по гомолитическому механизму с образованием атомарного водорода, который, мигрируя по поверхности носителя, гидрирует углеродсодержащие продукты уплотнения и таким образом предотвращает отравление активных центров. В присутствии платины в заряженном состоянии молекулярный водород диссоциирует по гетеролитическому механизму с образованием протонов, которые могут принимать участие в формировании дополнительного количества протонных кислотных центров катализатора и гидрид-ионов, необходимых для завершающей стадии реакции изомеризации (стадия гидридного переноса), что приводит к увеличению изомеризующей активности [14–18].
Таким образом, каталитические свойства ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ могут зависеть от параметров процесса активации перед реакцией, а именно, в существенной степени, от стадии восстановления катализатора, так как она может приводить к существенным изменениям в электронном состоянии поверхностных атомов катализатора.
Цель настоящей работы – исследование влияния процесса восстановления платиносодержащего вольфрамированного диоксида циркония в среде водорода на каталитические свойства в реакции гидроизомеризации смеси н-гептана с бензолом и состояние поверхностного слоя катализатора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление вольфрамированного диоксида циркония осуществляли путем прокаливания высушенного гидроксида циркония, модифицированного вольфрамат-анионами. Гидроксид циркония получали методом осаждения из раствора хлористого цирконила раствором гидроксида аммония при постоянной величине рН = 9.5 ± 0.5 [6]. Модифицирование вольфрамат-анионами осуществляли методом пропитки гидроксидного предшественника раствором метавольфрамата аммония. Высушенные образцы модифицированного гидроксида циркония подвергали термической обработке на воздухе при температуре 800°С. Содержание вольфрамат-анионов (в расчете на ${\text{WO}}_{4}^{{2 - }}$) в готовом катализаторе составляло 17.6 мол. %. Введение платины в катализатор (0.5 мас. %) осуществляли путем пропитки образцов прокаленного вольфрамированного диоксида циркония водным раствором платинохлористоводородной кислоты с последующим высушиванием и прокаливанием.
Катализаторы испытывали в реакции гидроизомеризации смеси н-гептана с бензолом (23.5 мол. %) на автоматизированной установке BI-CATflow4-2(А) с проточным реактором при атмосферном давлении водорода. Температура реакции 250°С, объемная скорость подачи углеводородов 1 ч–1, при мольном соотношении Н2 : углеводород = 6 : 1. Катализатор загружали в реактор в виде фракции с размером частиц 0.2–1.0 мм, перед началом процесса проводили подготовку катализатора. На первом этапе через катализатор продували аргон при 350°С в течение 90 мин. На втором этапе аргон заменяли водородом и осуществляли продувку в течение 30 мин, температуру варьировали от 200 до 420°С.
Продукты изомеризации анализировали в режиме on-line с использованием газового хроматографа в составе каталитической установки, снабженного капиллярной колонкой с разделительной фазой сквалан и пламенно-ионизационным детектором.
Фазовый состав катализаторов исследовали методом рентгеновской дифракции. Рентгенограммы снимали на дифрактометре PANalytical X’Pert PRO, оборудованном детектором PIXcel с графитовым монохроматором, используя отфильтрованное CuKα-излучение. Идентификацию фаз проводили по справочными данным рентгенометрической картотеки ICDD. Количественное определение фазового состава, размера кристаллитов и параметров элементарной ячейки осуществляли методом полнопрофильного анализа Ритвельда.
Пористую структуру (удельную поверхность, распределение пор по размерам и средний размер пор) определяли на установке Micromeritics ASAP 2020 по изотермам низкотемпературной адсорбции азота. Величину поверхности определяли по методу БЭТ. Объем пор рассчитывали по изотермам адсорбции сравнительным методом, распределение пор по размерам – по десорбционной ветви изотермы методом Баррета–Джойнера–Халенда (BJH). Из величины удельной поверхности оценивали средний размер частиц, принимая их сферическую (кубическую) форму.
Состав поверхностного слоя катализаторов изучали методом РФЭС на спектрометре SPECS (SPECS GmbH, Германия), укомплектованном энергоанализатором электронов PHOIBOS HSA3500 150 MCD9 при возбуждении немонохроматизированным излучением MgKα рентгеновской трубки (1235.6 эВ). Обработку спектров проводили в программе CasaXPS, разложение выполнялось Гауссо–Лоренцевскими компонентами (50%) после вычитания нелинейного фона по Ширли. Определение относительного содержания элементов осуществляли по интегральным интенсивностям РФЭС-линий с учетом соответствующих коэффициентов атомной чувствительности. Калибровку шкалы энергий связи (Есв) производили методом внутреннего стандарта по линии C1s (285.0 ± 0.1 эВ).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Каталитические свойства. Платиносодержащий катализатор на основе диоксида циркония, модифицированного вольфрамат-анионами, проявляет активность в процессе совместной гидроизомеризации н-гептана и бензола [11]. Максимальные показатели каталитической активности достигаются на катализаторе с концентрацией вольфрамат-анионов 17.6 мол. % при температурах 225–250°C. Основные продукты превращения н-гептана – ди- и монометилзамещенные изомеры, побочные продукты – преимущественно пропан, н-бутан и изо-бутан. Бензол гидрируется до циклогексана (ЦГ) с последующей изомеризацией в метилциклопентан (МЦП).
Независимо от температуры восстановительной обработки в процессе испытания ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ катализатора в реакции гидроизомеризации смеси н-гептана с бензолом при температуре 250°С наблюдается уменьшение конверсии н-гептана и бензола со временем. Через 120 мин работы катализатора показатели активности изменяются незначительно, достигается квазистационарный режим работы.
При анализе влияния температуры восстановления ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ можно выделить две области, в которых наблюдается ее различное действие на показатели активности катализатора. Так, до 250°С включительно температура восстановления не оказывает существенного влияния на степень превращения н-гептана и бензола (рис. 1 и 2). При дальнейшем повышении наблюдается уменьшение конверсии гептана и бензола и тем больше, чем выше температура восстановления. Селективность по продуктам изомеризации гептана возрастает с 81 мол. % (200°С) до 86% (300°С), а затем уменьшается до 71% для образца, восстановленного при 420°С (рис. 1).
Рис. 1.
Влияние температуры восстановления ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ на конверсию н-гептана, отношение долей изомеров н-гептана и продуктов крекинга С3 + С4.
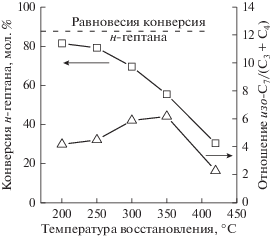
Рис. 2.
Влияние температуры восстановления ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ на конверсию бензола, отношение долей МЦП/ЦГ и ЦГ/С6Н6.
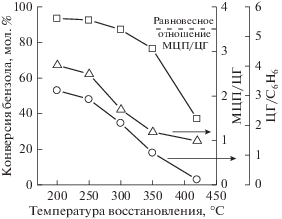
Селективности по ЦГ и МЦП изменяются незначительно при восстановлении до 250°С включительно и заметно уменьшаются с увеличением температуры восстановления (рис. 2).
Для понимания наблюдаемой динамики каталитических свойств ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ были исследованы структурные характеристики (кристаллическая и пористая структуры), состав и состояние поверхностного слоя катализаторов до и после процедуры восстановления, а также после испытания в реакции гидроизомеризации.
Структурные свойства. Прокаливание немодифицированного гидроксида циркония при 800°С приводит к образованию преимущественно моноклинной формы диоксида циркония (m-ZrO2) (рис. 3). Модифицирование гидроксида циркония вольфрамат-анионами способствует кристаллизации метастабильной тетрагональной формы ZrO2 (t-ZrO2). Дополнительно на рентгенограмме зафиксировано присутствие собственной фазы оксида вольфрама моноклинной модификации и небольшое количество m-ZrO2.
Рис. 3.
Рентгенограммы образцов ZrO2, 800 (1), ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ исходный (2) и ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ после опыта (3).
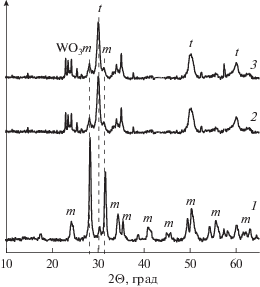
На основе данных полнопрофильного анализа рентгенограмм и определения параметров кристаллической решетки [6] установлено образование твердого раствора катионов вольфрама в t-ZrO2. Размер кристаллитов t-ZrO2 составляет 12–15 нм и мало отличается от среднего размера частиц, рассчитанного из величины удельной поверхности. Для восстановленных и испытанных катализаторов не наблюдалось изменения дифракционной картины, а также появления новых фаз. Таким образом, фазовый состав ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ катализатора проявляет устойчивость в условиях исследуемой реакции.
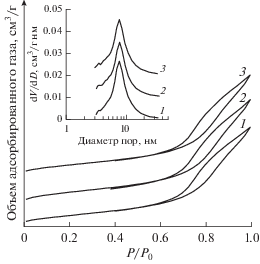
Влияние температуры восстановления на характер изотермы адсорбции азота для образца ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ показано на рис. 4. На изотерме наблюдается выраженный гистерезис, свидетельствующий о сформированных мезопорах. Максимальная доля объема пор приходится на диаметр 8.6 нм, объем пор составляет 0.16 см3/г. Удельная поверхность имеет величину 62 м2/г. После восстановительной обработки катализатора в диапазоне температур 200–420°С текстурные характеристики изменяются незначительно (не более 1%).
Рис. 4.
Изотермы низкотемпературной адсорбции азота и распределение пор по размерам для ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$, восстановленного при температуре: 1 – 250, 2 – 300 и 3 – 420°С.
Состояние поверхностного слоя ${{Pt} \mathord{\left/ {\vphantom {{Pt} {{{WO_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{WO_{4}^{{2 - }}} {Zr{{O}_{2}}}}} \right. \kern-0em} {Zr{{O}_{2}}}}}}} \right. \kern-0em} {{{WO_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{WO_{4}^{{2 - }}} {Zr{{O}_{2}}}}} \right. \kern-0em} {Zr{{O}_{2}}}}}}$ по данным спектров РФЭ. Данные по качественному и количественному составу поверхностного слоя образцов до и после восстановления и после реакции гидроизомеризации получены из анализа РФЭС-спектров. Основные линии, присутствующие в спектрах, соответствуют цирконию, кислороду, вольфраму, платине и углероду. Атомное содержание основных компонентов (без учета углерода) представлено в табл. 1. Видно, что с увеличением температуры восстановления содержание основных элементов изменяется незначительно. Поверхностная концентрация вольфрама (отношение W/Zr) мало отличается от объемной (0.22 по данным рентгеноспектрального флуоресцентного анализа).
Таблица 1.
Состав поверхностного слоя образцов ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$
| Температура восстановления, °С | Содержание элементов, ат. % | W/Zr, ат. | ||||
|---|---|---|---|---|---|---|
| Zr | O | W | Pt | |||
| Без восстановления | 23.2 | 72.0 | 4.3 | 0.5 | 0.18 | |
| Восстановленные | 250 | 22.7 | 72.0 | 4.8 | 0.5 | 0.20 |
| 300 | 23.1 | 71.9 | 4.6 | 0.4 | 0.19 | |
| 350 | 23.5 | 71.7 | 4.5 | 0.3 | 0.19 | |
| 420 | 23.5 | 71.8 | 4.4 | 0.2 | 0.19 | |
| Испытанные | 250 | 21.4 | 73.7 | 4.4 | 0.6 | 0.21 |
| 300 | 22.8 | 72.0 | 4.7 | 0.5 | 0.21 | |
| 350 | 23.2 | 71.6 | 4.8 | 0.4 | 0.21 | |
| 420 | 22.5 | 72.8 | 4.6 | 0.1 | 0.20 | |
Важно отметить, что с увеличением температуры восстановления наблюдается тенденция к уменьшению содержания платины в поверхностном слое катализатора (табл. 1).
Во всех катализаторах (прокаленном, восстановленном и испытанном) зафиксировано присутствие углерода. В восстановленных образцах содержание углерода составляет 14–17 ат. %. Присутствие углерода на поверхности исходного катализатора, вероятно, связано с наличием углеводородных загрязнений, накапливающихся в процессе хранения катализаторов, что отмечалось ранее и для сульфатциркониевых катализаторов [19, 20]. В испытанных катализаторах концентрация углерода на поверхности увеличивается до 21–27 ат. %, что указывает на дополнительное формирование углеродсодержащих отложений.
При разложении РФЭ-спектров как невосстановленных, так и восстановленных при различных температурах образцов в линии Zr3d5/2 выделена компонента с энергией связи 182.7–182.9 эВ, которая характеризует Zr4+ в ZrO2 [21]. Небольшой пик при меньшей энергии связи 181.4–181.6 эВ может быть отнесен к частично восстановленному состоянию циркония Zr(4 − x)+, которое наблюдалось в ряде работ методом РФЭ-спектров и объяснялось возникновением кислородных вакансий в координационном окружении катионов циркония [22, 23].
В спектре линии О1s выделено три составляющих. Наиболее интенсивный пик с энергией связи 530.6–530.9 эВ соответствует кислороду в диоксиде циркония, что согласуется с литературными данными [21]. Возникновение других менее интенсивных компонент может быть обусловлено рядом причин: наличием структурной неоднородности (529.1–529.3 эВ), остаточных ОН групп и/или адсорбированных форм кислорода (532.7) [24].
Спектр W4f представлен дублетом W4f7/2–W4f5/2 (рис. 5). Для всех образцов при разложении спектров можно выделить три линии W4f7/2 с Есв = 36.1 ± ± 0.2 эВ; 35.1 ± 0.2 эВ и 33.4 ± 0.2 эВ, которые, согласно литературным данным, могут быть отнесены к состояниям окисления W6+, W5+ и W4+соответственно [25–28].
Рис. 5.
РФЭ – спектры Zr3d, O1s, W4f и Pt4f для ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ без обработки в Н2 (1) и после восстановления в интервале температур: 2 – 250, 3 – 300, 4 – 350, 5 – 420°С.
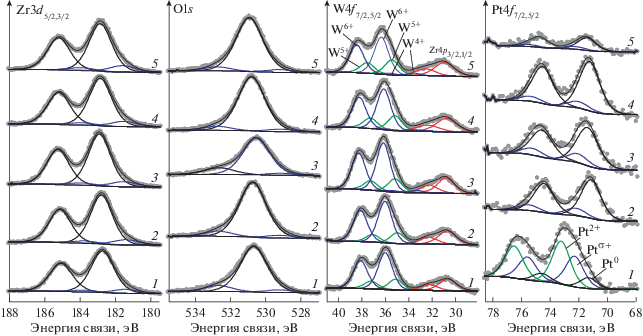
Все спектры Pt4f представляют собой характерный дублет Pt4f7/2–Pt4f5/2, интегральные интенсивности компонент которого соотносятся как 4 : 3 (рис. 5). Величина спин-орбитального расщепления (разница значений энергии связи Pt4f7/2 и Pt4f5/2) составляет 3.3 эВ. При разложении РФЭ-спектров восстановленных образцов выделены компоненты Pt4f7/2 с Есв = 71.1 ± 0.2 эВ (совпадает со справочным значением для металлической платины [21]), и с Есв = 72.1 ± 0.2 эВ. Энергия связи 72.1 эВ превышает энергию, характерную для Pt0 в платиносодержащих катализаторах (71.1 ± 0.2 эВ) [21, 27, 29–31]. В то же время наблюдаемое значение энергии связи меньше энергии для Pt2+ в составе ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ (72.6–74.0 эВ [27, 29, 30]). Таким образом, наблюдаемая энергия связи занимает промежуточное положение между значениями, отвечающими нуль-валентной и двухвалентной Pt. Можно предположить, что компонента с энергией связи 72.1 эВ характеризует платину с эффективным положительным зарядом менее +2, а именно платину в электронодефицитном состоянии Ptδ+. Присутствие в ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ катализаторе Ptδ+ было показано методами ИК-спектроскопии с адсорбированной молекулой СО в работах [30, 32] и РФЭС [33]. Для прокаленного и невосстановленного образца (рис. 5) в спектре Pt4f выделены три состояния платины Pt0 (71.3 эВ), Ptδ+ (72.1 эВ) и Pt2+ (73.2 эВ).
С увеличением температуры обработки в водороде происходит частичное восстановление поверхностных катионов вольфрама и платины, возрастает отношение Pt0/Ptδ+ и (W4+ + W5+)/(W6+) (рис. 6).
Рис. 6.
Отношение Pt0/Ptδ+ и (W4+ + W5+)/(W6+) в зависимости от температуры восстановления катализатора.
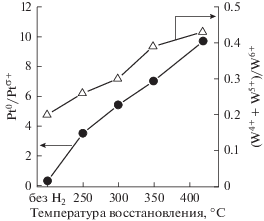
Наблюдаемое изменение состояния поверхностных катионов в ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ с увеличением температуры восстановления катализаторов сопоставлено с данными по каталитической активности. Так, с увеличением температуры восстановления на поверхности катализатора увеличивается доля Pt0, W4+ и W5+, тогда как содержание Ptδ+ и W6+ уменьшается, при этом наблюдается снижение как гидрирующей, так изомеризующей активности катализатора (рис. 7).
Рис. 7.
Влияние степени восстановления платины и вольфрама на состав продуктов превращения смеси гептана c бензолом на ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ катализаторе (*отношение (W4+ + W5+)/W6+).
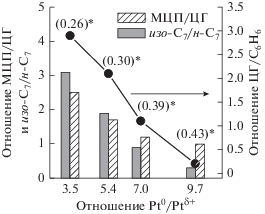
Уменьшение активности катализатора в реакции изомеризации н-гептана и циклогексана может быть связано как с изменением состояния вольфрама на поверхности катализатора, так и с превращением платины в металлическое состояние.
Согласно [34–38] кислотные свойства ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ катализаторов обусловлены формированием больших по размеру поливольфраматных анионов на поверхности диоксида циркония. Электронная плотность в таких вольфраматных доменах снижается вследствие акцептирования ее решеткой ZrO2 [34]. В результате дегидратации активных центров образуются координационно-ненасыщенные ионы W6+ и Zr4+, как соответственно сильные и умеренные льюисовские центры (ЛКЦ) [34]. В процессе обработки катализатора в токе водорода происходит уменьшение доли окисленных катионов W6+, что вероятно приводит к снижению как бренстедовской, так и льюисовской кислотности и, как следствие, каталитических свойств в реакции изомеризации.
В работах [39, 40] показано, что заряженные атомы платины в катализаторах на основе анион-модифицированного диоксида циркония адсорбируют молекулярный водород с последующим образованием протонов и гидрид-ионов. Протоны принимают участие в формировании и регенерации БКЦ. Поэтому уменьшение доли заряженной платины в ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ будет оказывать влияние на кислотные свойства катализатора, а именно приводить к снижению количества БКЦ, что в свою очередь отразится на изомеризующей активности ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}.$ Гидрид-ионы могут закрепляться на ЛКЦ, либо взаимодействовать с карбениевым ионом изомерного строения. Так при исследовании изомеризации н-гексана на ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ [41] авторы отмечали, что взаимодействие гидрид-иона с адсорбированным на кислотном центре карбкатионом форсирует его десорбцию в виде молекулы УВ. Это способствует понижению времени жизни реакционноспособных интермедиатов и предотвращает протекание побочной реакции крекинга [41, 42]. В нашей работе показано, что с увеличением температуры восстановления доля заряженной платины в катализаторе уменьшается, что, по-видимому, приводит к уменьшению количества гидрид-ионов и увеличению доли продуктов крекинга относительно целевых продуктов реакции.
При гидроизомеризации бензола установлено, что степень превращения бензола в циклогексан на ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ уменьшается с увеличением температуры восстановления, наиболее резкое падение гидрирующей активности (в 12 раз) наблюдается для восстановленных при 420°С образцов, при этом отношение Pt0/Ptδ+ увеличивается в 2.7 раза. Снижение активности металл-нанесенных катализаторов в реакции гидрирования бензола может быть обусловлено как уменьшением дисперсности металлического компонента, так и его доступностью для реагирующих молекул в связи с особенностями распределения в поверхностном слое катализатора. Действительно, в литературе имеются данные [43] показывающие, что в нанесенных металлических катализаторах при высокотемпературном восстановлении возможно покрытие частиц Pt частично восстановленным носителем или миграция металла с поверхности частиц в глубинные слои носителя и, соответственно, такой катализатор частично теряет свои адсорбционные и каталитические свойства. По полученным методом РФЭС данным (табл. 1) общее содержание платины на поверхности исследуемого катализатора уменьшается с повышением температуры восстановления. По-видимому, в процессе восстановления ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}},$ происходит изменение состояния поверхности катализатора, которое сопровождается миграцией платины в более глубокие слои вольфрамированного диоксида циркония.
Таким образом, при исследовании влияния температуры восстановления на каталитические свойства ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ в реакции гидроизомеризации установлено, что до 250°С включительно температура восстановления не оказывает существенного влияния на параметры активности катализатора. С увеличением температуры до 300°С и выше происходит принципиальное изменение каталитических свойств. Наблюдается уменьшение конверсии сырья и селективности по целевым продуктам, при этом катализатор сохраняет свою структурную и текстурную стабильность
Сопоставление данных РФЭС и активности катализатора в реакции гидроизомеризации смеси н-гептана с бензолом показало, что уменьшение каталитической эффективности ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ с увеличением температуры восстановления связано с изменением состояния поверхностного слоя. С увеличением температуры восстановления уменьшается доля окисленных катионов вольфрама, которые, согласно литературным данным, являются сильными ЛКЦ. Уменьшение доли заряженной формы платины Ptσ+, на которой водород диссоциирует по гетеролитическому механизму, приводит, по-видимому, к снижению в реакционной системе количества протонов водорода, принимающих участие в формировании и регенерации БКЦ. Соответственное уменьшение количества гидрид-ионов может снижать скорость десорбции молекулы УВ, адсорбированного на кислотном центре, что способствует поддержанию крекирующей функции катализатора.
Уменьшение гидрирующей активности ${{{\text{Pt}}} \mathord{\left/ {\vphantom {{{\text{Pt}}} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}} \right. \kern-0em} {{{{\text{WO}}_{4}^{{2 - }}} \mathord{\left/ {\vphantom {{{\text{WO}}_{4}^{{2 - }}} {{\text{Zr}}{{{\text{O}}}_{2}}}}} \right. \kern-0em} {{\text{Zr}}{{{\text{O}}}_{2}}}}}}$ с ростом температуры восстановления связано, согласно данным РФЭС, с уменьшением содержания платины в поверхностном слое катализатора.
Список литературы
Технический регламент таможенного союза ТР ТС 013/2011 “О требованиях к автомобильному и авиационному бензину, дизельному и судовому топливу, топливу для реактивных двигателей и мазуту”.
Специальный технический регламент “О требованиях к бензинам, дизельному топливу и отдельным горюче-смазочным материалам”, Федеральный закон, 2008.
Марышев В.Б., Можайко В.Н., Сорокин И.И. // Нефтепереработка и нефтехимия. 2005. № 9. С. 9.
Мириманян А.А., Вихман А.Г., Мкртычев А.А Марышев В.Б., Боруцкий П.Н., Можайко В.Н. // Нефтепереработка и нефтехимия. 2006. № 8. С. 11.
Федорова Е.Д., Казаков М.О., Лавренов А.В., Буяльская К.С., Леонтьева Н.Н., Гуляева Т.И., Шилова А.В. // Химия в интересах устойчивого развития. 2013. № 21. С. 115.
Kuznetsov P.N., Kazbanova A.V., Kuznetsova L.I., Kovalchuk V.I., Mikhlin Y.L. // Reac. Kinet. Mech. Cat. 2014. V. 113. P. 69.
Vu T.N., Gestel J.van, Gilson J.P., Collet C., Dath J.P., Duchet J.C. // J. Catal. 2005. V. 231. P. 453.
Busto M., Grau J.M., Vera C.R. // Appl. Catal. A. 2010. V. 387. P. 35.
Kauck D., Wichterlova B., Dedecek J., Sobalik Z., Jakubec I. // Appl. Catal. A. 2011. V. 397. P. 82.
Кузнецова Л.И., Казбанова А.В., Кузнецов П.Н. // Нефтехимия. 2012. Т. 52. № 2. С. 104 [Petrol. Chemistry. 2012. V. 52. № 2. P. 86].
Kuznetsov P.N., Obukhova A.V., Kuznetsova L.I., Mikhlin Y.L. // Catal. Let. 2017. V. 147. P. 773.
Barton D.G., Stuart. Soled S.L., Iglesia E. // Topics in Catalysis. 1998. V. 6. P. 87.
Yori J.C., Pieck C.L., Parera J.M. // Appl. Catal. A. 1999. V. 181. P. 5.
Ebitani K., Konishi J., Hattori H. // J. Catal. 1991. V. 130. P. 257.
Falco M.G., Canavese S.A., Comelli R.A., Figoli N.S. // Appl. Catal. A. 2000. V. 201. P. 37.
Hattori H. // Stud. Surf. Sci. Catal. 2001. V. 138. P. 3.
Triwahyono S., Yamada T., Hattori H. // Appl. Catal. A. 2003. V. 242. P. 101.
Kurshid M., Al-Daous M.A., Hattori H., Al-Khattaf S.S. // ppl. Catal. A. 2009. V. 362. P. 75.
Resofszki G., Muhler M., Sprenger S., Wild U., Paal Z. // Appl. Catal. A. 2003. V. 240. P. 71.
Yang Y.C., Weng H.S. // J. Mol. Catal. A Chem. 2009. V. 304. P. 65.
Wagner C.D., Moulder J.F., Davis L.E., Riggs W.M. Handbook of X-ray Photoelectron Spectroscopy. Perking-Elmer Corp., 1979. 189 p.
Chun M., Moon M.J., Park J., Kang Y.C. // Bull. Korean Chem. Soc. 2009. V. 30. № 11. P. 2729.
Chen F., Ma H., Wang B. // J. of Hazardous Materials. 2009. V. 162. P. 668.
Ntais S., Isaifan R.J., Baranova E.A. // Mater. Chem. Phys. 2014. V.148. P. 673.
Vaudagna S.R., Canavese S.A., Comelli R.A., Figoli N.S. // Appl. Catal. A. 1998. V. 168. P. 93.
Cortes-Jacome M.A., Angeles-Chavez C., Lopes-Salinas E. // Appl. Catal. A. 2007. V. 318. P.178.
Arribas M.A. Márquez F., Martínez A. // J. Catal. 2000. V.190. P. 309.
Occhiuzzi M., Cordischi D., Gazzoli D., Valigi M., Conceptiòn Heydorn P. // Appl. Catal. A. 2004. V. 269. P. 169.
Shkurenok V.A., Smolikov M.D., Yablokova S.S., Kir’yanov D.I., Paukshtis E.A., Koscheev S.V., Gulyaeva T.I., Belyi A.S. // Procedia Engineering. 2016. V. 152. P. 94.
Fan Y., Cheng S., Wang H., Tian J., Xie S., Pei Y., Qiao M., Zong B. // Appl. Catal. B: Environmental. 2017. V. 217. P. 331.
Hino M., Arata K. // Appl. Catal. A : General. 1998. V. 169. P. 151.
Falco M.G., Grau J.M., F’ıgoli N.S. // Appl. Catal. A. 2004. V. 264. P. 183.
Редина Е.А. Дис. … канд. хим. наук. М., Ин-т органической химии им. Н.Д. Зелинского РАН. 2015. 261 с.
Брей В.В. // Теорет. и эксперим. химия. 2005. Т. 41. № 3. С. 156.
Boyse R.A., Ko E.I. // J. Catal. 1997. V. 171. P. 191.
Baertsch C.D., Soled S.L., Iglesia E. // J. Phys. Chem. B. 2001. V. 105. P. 1320.
Macht J., Baertsh C.D., May-Lozano M. // J. Catal. 2004. V. 227. P. 479.
Scheithauer M., Grasselli R.K., Knozinger H. // Langmuir. 1998. V. 14. P. 3019.
Barton D.G., Soled S.L., Meitzner G.D., Fuentes G.A., Iglesia E. // J. Catal. 1999. V. 181. P. 57.
Смоликов М.Д., Гончаров В.Б., Садовская Е.М., Казанцев К.В., Затолокина Е.В., Кирьянов Д.И., Паукштис Е.А., Бальжинимаев Б.С., Белый А.С. // Катализ в промышленности. 2013. № 6. С. 51.
Iglesia E., Soled S.L., Kramer G.M. // J. Catal. 1993. V. 144. P. 238.
Иванов А.В., Кустов Л.М. // Росс. хим. журнал. 2000. Т. XLIV. № 2. С. 21.
Sanchez M.G., Gazquez J.L. // J. Catal. 1997. V. 104. P. 120.
Дополнительные материалы отсутствуют.


