Нефтехимия, 2019, T. 59, № 6-1, стр. 684-689
синтез, физико-химические свойства и термоокислительная стабильность сложных ТРИэфиров 1,3,5-АДАМАНТАНТРИОЛА и 7-этил-1,3,5-аДАМАНТАНТРИОЛА
Е. А. Ивлева 1, *, М. Р. Баймуратов 1, Ю. А. Малиновская 1, Ю. Н. Климочкин 1, В. А. Тыщенко 2, И. А. Куликова 2, В. В. Поздняков 3, 1, К. А. Овчинников 3
1 Самарский государственный технический университет
445000 Самара, Россия
2 Средневолжский научно-исследовательский институт по нефтепереработке
446200 Новокуйбышевск, Россия
3 АО “ВНИИ НП”
121609 Москва, Россия
* E-mail: elena.a.ivleva@yandex.com
Поступила в редакцию 15.04.2018
После доработки 30.06.2018
Принята к публикации 02.07.2019
Аннотация
Осуществлен синтез и изучены физико-химические и термоокислительные свойства ряда триэфиров на основе 1,3,5-адамантантриола и 7-этил-1,3,5-адамантантриола и алифатических кислот C4–C6. Проведено сравнение свойств полученных эфиров с эфирами пентаэритрита. Синтезированные эфиры имеют температуры застывания ниже минус 40 градусов, диапазон вязкостей при 100°С варьируется от 4.361 до 9.912 мм2/с, значения показателей термоокислительной стабильности составляют 221.6–240.3°С.
По мере развития техники с повышением механических, температурных нагрузок в агрегатах и увеличением сроков замены масел непрерывно повышаются требования к основам масел. В связи с этим все большее значение приобретают высокоиндексные базовые масла, имеющие высокую термостабильность, хорошую приемистость к пакетам многофункциональных присадок, хорошие пусковые свойства при низких температурах и необходимую вязкость в пределах рабочих температур.
Анализ перспектив развития авиационных ГТД [1] показывает, что в двигателях V–VI поколений уровень рабочих температур масла может достигать 240–250°С. Поэтому одним из основных требований к качеству смазочных масел для авиационных ГТД (Б-3В, ЛЗ-240, ПТС-225 и др.), созданных на основе эфиров пентаэритрита и жирных кислот C4–C10 с использованием комплекса присадок, является их высокая термостабильность, характеризующая способность масла сохранять на необходимом уровне физико-химические и эксплуатационные свойства при длительной работе в двигателе.
Использование адамантана и его производных в качестве структурных субъединиц в современных материалах обусловлено их высокой термической и термоокислительной стабильностью [2–4]. Одним из перспективных направлений использования производных адамантана является создание высокотемпературных основ масел с повышенными эксплуатационными характеристиками. В качестве таких основ предлагаются адамантансодержащие сложные эфиры [5–17]. В развитии этого направления весьма перспективными представляются полиэфиры, полученные из многоатомных спиртов – 1,3,5-адамантантриола и 1,3,5,7-адамантантетраола. Эти соединения уже нашли свое применение в качестве исходных субстратов в синтезе широкого ряда новых полифункциональных производных с ценными свойствами [18–28]. Поэтому использование их в качестве платформы для создания новых термостабильных основ масел для теплонапряженных газотурбинных двигателей представляется весьма актуальным.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Авторами был синтезирован и исследован ряд сложных триэфиров 7-R-1,3,5-адамантантриолов:
R = Н, R' = C3H7 (I); R = Н, R' = C4H9 (II); R = Н, R' = C5H11 (III);
R = C2H5, R' = C3H7 (IV); R = C2H5, R' = C4H9 (V); R = C2H5, R' = C5H11 (VI)
Качественные показатели и структуры синтезированных соединений подтверждали современными хроматографическими и спектральными методами (ГХ-МС, элементный анализ, ИК- и ЯМР-спектроскопия). Масс-спектры получены на хромато-масс-спектрометре ThermoFinnigan DSQ с использованием капиллярной колонки ВРХ-5 30 × 0.32 при энергии ионизирующих электронов 70 эВ. Элементный анализ выполнен на элементном анализаторе EuroVector 3000 EA с использованием в качестве стандарта L-цистина. ИК спектры записаны на спектрометре Shimadzu IRAffinity-1 на приставке НВПО. Спектры ЯМР 1H, 13С регистрировали на спектрометре Jeol JNM ECX-400 (рабочая частота 400 МГц) в CDCl3.
1,3,5-Адамантантриол получен по методике [29 ] . Выход 51%, т. пл. 203–205°С (лит. т. пл. 202–204°С). Содержание основного вещества – 98.5%.
7-Этил-1,3,5-адамантантриол. Смесь 50 г (0.3 моль) 1-этиладамантана, 5 г (0.03 моль) N-гидроксифталимида, 0.9 г (0.003 моль) ацетилацетоната кобальта(II) нагревают при интенсивном перемешивании до 60°С в 350 мл ледяной уксусной кислоты. После этого в реакционный сосуд пропускают ток молекулярного кислорода со скоростью 3–5 пузырьков в секунду. Реакционную массу перемешивают при данных условиях в течение 40 ч. После этого добавляют еще 5 г (0.03 моль) N‑гидроксифталимида, 0.9 г (0.003 моль) ацетилацетоната кобальта(II) и 1.32 г (0.015 моль) диоксида марганца и продолжают реакцию в заданных условиях еще 20 ч. Затем реакционную массу охлаждают, отфильтровывают диоксид марганца, уксусную кислоту упаривают в вакууме и переупаривают с толуолом 2–3 раза. К остатку добавляют 200 мл метил-трет-бутилового эфира, перемешивают при нагревании в течение 1.5 ч и, не охлаждая, фильтруют выпавший осадок 7-этил-1,3,5-адамантантриола, который загружают в аппарат Сокслета и экстрагируют этилацетатом в течение 60 ч. Чистый 7-этил-1,3,5-адамантантриол быстро кристаллизуется из этилацетата; осадок отфильтровывают и сушат. Выход 7-этил-1,3,5-адамантантриола составляет 35.5 г (45%). Содержание основного вещества – 98.5%. Т. пл. 238–240°С. Спектр ЯМР 1H, δ, м.д.: 0.72 т (3H, J = = 7.32 Гц, СH2CH3), 1.08−1.18 м (8H, СH2CH3, CH2Ad), 1.30−1.40 м (6H, CH2Ad), 4.45 с (3H, ОH). Спектр ЯМР 13C, δ, м.д.: 8.1 (CH3), 34.6 (CH2), 36.8 (C), 48.3 (CH2), 52.5 (CH2), 70.0 (C). Масс-спектр, m/z (Iотн, %): 212 [M+] (10), 164 (12), 138 (36), 127 (54), 110 (20), 58 (74), 55 (78), 43 (100). Найдено, %: C 67.92; H 9.52; C12H20O3. Вычислено, %: C 67.89; H 9.50.
Адамантан-1,3,5-триилтрибутаноат (I) Смесь 24 г (0.13 моль) 1,3,5-адамантантриола, 100 мл масляной кислоты, 30 мл петролейного эфира и 0.57 мл трифторметансульфокислоты нагревают при кипении при интенсивном перемешивании до окончания отделения воды (примерно 16 ч). Реакционную смесь охлаждают, разбавляют 200 мл толуола, промывают 5%-ным водным раствором КОН, затем водой до нейтральной среды, сушат над сульфатом натрия. Растворитель упаривают в вакууме, остаток очищают вакуумной перегонкой, собирая фракцию с т. кип. 155–156°C (0.0081 торр). Масса 26.7 г, выход 52%. ИК-спектр, ν, см–1: 1730 (С=О). Спектр ЯМР 1Н, δ, м.д.: 0.89 т (9Н, J = 7.56 Гц, СН3), 1.56 секстет (6Н, J = 7.36 Гц, СH2), 2.00–2.01 м (6Н, СН2Ad), 2.14–2.18 м (6Н, СН2Ad), 2.36–2.39 м (1Н, СНAd), 2.40–2.49 м (6Н, СH2). Спектр ЯМР 13С, δ, м.д.: 13.7 (СН3), 18.5 (CH2), 29.3 (CH), 37.4 (CH2), 39.0 (СН2), 44.2 (CH2), 79.7 (C), 172.7 (С). Масс-спектр, m/z (Iотн., %): 394 [М+] (<1), 305 (17), 246 (12), 219 (20), 176 (82), 147 (50), 105 (18), 71 (100), 43 (48). Найдено, %: C 67.05; H 8.77; C22H34O6. Вычислено, %: C 66.98; H 8.69.
Адамантан-1,3,5-триилтрипентаноат (II) получен аналогично триэфиру (I) из 20 г (0.108 моль) 1,3,5-адамантантриола, 90 мл валериановой кислоты, 0.48 мл трифторметансульфокислоты и 25 мл петролейного эфира. Масса продукта после перегонки составляет 23 г, выход 49%. Т. кип. 200–202°C (0.030 торр). ИК-спектр, ν, см–1: 1730 (С=О). Спектр ЯМР 1Н, δ, м.д.: 0.88 т (9Н, J = 7.36 Гц, СН3), 1.25–1.35 м (6Н, СH2), 1.48–1.54 м (6Н, СН2Ad), 2.00–2.01 м (6Н, СН2Ad), 2.09 с (1Н, СНAd), 2.17–2.20 м (6Н, СH2), 2.37–2.49 м (6Н, СH2). Спектр ЯМР 13С, δ, м.д.: 13.8 (СН3), 22.3 (CH2), 27.1 (CH2), 29.3 (CH), 35.2 (CH2), 39.0 (СН2), 44.3 (CH2), 79.7 (C), 172.9 (С). Масс-спектр, m/z (Iотн, %): 436 [М+] (<1), 334 (28), 333 (20), 275 (32), 274 (22), 233 (30), 232 (36), 190 (40), 189 (68), 148 (38), 147 (100), 106 (20), 84 (52), 56 (50). Найдено, %: C 68.83; H 9.30; C25H40O6. Вычислено, %: C 68.78; H 9.24.
Адамантан-1,3,5-триилтригексаноат (III) получен аналогично триэфиру (I) из 18 г (0.098 моль) 1,3,5-адамантантриола, 90 мл капроновой кислоты, 0.43 мл трифторметансульфокислоты и 30 мл петролейного эфира. Масса продукта после перегонки составляет 20.8 г, выход 45%. Т. кип. 195–197°C (0.008 торр). ИК-спектр, ν, см–1: 1730 (С=О). Спектр ЯМР 1Н, δ, м.д.: 0.84 т (9Н, J = 7.32 Гц, СН3), 1.21–1.27 м (6Н, СH2, СН2Ad), 1.48–1.55 м (6Н, СН2Ad), 1.95–2.03 м (4Н, СН2Ad), 2.07 с (1Н, СНAd), 2.12–2.17 м (6Н, СH2), 2.36–2.46 м (6Н, СH2). Спектр ЯМР 13С, δ, м.д.: 13.9 (СН3), 22.4 (CH2), 24.7 (CH2), 29.3 (CH), 31.3 (CH2), 35.4 (CH2), 39.0 (СН2), 44.2 (CH2), 79.7 (C), 172.9 (С). Масс-спектр, m/z (Iотн, %): 478 [М+] (<1), 362 (18), 303 (42), 247 (34), 246 (32), 204 (100), 148 (72), 99 (38), 71 (24), 43 (18). Найдено, %: C 70.32; H 9.73; C28H46O6. Вычислено, %: C 70.26; H 9.69.
7-Этиладамантан-1,3,5-триилтрибутаноат (IV) получен аналогично триэфиру (I) из 14 г (0.066 моль) 7-этил-1,3,5-адамантантриола, 70 мл масляной кислоты, 0.29 мл трифторметансульфокислоты и 25 мл петролейного эфира. Масса продукта после перегонки составляет 19 г. Выход 68%. Т. кип. 159–160°C (0.0093 торр). ИК спектр, ν, см–1: 1734 (С=О). Спектр ЯМР 1Н, δ, м.д.: 0.82 т (3Н, J = 7.56 Гц, СН3), 0.91 т (9Н, J = 7.32 Гц, СН3), 1.32 кв (2Н, J = 7.56 Гц, СН2), 1.52–1.62 м (6Н, СН2Ad), 1.79 с (6Н, СН2Ad), 2.11–2.20 м (6Н, СH2), 2.43–2.49 м (6Н, СH2). Спектр ЯМР 13С, δ, м.д.: 7.5 (СН3), 13.7 (СН3), 18.6 (CH2), 34.4 (CH2), 36.8 (C), 37.4 (CH2), 43.7 (CH2), 43.9 (СН2), 79.9 (C), 172.8 (С). Масс-спектр, m/z (Iотн, %): 422 [М+] (<1), 333 (8), 204 (36), 175 (60), 133 (54), 70 (100), 42 (98). Найдено, %: C 68.27; H 9.11; C24H38O6. Вычислено, %: C 68.22; H 9.06.
7-Этиладамантан-1,3,5-триилтрипентаноат (V) получен аналогично триэфиру (I) из 26 г (0.122 моль) 7-этил-1,3,5-адамантантриола, 95 мл валериановой кислоты, 0.54 мл трифторметансульфокислоты и 30 мл петролейного эфира. Масса продукта после перегонки составляет 17 г. Выход 30%. Т. кип. 185–186°C (0.0081 торр). ИК-спектр, ν, см–1: 1734 (С=О). Спектр ЯМР 1Н, δ, м.д.: 0.82 т (3Н, J = 7.56 Гц, СН3), 0.87 т (9Н, J = 7.32 Гц, СН3), 1.25–1.32 м (8Н, СН2), 1.48–1.55 м (6Н, СН2Ad), 1.78 с (6Н, СН2Ad), 2.18 т (6Н, J = 7.32 Гц, СН2), 2.39–2.47 м (6Н, СH2). Спектр ЯМР 13С, δ, м.д.: 7.5 (СН3), 13.8 (СН3), 22.3 (CH2), 27.2 (CH2), 34.4 (CH2), 35.2 (CH2), 36.7 (C), 43.7 (CH2), 43.9 (СН2), 79.9 (C), 173.0 (С). Масс-спектр, m/z (Iотн, %): 464 [М+] (<1), 362 (10), 260 (32), 217 (70), 175 (78), 144 (30), 133 (52), 84 (100), 56 (80). Найдено, %: C 69.84; H 9.61; C27H44O6. Вычислено, %: C 69.79; H 9.55.
7-Этиладамантан-1,3,5-триилтригексаноат (VI) получен аналогично триэфиру (I) из 12 г (0.057 моль) 7-этил-1,3,5-адамантантриола, 60 мл капроновой кислоты, 0.18 мл трифторметансульфокислоты и 30 мл петролейного эфира. Масса продукта после перегонки составляет 15 г. Выход 52%. Т. кип. 208–209°C (0.0081 торр). ИК-спектр, ν, см–1: 1736 (С=О). Спектр ЯМР 1Н, δ, м.д.: 0.83 т (3Н, J = 7.56 Гц, СН3), 0.88 т (9Н, J = 7.32 Гц, СН3), 1.24–1.34 м (14Н, СН2), 1.50–1.58 м (6Н, СН2Ad), 1.79 с (6Н, СН2Ad), 2.19 т (6Н, J = 7.32 Гц, СН2), 2.42–2.48 м (6Н, СH2). Спектр ЯМР 13С, δ, м.д.: 7.5 (СН3), 13.9 (СН3), 22.4 (CH2), 24.8 (CH2), 31.3 (CH2), 34.4 (CH2), 35.4 (CH2), 36.8(C), 43.7 (CH2), 43.9 (СН2), 79.9 (C), 173.0 (С). Масс-спектр, m/z (Iотн, %): 506 [М+] (<1), 309 (8), 331 (5), 274 (32), 232 (66), 175 (74), 144 (30), 133 (78), 98 (100), 70 (70), 42 (60). Найдено, %: C 77.18; H 10.01; C30H50O6. Вычислено, %: C 77.11; H 9.95.
Физико-химические свойства синтезированных диэфиров изучали методами ГОСТ и ASTM (кинематическая вязкость при положительных и отрицательных температурах по ASTMD7042, плотность при 20°С по ASTMD7042, температура вспышки в открытом тигле по ГОСТ 4333, температура застывания по ГОСТ 20287, кислотное число по ГОСТ 11362).
Термоокислительную стабильность образцов в тонком слое исследовали методом дифференциальной сканирующей калориметрии высокого давления (ДСК ВД) на приборе DSC 204 HP Phoenix фирмы NETZSCH-Gerätebau GmbH (Германия) по ASTME2009 (testmethod В) на алюминиевых тиглях в среде кислорода (35 атм, поток 50 мл/мин) и динамическом режиме (от 70 до 300°С со скоростью 10°С/мин).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В данной работе были синтезированы два ряда сложных эфиров на основе 1,3,5-адамантантриола и 7-этил-1,3,5-адамантантриола и карбоновых кислот С4, С5, С6 линейного строения (масляная, валериановая, капроновая). Выбор данных кислот определялся получением эфиров с необходимыми физико-химическими и термоокислительными свойствами. Синтез сложных эфиров I–VI осуществляли этерификацией в присутствии трифторметансульфокислоты. Выходы эфиров I–VI после очистки вакуумной перегонкой составляют 30–68%.
Данные по физико-химическим свойствам (кинематической вязкости при положительных и отрицательных температурах, температуре застывания, температуре вспышки, плотности) и термоокислительной стабильности по ASTME2009 соединений I–VI и товарных эфиров пентаэритрита Synative ES2939 и NB5750 представлены в табл. 1.
Таблица 1.
Физико-химические свойства эфиров 7-R-1,3,5-адамантантриолов (I–VI) и эфиров пентаэритрита
| № образца | I | II | III | IV | V | VI | Эфиры пентаэритрита | |
|---|---|---|---|---|---|---|---|---|
| R = | –H | –H | –H | –C2H5 | –C2H5 | –C2H5 | Synative ES 2939 |
NB 5750 |
| R' = | –C3H7 | –C4H9 | –C5H11 | –C3H7 | –C4H9 | –C5H11 | ||
| Брутто-формула | C22H34O6 | C25H40O6 | C28H46O6 | C24H38O6 | C27H44O6 | C30H50O6 | Смесь эфиров | Смесь эфиров |
| Мол. масса, г/моль | 394 | 436 | 478 | 422 | 464 | 506 | ||
| Вязкость кинематическая, мм2/с: | ||||||||
| при 100°С | 9.912 | 9.461 | 9.426 | 4.361 | 4.713 | 4.965 | 4.910 | 5.013 |
| при 40°С | 118.1 | 91.35 | 82.57 | 27.45 | 32.33 | 35.82 | 23.33 | 23.91 |
| при –30°С | >100 000 | 41964 | 28447 | 3535 | 3625 | 4105 | 1947 | 2040 |
| при –40°С | – | >100 000 | 65 500 | 11 054 | 11 406 | 13 200 | 6411 | 6716 |
| Температура застывания, °С | –40 | –42 | –47 | –60 | –60 | –56 | –60 | –58 |
| Температура вспышки в открытом тигле, °С | 246 | 258 | >270 | 248 | 262 | 268 | 264 | 262 |
| Плотность при 20°С, кг/м3 | 1093 | 1062 | 1038 | 1037 | 1021 | 1011 | 988.6 | 986.4 |
| Кислотное число, мг КОН/г образца |
Отс. | Отс. | Отс. | Отс. | Отс. | Отс. | Отс. | Отс. |
| Термоокислительная
стабильность ASTME2009, ООТ,°С |
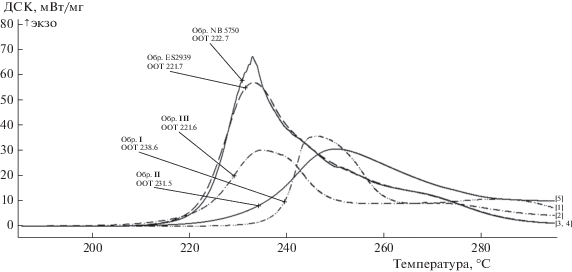
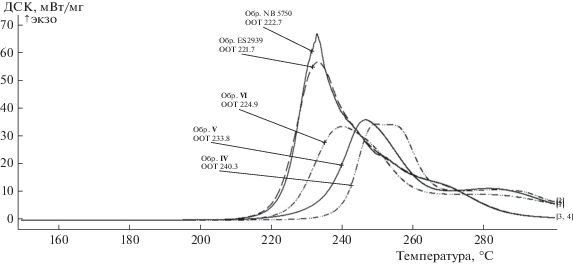
238.6 | 231.5 | 221.6 | 240.3 | 233.8 | 224.9 | 221.7 | 222.7 |
Четко прослеживается зависимость между строением эфиров двух рядов и их физико-химическими свойствами – отсутствием или наличием алкильного заместителя у 7-ого атома углерода адамантанового каркаса. Так эфиры I–III имеют более высокую вязкость при положительной и отрицательной температурах, чем эфиры IV–VI. Если у эфиров IV–VI вязкости повышаются с увеличением длины R'-радикала, то у эфиров I–III наблюдается обратная зависимость, что, по-видимому, связано с объемом и пространственным расположением заместителей. Все синтезированные эфиры имеют хорошие значения показателя кислотного числа (отсутствие) и температуры застывания ниже –40°С. Остальные показатели зависят от длины алкильного радикала в кислотном остатке – с увеличением количества атомов углерода плотность снижается, температура вспышки повышается, термоокислительные свойства ухудшаются.
На рис. 1–2 представлены результаты исследований термоокислительной стабильности эфиров по ASTME2009 в виде начальной температуры окисления (OOT). Из представленных данных видно, что с увеличением длины углеводородного радикала от С3 до С5 у эфиров I–VI термоокислительная стабильность постепенно снижается. Эфиры I, II, IV, V, VI обладают более высокими значениями термоокислительной стабильности (ООТ 240.3–224.9°С), а эфир III (ООТ 221.6°С) находится на уровне товарных пентаэритритовых эфиров (ООТ 221.7–222.7°С). Интенсивность окисления эфиров адамантанового ряда (30–35 мВт/мг) примерно в два раза ниже, чем эфиров пентаэритрита (55–65 мВт/мг).
ЗАКЛЮЧЕНИЕ
Исследовано влияние длины углеводородного остатка и строения эфиров 7-R-1,3,5 -адамантантриолов на физико-химические и термоокислительные свойства. Проведено сравнение адамантансодержащих эфиров с товарными пентаэритритовыми эфирами. По результатам исследования физико-химических свойств и термоокислительной стабильности синтезированные эфиры I–VI могут найти применение в качестве высокотемпературных основ смазочных материалов или их компонентов, особенно эфиры IV–VI.
Список литературы
Бабкин В.И., Алексашин А.А., Яновский Л.С., Дунаев С.В., Хурумова А.Ф. // Двигатель. 2012. Т. 83. № 5. С. 6.
Tsai C.W., Wu K.H., Yang C.C., Wang G.P. // Reactive Functional Polymers. 2015. V. 91–92. P. 11.
Tsai C.-W., Wang J.-C., Li F.-N., Chang Y.-C., Wu K.-H. // Mater. Express. 2016. V. 6. № 3. P. 220.
Tanaka K., Hiraoka T., Ishiguro F., Jeon J.-H., Chujo Y. // RSC Adv. 2014. V. 4. P. 28107.
Ouchi T., Nishimura Y. // Patent US № 8912366. 2014.
Huang M.-Y., Lin J.-C., Lin K.-H., Wu J.-C. // Patent US № 7488859. 2009.
Kojima A., Saito M. // Patent US № 7145048. 2006.
Ishii Y., Nakano T., Hirai N. // Patent US № 6392104. 1998.
Chen C.S. H., Schramm S.E., Wentzek S.E. // Patent US № 5397488. 1995.
Honna K., Seiki H. // Patent US № 4990691. 1991.
Honna K., Seiki H. // Patent US № 4963292. 1990.
Bäckvall J.-E. Modern Oxidation Methods. 2nd ed. Wiley, 2010. 483 p.
Багрий Е.И., Маравин Г.Б. // Нефтехимия. 2013. Т. 53. № 6. С. 467 [Petrol. Chemistry. 2013. V. 53. № 6. P. 418].
БагрийЕ.И., НехаевА.И., Максимов А.Л. // Нефтехимия. 2017. Т. 57. № 2. С. 123 [Petrol. Chem. 2017. V. 57. № 3. Р. 183].
Ивлева Е.А., Баймуратов М.Р., Журавлева Ю.А., Климочкин Ю.Н., Куликова И.А., Поздняков В.В., Шейкина Н.А., Тыщенко В.А., Рудяк К.Б. // Нефтехимия. 2015. Т. 55. № 2. С. 140 [Petrol. Chemistry. 2015. V. 55. № 2. P. 133].
Ивлева Е.А., Баймуратов М.Р., Журавлева Ю.А., Малиновская Ю.А., Климочкин Ю.Н., Куликова И.А., Поздняков В.В., Шейкина Н.А., Тыщенко В.А. // Нефтехимия. 2016. Т. 56. № 6. С. 655 [Petrol. Chemistry. 2016. V. 56. № 9. P. 873].
Ивлева Е.А., Баймуратов М.Р., Гаврилова В.С., Журавлева Ю.А., Климочкин Ю.Н., Куликова И.А., Поздняков В.В., Шейкина Н.А., Тыщенко В.А., Рудяк К.Б. // Нефтехимия. 2015. Т. 55. № 6. С. 528 [Petrol. Chemistry. 2015. V. 55. № 8. P. 673].
Klapçtke T. M., Krumm B., Widera A. // ChemPlusChem. 2018. V. 83. P. 61.
Fu S.-Q., Guo J.-W., Zhu D.-Y., Yang Z., Yang C.-F., Xian J.-X., Li X. // RSC Adv. 2015. V. 5. P. 67054.
Sayed S.M., Lin B.-P., Yang H. // Soft Matter. 2016.V. 12. P. 6148.
Menger F.M., Migulin V.A. // J. Org. Chem. 1999. V. 64. P. 8916.
Pannier N., Maison W. // Eur. J. Org. Chem. 2008. P. 1278.
Alexandre P.-E., Schwenger A., Frey W., Richert C. // Chem. Eur. J. 2017. V. 23. P. 9018.
Schwenger A., Frey W., Richert C. // Chem. Eur. J. 2015. V. 21. P. 1.
Schwenger A., Frey W., Richert C. // Angew. Chem. Int. Ed. 2016. V. 55. P. 1.
Tominaga M., Masu H., Azumaya I. // J. Org. Chem. 2009. V. 74. P. 8754.
Zhu H.,Guo J., Yang C., Liu S., Cui Y., Zhong X. // Synth. Commun. 2013. V. 43. P. 1161.
Yang H., Guo J., Tong R., Yang C., Chen J.-K. // Polymers. 2018. V. 10. P. 443.
Ивлева Е.А., Платонов И.А., Климочкин Ю.Н. // ЖОХ. 2015. Т. 85. № 8. С. 1271 [Rus. J. Gen. Chem. 2015. V. 85. № 8. P. 1830].
Дополнительные материалы отсутствуют.