Нефтехимия, 2019, T. 59, № 6-1, стр. 609-617
Развитие методов синтеза катализаторов на основе меди для реакции дегидрирования (ОБЗОР)
Xiaolin Lan 1, Zhengkang Duan 1, *, Yongsheng Wang 1, Jinxia Xu 1
1 College of Chemical Engineering, Hunan Collaborative Innovation Center of New Chemical Technologies
for Environmental Benignity and Efficient Resource Utilization, Xiangtan University
411105 Xiangtan, China
* E-mail: dzk0607@163.com
Поступила в редакцию 18.08.2018
После доработки 19.06.2019
Принята к публикации 03.07.2019
Аннотация
Медь – перспективный и недорогой переходный металл, который привлекает большое внимание исследователей в последние годы. Благодаря высокой каталитической активности наночастиц меди Cu (НЧ), катализаторы на их основе являются востребованными для реакции дегидрирования, в особенности при превращении спиртов в карбоновые кислоты. Однако наночастицы Cu в процессе каталитической реакции склонны к агломерации и дезактивации. По этой причине для улучшения характеристик катализатора важно изучить особенности механизма реакции дегидрирования, причины дезактивации катализатора, а также разработать подходы к модификации катализатора. В работе представлен обзор перспективных носителей для наночастиц меди, рассмотрены технологии синтеза мультиметаллических систем, а также в сжатой форме представлены методы синтеза катализаторов на основе меди. В будущем данная работа поможет исследователям ускорить разработку катализаторов для реакции дегидрирования, которая особенно важна в нефтяных технологиях. Из-за этого данная публикация полезна также для фундаментальных исследований в нефтехимическом синтезе.
Медь (Cu), благодаря своим каталитическим характеристикам, высокой проводимости и оптическим свойствам, применяется во многих областях, таких как катализ в органических реакциях, электроника и при производстве антибактериальных материалов [1]. Металлическая медь склонна к окислению, на воздухе при комнатной температуре степень окисления металла на поверхности изменяется в широком диапазоне (Cu1+ и Cu2+) [2]. Кроме того, при уменьшении размера частиц увеличивается каталитическая активность металла [3]. Однако, в процессе термической обработки наночастицы легко спекаются [4], из-за чего трудно получить наноразмерные и высокодисперсные частицы меди (НЧ). Для решения данных проблем в металл вводят промоторы и применяют различные методы синтеза.
Поскольку, медь расщепляет связи С–С и С–О с гораздо более низкой скоростью по сравнению с другими переходными металлами, катализаторы на основе меди обладают высокой селективностью в реакциях дегидрирования [5]. В зависимости от носителей и введенных промоторов, катализаторы на основе меди можно разделить на: оксиды меди, сплавы меди, медные металлорганические каркасные структуры (Cu–МОК), графен–медные композиты и т.д. В работе представлен анализ механизма реакции дегидрирования и предложены перспективы использования катализаторов на основе меди.
РЕАКЦИЯ ДЕГИДРИРОВАНИЯ СПИРТОВ
Реакция дегидрирования спиртов играет ключевую роль в синтетической химии и тонкой химической промышленности из-за широкого применения карбонильных соединений в медицине, при производстве сельскохозяйственных удобрений и ароматизаторов [6]. Катализаторы на основе меди активно используют в реакции окислительного дегидрирования спирта в карбоновую кислоту. На первом этапе в результате дегидрирования спирт превращается в альдегид [7–15]. Однако вопрос о второй стадии реакции остается дискуссионным.
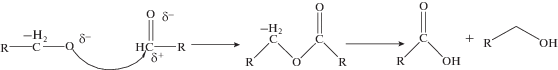
На первом этапе образуется частично положительный заряд в карбонильной группе [7], которая затем подвергается нуклеофильной атаке основанием – спиртом с отрицательным зарядом, образующимся на поверхности меди с образованием эфиров (рис. 1) [8, 9].
Напротив, так как в процессе каталитической реакции эфиры не были обнаружены, авторы [10] настаивали на том, что альдегид реагирует с водой, и, соответственно, второй атом кислорода в карбоновой кислоте появляется из растворителя (рис. 2) [10, 11].
Принимая во внимание различные пути образования воды в реакции, авторы [12] пришли к следующему заключению (рис. 3): спирт дегидрируется до альдегида и водорода; далее из альдегида и воды образуется диол, из которого в результате реакции дегидрирования образуется карбоксильная группа и H2. Кроме того, в процессе реакции образуется эфир, из которого в последствии получается альдегид и другие производные [12].
Валентность меди также является ключевым фактором в механизме реакции дегидрирования спирта. Информация о гетерогенном распределении частиц меди (Cu0/Cu+) необходима для изучения данной реакции [13]. Как показано на рис. 4, гидроксильная группа в спирте может легко взаимодействовать с поверхностными основными центрами, которые связаны с металлическими центрами Cu0. Высокодисперсные частицы Cu0 – эффективные активные центры для превращения спирта в альдегид [14]. Частицы Cu+ необходимы для обеспечения дополнительных кислотных центров Льюиса, которые активируют промежуточный продукт (ацетальдегид) с образованием сложных эфиров [15].
СИНТЕЗ КАТАЛИЗАТОРОВ НА ОСНОВЕ МЕДИ
Носители для катализаторов на основе меди
Оксиды металлов. Наночастицы Cu – высокоактивные катализаторы, однако теряют свою активность при агломерации. Взаимодействие наночастиц металлов с оксидами металлов может влиять на их стабильность, так как вследствие взаимодействия образуются частицы меньшего размера [16]. Кроме того, сильная связь металлического носителя и удельная плотность электронов на границах раздела металл–оксид играют ключевую роль в катализе [17, 18].
В качестве носителей для наночастиц меди использовались различные оксиды металлов [19]; одновременное присутствие в катализаторе оксида церия (CeO2) и меди (Cu) способствуeт образованию частиц HOCO и, таким образом, протеканию реакции в прямом направлении. К сожалению, компоненты катализатора по отдельности (Cu и CeO2) не столь эффективны в этой реакции. Оксиды металлов могут изменять свойства активных центров, например, CeO2 увеличивает стабильность наночастиц меди и количество активных центров. Более того, согласно [3], в реакции водного сдвига на катализаторе Cu−CeO2, который был получен методом пропитки по влагоемкости, выявлено, что размеры частиц и носителя, тонкая структура центров Cu−CuO–Cu на границе раздела, а также длина связей Cu−O, являются ключевыми факторами в повышении поверхностной активности катализатора.
Авторы [6] приготовили монодисперсную и высокостабильную каталитическую систему с наночастицами меди на оксиде алюминия для дегидрирования спиртов без участия акцепторов и окислителей. Методом соосаждения с использованием гидроксида натрия в качестве осадителя для доведения значения pH до 8 был синтезирован гидроталькит алюминия и меди (Cu−AlHT). После чего, Cu−AlHT прокаливали при 473 K в воздушном потоке в течение 5 ч до получения CuO/Al2O3. Аналогичным образом авторы [20] разработали высокоэффективный катализатор Cu(0)/Cr2O3 с большой площадью поверхности для дегидрирования спиртов без использования окислителей, который получали методом соосаждения. Применение системы металл–гидроталкит в качестве исходного прекурсора позволяет синтезировать стабильные наночастицы меди на оксидах металлов. Благодаря свойствам системы металл–гидроталкит органический лиганд удерживается на поверхностных центрах, что делает ее уникальным материалом [21].
Авторы [22] представили нановолокна из оксида титана в качестве носителя для наночастиц меди Cu(0), синтезированные методом электроспиннинга с последующей гидротермальной обработкой. Было доказано, что введение нановолокон улучшает стабильность катализаторов. Ключевым фактором, который влияет на каталитическую активность, выступает морфология катализатора [23]. Также авторами [24] были синтезированы нанокомпозиты Cu/ZrO2 методом соосаждения для оценки морфологии, структуры, теплопроводности и микротвердости. Полученные материалы показали отличную монодисперсность, хорошую теплопроводность и высокую микротвердость.
Кроме того, катализатор продемонстрировал восстановительные и окислительные свойства, высокую термическую стабильность и механическую прочность. Использование в качестве носителя наночастиц меди или структурного промотора ZrO2 перспективнее, чем применение SiO2 или Al2O3.
Оксид циркония может быть разделен на три фазы: аморфная (а-), моноклинная (м-) и тетрагональная (т-). Авторы [25] и [26] синтезировали образцы носителей наночастиц медиа а-ZrO2, т‑ZrO2 и м-ZrO2 для исследования эффекта носителя методом пропитки по влагоемкости. Характеристики катализаторов Cu/ZrO2 приведены в табл. 1. Размеры частиц CuO в катализаторах расположились в следующем порядке: Cu/м-ZrO2 (~7 нм) > Cu/т-ZrO2 (~3.5 нм) > Cu/a-ZrO2 (~2 нм). Такое распределение указывает на то, что частицы меди хорошо диспергированы на образцах a-ZrO2 и т-ZrO2 [26]. Анализ площади поверхности по БЭТ показал, что общий объем пор всех катализаторов Cu/ZrO2 находится в диапазоне 0.23~0.27 см3/г (Cu/a-ZrO2 > Cu/т-ZrO2 > > Cu/м-ZrO2) [26]. Плотность основных центров определяли комбинированием метода температурно-программированной десорбции CO2 (CO2-ТПД) с методом БЭТ. Катализатор Cu/м-ZrO2 обладал самой высокой плотностью основных центров, что благоприятно сказывается на реакции дегидрирования спирта [26]. На профиле температурно-программированной десорбции H2 (H2-ТПД) всех катализаторов присутствовали пики (α) и (β), дополнительный пик (γ) для катализатора Cu/м-ZrO2 обозначает десорбцию водорода из массива частиц Cu [26]. В Оже-спектрах катализаторов Cu/ZrO2 для образца Cu/а-ZrO2 пик при 915.6 эВ соответствует Cu2O, а для образца Cu/т-ZrO2 пик при 918.4 эВ соответствует CuO [25].
Таблица 1.
| Катализатор | Dоксид меди, ~нм | SБЭТ, м2/г |
Vp, см3/г | Основные центры, ммоль/м2 | Десорбция H2 на различных центрах, ммоль/гкатализатора | Пики в Оже-спектрах, эВ |
||
|---|---|---|---|---|---|---|---|---|
| α(63~66°C) | β(214~254°C) | γ(около 350°C) | ||||||
| Cu/а-ZrO2 | 2 | 222 | 0.27 | 4.55 | 1369.65 | 359.48 | – | 915.6 |
| Cu/м-ZrO2 | 7 | 111 | 0.23 | 5.55 | 396.87 | 24.16 | 230.40 | 915.5/918.3 |
| Cu/т-ZrO2 | 3.5 | 152 | 0.25 | 3.92 | 688.70 | 367.72 | – | 918.4 |
Был проведен эксперимент по дегидрированию этанола, в результате которого выявлено что фаза ZrO2 оказывает сильное влияние на селективность образования продукта. Селективность образования этилацетата на катализаторе Cu/м-ZrO2 при 200–250°С выше, чем на катализаторах Cu/а-ZrO2 и Cu/т-ZrO2 при высоком времени контакта. Следовательно, каталитическая активность Cu/ZrO2 зависит от валентности меди и типа носителя. Низкая степень превращения этанола в этилацетат на катализаторе Cu/м-ZrO2 обусловлена тем, что в образце повышенное количество основных центров, а распределение частиц меди на поверхности носителя более неоднородное. При этом, на поверхности образца т-ZrO2 наблюдалась высокая концентрация кислотных центров Льюиса [25]. Катализатор т-ZrO2 стабилен при более низкой температуре, в то время как катализатор м-ZrO2, полученный методом осаждения в геле, стабилен при температуре до 1170°С [26, 27].
Авторы [28] приготовили катализатор Cu/ZrO2 путем совместного осаждения с гидроксидом натрия в качестве осадителя и испытали его в реакции окислительного дегидрирования диэтаноламина (ДЭА) в микроканальном проточном реакторе. Оказалось, что степень превращения ДЭА и выход иминодиацетата (ИДА) увеличиваются в течении непрерывной реакции дегидрирования.
Графен – уникальный двумерный однослойный углеродный материал – привлек огромное внимание благодаря своим свойствам, таким как большая удельная поверхность, высокая проводимость, а также механические, тепловые и электрические свойства [29]. В связи с этим графен считается перспективным материалом, который может быть применен как носитель для наночастиц меди. Недавние успехи в использовании меди, внедренной в графен, подтолкнули к изучению катализаторов на основе меди, включая их синтез. Например, авторы [30] синтезировали наночастицы Cu на восстановленном оксиде графена (гGO) одностадийным методом in situ в течение нескольких минут, при комнатной температуре, с использованием борана аммиака в качестве восстановителя. Вышеупомянутый нанокатализатор оказался лучшим медным катализатором для дегидрирования борана аммиака с частотой оборотов реакции (TOF) 3.61 моль H2 на катализатор в минуту. Аналогично наночастицы меди получали в одну стадию путем восстановления CuSO4 гидратом гидразина в щелочном растворе, содержащем концентрированный водный раствор аммиака, в течение 3 ч при 80°С с перемешиванием. Полученный материал, использовали в качестве присадок к смазочным материалам для уменьшения коэффициента трения [31]. Авторы [32] синтезировали восстановленную на оксиде графена инкапсулированную медную сферу (Cu2-гGO) путем термической обработки после функциональной модификации, которая привела к созданию трехмерной структуры с высокой стойкостью к окислению, высокой теплопроводностью и увеличенным коэффициентом теплопередачи. В похожем исследовании плоскость графена с наночастицами Cu синтезировали методом одностадийного электрохимического восстановления на графене с медной фольгой, причем наночастицы Cu и гGO равномерно распределились на осажденной композитной пленке [33].
Метод электрохимического осаждения значительно проще восстановления. Авторы [34] разработали простой одностадийный способ синтеза наночастиц меди на графене гGO. В данном процессе восстановление оксида графена и наночастиц Cu и осаждение Cu-гGO на рабочий электрод проводили одновременно. Электрохимический метод в последнее время стал популярен, так как в реакции отсутствует дополнительный восстановитель и процесс протекает при мягких условиях.
Наночастицы Cu сильно адсорбируются в результате взаимодействия с азотными центрами, которые стабилизируют наночастицы от слипания [35]. Медные катализаторы на графеновой подложке, промотированной азотом, готовили в две стадии [36]: промотированной азотом графен синтезировали гидротермальным методом с добавлением аммиака с последующим введением меди в катализатор пропиткой. Авторы считают, что промотированние азотом может уменьшить размеры наночастиц Cu и увеличить их дисперсность.
Металлорганические каркасные структуры
Металлорганические каркасные структуры (МОК), также известные как металлорганические координационные полимеры (МКОП) или координационные полимерные сети (КПС), представляют собой трехмерные микропористые кристаллические материалы, которые обладают массой преимуществ, таких как большой внутренний объем пор, высокая удельная площадь поверхности и низкая плотность решетки [37]. В последнее время увеличивается интерес к разработке МОК в качестве носителей для определенных каталитических центров. Авторы [38] применили теорию функционала плотности для оценки переходных металлов первого ряда, таких как Fe, Co, Ni, Cu и Zn, нанесенных на МОК NU-1000, в реакции дегидрирования спирта. В данной реакции в процессах переноса протона МОК вносят положительные эффекты. Кроме того, авторы [39] получили со-катализатор Cu3(BTC)2 (BTC: 1,3,5-бензолтрикарбоксилат), модернизированный TEMPO (2,2,6,6-тетраметилпиперидин-1-ил)оксил) для реакции окислительного дегидрирования бензиловых спиртов. Несмотря на то, что катализатор имеет жесткую кристаллическую структуру, его каталитическая активность не снижается. В процессе реакции дегидрирования катализатор Cu3(BTC)2 демонстрирует стабильную работу без регенерации [39].
Также МОК могут быть прокалены в углеродные материалы с высокой пористостью и разнообразной морфологией: пористые материалы МОК [40], углеродные нанополиэдры [41], углеродные микротрубки [42] и так далее.
Промоторы для катализаторов на основе меди
При добавлении одного или нескольких металлических промоторов в катализатор увеличивается стойкость к окислению, предотвращается спекание, стабилизируется микроструктура катализатора и улучшается дисперсность наночастиц меди. Авторы [43] синтезировали медные скелетные катализаторы с промотором хромом (Cr). Катализаторы без Cr теряли свою активность за короткий промежуток времени, в то время, как катализаторы, содержащие Cr, оставались активными в шести последовательных реакционных циклах [43]. Методом соосаждения был синтезирован катализатор Cu–MoO3–ZrO2, который продемонстрировал превосходные каталитические свойства в реакции дегидрирования диэтаноламина, селективность образования целевого продукта составила 96.3% [44]. Определенное количество промотора повышает стабильность, увеличивает удельную площадь поверхности и объем пор катализатора.
Кроме того, ионы металлов могут быть нанесены на графен GO, модифицированный функциональной группой, который способствует образованию металлических наночастиц. Недавно, триметаллические наночастицы Cu2CoNi с ядром-оболочкой (НЧ), нанесенные на графен, синтезировали с помощью одностадийного метода восстановления in situ, в котором боран метиламина служил восстановителем. Полученные наночастицы продемонстрировали хорошую прочность и способность к магнитной переработке в реакции гидролитического дегидрирования борана аммиака с TOF 15.46 моль H2 на катализатор в минуту [45]. Также группа ученых синтезировала монодисперсные наночастицы CuCo (диаметр ≤ ≤ 2.4 нм) иммобилизованные на диамин-функционализированном восстановленном оксиде графена. Катализатор испытали в реакции гидролитического дегидрирования борана аммиака, значение TOF составило 51.5 моль H2 на катализатор в минуту [46]. Мульти-металлические катализаторы обладают отличными характеристиками. Монометаллические наноразмерные катализаторы легко спекаются во время реакции, в то время как биметаллические наночастицы обладают синергетическим структурным и электронным эффектами [47], что обуславливает их более высокие каталитические характеристики по сравнению с монометаллическими аналогами. Использование биметаллических наночастиц Cu с переходными металлами первого ряда (например, Ni, Co, Fe и др.) или благородными металлами (например, Pt, Au, Pd) для формирования структуры ядро-оболочка или сплава является одним из наиболее перспективных способов для повышения эффективности катализатора. Авторы [48] сообщили о простой процедуре синтеза наноструктур Co2Cu с ядром-оболочкой, основанной на гальванической замене. В процессе окисления и последующего восстановления наночастицы в катализаторе не агрегируют, из-за чего катализатор обладает превосходной термической стабильностью [48]. Авторы [49] синтезировали наногексаэдр и октаэдр с ядром-оболочкой Au−Cu путем восстановления CuCl2 аскорбиновой кислотой. Катализатор использовали для получения 4-аминофенола по реакции восстановления 4-нитрофенола. В реакции восстановления октаэдр Au−Cu оказался эффективнее, чем гексаэдр Au−Ag, следовательно, различные поверхностные электронные концентрации вызывают различную каталитическую активность [49]. Монодисперсные наночастицы сплава Cu−Pt синтезировали методом с использованием комплекса бора−трет-бутиламина (BTB) в качестве мягкого восстановителя и олеиламина в качестве поверхностно-активного вещества [50]. Полученные наночастицы сплава Cu−Pt обладали высокой каталитической активностью в реакциях гидролитического дегидрирования борана аммиака и гидразин-борана с TOF 859 и 832 моль H2 на катализатор в минуту. Исследование [51] показало, что кристаллическая структура металла Ni изменяется при добавлении Cu, в следствие чего катализатор из сплава Ni−Cu обладает хорошими каталитическими свойствами. Например, Cu улучшает восстановительные свойства катализатора, а Ni улучшает дисперсность.
Методы синтеза катализаторов на основе меди
Благодаря широкому применению катализаторов на основе меди, исследователи изучают различные методы их синтеза. Наиболее распространенные методы синтеза – совместное осаждениe, пропитка и золь-гель метод. Особое внимание следует уделить взаимосвязи между методами приготовления и каталитическими характеристиками [52]. Ниже приводится краткое описание методов, применяемых для синтеза катализаторов на основе меди.
Метод соосаждения. Было доказано, что процесс соосаждения является эффективным методом для приготовления ультратонких частиц, диспергированных на различных носителях. В типичном синтезе соли металлов растворяют в дистиллированной воде, затем осаждают, добавляя по каплям в качестве осаждающего агента, например, раствор гидроксида натрия, гидроксида аммония, бикарбоната натрия и т.д. Далее, приготовленный раствор смешанных оксидов металлов выдерживают в течении некоторого времени. Однако размеры частиц получаются неоднородными и нельзя контролировать форму наночастиц [53].
Недавно усовершенствованным методом химического соосаждения (обратное соосаждение) синтезировали нанокатализатор Co−Cu−ZrO2 путем одновременного осаждения катионов [54]. Катализатор испытали в реакции метанирования CO2, в результате которой выход CH4 составил 58%, что в 1.27 раза выше, чем у исходного катализатора Co−ZrO2. В отличие от традиционного метода соосаждения, раствор смеси солей металлов медленно добавляли в раствор осадителя, чтобы убедиться, что осадитель находится в избытке, вследствие чего, соли металлов были полностью осаждены до однородного состояниря. Сравнение двух методов соосаждения, использованных для синтеза катализаторов на основе меди, представлены на рис. 5.
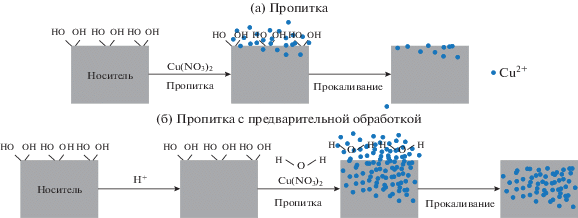
Метод пропитки. Носитель обычно пропитывают водным раствором нитрата Cu(II) при комнатной температуре. Затем, после того, как катализатор в естественных условиях высыхает, его прокаливают [25, 26]. Данный метод подходит для катализатора с низким содержанием активных компонентов или с высокой механической прочностью. Предложен улучшенный метод пропитки, который в значительной степени увеличивает поверхность катализатора по БЭТ и улучшает дисперсность металла. В отличие от обычного метода пропитки, носитель предварительно обрабатывают в растворе уксусной кислоты, что приводит к адсорбции протонов на части гидроксильных центров поверхности носителя, вследствие чего уменьшается количество участков, с которыми медь вступает во взаимодействие, что позволяет ионам меди проникнуть во внутренние поры [55]. Данным методом синтезировали катализатор Cu/γ-Al2O3/Al для реакции конверсии водяного пара. Катализатор показал высокую активность и стабильность [55]. Механизмы двух методов пропитки представлены на рис. 6.
Золь-гель технология. Золь-гель метод представляет собой гомогенный процесс, позволяющий получать катализаторы с улучшенными характеристиками: большая площадь поверхности, малый размер частиц, стабильность носителя и улучшенная морфология [56]. В ходе синтеза исследователи могут изменять типы реагентов, порядок добавления реагентов, температуру и pH [57]. Стандартный метод, принятый для синтеза катализаторов на основе меди с помощью золь-гель процесса, представлен на рис. 7. В золь-гелевом методе гелеобразующий агент добавляют для контроля реакции гидролиза, что позволяет уменьшать степень агрегации и получать частицы меньшего размера [56]. Авторам [58] удалось доказать, что Cu/ZrO2, приготовленный золь-гель методом, включает в себя два дополнительных типа Cu, а именно замещающие и внерешеточные ионы, которые усиливают каталитические свойства [58]. Однако пропитка и соосаждение вызывают образование только поверхностно-связанных ионов и нано-кластеров оксида меди. В связи с чем крайне важно изучить механизмы действия замещающих и внерешеточных ионов Cu в каталитическом процессе.
Таким образом, катализаторы на основе меди обладают рядом недостатков, которые могут быть устранены с помощью различных методов синтеза и использования промоторов. Стоит обратить внимание на исследование стабильных носителей для наночастиц меди (полые углеродные материалы, металлорганические каркасные структуры (МОК)) и на повышение устойчивости катализаторов к окислению. Также необходимо изучить детали процесса, скорость и порядок введения растворителя. Мы рассмотрели возможные механизмы дегидрирования на медных катализаторах, но не пришли к однозначному решению о природе активных центров. Необходимо подробно изучить процессы введения меди в носитель, а также этапы дезактивации катализаторов, независимо от того, способствует ли окисление меди уменьшению каталитической активности, или напротив, различные формы меди вносят положительный эффект в реакцию дегидрирования. Для решения этих проблем нужно двигаться одновременно в двух направлениях: во-первых, синтезировать серию медных катализаторов с различной валентностью методом физического перемешивания и изучать поведение каталитических систем в режиме реального времени; во-вторых, использовать фазу ZrO2 в качестве первого носителя для различных типов меди, и восстановленный оксид графена в качестве второго носителя для увеличения стойкости к окислению.
Список литературы
Kang M.H., Lee S.J., Park J.Y., Park J.K. // J. of Alloys and Compounds. 2018. V. 735. P. 2162.
Chan G.H., Zhao J., Hicks E.M., Schatz G.C., Van Duyne R.P. // Nano Lett. 2015. V. 7. P. 1947.
Caldas P.C.P., Gallo J.M.R., Lopez-Castillo A., Zanchet D., Bueno J.M.C. // ACS Catalysis. 2017. V. 7. P. 2419.
Chen C.S., Lai Y.T., Lai T.W., Wu J.H., Chen C.H., Lee J.F., Kao H.M. // ACS Catalysis. 2013. V. 3. P. 667.
Sitthisa S., Resasco D.E. // Catal. Lett. 2011. V. 141. P. 784.
Damodara D., Arundhathi R., Likhar P.R. // Adv. Synth. Catal. 2014. V. 356. P. 189.
Yang Y.Q., Duan Z.K., Liu W.Y., Li G.L., Xiong Y. // Chem. Reaction Engineering and Technology. 2001. V. 17. P. 210.
Neurock M., Tao Z.Y., Chemburkar A., Hibbitts D.D., Iglesia E. // Faraday Discuss. 2017. V. 197. P. 59.
Scotti N., Zaccheria F., Evangelisti C., Psaroa R., Ravasio N. // Catal. Sci. Technol. 2017. V. 7. P. 1386.
Sarbajna A., Dutta I., Daw P., Dinda S., Rahaman S.M.W., Sarkar A., Bera J.K. // ACS Catal. 2017. V. 7. P. 2786.
Balaraman E., Khaskin E., Leitus G., Milstein D. // N-ature Chem. 2013. V. 5. P. 122.
Dai Z.J., Luo Q., Jiang H., Luo Q., Li H., Zhang J., Peng T.Y. // Catal. Sci. Technol. 2017. V. 7. P. 2506.
Sato A.G., Volanti D.P., de Freitas I.C., Longo E., Bueno J.M.C. // Catal. Commun. 2012. V. 26. P. 122.
Zhang M., Zhao Y.J., Liu Q., Yang L., Fan G., Li F. // Dalton Trans. 2016. V. 45. P. 1093.
Wang L.X., Zhu W.C., Zheng D.F., Yu X., Cui J., Jia M.J., Zhang W.X., Wang Z.L. // React. Kinet. Mech. Catal. 2010. V. 101. P. 365.
Campbell C.T. // Acc. Chem. Res. 2013. V. 46. P. 1712.
Bruix A., Rodriguez J.A., Ramirez P.J., Senanayake S.D., Evans J., Park J.B., Stacchiola D., Liu P., Hrbek J., Illas F. // J. Am. Chem. Soc. 2012. V. 134. P. 8968.
Freitas I.C., Damyanova S., Oliveira D.C., Marques C.M.P., Bueno J.M.C. // J. Mol. Catal. A: Chemical. 2014. V. 381. P. 26.
Mudiyanselage K., Senanayake S.D., Feria L., Kundu S., Baber A.E., Graciani J., Vidal A.B., Agnoli S., Evans J., Chang R., Axnanda S., Liu Z., Sanz J.F., Liu P., Rodriguez J. A., Stacchiola D.J. //Angewandte Chemie. 2013. V. 125. P. 5205.
Zhu Y., Shen M., Xia Y., Lu M. // Appl. Organomet. Chem. 2015. V. 29. P. 152.
Greenwell H.C., Marsdenb C.C., Jonesc W. // Green Chemistry. 2007. V. 9. P.1299.
Yousef A., Barakat N.A.M., El-Newehy M.H., Ahmed M.M., Kim H.Y. //Colloids & Surfaces A: Physicochem. Eng. Aspects. 2015. V. 470. P. 194.
Fernandez E., Boronat M., Corma A. // J. Phys. Chem. C. 2015. V. 119. P. 19832.
Fathy A. // Mater. Lett. 2018. V. 213. P. 95.
Sato A.G., Volanti D.P., Meira D.M., Damyanova S., Longo E., Bueno J.M.C. // J. Catal. 2013. V. 307. P. 1.
Witoon T., Chalorngtham J., Dumrongbunditkul P., Chareonpanich M., Limtrakul J. Chem. Eng. J. 2016. V. 293. P. 327.
Samson K., Sliwa M., Socha R.P., Gora-Marek K., Mucha D., Rutkowska-Zbik D., Paul J.-F., Ruggiero-Mikołajczyk M., Grabowski R., Słoczynski J. // ACS Catal. 2016. V. 4. P. 3730.
Andreev D.V., Sergeev E.E., Gribovskii A.G., Makarshin L.L., Prikhodko S.A., Adonin N.Yu., Pai Z.P., Parmon V.N. // Chem. Eng. J. 2017. V. 330. P. 899.
Huang C., Li C., Shi G. // Energy Environ. Sci. 2012. V. 5. P. 8848.
Yang Y., Lu Z.H., Hu Y., Zhang Z., Shi W., Chen X., Wang T. // RSC Adv. 2014. V. 4. P. 13749.
Z. Jia, T. Chen, J. Wang, J. Ni, H. Li, X. Shao // Tribol. Int. 2015. V. 88. P. 17.
Liu S.Q., Zhao B., Jiang L., Zhu Y.W., Fu X.Z., Sun R., Xu J.B., Wong C.P. // J. Mater. Chem. C. 2018. V. 6. P. 257.
Xie G., Forslund M., Pan J. // ACS Appl. Mater. Interfaces. 2014. V. 6. P. 7444.
Nia P.M., Woi P.M., Alias Y. // Appl. Surf. Sci. 2017. V. 413. P. 56.
Zhang P., Wang Q.N., Yang X., Wang D., Li W.C., Zheng Y., Chen M., Lu A.H. // ChemCatChem. 2017. V. 9. P. 505.
Shi R., Zhao J., Liu S., Sun W., Li H., Hao P., Li Z., Ren J. // Carbon. 2018. V. 130. P. 185.
Dhakshinamoorthy A., Garcia H. // Chem. Soc. Rev. 2014. V. 45. P. 5750.
Ortuño M.A., Bernales V., Gagliardi L., Cramer C.J. // J. Phys. Chem. C. 2016. V. 120. P. 24697.
Dhakshinamoorthy A., Alvaro M., Garcia H. // ACS Catal. 2011. V. 1. P. 48.
Jayakumar A., Antony R.P., Wang R., Lee J.M. // Small. 2017. V. 13. 1603102.https://doi.org/10.1002/smll.201603102
Song X.K., Guo L.L., Liao X.M., Liu J., Sun J.H., Li X.P. // Small. 2017. V. 13. 700238.https://doi.org/10.1002/smll.201700238
Ahn S.H., Manthiram A. // Small. 2017. V. 13. 1702068. doi 201702068.https://doi.org/10.1002/smll.201702068
Liu D.S., Cant N.W., Smith A.J., Wainwright M.S. // Appl. Catal. A: General. 2006. V. 297. P.18.
Wu J., Duan Z.K., Li W.J., Jin S.L. // J. Molecular Catalysis (China). 2013. V. 27. P. 515.
Meng X.Y., Yang L., Cao N., Du C., Hu K., Su J., Luo W., Cheng G.Z. // ChemPlusChem. 2014. V. 79. P. 325.
Song F.Z., Zhu Q.L., Yang X.C., Xu Q. // ChemNanoMat. 2016. V. 2. P. 942.
Yao Q., Lu Z.H., Wang Y.Q., Chen X. S., Feng G. // J. Phys. Chem. 2015. V. 119. P. 14167.
Nafria R., Genc A., Ibanez M., Arbiol J., Ramirez de la Piscina P., Homs N., Cabot A. // Langmuir. 2016. V. 32. P. 2267.
Hsia C.F., Madasu M., Huang M.H. / /Chem. Mater. 2016. V. 28. P. 3073.
Karaca T., Sevim M., Metin O. // ChemCatChem. 2017. V. 9. P. 1.
Xia Z.J., Liu H.Y., Lu H.F., Zhang Z.K., Chen Y.F. // Appl. Surf. Sci. 2017. V. 422. P. 905.
Yao C.Z., Wang L.C., Liu Y.M., Wu G.S., Cao Y., Dai W.L., He H.Y., Fan K.N. // Appl. Catal. A: General. 2006. V. 297. P. 151.
Feng H.X., Chen B.Y., Zhang D.Y., Zhang J.P., Tan L. // J. Magn. Magn. Mater. 2014. V. 356. P. 68.
Dumrongbunditkul P., Witoon T., Chareonpanich M., Mungcharoen T. // Ceram. Int. 2016. V. 42. P. 10444. https://doi.org/10.1016/j.ceramint.2016.03.193
Zhang Q., Xu J.J., Fan F.Y., Sun D.M., Xu G.M., Zhang S., Zhu Z.B. // Fuel Process. Technol. 2014. V. 119. P. 52.
Sajjadi S.M., Haghighi M., Eslami A.A., Rahmani F. // J. Sol-Gel Sci. Technol. 2013. V. 67. P. 601.
Esposito S., Turco M., Bagnasco G., Cammarano C., Pernice P., Aronne A. // Appl. Catal. A: General. 2010. V. 372. P. 48.
Ramaswamy V., Bhagwat M., Srinivas D., Ramaswamy A.V. // Catal. Today. 2004. V. 97. P. 63.
Дополнительные материалы отсутствуют.
Инструменты
Нефтехимия