Нефтехимия, 2019, T. 59, № 6-2, стр. 768-774
Активность цеолитов различных типов в реакции крекинга н-алканов в трехфазном реакторе
К. И. Дементьев 1, *, Т. А. Паланкоев 1, Д. С. Абрамова 1, 2, П. С. Кузнецов 1, А. В. Золотухина 1, 2, А. Л. Максимов 1, 2, С. Н. Хаджиев 1
1 Институт нефтехимического синтеза им. А.В. Топчиева РАН
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: kdementev@ips.ac.ru
Поступила в редакцию 10.12.2018
После доработки 01.02.2019
Принята к публикации 12.02.2019
Аннотация
Оценена каталитическая активность цеолитов трех типов – Y, ZSM-5 и Beta – в реакции крекинга н-алканов С20–С35 в трехфазном реакторе в следующих условиях: температура 300–380°С, давление водорода 7 атм, содержание катализатора 1 мас. %. Показано, что активность цеолит Beta в реакциях крекинга в разы превышает показатели цеолитов других типов, что связано, вероятно, с большим объемом мезопор в его структуре.
Одна из особенностей развития современных процессов глубокой переработки нефти (гидрокрекинга, каталитического крекинга) – утяжеление сырья процесса. Данная тенденция связана как с увеличением доли тяжелых нефтей в структуре нефтедобычи, так и с необходимостью увеличения глубины переработки нефти за счет более эффективной конверсии нефтяных остатков. Однако переработка остаточного сырья с использованием традиционных цеолитных катализаторов связана с рядом серьезных проблем: низкая селективность по целевым продуктам, повышенное коксообразование, быстрая дезактивация катализатора вследствие закупорки пор. Основной причиной описанных проблем является затрудненная диффузия крупных молекул сырья в узких порах цеолитов. Таким образом, актуально создание новых каталитических систем, свободных от диффузионных ограничений [1].
Традиционным подходом в данном случае является модификация структуры цеолитных катализаторов с увеличением доли мезо- и макропор. Можно выделить два направления в этой области: разработка новых методик синтеза цеолита и пост-модификация готовых цеолитов. В рамках первого направления при синтезе цеолита вводят различные органические темплаты (гидроксид тетрапропиламмония, блоксополимеры оксидов пропилена и этилена и др.), позволяющие создавать мезопористые и иерархические структуры при последующей кристаллизации [2, 3]. Модификация готовых цеолитов подразумевает частичное разрушение кристаллической решетки при воздействии водяного пара и повышенных температур [4], десиликатизацию/деалюминирование [5, 6] или в процессе перекристаллизации цеолита [7]. Отдельно можно выделить метод, подразумевающий создание цеолитных структур типа ядро–оболочка, где ядро стандартного цеолита окружено оболочкой с мезопорами [8]. Такая комбинация микро- и мезопор способна обеспечить высокую эффективность диффузии и рациональное распределение силы кислотных центров [9]. Создание мезо- и макропористой поверхности у цеолитов позволяет достичь повышенной конверсии сырья в процессе каталитического крекинга и гидрокрекинга, высокой селективности по олефинам C2–C4 и устойчивости к дезактивации.
Повышенная устойчивость цеолитных катализаторов к дезактивации в результате коксообразования наблюдается при проведении реакции в трехфазной системе, когда дисперсионная среда находится в сверхкритических условиях. При давлении свыше 40 атм и температуре в диапазоне 400–500°С углеводороды (УВ) выполняют роль растворителя кокса, удаляя его с поверхности катализатора [10, 11]. При этом, однако, большую роль играет размер пор используемого катализатора: так, узкопористый цеолит ZSM-5 обладает меньшей активностью чем катализаторы с большим размером пор, например цеолиты Y, β [12] или катализаторы типа ядро–оболочка [11]. Ярко выражен также эффект размера кристалла – активность катализатора в гидрокрекинге додекана возрастает на 30% с уменьшением размера кристаллов цеолита сo 100 до 20–40 нм [13].
Перспективным подходом, позволяющим увеличить как активность катализатора, так и его устойчивость к дезактивации, является наногетерогенный катализ, заключающийся в уменьшении размера частиц катализатора вплоть до нескольких нанометров [14]. Столь малые частицы могут быть сформированы in situ из прекурсора, диспергированного в инертной среде либо непосредственно в сырье процесса; реакция при этом проводится в трехфазной системе. Применение данного подхода к реакции гидроконверсии нефтяных остатков позволяет увеличить степень превращения исходного сырья вплоть до 90–95%, причем гидроконверсия протекает в мягких условиях, а нанокатализатор в этих условиях может работать без изменения активности в течение многих месяцев [15]. Перспективность подхода показана также для реакций гидрирования полициклических ароматических соединений [16], синтеза олефинов из диметилового эфира [17] и синтеза Фишера–Тропша [18].
Применение концепции наногетерогенного катализа может быть перспективно также для реакции каталитического крекинга, направленной на получение легких УВ. При этом по сравнению с традиционным газофазным процессом решается проблема подвода тепла и быстрой дезактивации катализатора вследствие отложения кокса. Основная проблема – сложность формирования активных кислотных твердых контактов в жидкой дисперсионной среде. В качестве первого этапа решения этой проблемы в настоящей работе проводится изучение активности измельченных цеолитных катализаторов различной структуры в крекинге модельной углеводородной смеси при низком давлении и температуре.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов. В качестве основы для катализаторов крекинга были использованы стандартные порошки цеолитов марок CBV 780 (H-Y), CBV 8014 (NH4-ZSM-5) и CP811E-75 (H-Beta) производства компании Zeolyst. Перед дальнейшим использованием все образцы подвергались прокалке при 550°С в токе воздуха в течении 5 ч с последующим измельчением на шаровой мельнице до размера частиц не более 1.0–1.5 мкм. Контроль размера осуществляли с помощью оптической микроскопии при увеличении 40×.
Исследование катализаторов. Фазовый состав образцов цеолитов определяли с помощью рентгеновского спектрометра Rigaku Rotaflex RU-200 с вращающимся медным анодом (излучение CuKα с Ni-фильтром) в режиме 50 кВ/160 мА. Спектры записывали с помощью горизонтального широкоуглового гониометра по геометрии Брегга–Бретано в режиме сканирования θ–2θ.
Элементный состав определяли с помощью рентгено-флуоресцентного спектрометра ARL PERFORM’X 2500 (Thermo Fischer Scientific), оборудованном рентгеновской трубкой 2500 W.
Текстурные характеристики цеолитов исследовали методом низкотемпературной адсорбции азота с помощью прибора Micromeritics ASAP 2020. Свойства образцов рассчитывали с помощью стандартного программного обеспечения. Удельную площадь поверхности рассчитывали по модели Брунауэра–Эмметта–Теллера (БЭТ) при относительном парциальном давлении азота P/P0 = 0.17. Объем пор рассчитывался по модели Barrett–Joyner–Halenda (BJH) при относительном парциальном давлении азота P/P0 = 0.95. Объем микропор определялся по методу t-plot.
Характеристика кислотности образцов проводилась методом термопрограммированной десорбции аммиака (ТПД NH3) с использованием анализатора хемосорбции УСГА-101 (“УНИСИТ”, Россия). Спектры десорбции аммиака снимались в диапазоне температур 60–750°С при нагреве со скоростью 8°С/мин до 750°С в потоке гелия (30 мл/мин). Выделяющийся аммиак регистрировался детектором по теплопроводности. Расчет количества десорбированного аммиака производился с учетом предварительной калибровки прибора УСГА-101.
Каталитические эксперименты
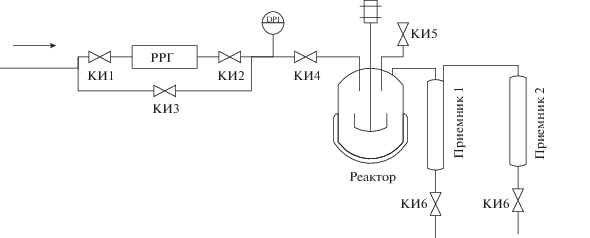
Для исследования активности катализаторов использовали установку с реактором автоклавного типа, проточную по газу и снабженную механической мешалкой (рис. 1). В реактор загружали 0.7–0.8 г катализатора, после чего заливали 100 мл парафина П-2 (ГОСТ 23683-89) при температуре 110°С, таким образом содержание катализатора в дисперсионной среде для всех экспериментов составляет 1%. Парафин содержал свыше 98% алканов С20–С35 нормального строения; его молекулярно-массовое распределение приведено на рис. 2. Далее реактор герметизировали, включали перемешивание, ток водорода и начинали нагрев до температуры реакции. После окончания эксперимента реактор охлаждали, вскрывали и выгружали остаточный продукт.
Условия в процессе крекинга подобраны таким образом, чтобы углеводороды <C20 в условиях реакции находились преимущественно в паровой фазе, а более тяжелые – преимущественно в жидкой.
Условия экспериментов:
– начальный объем суспензии катализатора – 100 мл (~75–79 г парафина).
– давление водорода 7 атм;
– расход водорода 9 л/ч;
– температура 300–380°С.
Температура крекинга поднимается ступенчато (300, 350, 380°С) с выдержкой 1 ч при каждой температуре. После истечения времени выдержки производится отбор газового и жидкого продукта с последующим подъемом температуры со скоростью 2–3°С/мин. Приемник 1 выполнен обогреваемым (60°С) для сбора тяжелых высокозастывающих продуктов; приемник 2 охлаждается с помощью криотермостата до –20°С; для более полной конденсации легких продуктов этот приемник заполнен ректификационной насадкой.
Для оценки протекающего при температуре реакции термического крекинга парафина проводили серию экспериментов в отсутствии катализатора. Активность цеолитов при заданной температуре Т в крекинге рассчитывали с учетом образования продуктов в термическом крекинге по формуле:
где $TO{{F}^{T}}$ – удельная активность цеолита, г/(г ч);
$G_{{{\text{cat}}}}^{T}$ – суммарный выход газа крекинга и жидкого продукта в эксперименте с катализатором, г;
$G_{t}^{T}$ – суммарный выход газа крекинга и жидкого продукта в эксперименте без катализатора, г; mcat – масса загруженного катализатора.
Анализ газового продукта осуществлялся на хроматографе “Кристаллюкс-4000М” с детектором ПИД/ДТП по двухколоночной схеме. Неуглеводородные газы, водород и метан разделяли на насадочной колонке с молекулярным ситом типа CaX (3 м × 3 мм), углеводороды С1–С6 определяли на капиллярной колонке HP-Plot Al2O3/Na2SO4 (Agilent, 50 м, 0.32 мм). Анализ жидкого продукта проводился на хроматографе “Кристаллюкс-4000М”, оснащенном капиллярной колонкой длиной 25 м с фазой типа OV-101.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изучение катализаторов
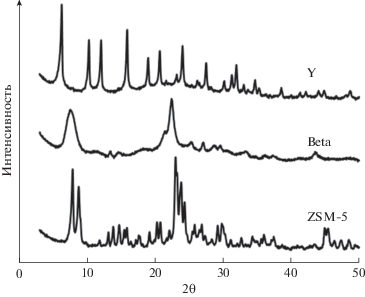
Все исследуемые образцы цеолитов после прокалки и измельчения соответствуют своим структурным типам (рис. 3), причем степень кристалличности образцов во всех случаях составляет не менее 90%. Элементный состав образцов также соответствуют заявленному: содержание натрия во всех случаях составляет менее 0.1%, а массовое соотношение SiO2/Al2O3 находится в пределах 41–54. По данным низкотемпературной адсорбции азота наиболее развитой поверхностью обладает цеолит Y – удельная площадь поверхности составляет 631 м2/г. Цеолит Beta примечателен наиболее высокой долей мезопор, на которые приходится 74% общего объема пор. Наименьшую поверхность из всех образцов имеет цеолит ZSM-5 (406 м2/г), который также имеет наименьший объем пор – 0.23 см3/г. Полученные данные согласуются с размером входных окон каналов соответствующих цеолитов.
Таблица 1.
Текстурные характеристики и элементный состав катализаторов
| Цеолит | Содержание Na, мас. % | Отношение SiO2/Al2O3, г/г | SBET, м2/г | Vtotal, см3/г | Vmicro, см3/г |
|---|---|---|---|---|---|
| ZSM-5 | 0.07 | 43.4 | 406 | 0.23 | 0.10 |
| Beta | 0.09 | 41.5 | 579 | 0.62 | 0.16 |
| Y | 0.05 | 53.7 | 631 | 0.38 | 0.18 |
Кривые ТПД аммиака исследуемых образцов приведены на рис. 4. Вид кривых типичен для цеолитов. Заметно выделяются области с максимумами десорбции при температурах 200 и 380°С, соответствующие слабым кислотным центрам и центрам средней силы. Для всех образцов положение максимума совпадает, за исключением цеолита ZSM-5, второй максимум десорбции которого сдвинут в область высокой кислотности. Также присутствует область с максимумом десорбции при 600°С, относимая к сильным кислотным центрам.
Наибольшим количеством кислотных центров обладает цеолит ZSM-5, для которого значение кислотности составляет 535 мкмоль NH3/г. Кислотность цеолита Beta близка к этому значению и составляет 476 мкмоль NH3/г. Цеолит Y обладает существенно меньшей кислотностью (154 мкмоль NH3/г), что типично для высокомодульных цеолитов этого типа.
Изучение каталитической активности цеолитов
В отсутствиe катализатора крекинг парафина П-2 со сколь-нибудь заметной скоростью протекает только при температуре выше 370–380°С. Выход продуктов крекинга (<C20) при 380°С составляет 0.82%; при 420°С – 18.9% в час; при температурах 300 и 350°С жидкие продукты практически отсутствуют, а в газе наблюдаются следы углеводородов С1–С7.
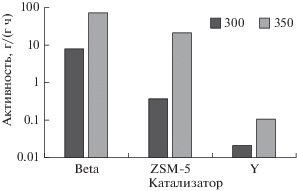
В присутствии катализатора реакции крекинга ускоряются. На рис. 5 приведена активность различных катализаторов в процессе крекинга парафина при различных температурах (масштаб оси Y логарифмический). Наибольшую активность в крекинге проявляет цеолит Beta – его активность уже при 300°С составляет 7.9 г/(г ч). Активность цеолита ZSM-5 более, чем на порядок ниже, а цеолит Y при этой температуре практически не проявляет каталитической активности. Повышение температуры с 300 до 350°С приводит к возрастанию активности всех катализаторов на порядок. Активность цеолита Beta достигла значения 72 г/(г ч), что привело к невозможности испытать катализатор при более высокой температуре из-за исчерпания реакционного субстрата. Активность цеолита ZSM-5 также достигает значительных величин (21.6 г/(г ч)), цеолит Y при температуре 350°С все также малоактивен; значение его активности составляет всего 0.1 г/(г ч).
Полученные данные свидетельствуют об отсутствии прямой корреляции каталитической активности цеолитов в условиях трехфазного катализа с их кислотностью или площадью поверхности. Так, наибольшую кислотность имеет цеолит ZSM-5, наибольшую удельную поверхность – цеолит Y, а наибольшей активностью в крекинге обладает цеолит Beta. По всей видимости, высокая скорость крекинга для этого цеолита обусловлена высоким объемом мезопор (0.46 см3/г), который более, чем вдвое превышает объем мезопор в цеолите Y и ZSM-5. Наличие развитой мезопористой структуры способствует уменьшению диффузионных ограничений на транспорт молекул сырья и продуктов в порах цеолита, что и приводит к высокой каталитической активности. С уменьшением объема мезопор главную роль в обеспечении каталитической активности, вероятно, начинает играть кислотность: ZSM-5 имеет значительно больше кислотных центров, чем цеолит Y, причем центры в среднем сильнее.
Молекулярно-массовое распределение (ММР) продуктов крекинга в присутствии катализатора также существенно меняется (рис. 6). Провал на кривой ММР в области С6 обусловлен, по всей видимости, неполной конденсацией легких продуктов крекинга в приемниках. Для цеолитов Beta и ZSM-5, проявляющих высокую активность в крекинге, большая часть продуктов состоит из углеводородов С4–С11, причем максимум на кривой приходится на С5. Доля углеводородов С12+ для цеолитов обоих типов невелика и составляет 9–10%. ММР для цеолита Y имеет два выраженных максимума в области С4 и С22; очевидно, второй максимум связан с уносом парафина из реактора. Содержание углеводородов С12+ близко к таковому для термического крекинга и составляет 55%.
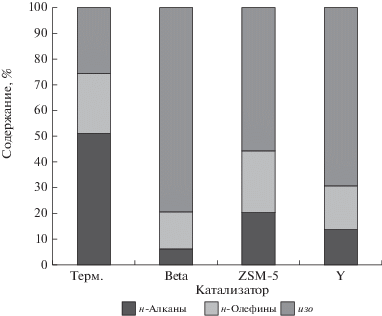
Групповой состав жидкого продукта для всех цеолитов достаточно близок (рис. 7). Продукт крекинга в отсутствии катализаторов на 75% состоит из углеводородов нормального строения – алканов и алкенов, причем двойная связь в алкенах расположена у терминального атома углерода. Введение в систему катализатора приводит к увеличению доли изоструктур до 55–80%. Изомеризованные углеводороды представлены, в основном, 2- и 3-метилзамещенными структурами; наибольшее количество изомерных углеводородов наблюдается для цеолита Beta, наибольшее – для цеолита ZSM-5, что связано, вероятно, с особенностями пористой структуры этих катализаторов.
Некоторые показатели состава газа крекинга приведены в табл. 2. В присутствии катализаторов существенно увеличивается доля непредельных углеводородов в газе крекинга. Содержание бутиленов во фракции С4 при наличии катализатора составляет 86–90% против 54% при термическом крекинге, причем значение практически не зависит от типа катализатора. Этот показатель может рассматриваться как индикатор специфической активности катализатора, связанной с наличием кислотных центров. Также можно отметить наличие своеобразных маркеров каталитической активности для всех исследованных цеолитов: Y более селективен в отношении пропилена, ZSM-5 – этилена, Beta – изомерных С4-углеводородов, что коррелирует с их пористой структурой.
Таблица 2.
Показатели газа крекинга (350°С)
| терм. | Beta | ZSM-5 | Y | |
|---|---|---|---|---|
| ${{{\text{C}}_{{\text{2}}}^{ = }} \mathord{\left/ {\vphantom {{{\text{C}}_{{\text{2}}}^{ = }} {{{{\text{C}}}_{2}}}}} \right. \kern-0em} {{{{\text{C}}}_{2}}}}$ | 0.18 | 2.31 | 8.54 | 0.56 |
| ${{{\text{C}}_{{\text{3}}}^{ = }} \mathord{\left/ {\vphantom {{{\text{C}}_{{\text{3}}}^{ = }} {{{{\text{C}}}_{3}}}}} \right. \kern-0em} {{{{\text{C}}}_{3}}}}$ | 0.93 | 1.52 | 0.97 | 5.17 |
| ${{{\text{C}}_{{\text{4}}}^{ = }} \mathord{\left/ {\vphantom {{{\text{C}}_{{\text{4}}}^{ = }} {{{{\text{C}}}_{4}}}}} \right. \kern-0em} {{{{\text{C}}}_{4}}}}$ | 0.54 | 0.86 | 0.90 | 0.89 |
| изо-C4/н-C4 | 0.21 | 3.38 | 0.58 | 1.62 |
ЗАКЛЮЧЕНИЕ
Проведено сравнение каталитической активности цеолитов типов Y, Beta, ZSM-5 в крекинге нормальных алканов С20–С35 в условиях катализа в трехфазной системе. Установлено, что наибольшей каталитической активностью обладает цеолит Beta, причем крекинг алканов с заметной скоростью протекает уже при температуре 300°С. В продуктах крекинга преобладают углеводороды С4–С12, состоящие, в основном, из изомерных углеводородов. Проявление цеолитом Beta высокой активности в крекинге углеводородов при низкой температуре позволяет рекомендовать его для дальнейших исследований с целью создания научных основ крекинга в трехфазной реакционной системе.
ФИНАНСИРОВАНИЕ РАБОТЫ
Исследование выполнено на базе ИНХС РАН за счет гранта Российского научного фонда (проект № 17-73-30046).
КОНФЛИКТ ИНТЕРЕСОВ Максимов А.Л. является главным редактором журнала "Нефтехимия", остальные авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.ИНФОРМАЦИЯ ОБ АВТОРАХ Дементьев Константин Игоревич, к.х.н., O-RCID-https://orcid.org/0000-0002-8102-8624Паланкоев Тимур Ахметович, ORCID −https://orcid.org/0000-0001-9880-6755Абрамова Дарья Сергеевна, ORCID −https://orcid.org/0000-0001-8673-0482Кузнецов Петр Сергеевич, н.с., ORCID −https://orcid.org/0000-0002-3140-3035Золотухина Анна Владимировна, к.х.н., постдокторант, ResearcherID – F-9010-2014Максимов Антон Львович, д.х.н, ORCID −https://orcid.org/0000-0001-9297-4950
Список литературы
Corma A. // J. Catal. 2003. V. 216. № 1–2. P. 298.
Zhao J., Wang G., Qin L., Li H., Chen Y., Liu B. // Catal. Commun., 2016. vol. 73, P. 98.
Zhang X., Cheng D., Chen F., Zhan X. // Chem. Eng. Sci., 2017, vol. 168, P. 352 .
Guo D., Shen B., Qin Y., Sun J., Guo Q., Ren S., Gao X., Pang X., Wang B., Zhao H., Liu H. //Microporous Mesoporous Mater., 2015, vol. 211, P. 192.
Qin Z., Shen B., Gao X., Lin F., Wang B., Xu C. // J. Catal., 2011, vol. 278, no. 2, P. 266 .
Yu Q., Sun H., Sun H., Li L., Zhu X., Ren S., Guo Q., Shen B. // Microporous Mesoporous Mater. 2019. V. 273. P. 297.
Kazakov M.O., Nadeina K.A., Danilova I.G., Dik P.P., Klimov O.V., Pereyma V.Yu., Gerasimov E.Yu., Dobryakova I.V., Knyazeva E.E., Ivanova I.I., Noskov A.S. // Catal. Today. 2018. V. 305. P. 117.
Jia L., Sun X., Ye X., Zou C., Gu H., Huang Y., Niu G., Zhao D. // Microporous Mesoporous Mater. 2013. V. 176. P. 16.
Zhao Q., Qin B., Zheng J., Du Y., Sun W., Ling F., Zhang X., Li R. // Chem. Eng. J. 2014. V. 257. P. 262.
Xian X., Liu G., Zhang X., WangL., Mi Z. // Chem. Eng. Sci. 2010. V. 65. № 20. P. 5588.
Diao Z., Wang L., Zhang X/. Liu G. // Chem. Eng. Sci. 2015. V. 135. P. 452.
Zaker A., Gueraa P., Wang Y., Tompsett G.A., Huang X., Bond J.Q., Timko M.T. // Catal. Today. 2018. V. 317. P. 2.
Wan L., Bao S., Liu G., Wang L., Zhang X. // Catal. Today. 2018. V. 317. P. 2.
Хаджиев С.Н. // Нефтехимия. 2011. Т. 51. № 1. С. 1. [Petrol. Chemistry. 2011. V. 51. № 1. P. 1].
Хаджиев С.Н., Кадиев Х.М., Кадиева М.Х. // Нефтехимия. 2014. Т. 54. № 5. С. 327. [Petrol. Chemistry. 2014. V. 54. № 5. P. 323].
Maximov A.L., Sizova I.A., Khadzhiev S.N. // Pure Appl. Chem. 2017. V. 89. № 8. P. 1145.
Колесниченко Н.В., Коннов С.В., Павлов В.С., Яшина О.В., Ежова Н.Н., Хаджиев С.Н. // Наногетерогенны катализ. 2017. Т.2. № 1. С. 29 [Petrol. Chemistry. 2017. V. 57. № 7. P. 576].
Куликова М.В., Хаджиев С.Н. // Нефтехимия. 2017. Т. 57. № 6. С. 796 [Petrol. Chemisrty. 2017. V. 57. № 12. P. 1173].
Дополнительные материалы отсутствуют.