Нефтехимия, 2019, T. 59, № 6-2, стр. 806-814
Компьютерное моделирование распада пероксида водорода в комплексе с диенами и изопропиловым спиртом
М. Е. Соловьев 1, 2, *, В. П. Бойко 3, В. К. Грищенко 3, Е. М. Плисс 1
1 Ярославский государственный университет им. П.Г. Демидова
150003 Ярославль, Россия
2 Ярославский государственный технический университет
150023 Ярославль, Россия
3 Институт химии высокомолекулярных соединений НАН Украины
02160 Киев, Украина
* E-mail: soloviev56@gmail.com
Поступила в редакцию 06.03.2018
После доработки 11.02.2019
Аннотация
Квантово-химическим методом функционала плотности изучены конформации молекул в комплексе диен (бутадиен, изопрен) с пероксидом водорода и изопропиловым спиртом, в которых достигаются локальные минимумы энергии, и исследован механизм распада молекулы пероксида водорода. Показано, что в зависимости от исходной мультиплетности системы распад может приводить к образованию различных промежуточных и конечных продуктов, что свидетельствует о вероятности синглет-триплетной конверсии пероксида водорода в реальной системе.
Олигодиены с концевыми гидроксильными группами находят широкое применение в различных отраслях нефтехимической промышленности [1–3]. Одним из перспективных промышленных методов получения таких соединений является радикальная полимеризация диенов, инициированная пероксидом водорода (H2O2) в растворах спиртов [4–6]. Повышение эффективности данного процесса с точки зрения получения олигомеров с требуемым распределением функциональных групп предполагает изучение его механизма, в первую очередь, реакции инициирования [7, 8]. Примечательно, что исследования в этом направлении могут пролить свет и на некоторые особенности механизмов окисления биологически значимых полиненасыщенных жирных кислот и их эфиров, окисления в мицеллах, мембранах, липопротеинах и так далее, поскольку олигодиены являются известными моделями фрагментов липидных мембран [7]. Кроме того, изучение механизма инициирования пероксидом водорода, одного из ряда кислородных метаболитов, имеет принципиальное значение для выявления причин, вызывающих окислительный стресс, генетическую мутацию и/или апоптоз [9]. Стоит отметить также, что образование радикалов при распаде H2O2 затрагивает фундаментальные вопросы теории радикальных пар и механизмов взаимодействия магнитного поля с биологическими системами [10–12].
Ранее с использованием меченых по углероду спиртов было показано, что фрагменты спиртов, содержащие гидроксильные группы, входят в состав олигомеров, получаемых в результате полимеризации [6]. Вместе с тем установлено, что H2O2 не распадается на радикалы при температурах полимеризации 373 K ни в чистом виде, ни в растворе изопропилового спирта (ИПС), в котором осуществляется промышленный процесс [13–16]. Известно, что скорость распада гидропероксидов возрастает в присутствии олефинов, при этом доказано, что данная реакция протекает по бимолекулярному механизму через образование комплекса с переносом заряда с π-связи олефина на атом водорода гидропероксида [7, 17, 18]. Образование такого комплекса и приводит к снижению эндотермичности процесса, а, следовательно, и энергии активации. Это позволяет сделать вывод, что реакция инициирования протекает с участием мономера. Вместе с тем, поскольку гидроксильная группа молекулы спирта способна к образованию водородной связи с H2O2, спирт с большой вероятностью также будет принимать участие в реакции инициирования. В этой связи авторами [4–6] была выдвинута гипотеза, что распад H2O2 протекает в тройном комплексе: мономер–инициатор–растворитель в клетке из молекул мономера и спирта, по следующей суммарной реакции:
Для проверки схемы были выполнены квантово-химические расчеты этого комплекса методом DFT B3LYP/6-31G(d) [19] в рамках анализа механизма инициирования радикальной полимеризации.
В настоящей работе данное исследование было продолжено с использованием метода DFT B3LYP/6-311G(d,p). Как показано авторами [20] на примере комплекса из двух молекул воды, использование функционала B3LYP с данным базисом является приемлемым компромиссом с точки зрения точности описания водородной связи и используемых компьютерных ресурсов. Его использование приводит к взаимной компенсации ошибок, вызванных с одной стороны недостаточностью количества базисных функций, а с другой стороны выбранным типом функционала.
Заметим, что наличие достаточно большого количества спирта в реакционной среде заметно повышает ее диэлектрическую постоянную. Поэтому для учета поляризации реакционного комплекса молекулами среды расчет проводили с использованием континуального приближения для внешней среды в рамках модели COSMO, предложенной авторами [21] и усовершенствованной в работе [22]. Позднее Klamt с сотр. на примере большой выборки нейтральных и ионизированных растворов сопоставили модель COSMO с более современной континуальной моделью среды IEF-PCM и пришли к заключению, что при правильном выборе параметризации разница между результатами вычислений в рамках обоих подходов не существенная [23].
В настоящей работе при вычислениях для значения диэлектрической постоянной среды было принято значение, рассчитанное по аддитивной функции на основании состава раствора и диэлектрических постоянных компонентов.
Цель работы – исследование различных вариантов конформаций реакционного комплекса и сравнение их для двух наиболее распространенных на практике типов мономеров: изопрена (ИП) и бутадиена (БД). Помимо оптимизации геометрии комплекса в рамках адиабатического приближения были изучены различные траектории реакции при значениях мультиплетности системы 1 и 3. Данные расчеты проводились для оценки возможности синглет-триплетной конверсии при распаде молекулы пероксида водорода, предположение о которой было сделано в работе [19].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В результате проведенных расчетов установлено, что существует не одна, как было показано ранее, а по крайней мере четыре устойчивых конформации комплекса, структуры и энергии образования которых аналогичны для обоих изученных мономеров. Расположение молекул в устойчивых конформациях комплекса с участием бутадиена показано на рис. 1, а комплекса с участием изопрена — на рис. 2. Как можно сделать вывод, расположение молекул реагентов в комплексах в основном определяется двумя видами взаимодействий: взаимодействием атомов водорода H2O2, несущими частичный положительный заряд с π-электронными облаками двойных связей мономера, и образованием водородных связей между гидроксильной группой спирта и атомами H2O2. В конформации 1 один из атомов водорода H2O2 взаимодействует с π-связью мономера, а водородная связь образуется между атомом водорода гидроксильной группы спирта и тем атомом кислорода H2O2, атом водорода которого принимает участие в π-комплексе. В конформации 2 водородная связь формируется между атомом водорода у второго атома кислорода H2O2 и атомом кислорода гидроксильной группы спирта. Конформация 4 отличается от конформации 1 лишь тем, что водородная связь в данном случае формируется не с тем атомом кислорода H2O2, который участвует в π-комплексе, а с другим.
Рис. 1.
Геометрические модели структур комплекса БД⋅⋅⋅H2O2⋅⋅⋅ИПС в конформациях с минимальной энергией. Номер на рисунке отвечает номеру конформации в табл. 1, 2.
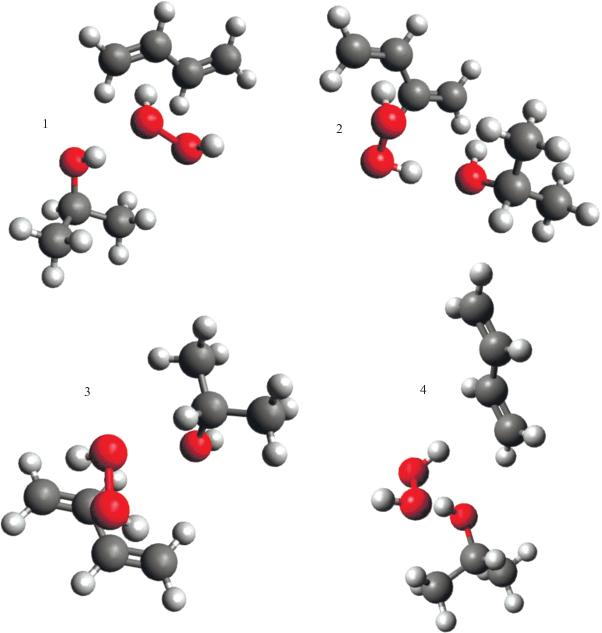
Рис. 2.
Геометрические модели структур комплекса ИП⋅⋅⋅H2O2⋅⋅⋅ИПС в конформациях с минимальной энергией. Номер на рисунке отвечает номеру конформации в табл. 1, 2.
От этих трех конформаций отличается конформация 3 тем, что в этом случае не один, а оба атома водорода H2O2 участвуют во взаимодействиях с обеими двойными связями мономера. При этом спирт взаимодействует с пероксидом не посредством гидроксильной группы, а за счет атома водорода у третичного атома углерода. Эта конформация ближе всего соответствует суммарной реакции (см. выше), предложенной авторами [4–6]. Укажем, однако, что не было учтено участие в π-комплексе одновременно двух атомов водорода H2O2 – по одному с каждой двойной связью. Все четыре рассмотренных конформации практически совпадают по структуре для обоих мономеров.
В табл. 1 представленные вычисленные значения энергии образования комплексов из исходных молекул (ΔE), вычисленной как разность энергии комплекса и суммы энергий изолированных молекул.
Таблица 1.
Энергии образования комплексов мономер⋅⋅⋅H2O2⋅⋅⋅ИПС из исходных молекул, ΔE, кДж/моль
| Мономер | Конформация | |||
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |
| БД | –49.9 | –63.0 | –42.5 | –51.6 |
| ИП | –49.7 | –63.9 | –44.8 | –42.2 |
Как видно из представленных данных, для всех четырех конформаций энергии образования комплекса имеют достаточно большие значения, что говорит о том, при температуре полимеризации комплексы находятся в значительной концентрации, так что распад H2O2 происходит в клетке, образуемой молекулой мономера и ИПС. Наибольшей абсолютной величиной ΔE характеризуется конформация 2, что, по-видимому, объясняется тем, что гидроксильная группа спирта помимо образования водородной связи с H2O2 частично принимает участие во взаимодействии с π-электроном второй двойной связи мономера посредством атома водорода, несущего положительный заряд. Значения ΔE для обоих мономеров для конформаций 1 и 2 почти совпадают, а для конформаций 3 и 4 различаются не слишком значительно, что позволяет сделать вывод, механизм распада инициатора в обоих мономерах один и тот же.
Распад инициатора в комплексе является термодинамически более выгодным, чем в газовой фазе. Так вычисленные значения изменения стандартной энергии Гиббса для представленной выше реакции при условии, что исходные вещества и продукты реакции находятся в состоянии идеального газа положительны и для бутадиена составляет 19.9 кДж/моль, а для изопрена 13.2 кДж/моль. В то же время для реакции в комплексе, как видно из данных, представленных в табл. 2, эти значения для всех четырех конформаций комплекса и для обоих мономеров отрицательны.
Таблица 2.
Изменение стандартной энергии Гиббса в результате реакции распада H2O2 в комплексе с мономером и ИПС с образованием алкильных радикалов и воды для различных конформаций комплекса, ΔG, кДж/моль
| Мономер | Конформация | |||
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |
| БД | –10.9 | –3.3 | –12.5 | –12.2 |
| ИП | –19.4 | –9.5 | –25.7 | –30.4 |
Для обоих мономеров наиболее термодинамически выгодными исходными конформациями комплекса являются конформации 3 и 4. Для изопрена в среднем реакция распада инициатора в комплексе является термодинамически более выгодной, чем для бутадиена, что объясняется большим выигрышем в энергии при присоединении гидроксильного радикала к двойной связи изопрена по сравнению с бутадиеном.
В табл. 3 приведены геометрические параметры молекулы H2O2 в изолированном состоянии и в комплексах в различных конформациях. Как видно, геометрические параметры в аналогичных конформациях в комплексах с ИП и БД почти совпадают, что согласуется с данными табл. 1 по энергиям образования комплексов в различных конформациях. Вместе с тем, можно отметить, что геометрические параметры H2O2 в комплексах существенно отличаются от их значений в свободном состоянии. В том числе достаточно сильными выглядят различия в расстояниях между атомами и двугранном угле H–O–O–H. Это свидетельствует о том, что молекула пероксида в комплексах находится в напряженном состоянии, что должно приводить к увеличению вероятности ее распада в реакционном комплексе по сравнению со свободным состоянием в газе. Этот вывод подтверждается также расчетом зависимостей энергии молекулы H2O2 от расстояния между атомами O…O при условной оптимизации геометрии молекулы и комплекса с фиксированными координатами данных атомов.
Таблица 3.
Геометрические параметры изолированной молекулы ПВ и в комплексах в различных конформациях
| Соединение, комплекс, конформация | Расстояние между атомами, м × 10–10 | Угол, град | |||
|---|---|---|---|---|---|
| O…H | O…O | H…H | H…O…O | H…O…O…H | |
| H2O2 | 0.966 | 1.454 | 2.435 | 100.1 | 120.2 |
| H2O2 + БД + ИПС, 1 | 0.975; 0.967 | 1.451 | 2.407 | 100.7 | 111.5 |
| H2O2 + БД + ИПС, 2 | 0.970; 0.981 | 1.452 | 2.353 | 100.8 | 102.8 |
| H2O2 + БД + ИПС, 3 | 0.970; 0.970 | 1.448 | 2.260 | 101.2 | 88.9 |
| H2O2 + БД + ИПС, 4 | 0.967; 0.975 | 1.453 | 2.454 | 100.2 | 120.0 |
| H2O2 + ИП + ИПС, 1 | 0.976; 0.967 | 1.451 | 2.415 | 100.6 | 112.9 |
| H2O2 + ИП + ИПС, 2 | 0.970; 0.981 | 1.452 | 2.355 | 100.8 | 103.1 |
| H2O2 + ИП + ИПС, 3 | 0.971; 0.971 | 1.448 | 2.260 | 101.3 | 88.6 |
| H2O2 + ИП + ИПС, 4 | 0.967; 0.975 | 1.453 | 2.455 | 101.3 | 120.3 |
В качестве примера на рис. 3 приведены такие зависимости для свободной молекулы H2O2 и молекулы в комплексе с БД в конформациях 2 и 3, которые отвечают, соответственно, самому меньшему и самому большему абсолютным значениям изменения энергии Гиббса при реакции распада H2O2 для данного комплекса, приведенных в табл. 2.
Рис. 3.
Зависимость энергии молекулы H2O2 от расстояния между атомами О⋅⋅⋅О: 1 – изолированная молекула; 2 – в комплексе БД⋅⋅⋅H2O2⋅⋅⋅ИПС в конформации 2; 3 – в комплексе БД⋅⋅⋅H2O2⋅⋅⋅ИПС в конформации 3.

Как видно, кривые зависимости энергии от расстояния для молекулы в комплексе проходят выше по сравнению с кривой для свободной молекулы, причем эта разница возрастает для конформации комплекса, характеризующейся большим абсолютным значением изменения свободной энергии Гиббса при реакции. Данная конформация, как отмечалось выше, ближе всего соответствует схеме комплекса предложенной авторами [10–12].
Таким образом, в ходе проведенных расчетов установлено, что молекула H2O2 в реакционном комплексе находится в относительно напряженном состоянии, что должно увеличивать вероятность ее распада. Вместе с тем величина этого напряжения по сравнению с энергией распада изолированной молекулы H2O2 не слишком велика, так что оно, хотя и вносит вклад в увеличение скорости распада, но этот вклад не является решающим фактором.
Отметим, что при рассмотрении влияния магнитного поля на кинетику фотоинициированной радикальной полимеризации механизм распада инициатора рассматривается весьма подробно (см., например, [24, 25]). При этом подчеркивается важная роль в механизме инициирования триплет-синглетной конверсии при распаде фотоинициатора в клетке. В работе [19], было высказано предположение, что обратный процесс синглет-триплетного перехода должен играть существенную роль и при термически активированном распаде инициатора. Существенная роль синглет-триплетной конверсии отмечается и в биологических системах, в частности при взаимодействии H2O2 с ДНК [10, 11]. В нормальных условиях для H2O2 триплетное состояние лежит существенно выше по энергии по сравнению с основным синглетным и синглет-триплетный переход запрещен по спину. Однако при увеличении расстояния между атомами O…O адиабатические термы синглетного и триплетного состояния начинают сближаться и при определенном значении расстояния пересекаются. Это означает, что для колебательно-возбужденных состояний молекулы H2O2 вероятность синглет-триплетного перехода возрастает. Радикальная пара, возникающая при поглощении молекулой инициатора кванта тепловой энергии, фактически представляет собой колебательно возбужденное состояние молекулы. В работе [24] отмечается, что вероятность триплет-синглетного перехода увеличивается с ростом вязкости среды, поскольку в этом случае увеличивается время существования радикальной пары. То же самое можно сказать и об обратном процессе синглет-триплетного перехода. В нашем случае вероятность его будет возрастать, поскольку распад радикальной пары происходит в реакционном комплексе при достаточно высоком уровне межмолекулярного взаимодействия.
Для того чтобы проанализировать роль возможной синглет-триплетной конверсии при распаде H2O2 в реакционном комплексе были рассчитаны зависимости энергии комплекса от расстояния между атомами O⋅⋅⋅O для двух значений полной мультиплетности системы mS, равных 1 (синглет) и 3 (триплет). При этом проводилась условная оптимизация геометрии системы при фиксированных координатах атомов кислорода. Для обоих типов мономеров были изучены комплексы в конформациях 2 и 3, рассмотренные выше. На рис. 4 приведены зависимости энергии комплекса с участием БД от расстояния между атомами О⋅⋅⋅О, а на рис. 5 – аналогичные кривые для комплексов с участием ИП.
Рис. 4.
Зависимость энергии комплексов БД⋅⋅⋅ H2O2⋅⋅⋅ИПС от расстояния между атомами О⋅⋅⋅О H2O2: 1, 1' – в конформации 2; 2, 2' – в конформации 3. 1, 2 mS = 1; 1', 2' mS = 3.

Рис. 5.
Зависимость энергии комплексов ИП⋅⋅⋅ H2O2⋅⋅⋅ИПС от расстояния между атомами О…О H2O2. 1, 1' – в конформации 2; 2, 2' – в конформации 3. 1, 2 mS = 1; 1', 2' mS = 3

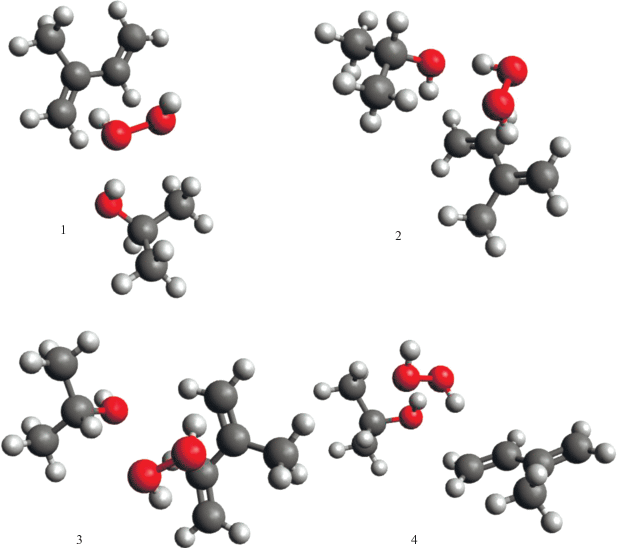
Как видно, для комплексов с mS, равным 1, вместо плавной кривой с насыщением, которая имеет место при растяжении связи О–О изолированной молекулы H2O2, во всех видах комплексов при достижении определенного расстояния между атомами О⋅⋅⋅О происходит резкий спад энергии, после которого энергия перестает существенно изменяться. Исследование геометрии систем после спада энергии показывает, что этот спад обусловлен протеканием химической реакции распада инициатора по молекулярному механизму без образования свободных радикалов. На рис. 6 приведены геометрические модели структур, образующихся в синглетных комплексах после протекания химической реакции. Как видно, направление реакции зависит как от типа мономера, так и от исходной конформации комплекса. Для комплекса с участием ПБ в конформации 2 продуктами реакции являются эпоксид и вода, в конформации 3 продуктом реакции является диол, получающийся при присоединении двух гидроксильных радикалов к двойной связи. Для комплекса с участием ИП в конформации 2 продуктом реакции является вода и альдегид, а в конформации 3 – вода и эпоксид.
Рис. 6.
Геометрические модели структур после реакций в результате распада ПВ в синглетных комплексах БД⋅⋅⋅H2O2⋅⋅⋅ИПС (1, 2) и ИП⋅⋅⋅H2O2⋅⋅⋅ИПС (3, 4). 1, 3 – в конформациях 2; 2, 4 – в конформациях 3.

Протекание этих реакций при распаде инициатора в реакционном комплексе в синглетном состоянии происходит самопроизвольно при достижении расстояния между атомами О⋅⋅⋅О некоторого критического значения. Это может привести к предположению, что в синглетной паре возможно диспропорционирование радикалов, приводящее к молекулярным продуктам, что резко снижает вероятность выхода радикалов из клетки. В реальном процессе этого не происходит: в невязких средах эффективность инициирования находится в пределах 0.5–0.7 [7, 13]. Можно представить себе две причины этого эффекта: быстрая, с диффузионной константой скорости рекомбинация части радикалов в клетке и синглет-триплетная конверсия. Действительно, как видно из графиков на рис. 4 и 5, пересечение триплетных и синглетных термов происходит раньше, чем кривые синглетных термов претерпевают излом со спадом. После синглет-триплетного перехода в клетке возникает радикальная пара c параллельными спинами и характер дальнейших превращений принципиально изменяется. На термах, отвечающих триплетному состоянию комплексов, также имеются изломы, связанные с протеканием реакций, но эти реакции протекают с сохранением полного спина, равного в данном случае 1, и результатом реакций являются не молекулярные продукты, а радикалы. На рис. 7 приведены геометрические модели структур, образующихся в комплексах после протекания химической реакции в триплетных комплексах.
Рис. 7.
Геометрические модели структур после реакций в результате распада ПВ в триплетных комплексах БД⋅⋅⋅H2O2⋅⋅⋅ИПС (1, 2) и ИП⋅⋅⋅H2O2⋅⋅⋅ИПС (3, 4). 1, 3 – в конформациях 2; 2, 4 – в конформациях 3.
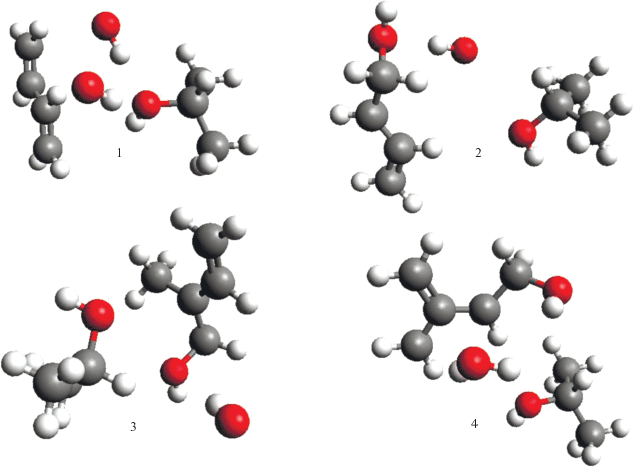
В случае комплекса с участием ПБ в конформации 2 видно, что образовавшиеся в результате распада H2O2 два гидроксильных радикала выходят из клетки, в конформации 3 один гидроксильный радикал присоединился к двойной связи мономера. Образовавшийся таким образом углерод-центрированный радикал, может явиться началом полимерной цепи. Второй гидроксильный радикал сориентирован на атом водорода у третичного углерода спирта, что позволяет предположить возможность последующего отрыва им этого атома водорода с образованием воды и третичного углерод-центрированного радикала для начала полимерной цепи. В комплексе с участием ИП в конформации 2 в результате реакции один из гидроксильных радикалов присоединяется к двойной связи ИП, а второй ●OH выходит из клетки. В конформации 3 в результате реакции один из радикалов присоединяется к концевому атому углерода мономера, а второй отрывает водород у метильной группы с образованием воды и углерод-центрированного радикала. Таким образом, при реализации синглет-триплетной конверсии в радикальной паре общий результат процесса соответствует наблюдаемым явлениям: радикалы или выходят в объем или присоединяются к мономеру в комплексе с формированием активного центра полимеризации.
ЗАКЛЮЧЕНИЕ
В результате квантово-химических вычислений найдены варианты структур реакционного инициирующего комплекса радикальной полимеризации диенов с гидроксильными группами. Показано, что существует, по крайней мере, 4 устойчивых конформации инициирующего комплекса, аналогичных по структуре как в случае бутадиена, так и изопрена. Показано, что молекула пероксида водорода в реакционном комплексе находится в относительно напряженном состоянии, что увеличивает вероятность ее распада. Расчет показал, что выходу радикалов в объем способствует синглет-триплетная конверсия. Наличие тройного комплекса с реакционноспообными π- и С–H-связями уменьшает время жизни гидроксильных радикалов, препятствует их обратной рекомбинации и увеличивает скорость инициирование. Последнее обстоятельство может иметь реальное практическое значение для регулирования скорости полимеризации. С другой стороны, найденная специфика может оказывать существенное влияние на скорость элементарного акта протекания биохимических реакций.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа выполнена при финансовой поддержке Российского научного фонда (грант 14-23-00018).
КОНФЛИКТ ИНТЕРЕСОВ Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.ИНФОРМАЦИЯ ОБ АВТОРАХ Соловьев Михаил Евгеньевич, д.ф.-м.н., профессор, ORCID – http://orcid.org/0000-0002-8840-248XБойко Виталий Петрович, к.х.н., с.н.с., ORCID – https://orcid.org/0000-0002-2837-1554Грищенко Владимир Константинович, к.х.н., в.н.с.Плисс Евгений Моисеевич, д.х.н, профессор, ORCID – https://orcid.org/0000-0002-3585-9064
Список литературы
Королев Г.В., Могилевич М.М. Трехмерная радикальная полимеризация. Сетчатые и гиперразветвленные полимеры. М.: Химиздат, 2006. 344 с.
Matyjaszewski K., Gnanou Y., Leibler L. Macromolecular Engineering. Precise Synthesis, Materials, Properties, Applications. Weinheim: Wiley-VCH, 2007. 2982 p.
Sutton George P. (eds.). Rocket Propulsion Elements. John Wiley & Sons. Inc., 2010. 760 p.
Гусев Ю.К., Глуховской В.С., Юдин В.П., Швецова Е.А. // Каучук и резина. 2009. № 2. С. 15.
Boiko V.P. // Polymer Science. Series A. 2005. T. 47. № 12. C. 1239.
Grishchenko V.K., Boiko V.P., Svistova E.I., Yatsimirs-kaya T.S., Valuev V.I., Dmitrieva T.S. // J. Appl. Polym. Sci. 1992. V. 46. № 12. P. 2081.
Denisov E.T., Afanas’ev I.B. Oxidation and Antioxidants in Organic Chemistry and Biology. Boca Raton (FL): CRC Press, 2005. 992 p.
Denisov E.T, Denisova T.G, Pokidova T.S. Handbook of Radicals Initiators. Wiley, New York, 2003. 850 p.
Yin H., Xu L., Porter A. // Chem. Rev. 2011. V. 111. P. 5944.
Hore P.J., Mouritsen H. // Annu. Rev. Biophys. 2016. V. 45. P. 299.
Hayashi H. Introduction to Dynamic Spin Chemistry: Magnetic Field Effects on Chemical and Biochemical Reactions. New Jersey: World Scientific, 2004. 268 p.
Pliss E.M., Grobov A. M., Kuzaev A.K., Buchachenko A.L. // Mendeleev Commun. 2017. V. 27. P. 246.
Борисов И.М., Газизова З.Ш., Лукша Р.С., Маркова Е.Л., Файзрахманов И.С. // Технология нефти и газа. 2015. № 3. С. 15.
Boiko V.P., Grishchenko V.K. // KGK – Kautschuk Gummi Kunststoffe. 2009. № 12. P. 546.
Файзрахманов И.С., Борисов И.М., Шаяхметова Г.Р., Хайрудинов И.Р. // Журн. прикл. хим. 2010. Т. 83. № 11. С. 1850.
Borisov I.M., Gazizova Z.S., Luksha R.S., Shayakhmetova G.R. // Biosciences Biotechnology Research Asia. 2014. V. 11. P. 1525.
Плисс Е.М., Яблонский О.П., Русаков А.И., Сирик А.В. Комплексообразование гидропероксидов в растворе. М.: Мир, 2008. 245 с.
Плисс Е.М., Русаков А.И., Мендкович А.С., Сирик А.В. Эффекты сольватации в жидкофазных реакциях нейтральных и отрицательно заряженных парамагнитных частиц. М.: Мир, 2012. 251 с.
Solov’ev M.E., Lyubimov D.V., Boiko V.P., Grishchenko V.K. // Theoretical and Experimental Chemistry. 2011. V. 47. № 3. P. 159.
Plumley J.A., Dannenberg J.J. // J. Comput. Chem. 2011. V. 32. № 8. P. 1519.
Klamt A., Schuurmann G. // J. Chem. Soc. Perkin Trans. 1993. V. 2. P. 799.
York D.M., Karplus M. // J. Phys. Chem. A. 1999. V. 103. P. 11060.
Klamt A., Moya C., Palomar J. // J. Chem. Theory Comput. 2015. V. 11. P. 4220.
Khudyakov I.V., Arsu N., Jockusch S., Turro J. // Designed Monomers and Polymers. 2003. V. 6. № 1. P. 91.
Rintoul I. // Processes – Open Access Chemical and Biological Process Engineering Journal. 2017. V. 5. № 2. P. 15.
Дополнительные материалы отсутствуют.


