Нефтехимия, 2020, T. 60, № 1, стр. 57-60
Инициированное и ингибированное окисление 1,1-дихлор-2-винил-2-метилциклопропана
А. В. Байбуртли 1, Г. З. Раскильдина 1, *, С. С. Злотский 1, Е. М. Плисс 2
1 Уфимский государственный нефтяной технический университет
450062 Башкортостан, Уфа, Россия
2 Ярославский государственный университет им. П.Г. Демидова
150003 Ярославль, Россия
* E-mail: graskildina444@mail.ru
Поступила в редакцию 03.09.2018
После доработки 05.08.2019
Принята к публикации 06.09.2019
Аннотация
Исследовано инициированное и ингибированное окисление 2-винил-2-метил-гем-дихлорциклопропана. Установлено, что в процессе окисления продолжение цепей происходит за счет присоединения полипероксидного радикала к двойной связи. По активности изученный мономер близок к метакриловым эфирам. Изучено ингибирующее влияние фенольных, аминных антиоксидантов и стабильных нитроксильных радикалов на радикально-цепное окисление 2-винил-2-метил-гем-дихлорциклопропана и показано, что амины и нитроксилы многократно обрывают цепи за счет регенерации ингибитора.
В последние годы разработаны селективные методы синтеза монокарбенированных промышленных диенов − винилциклопропанов и винил-гем-дихлорциклопропанов [1, 2]. Эти соединения находят применение в качестве мономеров и сомономеров в процессах радикальной полимеризации, алкилировании, изомеризации и др. [3, 4]. В этой связи представляло интерес изучить кинетику и механизм инициированного и ингибированного окисления наиболее доступного производного изопрена – 1,1-дихлор-2-винил-2-метилциклопропана, синтез которого описан нами ранее [1].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2-Метил-2-винил-гем-дихлорциклопропан (В-МДХЦП) получен и очищен по известной методике [1]. Использованы коммерчески доступные11 ингибиторы окисления: фенолы – 2,4,6-три-трет-бутилфенол (InHа), 2-карбокси-6-гидрокси-2,5,7,8-тетраметилбензохроман (InHb); ароматические амины – дифениламин (InHc), α-нафтиламин (InHd); стабильные нитроксильные радикалы (>NO•) – 2,2,6,6-тетраметил-4-оксипиперидин-1-оксил (NO•a), 2,2,6,6-тетраметил-4-оксопиперидин-1-оксил (NO•b).
Скорость поглощения кислорода измеряли с помощью компьютезированного высокочувствительного микроволюмометра, реакционный сосуд которого спроектирован таким образом, чтобы вводить в реакционную смесь дополнительные компоненты можно было в ходе опыта. Соответствующие экспериментальные методики описаны в работе [5].
За кинетической чистотой всех использованных субстратов и растворителя хлорбензола (ХБ) следили хроматографически с помощью высокоэффективного жидкостного хроматографа Flexar и газового хромато-масс-спектрометра Clarus 680T MS (оба фирмы PerkinElmer, США). Во всех случаях концентрация основного компонента в субстратах окисления была не ниже 99%. Для всех исходных реактивов концентрация пероксидных соединений не превышала 1 × 10–6 моль/л.
Дополнительно концентрацию пероксидных соединений контролировали иодометрическим титрованием и полярографически (полярограф LP-10).
В качестве инициатора использовали трижды перекристаллизованный из этанола азодиизобутиронитрил (АИБН). Скорость инициирования (Wi) определяли в анаэробной среде по скорости расходования стабильного нитроксильного радикала NO•a по соотношению Wi = [NO•a]/τind, где τind – время полного израсходования NO•a. За концентрацией NO•a следили методом спектроскопии ЭПР (спектрометр CMS 8400 X-диапазона, центр поля 3362 Гс, частота модуляции 100 кГц, амплитуда модуляции 2 Гс, ослабление микроволновой мощности 5 мВт).
Квантово-химические расчеты осуществляли в программе NWChem методом функционала плотности (DFT) в базисе cc‑pVDZ [6]
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Неингибированное окисление. Кинетика поглощения кислорода ВМДХЦП имеет линейный характер (рис. 1), при этом скорость инициированного окисления W0 не зависит от давления в диапазоне 20–100 кПа и прямо пропорциональна концентрации мономера и корню квадратному из скорости инициирования (см. рис. 1 и 2).
Рис. 1.
Кинетика поглощения кислорода окисляющимся ВМДХЦП (M) при 343 K; Wi = 1.1 × 10–7 (1), Wi = 1.1 × 10–8 моль/(л с) (2).

Рис. 2.
Зависимость скорости окисления (W0) мономера от ${{W}_{i}}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}$ (1) и его концентрации (2) в хлорбензоле (323 К, Wi = 3.3 × 10–7 моль/л с).

На низких глубинах превращенния (≤5%) хроматографический и иодометрический анализ гидропероксидных групп не обнаруживает ([ROOH] ≤ 1 × 10–5 моль/л). При этом [~MO–OM~] практически совпадает с количеством поглощенного кислорода: 2.11 и 1.95 × 10–2 моль/л соответственно; 343 K, Wi = 1.1 × 10–7 моль/л с.
Таким образом, на малых глубинах превращения (конверсия ВМДХЦП ≤ 1%) справедлив известный механизм процесса с продолжением цепей за счет присоединения полипероксидного радикала ${\text{MO}}_{2}^{\centerdot }$ к двойной связи [7] по схеме:
(i)
${\text{АИБН}}\xrightarrow{{{{{\text{O}}}_{2}},{\text{ M}}}}~{{{\text{M}}}^{\centerdot }}\,\,{\text{или}}\,\,{{{\text{R}}}^{ \bullet }},$Отсюда ${{W}_{0}} = {{k}_{2}}{{(2{{k}_{3}})}^{{--0.5}}}\left[ M \right]W_{i}^{{0.5}},$ где [M] – концентрация мономера, моль/л; k2 и k3 – константы скорости роста и обрыва цепи соответственно, л/моль с; Wi – скорость инициирования, моль/л с, что позволило определить значения параметра k2(2k3)–0.5 = 5.3 × 10–3 [л/(моль с)]0.5 при Т = 323 К. Близкие значения в ряду винильных мономеров известны для метакриловых эфиров, например, для хлорэтилметакрилата 5.1 × 10–3 [л/(моль с)]0.5) [8]. Отметим, что эта величина для стирола составляет 2.9 × 10–2 [л/(моль с)]0.5 [7].
Можно полагать, что прочности двойных связей в ВМДХЦП и акриловых эфирах близки. На это также указывают рассчитанные методом DFT B3LYP/6-31G* [6] энергии π-связей в ВМДХЦП: 104.4 кДж/моль и хлорэтилметакрилате 105.1 кДж/моль, тогда как эта величина для стирола равна 89.7 кДж/моль.
Ингибированное окисление. Кинетические кривые окисления ВМДХЦП для антиоксидантов разных классов вид зависимостей значительно различается. Для фенолов (рис. 3) наблюдается “классический” индукционный период: τэксп = = τтеор = f [InH]/Wi (где стехиометрический коэффициент ингибирования f = 2 [1]) с выходом после его окончания на скорость неингибированного окисления W0 (рис. 3). Отметим, что в этих условиях W не зависит от [O2] в диапазоне парциальных давлений кислорода 20–100 кПа.
Рис. 3.
Кинетика поглощения кислорода при окислении ВМДХЦП в присутствии InHa. [InHa] = 0 (1); 1.9 × 10–5 (2); 3.7 × 10–5 (3); 5.5 × 10–5 (4) моль/л, Wi = 1.4 × 10–7 моль/л с.

Эти факты свидетельствуют, что фенолы тормозят окисление по стандартным реакциям [7]:
(4.1)
$\begin{gathered} {\text{MO}}_{2}^{ \bullet } + {\text{InH}} \to \\ \to {\text{молекулярные}}\,\,{\text{продукты}} + {\text{I}}{{{\text{n}}}^{ \bullet }}, \\ \end{gathered} $(4.2)
${\text{MO}}_{2}^{ \bullet } + {\text{I}}{{{\text{n}}}^{ \bullet }} \to {\text{молекулярные}}\,\,{\text{продукты}}.$Иная ситуация реализуется для окисления в присутствии ароматических аминов и >NO•. Скорость поглощения кислорода в начальный период постоянна во времени (типичная зависимость представлена на рис. 4).
Рис. 4.
Кинетика поглощения кислорода при окислении ВМДХЦП в присутствии 104[ДФА] = 0 (1); 0.4 × 10–4 (2); 0.9 × 10–4 (3); 1.8 × 10–4 (4) моль/л, Wi = = 8.4 × 10–7 моль/л с.

Существенно, что в режиме линейного обрыва W в присутствии ароматических аминов практически не зависит от [O2] в диапазоне парциальных давлений кислорода 20–100 кПа. В этих же условиях W для >NO• при уменьшении [O2] падает в 1.5–2 раза.
В присутствии стабильных нитроксильных радикалов скорость окисления снижается в 1.5–2 раза при уменьшении концентрации О2. В соответствие с [7, 9] это указывает, что обрыв цепи осуществляется не только по реакции с ${\text{MO}}_{2}^{ \bullet }{\text{,}}$ но и за счет быстрой реакции углерод-центрированных радикалов M• со стабильными радикалами:
Для фенольных антиоксидантов IIа,b τэксп = τтеор, тогда как в присутствии аминов IIc и IId и нитроксилов IIe и IIf скорость окисления после окончания индукционного периода достаточно долго остается меньше W0 и τэксп > τтеор.
Из известных представлений о механизме ингибированного окисления [7, 10–12 ] следует, что эти антиоксиданты многократно обрывают цепи. На это указывают рассчитанные значения (табл. 1) кинетических коэффициентов ингибирования (ƒкин).
Таблица 1.
Значения кинетических коэффициентов ингибирования (ƒкин) для окисления ВМДХЦП в присутствии InH, 323 K
| InH | ƒкин |
|---|---|
 |
2.1 |
 |
1.9 |
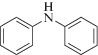 |
>5 |
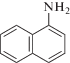 |
>5 |
 |
>8 |
 |
>9 |
Полученных экспериментальных данных явно недостаточно, чтобы объяснить причину регенерации. В качестве рабочей гипотезы можно предположить, что многократный обрыв осуществляется по реакции диспропорционирования пероксильного радикала субстрата ~OOCH2CH(OO•)X и >NO•, как доказано для метакриловых эфиров и стирола [9, 10]:
Загадочным остается пока и механизм регенерации ароматических аминов
Очевидно, что для столь сложного мономера, как ВМДХЦП требуется дополнительное углубленное кинетическое, квантово-химическое исследование и подробный анализ состава продуктов окисления. Подобная работа запланирована авторами.
Список литературы
Раскильдина Г.З., Борисова Ю.Г., Яныбин В.М., Злотский С.С. // Нефтехимия. 2017. Т. 57. № 2. С. 220.
Богомазова А.А., Михайлова Н.Н., Злотский С.С. Успехи химии гем-дигалогенциклопропанов. Саарбрюккен: LAP LAMBERT Academic Publishing, 2011. 89 с.
Брусенцова Е.А., Колесов С.В., Воробьева А.И., Злотский С.С., Хамидуллина А.Р., Муслухов Р.Р., Спирихин Л.В., Заиков Г.Е. // Журнал общей химии. 2008. Т. 78 (140). № 5. С. 783.
Брусенцова Е.А., Злотский С.С., Хамидуллина А.Р. // Известия ВУЗов. Химия и химическая технология. 2008. Т. 51. № 9. С. 106.
Loshadkin D., Roginsky V., Pliss E. // Int. J. Chem. Kinet. 2002. V. 34. P. 162.
Beke A.D. // Chem. Phys. 1993. V. 98. P. 5648.
Плисс Е.М., Злотский С.С., Сафиуллин Р.Л. / Ингибированное окисление непредельных соединений. Кинетика, механизм, связь структуры с реакционной способностью. LAP LAMBERT Academic Publishing GmbH & Co. KG, Saarbruchen, Germany, 2012. 130 с.
Lednev S., Sirick A., Pliss E., Rusakov A., Shvyrkova N., Ivanov A. // Reaction Kinetics, Mechanisms and Catalysis. 2015. V. 116. № 1. P. 43.
Pliss E.M., Tikhonov I.V., Rusakov A.I. Kinetics and Mechanism of Reactions of Aliphatic Stable Nitroxide Radicals in Chemical and Biological Chain Processes. In: Nitroxides – Theory, Experiment and Applications; Kokorin A.I., editor. InTech: Rijeka; 2012. Chapter 9. P. 263.
Pliss E.M., Soloviev M.E., Tikhonov I.V., Loshadkin D.V., Buchachenko A.L. // Russian Journal of Physical Chemistry B. 2016. V. 10. № 3. P. 417.
Denisov E. Afanas’ev I. Oxidation and Antioxidants in Organic Chemistry and Biology, CRC Press, 2005. 992 p.
Дополнительные материалы отсутствуют.


