Нефтехимия, 2020, T. 60, № 3, стр. 417-421
Особенности превращения пропана и его смеси с метаном в присутствии воды в барьерном разряде
А. Ю. Рябов 1, *, С. В. Кудряшов 1, А. Н. Очередько 1
1 Институт химии нефти СО РАН
634055 Томск, Россия
* E-mail: andrey@ipc.tsc.ru
Поступила в редакцию 14.10.2019
После доработки 03.11.2019
Принята к публикации 18.11.2019
Аннотация
Изучен процесс плазмохимической конверсии пропана и его смеси с метаном в присутствии воды в барьерном разряде. Продуктами обработки исходных смесей являются водород, газообразные углеводороды С1–С4 и жидкие алканы С5–С12 изомерного строения. Полученные закономерности объясняются особенностями протекания электронно-молекулярных реакций с участием молекул пропана, метана на стадии разрядного инициирования в условиях плазмы барьерного разряда.
Несмотря на внушительную историю исследований в области переработки углеводородных газов, интерес специалистов к поиску альтернативных методов конверсии углеводородов, в частности с использованием плазмохимии, только возрастает [1]. Применение электрических разрядов для стимулирования химических реакций привлекает возможностью получения сверхравновесной концентрации активных частиц (возбужденных молекул, атомов, радикалов, ионов) в объеме плазмы, благодаря чему реакции с высокой энергией активации протекают при комнатной температуре и атмосферном давлении без участия катализаторов [2].
Ранее авторами [3] предложен способ неокислительной конверсии метана в плазме барьерного разряда (БР) с образованием водорода, газообразных и жидких углеводородов. Существенным отличием полученных результатов от данных, опубликованных в работах по плазмохимическому превращению газообразных углеводородов [4–14], явилось создание условий проведения процесса, препятствующих формированию полимероподобного депозита на стенках реактора. Данный эффект достигнут добавкой воды в поток метана, что создает условия для эффективного вывода продуктов из разрядной зоны реактора.
В работе [15] авторами рассмотрен механизм образования газообразных продуктов превращения метана в БР в присутствии жидкой воды. Результаты математического моделирования кинетики реакции подтвердили основные выводы о механизме ее протекания. В частности, показано, что основная роль в образовании углеводородов С3+ принадлежит реакциям с участием СН2-радикала. Настоящая работа является логическим продолжением исследований, опубликованных в [3, 15].
В статье обсуждены особенности превращения пропана и его смесей с метаном в присутствии воды в БР, а также проведено сравнение с полученными ранее результатами для метана и смеси метан–вода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты проведены на лабораторной установке, общий вид которой показан в работе [3]. Вода, в виде жидкости, смешивается при комнатной температуре с потоком газообразных углеводородов в смесителе с помощью перистальтического насоса. Далее газожидкостная смесь направляется в плазмохимический реактор, где большая часть воды образует жидкий слой на поверхности электродов реактора. Пары воды совместно с углеводородными газами образуют реакционную смесь и подвергаются воздействию БР. После обработанная смесь разделяется на газовую и жидкую части и анализируется.
Плазмохимический реактор является разборной конструкцией коаксиального типа с одним диэлектрическим барьером. Зазор в разрядной зоне составляет 1 мм, ее длина 10 см, объем равен 7 см3. Во всех экспериментах амплитуда высоковольтных импульсов напряжения не превышала 7.2 кВ, частота их повторения 2 кГц. Активная мощность разряда составила ~ 9.6 Вт. Объемный расход реакционной смеси составлял 30 см3/мин, расход воды равнялся 0.1 см3/мин. В экспериментах использовался метан (99.99%, ОАО “Московский газоперерабатывающий завод”), пропан (99.95%, ООО “Чистые газы”, Новосибирск).
Анализ газообразных и жидких продуктов реакции проводили на газовом хроматографе HP 6890, оборудованном детектором по теплопроводности и пламенно-ионизационным детектором, а также с применением хромато-масс-спектрометра ThermoScientific DFS. Растворенные в воде углеводороды С5–С12 анализировали методом микроэкстракции, который в деталях описан в [16].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 приведен состав продуктов превращения пропана и его смесей с метаном в присутствии воды в БР в сравнении с полученными ранее результатами для метана и смеси метан–вода [3].
Таблица 1.
Конверсия и общий состав продуктов превращения метана, пропана и их смеси с парами воды. Для всех смесей [H2O] = 2 об. % и соответствует равновесной концентрации при 20°С
| Наименование | Содержание, % | |||
|---|---|---|---|---|
| СН4 [3] | СН4–Н2О [3] | C3H8–H2O | C3H8 (50%)–СН4–Н2О | |
| Н2 | 60.40 | 52.48 | 21.53 | 36.74 |
| CH4 | Не опр.*** | Не опр.*** | 15.02 | Не опр.*** |
| С2Н4 | 3.30 | 0.43 | 11.40 | 9.34 |
| C2H6 | 24.60 | 25.03 | 9.69 | 13.97 |
| C3H6 | 0.50 | 0.09 | – | – |
| С3Н8 | 7.80 | 4.76 | Не опр.*** | Не опр.*** |
| C4* | 2.60 | 2.86 | 5.99 | 5.16 |
| С5 | 0.60 | 1.64 | 4.98 | 6.13 |
| С6 | 0.20 | 2.87 | 5.28 | 4.60 |
| С7 | – | 2.89 | 3.52 | 3.93 |
| С8 | – | 3.17 | 8.75 | 8.42 |
| С9 | – | 2.33 | 8.07 | 6.81 |
| С10 | – | 1.29 | 3.82 | 4.00 |
| С12 | – | – | 1.94 | 0.90 |
| Конверсия, % | 9.7 | 9.5 | 10.3 | 5.1 (17.2)** |
Основными газообразными продуктами превращения чистого метана являются водород (~60%) и этан (~29%), образуются также алканы С3–С4 в количестве ~10%; на поверхности электродов реактора наблюдается образование депозита. Добавка воды в поток метана практически не оказывает влияния на его конверсию, но предотвращает образование депозита на поверхности электродов реактора, при этом в составе продуктов обнаружены жидкие углеводороды С5–С10 (14.2%). В случае превращения пропана набор продуктов практически остается прежним, но существенно изменяется состав послереакционной смеси: наблюдается снижение содержания водорода и рост селективности образования жидких углеводородов С5–С12 до ~36.4% для смеси пропан–вода.
Как и в случае превращения метана, жидкие углеводороды представлены в основном алканами изомерного строения. Добавка метана и воды к пропану не приводит к образованию новых продуктов реакции, изменяя только содержание веществ в смеси.
Величины конверсии метана и пропана с добавкой воды имеют близкие значения – 9.5 и 10.3%, соответственно. Конверсия углеводородов в смеси пропан–метан–вода изменяется разнонаправлено: для метана наблюдается снижение конверсии, а для пропана – увеличение. Объяснением данного факта являются различия в механизме превращения углеводородов на стадии разрядного инициирования реакции.
Инициирование химических превращений веществ в плазме БР происходит в результате электронно-молекулярных столкновений [2]. Анализ потерь энергии электронов при столкновениях с молекулами исходной газовой смеси позволяет оценить состав частиц, образовавшихся на стадии разрядного инициирования реакции, раскрыть особенности протекания плазмохимической реакции.
В табл. 2 приведены значения потерь энергии электронов БР в метане, пропане и их смеси с парами воды. Расчеты выполнены в программе Bol-sig+ [18 ] , сечения рассеяния электронов молекулами метана, воды и пропана взяты из базы данных [19].
Таблица 2.
Потери энергии электронов БР в различных смесях. Приведенная напряженность электрического поля (E/n) = 110 Td, [H2O] = 2 об. % и соответствует равновесной концентрации при 20°С
| Потери энергии, % | Метан | Метан–вода | Пропан–вода | Пропан (50%)–метан–вода | ||||
|---|---|---|---|---|---|---|---|---|
| СН4 | СН4 | Н2О | С3Н8 | Н2О | СН4 | С3Н8 | Н2О | |
| Колебательные состояния | 45.03 | 43.41 | 1.26 | 57.35 | 1.21 | 18.71 | 31.29 | 1.2 |
| Электронные состояния | 53.77 | 53.77 | 0.3 | 41.22 | 0.05 | 7.31 | 40.83 | 0.11 |
| Ионизация | 1.20 | 1.26 | 0.01 | 0.18 | 0 | 0.07 | 0.48 | 0 |
| Средняя энергия (εср.), эВ | 4.6 | 4.6 | 3.4 | 3.9 | ||||
Видно, что основные потери энергии электронов БР приходятся на возбуждение колебательных и электронных состояний молекул углеводородов, на процессы ионизации приходится менее 1.5%, добавка воды в исходную смесь не оказывает существенного влияния на распределение потерь энергии электронов.
Использование пропана в качестве плазмообразующего газа приводит к снижению средней энергии электронов БР с 4.6 эВ (метан, метан–вода) до 3.4 эВ (пропан–вода). Это связано с большим значением интегрального сечения рассеяния электронов молекулой пропана по сравнению с молекулой метана [20]. Несмотря на снижение значений εср, конверсия пропана в смеси с водой выше, чем в случае с метаном и составляет 10.3 об. % (табл. 1), что обусловлено более низкими пороговыми значениями энергии возбуждения электронных состояний молекулы пропана (6.72 эВ) в сравнении с метаном (9.0 эВ).
Особенности электронного строения молекулы пропана приводят к тому, что в смеси метан–пропан (50 об. %)–вода основные потери энергии электронов БР приходятся на возбуждение электронных состояний пропана (40.8%), что оказывает влияние на механизм образования продуктов реакции и подтверждается данными их группового состава (см. рисунок).
Рис. 1.
Групповой состав продуктов реакции в зависимости от начальной концентрации пропана в смеси пропан–метан–вода: ◻ – H2, ⚪ – алканы С2–С4, △ − этилен и пропилен, ◼ – алканы (С6–С12).
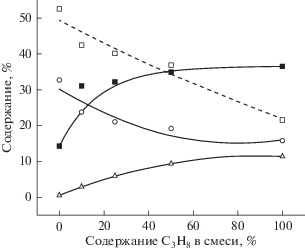
На рисунка видно, что увеличение начальной концентрации пропана в исходной смеси сопровождается ростом содержания газообразных олефинов и жидких углеводородов в продуктах реакции, противоположная тенденция наблюдается для молекулярного водорода и алканов С2–С4.
Для интерпретации полученных результатов рассмотрим некоторые электронно-молекулярные процессы, протекающие на стадии разрядного инициирования реакции.
Как показано в работе [20], в результате диссоциации электронно-возбужденной молекулы метана происходит образование частиц:
(1)
${\text{C}}{{{\text{H}}}_{4}} + \,{\text{e}} \to {\text{C}}{{{\text{H}}}_{3}}\,\, + \,\,{\text{H}} + {\text{e,}}\,\,{\text{76\% ,}}$(2)
${\text{C}}{{{\text{H}}}_{4}} + {\text{e}} \to {\text{C}}{{{\text{H}}}_{2}} + {{{\text{H}}}_{2}} + {\text{e,}}\,\,{\text{14}}{\text{.4\% ,}}$(3)
${\text{C}}{{{\text{H}}}_{4}} + {\text{e}} \to {\text{CH}} + {{{\text{H}}}_{2}} + {\text{H}} + {\text{e,}}\,\,{\text{7}}{\text{.3\% ,}}$(4)
${\text{C}}{{{\text{H}}}_{4}} + {\text{e}} \to {\text{C}} + {\text{2}}{{{\text{H}}}_{2}} + {\text{e,}}\,\,{\text{2}}{\text{.3\% }}{\text{.}}$Видно, что на стадии разрядного инициирования образуется достаточно много водорода, что хорошо согласуется с экспериментальными данными (табл. 1).
Диссоциация пропана [21 ] под действием электронного удара приводит к более широкому набору соединений:
(5)
${{{\text{C}}}_{3}}{{{\text{H}}}_{8}} + {\text{e}} \to {{{\text{C}}}_{3}}{{{\text{H}}}_{6}} + {{{\text{H}}}_{2}} + {\text{e,}}\,\,{\text{34\% ,}}$(6)
${{{\text{C}}}_{3}}{{{\text{H}}}_{8}} + {\text{e}} \to {{{\text{C}}}_{2}}{{{\text{H}}}_{4}} + {\text{C}}{{{\text{H}}}_{4}} + {\text{e,}}\,\,{\text{30\% ,}}$(7)
${{{\text{C}}}_{3}}{{{\text{H}}}_{8}} + {\text{e}} \to {{{\text{C}}}_{3}}{{{\text{H}}}_{7}} + {\text{H}} + {\text{e,}}\,\,{\text{22\% ,}}$(8)
${{{\text{C}}}_{3}}{{{\text{H}}}_{8}} + {\text{e}} \to {{{\text{C}}}_{3}}{{{\text{H}}}_{4}} + {\text{2}}{{{\text{H}}}_{2}} + {\text{e,}}\,\,{\text{7\% ,}}$(9)
${{{\text{C}}}_{3}}{{{\text{H}}}_{8}} + {\text{e}} \to {{{\text{C}}}_{2}}{{{\text{H}}}_{5}} + {\text{C}}{{{\text{H}}}_{3}} + {\text{e,}}\,\,{\text{4\% }}$(10)
${{{\text{C}}}_{3}}{{{\text{H}}}_{8}} + {\text{e}} \to {{{\text{C}}}_{2}}{{{\text{H}}}_{6}} + {\text{C}}{{{\text{H}}}_{2}} + {\text{e,}}\,\,{\text{3\% }}{\text{.}}$Водорода образуется значительно меньше (реакции (5), (8)). Кроме этого, наблюдается образование значительных количеств этилена (30%) и пропилена (34%) по реакциям (5), (6), что приведет к расходу атомарного водорода в реакциях их гидрирования, например:
(11)
${{{\text{C}}}_{2}}{{{\text{H}}}_{4}} + {\text{Н\;}} \to {\text{\;}}{{{\text{C}}}_{2}}{{{\text{H}}}_{5}}{\text{\;}}.$Приведенный набор реакций хорошо объясняет ход экспериментальных кривых, отражающих изменение концентраций водорода и газообразных олефинов на рисунке.
ЗАКЛЮЧЕНИЕ
Установлены закономерности превращения пропана и его смеси с метаном в присутствии воды в барьерном разряде. Применение воды позволяет избежать нежелательного образования депозита на поверхности электродов реактора. Основными продуктами превращения пропана и его смеси с метаном в присутствии воды являются водород и газообразные углеводороды С1–С4, также обнаружены жидкие углеводороды, представленные алканами С5–С12 изомерного строения. Установлено, что конверсия углеводородов в смеси пропан−метан−вода снижается для метана и увеличивается для пропана. С ростом концентрации пропана в исходной смеси увеличивается содержание газообразных олефинов и жидких углеводородов в продуктах реакции, содержание молекулярного водорода и алканов С2−С4 снижается, что объясняется кинетикой протекания реакций в плазме.
Список литературы
Puliyalil H., Lašič Jurković D., Dasireddy V.D.B.C., Likozar B. // RSCAdv. 2018. V. 8. № 48. P. 27481.
Fridman A. Plasma Chemistry. NY: Cembridge University Press, 2012. 979 p.
Kudryashov S.V., Ryabov A.Y., Ochered’ko A.N. // High Energ. Chem. 2017. V. 51. № 2. P. 128.
Scapinello M., Delikonstantis E., Stefanidis G.D. // Fuel. 2018. V. 222. P. 705.
SriBala G., Michiels D., Leys Ch., Geem K.M.V., Marin G.B., Nikiforov A. // J. Clean. Prod. 2019. V. 209. P. 655.
Jeon B., Park E.D., Kim Yu K. // Res. Chem. Intermed. 2018. V. 44. № 6. P. 3761.
Khoja A.H., Tahir M., Amin N.A.S. // Energy Convers. Manag. 2019. V. 183. P. 529.
Moshrefi M.M., Rashidi F. // Plasma Chem. Plasma Process. 2018. V. 38. № 3. P. 503.
Khadir N., Khodja K., Belasri A. // Plasma Sci. Technol. 2017. V. 19. № 9. P. 095502.
Lim M.S., Chun Y.N. // Plasma Chem. Plasma Process. 2016. V. 36. № 5. P. 1211.
Indarto A., Coowanitwong N., Choi J.-W., Lee H., Song H.K. // Fuel Process. Technol. 2008. V. 89. № 2. P. 214.
Shapoval V., Marotta E. // Plasma Process. Polym. 2015. V. 12. № 8. P. 808.
Kadoa S., Sekine Y., Nozaki T., Okazaki K. // Catal. Today. 2004. V. 89. № 1–2. P. 47.
Dors M., Nowakowska H., Jasiński M., Mizeraczyk J. // Plasma Chem. Plasma Process. 2014. V. 34. № 2. P. 313.
Kudryashov S.V., Ryabov A.Y., Ochered’ko A.N. // High Energ. Chem. 2018. V. 52. № 2. P. 167.
Il’ina A.A., Ryabov A.Yu., Chuikin A.V., Velikov A.A. // J. Anal. Chem. 2015. V. 70. № 2. P. 125.
Robertson J. // Mater. Sci. Eng. R Reports. 2002. V. 37. № 4–6. P. 129.
Hagelaar G.J.M., Pitchford L.C. // Plasma Sources Sci. Technol. 2005. V. 14. № 4. P. 722.
Viehland database. http://www.lxcat.net.
Janev R.K., Reiter D. // Phys. Plasmas. 2002. V. 9. № 9. P. 4071.
Janev R.K., Reiter D. // Phys. Plasmas. 2004. V. 11. P. 780.
Дополнительные материалы отсутствуют.


