Нефтехимия, 2020, T. 60, № 3, стр. 353-361
Кинетические модели процесса Клауса в присутствии алюминиевых и титановых катализаторов, основанные на экспериментальных данных
Sepehr Sadighi 1, 2, *, Seyed Reza Seif Mohaddecy 1, 2, Mehdi Rashidzadeh 1, 2, Parisa Nouriasl 3
1 Catalysis Development Technologies Division, Research Institute of Petroleum Industry (RIPI)
P.O. Box 1485733111 Tehran, West Side of Azadi Complex, Iran
2 Gas Processing Institute (GPI), Research Institute of Petroleum Industry (RIPI)
P.O. Box 1485733111 Tehran, West Side of Azadi Complex, Iran
3 Research & Technology Development Department, National Iranian Gas Company (NIGC),
Keshavarz Blvd.
P.O. Box 1416613631 Tehran, Naderi St., No. 4, Iran
* E-mail: sadighis@ripi.ir
Поступила в редакцию 13.02.2019
После доработки 19.08.2019
Принята к публикации 18.11.2019
Аннотация
Каталитическая секция процесса Клауса имеет большое значение для получения серы и уменьшения выбросов H2S в окружающую среду. В данной работе эксперименты проводились на лабораторной установке при различных значениях потоков газа и температурах. В качестве катализаторов процесса были использованы применяемые в промышленности оксид алюминия (Al2O3) и диоксид титана (TiO2). Состав исходного газа и условия протекания процесса подобраны на основании данныхс предприятия. На основании полученных данных была построена кинетическая модель для лабораторного изотермического реактора и определены ее кинетические параметры. Показано, что степень превращения H2S и CS2 может быть предсказана со средним абсолютным отклонением ($\bar {\Delta }$) 9.86 и 30.3% для реакции в присутствии Al2O3 и 15.31 и 4.22% при катализе диоксидом титана.
Из-за жестких экологических норм выбросы таких токсичных соединений, как H2S, SO2 и CS2 в атмосферу должны строго контролироваться. На промышленных объектах эти правила особенно строги в отношении H2S, который является высокотоксичным и коррозионноактивным газом. При воздействии на живых существ даже в небольших количествах он может разрушать центральную нервную систему [1, 2]. Модифицированная установка извлечения серы (УИС) широко используется для преобразования H2S, присутствующего в выхлопных газах, поступающих с заводов по переработке природного газа, нефтеперерабатывающих заводов, нефтехимических установок и отраслей газификации угля, в элементарную серу [3, 4]. Данный процесс состоит из термической и каталитической секций, что способствует протеканию целевых реакций. В качестве катализаторов на УИС используются широкодоступный активированный оксид алюминия (например, CR3S, производимый компанией Axens и S-2001 компании UOP) и TiO2 (например, CRS31 от Axens и S-7001 от UOP). Каталитическая секция может состоять как из слоя катализатора одного вида, так и из нескольких, различающихся в зависимости от требуемой производительности [5]. В данном процессе H2S и CS2 превращаются в элементарную серу и другие соединения по следующим уравнениям реакций [6]:
(1)
$2{{{\text{H}}}_{2}}{\text{S}} + {\text{S}}{{{\text{O}}}_{2}} \leftrightarrow 2{{{\text{H}}}_{{\text{2}}}}{\text{O}} + \frac{3}{n}{{{\text{S}}}_{n}},$(2)
${\text{C}}{{{\text{S}}}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{S}} + {\text{C}}{{{\text{O}}}_{2}},$(3)
${\text{C}}{{{\text{S}}}_{{\text{2}}}} + {\text{S}}{{{\text{O}}}_{{\text{2}}}} \to {\text{C}}{{{\text{O}}}_{{\text{2}}}} + \frac{3}{n}{{{\text{S}}}_{n}}.$Исходя из указанных соображений, необходимо разработать надежную и достоверную модель для определения недостающих параметров работы УИС [7]. Кроме того, такие модели могут быть полезны для математического описания процесса Клауса и его модификации с целью увеличения производительности [8]. Опубликовано большое количество работ, посвященных построению кинетической модели термической секции (реакционной печи) процесса Клауса [9–14]. В то же время число публикаций, касающихся кинетического моделирования каталитической секции процесса (конвертера) на основании экспериментальных данных, полученных на лабораторных или стендовых установках, значительно меньше. Причем во всех работах, опубликованных к настоящему времени, рассматриваются только катализаторы на основе Al2O3. Так, Kerr R.K. с соавт. [15–17] разработали кинетическую модель для изучения и предсказания дезактивации глинозема и боксита, используемых в качестве катализаторов. В этой модели были рассмотрены уравнение степенного закона для реакции между H2S и SO2 (основная реакция процесса Клауса), а также гидролиз COS и CS2. Эксперименты были выполнены в изотермическом реакторе лабораторного масштаба; полученная модель адекватно описывает поведение катализатора при различных температурах (от 230 до 300°С). Besher E.M. [18] изучил кинетику процесса Клауса в присутствии Al2O3 и показал невозможность установления термодинамического равновесия в реакторах Клауса. Gemmingen U. c соавт. [19] смоделировали Clinsulf® процесс компании Линде. При этом они рассмотрели только основную реакцию Клауса и гидролиз COS. Все необходимые параметры предложенной кинетической модели были рассчитаны на основании химического равновесия каждой реакции согласно закону сохранения масс и зависимости констант равновесия от температуры. Mondioroz S. с соавт. [20] исследовали окисление H2S на γ-Al2O3 при низких температурах (100−200°C) и обнаружили, что экспериментальные данные с высокой точностью могут быть описаны кинетическим уравнением Ленгмюра. Zagoruiko A.N. с соавт. [21] представили математическую модель, отвечающую работе промышленного реактора УИС. В данной работе была рассмотрена только основная реакция Клауса, а соответствующие константы получены из литературных источников. Abedini R. с соавт. [22] разработали модель для быстрой оценки серосодержащих продуктов в каталитическом слое процесса Клауса, в которой была учтена только основная реакция Клауса. Nabikandi N.J. с соавт. [23] предложили кинетическую модель промышленной УИС, в которой рассматривалась основная реакция Клауса, а также гидролиз CS2 и COS. Согласно общепринятому мнению, сера, образующаяся в процессе Клауса, состоит из 6 атомов. Было установлено, что кинетическое моделирование является более надежным способом описания, чем термодинамический подход (основанный на уменьшении энергии Гиббса). Ghahraloud H. с соавт. [24] получил модель промышленного процесса Клауса с использованием кинетических параметров, представленных в литературе для Al2O3, используемого в качестве катализатора. Они пришли к выводу, что данная модель может достаточно точно предсказывать скорость и температуру потоков на выходе из реактора Клауса; как следствие, она может быть использована для оптимизации процесса. Более того, в следующей работе авторы обратились к той же модели для уменьшения выбросов серы с УИС путем замены адиабатических конверторов на изотермические реакторы [25]. В итоге результаты моделирования показали, что данная стратегия действительно позволяет увеличить степень превращения H2S на 1.87% по сравнению с классическим процессом Клауса. Относительно недавно Khanaev V.M. с коллегами [26] провел лабораторное исследование различных катализаторов на основе оксида алюминия и разработал кинетическую модель, включающую одну единственную реакцию Клауса (уравнение (1)). Они обнаружили, что скорость дезактивации данного типа катализаторов сильно зависит от количества макро- и микропор, которое неодинаково для катализаторов, полученных из различных источников или синтезированных в лаборатории.Поэтому в особых случаях скорость дезактивации должна быть учтена в кинетическом уравнении для построения точной и надежной модели.
Цель данного исследования – разработка кинетической модели с учетом всех возможных реакций для катализаторов из Al2O3 и TiO2, используемых в каталитической секции (конверторах) промышленных УИС. Соответствующие кинетические параметры были оценены и подтверждены экспериментальными данными, полученными на стендовой установке с использованием промышленных катализаторов и в условиях, соответствующих реальным условиям эксплуатации установки Клауса. В связи с малым количеством экспериментальных данных и кинетических параметров для катализаторов процесса Клауса, особенно для катализаторов из TiO2, в литературе, доступной широкому кругу читателей, эта работа имеет высокую значимость.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
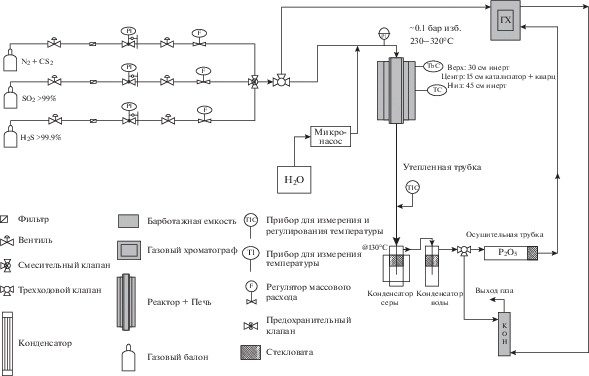
Оборудование. Эксперименты выполнены на стендовой установке, которая была спроектирована и изготовлена Научно-исследовательским институтом нефтяной промышленности (RIPI) с целью изучения реакций, протекающих в каталитической секции процесса Клауса. Технологическая схема установки представлена на рис. 1. Реактор представляет собой трубку диаметром 16 мм и длиной 2160 мм. Как для Al2O3, так и для TiO2, верхний слой (длиной 30 мм) состоит из шарикового α-Al2O3, который является инертным в данном процессе и служит для усреднения скорости и температуры потока. Средний слой представлен смесью, состоящей из равных объемов катализатора и кварца; остальной объем также заполнен частицами α-Al2O3. Характеристики катализаторов Клауса, изученных в данном исследовании, представлены в табл. 1.
Таблица 1.
Характеристики изучаемых катализаторов
| Свойство | Единицы измерений | Al2O3 | TiO2 |
|---|---|---|---|
| Цвет | – | Белый | Белый |
| Форма | – | Гранула | Шарик |
| Размер | мм | 3−6 | 3−4 |
| Плотность | кг/м3 | 680 | 980 |
| Прочность | Н/см | >12 | >70 |
| Удельная поверхность | м2/г | 300−400 | >100 |
Температура вдоль каталитического слоя регулируется с помощью пяти приборов, измеряющих и контролирующих температуру (TIC). Кроме того, для анализа состава сырья и продуктов (а именно N2, H2S, SO2 и CS2) в систему был встроен газовый хроматограф, в котором в качестве газа-носителя использовался гелий. Состав сырья стендовой установки поддерживался на уровне, соответствующем составу промышленного сырья, с помощью регуляторов массового расхода и микро-насоса для подачи воды. Однако из-за ограничений в системе анализа газов карбонилсульфид (COS) и сероуглерод (CS2) объединены в одно вещество, а именно CS2. Поскольку в промышленном реакторе первый каталитический слой заполнен Al2O3, состав сырья в стендовой установке при использовании данного катализатора соответствовал реальному составу газа на предприятии. В то же время состав входящего газа для TiO2 должен соответствовать составу газа, выходящего после слоя, заполненного Al2O3. С учетом вышесказанного состав сырья был подобран для каждого катализатора в отдельности, как показано в табл. 2.
Таблица 2.
Состав сырья, используемого при испытании Al2O3и TiO2 на стендовой установке
| Соединение, мольн. % | Al2O3 | TiO2 |
|---|---|---|
| CS2 + COS | 2.05 | 1.2 |
| H2O | 25.24 | 25.2 |
| H2S | 3.61 | 1.6 |
| SO2 | 2.86 | 1.1 |
| N2 | Остальное | Остальное |
Методическая часть. В реакторе промышленного масштаба каталитическая секция состоит из слоя катализатора Al2O3, находящегося в верхней части, и слоя TiO2, расположенного под слоем Al2O3. Отношение объемов катализаторов Al2O3 и TiO2 приближенно равно двум. Поскольку температура газа на входе в реактор Клауса составляет 235°С и повышается по мере прохождения через слои вследствие экзотермичности процесса, эксперименты для Al2O3 проводились при трех различных температурах (а именно 235, 260 и 280°С). Кроме того, реакция проводилась при трех значениях газовой часовой объемной скорости потока (GHSV, ч−1 ) (а именно 800, 1000 и 1200 ч–1). В итоге было получено девять точек, необходимых для определения кинетики процесса Клауса, протекающего в присутствии Al2O3. Кроме того для определения точности изотермической модели был проведен дополнительный эксперимент при температуре 250°С (средняя температура данного слоя) и GHSV, равной фактической скорости газа в условиях промышленного производства – 1000 ч–1.
По тем же причинам эксперименты с TiO2, который располагается после Al2O3, были выполнены при трех температурах (285, 300 и 310°С) и трех GHSV (1800, 2100 и 2400 ч–1). Было получено также девять точек. Помимо этого, для проверки полученной модели был проведен еще один эксперимент при реальной GHSV (2100 ч–1) и температуре, зафиксированной на уровне 305°С. Для изучения влияния парциального давления компонентов на степень превращения H2S и CS2 в присутствии катализатора из TiO2 состав сырья был изменен в соответствии с составом газа, используемого в литературе [27] для оценки эффективности катализатора (H2S = 6, SO2 = 4, CS2 = 1, H2O = 30 мольн. % и балансовое количество N2). Эта часть работы (эксперименты названы 2100E ч–1) была проведена при объемной скорости потока 2100 ч–1 и трех различных температурах (285, 300 и 310°С).
РАЗРАБОТКА КИНЕТИЧЕСКОЙ МОДЕЛИ
Используемые обозначения
| $\bar {\Delta },\% $ | Среднее абсолютное отклонение, % |
| Ci | Концентрация компонента i, кмоль м–3 |
| Ei | Энергия активации i реакции, ккал моль–1 |
| K5 | Константа адсорбции в основной реакции Клауса |
| k0i | Предэкспоненциальный множитель i реакции |
| ki | Константа скорости i реакции |
| Kp | Константа равновесия реакции Клауса |
| mf | Массовый расход, кг ч–1 |
| σ | Среднеквадратичное отклонение |
| nsi | Порядок реакции |
| Nt | Количество экспериментальных точек |
| Pi | Парциальное давление, атм |
| Q | Объемный расход газа, м3 ч–1 |
| ri | Скорость реакции i компонента |
| Rg | Газовая постоянная, ккал моль−1 К−1 |
| Ri | Суммарная скорость реакции всех компонентов |
| СКО | Сумма квадратов ошибок |
| T | Температура реакции, K |
| tr | Время реакции, ч |
| V | Объем каталитического слоя, см3 |
| xm,i | Массовая доля i компонента |
| $x_{{nj}}^{{{\text{изм}}}}$ | Мольная доля j компонента, полученная из эксперимента |
| $x_{{nj}}^{{{\text{модель}}}}$ | Мольная доля j компонента, рассчитанная по модели |
| ρi | Плотность i компонента, кг м–3 |
| $\partial V$ | Элементарный объем каталитического слоя, см3 |
| ${{\rho }_{{{\text{ave}}}}}$ | Средняя плотность при температуре реакции, кг м–3 |
Для разработки модели стендовой установки Клауса предполагаются следующие допущения:
– режим движения потока через каталитический слой является поршневым;
– активность катализаторов Клауса существенно не изменяется в ходе экспериментов, и поэтому модель справедлива только для условий запуска;
– температура в реакторе постоянна и не изменяется по длине;
– из-за высокой температуры и низкого давления сырье и продукт ведут себя как идеальные газы.
– выражение скорости реакции Клауса (уравнение (1)) соответствует Ленгмюровскому типу [21], другие реакции (уравнения (2) и (3)) являются уравнениями первого порядка.
Поэтому константы скорости могут быть записаны следующим образом:
Прямое направление реакции Клауса:
(4)
${{r}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}}(1) = - {{k}_{1}}\frac{{{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}}C_{{{\text{S}}{{{\text{O}}}_{{\text{2}}}}}}^{{0.5}}}}{{{{{(1 + {{K}_{5}}{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}})}}^{2}}}}.$Обратное направление реакции Клауса:
(5)
${{r}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}(1) = - {{k}_{2}}{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}C_{{{\text{s}}n}}^{{n{\text{s}}1}}.$Скорость расходования CS2 по второй и третьей реакциям:
(6)
${{r}_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}}(2) = - {{k}_{3}}C_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}^{{0.5}}{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}},$(7)
${{r}_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}}(3) = - {{k}_{4}}{{C}_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}}{{C}_{{{\text{S}}{{{\text{O}}}_{{\text{2}}}}}}}.$Кроме того, кинетические константы модели могут быть выражены следующим образом:
Константа равновесия (Кр) основной реакции Клауса вычисляется по следующему выражению [21]:
Рассматривая бесконечно малый объем катализатора внутри реактора, уравнение сохранения массы, основанное на упомянутых предположениях, может быть выражено как:
(13)
${{\left. {Q{{C}_{i}}} \right|}_{{V + dV}}} - {{\left. {Q{{C}_{i}}} \right|}_{V}} \pm {{R}_{i}}\partial V = \frac{{\partial (\partial V{{C}_{i}})}}{{\partial {{t}_{r}}}}.$В конечном итоге это уравнение можно переформулировать следующим образом:
(14)
$\frac{{\partial {{C}_{i}}}}{{\partial V}} = \frac{{{{R}_{i}}{{\rho }_{{{\text{ave}}}}}}}{{{{m}_{f}}}},$(16)
$\frac{{\partial {{P}_{i}}}}{{\partial V}} = {{R}_{g}}T\left( {\frac{{{{R}_{i}}{{\rho }_{{{\text{ave}}}}}}}{{{{m}_{f}}}}} \right).$В уравнении (16) Ri – это скорость реакции каждого компонента (CS2, H2O, SO2, H2S, N2 и S), которая может быть выражена следующим образом:
(17)
${{R}_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}} = {{r}_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}}(2) + {{r}_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}}(3),$(18)
${{R}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} = + 2{{r}_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}}(2) - {{r}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}}\,\,(1) + {{r}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}\,\,(1),$(19)
${{R}_{{{\text{S}}{{{\text{O}}}_{{\text{2}}}}}}} = + {{r}_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}}(3) + 0.5{{r}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}}\,\,(1) - 0.5{{r}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}\,\,(1),$(20)
${{R}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}} = - 2{{r}_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}}(2) + {{r}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}}}}(1) - {{r}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}\,\,(1),$(22)
${{R}_{{\text{S}}}} = - \frac{3}{n}{{r}_{{{\text{C}}{{{\text{S}}}_{{\text{2}}}}}}}(3) - \frac{{1.5}}{n}{{r}_{{{{{\text{H}}}_{{\text{2}}}}{\text{S}}\,\,}}}(1) + \frac{{1.5}}{n}{{r}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}\,\,(1),$(23)
${{R}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}} = - {{r}_{{{\text{C}}{{S}_{2}}}}}(2) - {{r}_{{{\text{C}}{{{\text{S}}}_{2}}}}}(3).$Решение и оценка модели процесса Клауса. Для нахождения кинетических параметров предложенной модели уравнения (4)−(23) были внесены в программный пакет MATLAB (MathWorks, 2013). После построения модели для корректировки полученных параметров кинетического уравнения с использованием экспериментальных данных сумма квадратов отклонений (СКО) минимизируется следующим образом:
(24)
${\text{СКО}} = \sum\limits_{n = {\text{1}}}^{{{{\text{N}}}_{{\text{t}}}}} {\sum\limits_{j = {\text{C}}{{{\text{S}}}_{{\text{2}}}}}^{{{{\text{H}}}_{{\text{2}}}}{\text{S}}} {(x_{{nj}}^{{{\text{изм}}}}} - x_{{nj}}^{{{\text{модель}}}})} .$Для оценки точности модели были рассчитаны среднее абсолютное отклонение ($\bar {\Delta }$) и среднеквадратичное отклонение (σ) по уравнениям (25) и (26) соответственно.
(25)
$\bar {\Delta }\,{\text{(\% )}} = \frac{{\sum\limits_{n = {\text{1}}}^{{{{\text{N}}}_{{\text{t}}}}} {\sum\limits_{j = {\text{C}}{{{\text{S}}}_{{\text{2}}}}}^{{{{\text{H}}}_{{\text{2}}}}{\text{S}}} {\sqrt {\frac{{{{{(x_{{nj}}^{{{\text{изм}}}} - x_{{nj}}^{{{\text{модель}}}})}}^{2}}}}{{x_{{nj}}^{{{\text{изм2}}}}}}} } } }}{{{{N}_{t}}}} \times 100,$РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
На рис. 2 изображена зависимость конверсии H2S от температуры процесса и GHSV на катализе Al2O3. Как можно увидеть, повышение температуры и объемной скорости (до 800 и 1000 ч–1) приводит к уменьшению степени превращения H2S, что обусловлено сокращением времени пребывания газа в реакторе и экзотермической природой конверсии H2S. Однако из рис. 2 также видно, что при GHSV 1200 ч–1 конверсия H2S растет с увеличением температуры. Данное явление может быть связано со следующими причинами:
а) при проведении исследования дезактивация катализатора недопустима. Таким образом, снижение его активности приводит к возрастанию ошибки эксперимента. Согласно графику проведения испытаний, (повышение температуры до заданной и установление объемной скорости потока) данные, получаемые при 280°С, регистрировались через 10 ч после запуска установки, что увеличивает вероятность ошибки эксперимента вследствие дезактивации катализатора. Данный феномен будет обсуждаться далее;
б) согласно литературным данным активность катализаторов Клауса сильно зависит от количества макропор. Производительность катализаторов резко снижается при закупоривании пор и блокировке активных центров вследствие конденсации серы [26]. Считается, что повышение GHSV приводит к увеличению критерия Рейнольдса потока в каталитическом слое, что приводит к уносу элементарной серы из пор из-за возрастания коэффициента массоотдачи. Кроме того, повышение температуры способствует испарению серы с поверхности, а значит и уменьшению количества серы, сконденсированной и адсорбированной на активных центрах [21, 28]. Следовательно, освобождение активных центров от сконденсировавшейся серы при GHSV 1200 ч–1, обусловленное лучшей испаряемостью и десорбцией жидкой серы при повышенных температурах, является основной причиной увеличения степени превращения H2S, несмотря на уменьшение времени контакта.
На рис. 3 представлено изменение степени превращения CS2 при различных температурах и GHSV. Можно заметить, что увеличение потока сырья приводит к уменьшению конверсии CS2 вследствие снижения времени контакта. Помимо этого, на графике наблюдается рост степени превращения при увеличении температуры, что обуславливается высокой активностью катализатора в реакциях преобразования CS2 при повышенных температурах. Можно сделать вывод, что в этой серии экспериментов катализатор демонстрирует незначительную потерю активности при превращении CS2, а высокая температура предотвращает дезактивацию катализатора. Однако при 280°С и GHSV 1000 ч–1 интенсивность гидролиза CS2 незначительно уменьшается по сравнению с экспериментом, проведенным при 260°С. Мы предполагаем, что при 1000 ч–1 из-за увеличения скорости потока и, как следствие, роста производительности по элементарной сере, активные центры блокируются и дальнейшее повышение температуры уже не способствует увеличению скорости гидролиза. Но, как было сказано ранее, увеличение GHSV до 1200 ч–1 приводит к удалению серы из пор и с активных центров, поэтому на графике наблюдается резкое увеличение степени превращения CS2 с увеличением температуры.
Из результатов РФА серы, полученной при протекании реакции, катализируемой Al2O3, определено, что ее молекула состоит из 8 атомов. Таким образом, стехиометрический коэффициент при сере в кинетической модели (уравнения (1) и (2)) равен восьми.
На основании полученных результатов были определены кинетические параметры модели (табл. 3). После нахождения этих коэффициентов сопоставили расчетные значения конверсии H2S и CS2 с экспериментальными данными и определили среднее абсолютное отклонение ($\bar {\Delta }$) и среднеквадратичное отклонение (σ), которые представлены в табл. 4. Установлено, что модель с удовлетворительной точностью может предсказывать скорость превращения CS2 и H2S. Неточность в расчете конверсии H2S обусловлена вышеупомянутыми причинами (а и б). Несмотря на низкое значение σ, можно ожидать, что модель будет верно предсказывать степень превращения компонентов только при запуске установки.
Таблица 3.
Кинетические параметры, рассчитанные для промышленных катализаторов из Al2O3 и TiO2
| Кинетический параметр | Al2O3 | TiO2 |
|---|---|---|
| k01, м3/(см3 кат. ч кмоль0.5) | 1.36E-7 | 15.94E5 |
| E1, ккал/моль | 7.64 | 25.05 |
| k03, м3/(см3 кат. ч кмоль0.5) | 123.17E3 | 97.49E3 |
| E3, ккал/моль | 12.12 | 8.68 |
| k04, м3/(см3 кат. ч кмоль0.5) | 29.13 | 16.81 |
| E4, ккал/моль | 3.5 | 3.5 |
| K5 | 87.05 | 218.69 |
| ns1 | 0 | 0 |
Таблица 4.
$\bar {\Delta },\% $ и σ модели процесса в присутствии Al2O3
| $\bar {\Delta },\% $ | σ | |
|---|---|---|
| Конверсия CS2 | 9.86 | 0.06 |
| Конверсия H2S | 30.03 | 0.22 |
Рис. 4 отражает изменение степени превращения H2S на титановом катализаторе. Было обнаружено, что конверсия H2S отрицательна при любых значениях GHSV и температуры в том случае, если используется газ, состав которого представлен в табл. 2. Это говорит о накоплении этого соединения при реакции в слое, заполненном TiO2. Возможной причиной данного явления является повышенная температура слоя, которая благоприятствует протеканию реакции Клауса в обратном направлении и, как следствие, образованию сероводорода. Для изучения этого явления был проведен эксперимент при GHSV равной 2100 ч–1 и другом составе сырья (H2S = 6, SO2 = 4, CS2 = 1, H2O = 30 мольн. % и балансовое количество N2). Как видно из рис. 4, конверсия H2S в данных условиях больше 0 (точки обозначены, как 2100E ч–1). Таким образом, можно сделать вывод, что низкие концентрации и парциальные давления этих компонентов приводят к преимущественному протеканию реакции Клауса в обратном направлении, а увеличение температуры ускоряет эту реакцию.
На рис. 5 показана зависимость конверсии CS2 на TiO2 при различных значениях температуры и GHSV. Как можно видеть, степень превращения CS2 уменьшается при увеличении GHSV. К тому же, как и для катализатора на основе Al2O3, повышение температуры способствует увеличению конверсии CS2 вследствие роста активности катализатора в реакциях гидролиза соединений серы и углерода при повышенных температурах.
Из результатов РФА определено, что сера, образующаяся по реакции Клауса, представлена в виде молекулы, состоящей из 8 атомов. Следовательно, стехиометрический коэффициент, находящийся при сере в кинетический модели (ns), должен быть равен восьми.
На основании полученных экспериментальных данных определены кинетические параметры модели, приведенные в табл. 3. Затем рассчитанные значения степеней превращения H2S и CS2 были сопоставлены с экспериментальными данными и вычислены среднее абсолютное отклонение ($\bar {\Delta }$) и среднеквадратичное отклонение (σ) модели, представленные в табл. 5. Как видно, с использованием данной модели можно с высокой точностью предсказать степень превращения H2S и CS2. Большое отклонение при расчете степени превращения CS2, по-видимому, вызвано малым его содержанием в продукте, из-за чего повышается значимость инструментальной погрешности. Однако даже с учетом данной погрешности можно ожидать, что модель будет с высокой точностью предсказывать конверсию сырья на стадии запуска установки.
Таблица 5.
$\bar {\Delta },\% $ и σ модели процесса в присутствии TiO2
| $\bar {\Delta },\% $ | σ | |
|---|---|---|
| Конверсия CS2 | 15.31 | 0.69 × 10–3 |
| Конверсия H2S | 4.22 | 2.7 × 10–3 |
При сравнении точности кинетических моделей, полученных для TiO2 (табл. 5) и Al2O3 (табл. 4), можем заметить, что диоксид титана является более устойчивым к дезактивации. Несмотря на это, обе модели с высокой точностью описывают процесс, из чего можно заключить, что катализатор незначительно дезактивируется в ходе испытания. Однако для описания реакции, протекающей в течение длительного времени, в модель необходимо включать выражения для процессов дезактивации катализаторов (например, из-за его старения).
Кроме того, в табл. 3 было показано, что обратная реакция Клауса (реакция между водой и серой) имеет нулевой порядок по сере (ns1 = 0). Это означает, что скорость данной реакции не зависит от концентрации серы и определяется исключительно парциальным давлением воды. Поскольку сера образуется в порах и десорбируется по мере протекания процесса, можно предположить, что активные центры катализатора насыщены серой, вследствие чего обратная реакция Клауса не зависит от её концентрации.
Таким образом, для определения кинетических параметров процесса Клауса, протекающего в присутствии промышленных катализаторов (таких как Al2O3 и TiO2), была проведена серия экспериментов на стендовой установке в условиях, соответствующих промышленным. Помимо температуры и объемного расхода газа, состав сырья был также подобран таким образом, чтобы максимально соответствовать реальному процессу. На основании полученных результатов сделан следующий вывод: увеличение температуры при GHSV, равных 800 и 1000 ч–1, приводит к увеличению конверсии H2S, если в качестве катализатора выбран Al2O3, что объясняется уменьшением времени пребывания газа в реакционной зоне, а также экзотермической природой реакции Клауса. Однако при GHSV, равной 1200 ч–1, можно видеть рост степени превращения при увеличении температуры. Если не рассматривать приборную погрешность при измерении малых концентраций H2S и незначительное снижение активности катализатора, основной причиной таких отклонений является увеличение коэффициента массоотдачи и, как следствие, удаление серы с активных центров и из пор катализатора. В дополнение к этому установлено, что при повышении температуры наблюдается рост степени превращения CS2, что в основном связано с повышением активности катализаторов Клауса в реакциях превращения этого компонента при повышенных температурах.
Кинетическое исследование процесса, катализируемого TiO2, показало, что увеличение температуры и GHSV газа приводит к снижению степени превращения H2S из-за уменьшения времени контакта и экзотермической природы процесса. Кроме того, уменьшение концентрации H2S приводит к преобладанию обратной реакции. В результате, при низких концентрациях TiO2 способствовал протеканию процесса в обратном направлении, что является важным фактором оценки его каталитической активности. Для данного катализатора увеличение скорости потока газа также приводит к уменьшению степени превращения CS2 вследствие уменьшения времени контакта. В то же время увеличение температуры положительно влияет на конверсию данного соединения. На основании РФА установлено, что независимо от типа катализатора в процессе образуется орторомбическая сера S8. Таким образом, стехиометрический коэффициент при сере во всех уравнениях модели должен быть равен восьми.
После нахождения кинетических коэффициентов модели и сравнения результатов с экспериментальными данными было показано, что с помощью данной модели можно предсказывать конверсию H2S и CS2 в присутствии Al2O3 со средним абсолютным отклонением 30.03 и 9.86%, соответственно. Отклонение степени превращения этих соединений, рассчитанное по модели, полученной для TiO2, составляет 15.31 и 4.22%.
Список литературы
Shareefdeen Z.M., Hashim M.A. // Int. J. Chem. React. Eng. 2009. V. 7. P. 1.
Dhussa A.K., Sambi S.S., Kumar S., Prajapati J.K. // Int. J. Chem. React. Eng. 2012. V. 10. P. 1.
Mora R.L. // J. Hazard. Mater. 2000. V. 79. P. 103.
Chiappe C., Pomelli C.S. // Top. Curr. Chem. 2017. V. 375. № 3. P. 52.
Zare Nezhad B. // J. Ind. Eng. Chem. 2009. V. 15. P. 143.
Clark P.D., Dowling N.I., Huang M. // Appl. Catal. A: Gen. 2008. V. 343. P. 104.
Signor S., Manenti F., Grottiti M., Fabbri P., Pierucci S. // Ind. Eng. Chem. Res. 2010. V. 49. P. 5714.
Rao K.N., Haydary J. // J. Petrol. Coal. 2019. V. 61. № 2. P. 292.
Monnery W.D., Hawboldt K.A., Pollock A., Svrcek W.Y. // Chem. Eng. Sci. 2000. V. 55. P. 5141.
Manenti G., Papasidero D., Manenti F., Bozzano G., Pierucci S. // Procedia Eng. 2012. V. 42. P. 376.
Pahlavan M., Fanaei M.A. // Iran. J. Oil Gas Sci. Technol. 2016. V. 5. № 1. P. 42.
Zarei S., Ganji H., Sadi M., Rashidzadeh M. // J. Nat. Gas Sci. Eng. 2016. V. 31. P. 747.
Zarei S. // COJ Tech. Sci. Res. 2018. V. 1. № 3. P. 1.
Zarei S. // Innovative Energy & Research. 2018. V. 7. № 3. P. 2.
Kerr R.K., Paskal H.G., Ballash N. // Energy Processing (Canada). 1976. Sept.−Oct. P. 66.
Kerr R.K., Paskal H.G. // Energy Processing (Canada). 1976. Nov.−Dec. P. 38.
Kerr R.K., Paskal H.G., Ballash N. // Energy Processing (Canada). 1977. Janю–Feb. P. 40.
Besher E.M. Low Temperature Claus Reactor Studies, 1st ed. Vancouver, Canada: University of British Colombia, 1990.
Gemmingen U., Lahne U. // Gas Sep. Purif. 1994. V. 8. P. 241.
Mondioroz S., Munoz V., Alvarez E., Palacios J.M. // Appl. Catal. A: Gen. 1995. V. 132. P. 111.
Zagoruiko A.N., Matros Y.S. // Chem. Eng. J. 2002. V. 87. P. 73.
Abedini R., Koolivand M., Ghasemian S. // Chem. Eng. Res. Bull. 2010. V. 14. P. 110.
Nabikandi N.J., Fatemi S. //J. Ind. Eng. Chem. 2015. V. 30. P. 50.
Ghahraloud H., Farsi M., Rahimpour M.R. / J. Taiwan Inst. Chem. Eng. 2017. V. 76. P. 1.
Ghahraloud H., Farsi M., Rahimpour M.R. // Chem. Prod. Process Model. 2018. V. 14. № 2. P. 1.
Khanaev V.M., Borisova E.S., Kalinkin P.N., Kovalenko O.N. // Theor. Found. Chem. Eng. 2018. V. 52. № 4. P. 506.
Nedez C., Ray J.L. Understanding Claus Catalyst Deactivation Mechanisms: Optimization of Al2O3 Using Physic-Chemical Parameters, Catalyst Deactivation. Bartholomew C.H., Fuentes G.A. Eds. − Elsevier Science, 1997. P. 251.
Platonov O.I. // Coke Chem. 2019. V. 62. № 3. P. 103.
Дополнительные материалы отсутствуют.