Нефтехимия, 2020, T. 60, № 4, стр. 529-537
Изучение жидкофазного алкилирования толуола гексеном-1 методом ЯМР-спектроскопии: влияние катализатора на селективность
E. Pérez-Guevara 1, 2, 3, *, J. M. G. Molinillo 1, **, M. J. Franco 1, E. J. Martínez de la Ossa 3, J. Frontela 1, J. Lázaro 1
1 Cepsa Research Center, Compañía Española de Petróleos S.A.U.
28850 Alcalá de Henares, Madrid, Av. Punto Com 1, Spain
2 Department of Organic Chemistry, School of Sciences, Institute of Biomolecules (INBIO), University of Cadiz
11510 Cádiz, C/República Saharaui, 7, Puerto Real, Spain
3 Department of Chemical Engineering and Food Technology, School of Sciences, University of Cadiz
11510 Cádiz, C/República Saharaui 7, Puerto Real, Spain
* E-mail: elena.perez@cepsa.com
** E-mail: chema.gonzalez@uca.es
Поступила в редакцию 01.04.2019
После доработки 06.06.2019
Принята к публикации 11.03.2020
Аннотация
В данной работе изучалась селективность различных твердых катализаторов в реакции алкилирования толуола гексеном-1 с целью оптимизации образования монозамещенных продуктов. Реакцию проводили в реакторе с неподвижным слоем катализатора при 120°C. Наряду с тремя коммерчески доступными кислотными цеолитами разной структуры (фожазит, морденит и бета), в качестве эталона использовался промышленный катализатор процесса алкилирования. Все катализаторы обеспечивали полную конверсию сырья. Во всех случаях селективность образования моноалкилтолуолов была более 95%, а образования диалкилтолуолов – менее 4.5%. Методом ЯМР-спектроскопии были идентифицированы основные продукты реакции (моноалкилтолуолы). В данной работе исследуется влияние физико-химических и структурных свойств твердых катализаторов на селективность образования различных продуктов алкилирования.
В настоящее время отмечается снижение уровня потребления таких видов топлива, как бензин и дизельное топливо. Присутствующие в топливе ароматические углеводороды могут быть превращены в ценные нефтехимические продукты посредством реакции алкилирования. В связи с этим увеличение активности и селективности твердых кислотных катализаторов алкилирования является актуальной задачей.
Реакция алкилирования ароматических углеводородов (УВ) олефинами широко применяется в химической, нефтехимической и нефтеперерабатывающей промышленности [1–4]. Традиционно в данной реакции используются гомогенные катализаторы с высокой кислотностью (HF, H2SO4, H3PO4, AlCl3). Данный тип катализаторов обладает значительными недостатками, такими как опасность при обращении и транспортировке, коррозионная активность, токсичность и опасность загрязнения окружающей среды. Кроме того, необходимо отделять кислотный катализатор от полученных продуктов. По этим причинам в последние десятилетия были предприняты значительные усилия для замены гомогенных катализаторов на гетерогенные, такие как цеолиты, мезопористые молекулярные сита или иммобилизованная фосфорная кислота [5, 6].
Поэтому реакция алкилирования на гетерогенных катализаторах все чаще вызывает интерес для получения множества нефтехимических полупродуктов. Так, например, алкилированием бензола на цеолите H-MCM-22 получают кумол [7, 8], а прекурсоры поверхностно-активных веществ, такие как линейные алкилбензолы (ЛАБ), могут быть получены с помощью реакций алкилирования на цеолитах различного типа, мезопористых материалах или ионах гетерополикислот, нанесенных на оксид циркония или титана [9–11]. Кроме того, в нефтепереработке также возрастает интерес к применению подобных реакций алкилирования вследствие необходимости адаптации производственных цепочек к постоянно меняющейся конъюнктуре рынка. Это вызвано как ужесточением требований к топливам, так и удобством переработки некоторых промышленных фракций [12, 13]. В связи с этим поиск активных твердых катализаторов алкилирования с высокой селективностью к монозамещенным продуктам все еще продолжается [14, 15].
Хорошо известно, что активность цеолитов зависит от их кислотности, а также от диффузионных свойств катализатора. Бренстедовские кислотные центры играют важную роль в реакции алкилирования, причем оптимальное распределение кислотных центров по силе также важно. В то же время, важно использовать широкопористые материалы с высокой доступностью активных центров и легкой десорбцией продуктов [5, 9]. При использовании кислотных катализаторов может быть легко достигнута высокая степень превращения, однако селективность и распределение продуктов сильно зависят от свойств катализатора [14].
Благодаря одновременному разветвлению и двойной связи изомеризации олефина, алкилирование толуола гексеном-1 позволяет получить все типы изомеров моноалкилированных продуктов толуола. Разные авторы сообщают о полизамещенных ароматических веществах и некоторых соединениях, получаемых в ходе изомеризации и олигомеризации олефинов в качестве возможных побочных продуктов реакции [6, 16].
Цель данной работы – изучение селективности алкилирования толуола гексеном-1 на катализаторах с различной топологией и физико-химическими свойствами для оптимизации образования монозамещенных продуктов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для проведения данного исследования были выбраны катализаторы с разной структурой: аморфный промышленный катализатор алкилирования, используемый в процессе алкилирования бензола, и три коммерчески доступных кислотных цеолита с разной структурой (фожазит, морденит и бета). Сравнительные испытания четырех выбранных катализаторов проводили в реакторе с неподвижным слоем катализатора в жидкой фазе. Для того чтобы соотнести свойства катализаторов с селективностью образования продуктов реакции, было тщательно изучено распределение продуктов методом ЯМР-спектроскопии, идентификация и количественная оценка выхода продуктов.
Физико-химические свойства катализаторов. В качестве эталона был использован промышленный катализатор алкилирования (REF) фирмы Cepsa SAU – аморфный алюмосиликатный катализатор с размером частиц 0.5−0.84 мм. Были исследованы три коммерчески доступных цеолита: бета (BETA), морденит (MOR) и фожазит (FAU). Перед реакцией цеолиты, поставляемые в виде порошка, прессовали в таблетки с помощью гидравлического пресса, а затем измельчали и просеивали. Для экспериментов использовали фракцию 0.5−0.84 мм.
Изотермы адсорбции/десорбции азота измеряли при 77 K с помощью прибора Micromeritics ASAP 2010. Перед измерением образцы вакуумировали при 300°C в течение 4 ч. Удельную поверхность рассчитывали, применяя модель БЭТ к полученным данным. Объем пор и внешнюю поверхность определяли методом t-plot. Количество кислотных центров катализаторов измеряли с помощью температурно-программируемой десорбции (ТПД) н-пропиламина. Измерения проводили на приборе TA SDT 2960 Simultaneous и DTA-TGA. Катализаторы активировали in situ при 600°C в течение 20 мин в токе He. Адсорбцию н-пропиламина (Merck, реактивной чистоты) проводили при 150°C до полного насыщения катализатора. После удаления физически адсорбированного амина при комнатной температуре проводили ТПД со скоростью нагрева 10°C/мин с 150 до 700°C в токе He. Значения SiO2/Al2O3 были предоставлены поставщиками.
Испытание активности. Активность катализатора оценивали в непрерывном проточном реакторе из нержавеющей стали с неподвижным слоем катализатора при 120°C, под общим давлением 2.0 MПа и LHSV, равной 15 ч–1 (по толуолу). Для контроля давления использовали поток чистого N2 с объемным расходом 1.5 ч–1. Слой катализатора поддерживали в изотермическом режиме с помощью трехзонной электрической печи с внутренним контролем температуры (рис. S1 ). Для каждого эксперимента в реактор загружали 5 мл катализатора. Перед началом реакции катализатор активировали in situ сушкой в среде N2 при 140°C в течение 8 ч, а затем при 260°C в течение 12 ч. Затем на протяжении 48 ч проводили жидкофазную реакцию.
Сырье, предварительно высушенное, представляло собой смесь толуола (Scharlau, особо чистый >99.5%) и гексена-1 (Aldrich, 97%) с мольным соотношением 20 : 1.
Продукты охлаждали в газо-жидкостном сепараторе и собирали в виде жидкости. Для каждого катализатора несколько образцов были отобраны при разном времени реакции и проанализированы методом газовой хроматографии (ГХ). Конверсию гексена-1 (Xгекс) и селективность образования моно- (SМА) и диалкилтолуолов (SДА) рассчитывали, используя следующие уравнения:
Анализ продуктов. Для глубокого анализа продуктов реакции все жидкие продукты, собранные в стационарном состоянии, нагревали для испарения непрореагировавшего сырья и концентрирования продуктов реакции. Концентрированные образцы анализировали методом ГХ на приборе Agilent Technologies 6890N GC с капиллярной колонкой (J&M Scientific DB-1) и пламенно-ионизационным детектором. Предварительно моно- и диалкилтолуолы, собранные в группу, идентифицировали методом ГХ-МС с помощью масс-спектрометра Agilent Technologies 5975 VLMSD, совмещенного с газовым хроматографом Agilent Technologies 7890A GS, снабженном капиллярной колонкой (Agilent Technologies HP-1).
Дополнительно образцы анализировали методом ЯМР-спектроскопии. Спектры 1H и 13C так же, как и двумерные спектры, были сняты при комнатной температуре с использованием CDCl3 в качестве растворителя на спектрометре Agilent INOVA при разрешении 600 и 150 МГц соответственно. Концентрация образцов в растворе составляла 5 об. %. Резонансный сигнал остаточного хлороформа был установлен при δ 7.25 ppm в спектре 1H и δ 77.0 ppm в спектре 13C. В ходе предварительных экспериментов на MK-72 в качестве растворителя использовали хлороформ и метанол.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства катализаторов. В табл. 1 приведены физико-химические и структурные характеристики цеолитных катализаторов. Катализатор REF не может быть охарактеризован по причине коммерческой тайны.
Таблица 1.
Физико-химические и структурные свойства исследуемых цеолитов
| Катализатор | SБЭТ, м2/г | Sвнешн, м2/г | Vмезо, см3/г | Vмикро, cм3/г | Кислотность, мкмоль н-C3H7NH2/г | SiO2/Al2O3 | Структура |
|---|---|---|---|---|---|---|---|
| BETA | 643 | 186 | 0.22 | 0.182 | 746.8 | 250 | 12MR (6.6 × 6.7 Å) 12MR (5.6 × 5.6 Å) (3-х мерный) |
| FAU | 930 | 305 | 0.28 | 0.25 | 1066.8 | 30 | 12MR (7.4 × 7.4 Å) (3-х мерный) |
| MOR | 507 | 112 | 0.24 | 0.154 | 1098.3 | 6 | 12MR (6.5 × 7.0 Å) 8MR (2.6 × 5.7 Å) (1-мерный) |
Изотермы адсорбции азота свидетельствуют о том, что образец FAU обладает наибольшими удельной внешней поверхностью и объемом пор. Следует отметить, что наличие мезопор в катализаторе приводит к большей доступности кислотных центров [17]. В отношении кислотности цеолиты FAU и MOR демонстрируют очень близкие значения, в то время как цеолит BETA обладает гораздо меньшим значением кислотности.
Структура катализатора значительно влияет на его селективность и на свойства конечного продукта. Аморфные материалы не обладают упорядоченной решеткой, поэтому конфигурационная селективность не характерна для данного вида твердых катализаторов. Напротив, цеолиты обладают упорядоченной структурой, причем строение решетки зависит от типа цеолита [18]. Цеолит FAU имеет широкие прямые каналы в трех плоскостях, что позволяет реагентам и продуктам легко перемещаться в них. Этот факт позволяет формировать более объемные молекулы в процессе реакции. Каналы в BETA имеют меньший размер, чем у FAU, поэтому селективность образования меньших молекул в BETA выше. Кроме того, каналы BETA достаточно извилистые, что может затруднить прохождение молекул через катализатор. Одномерные прямые и эллиптические каналы в MOR образуют особую структуру, обуславливающую образование определенных продуктов.
Испытание активности. На рис. 1 показана зависимость конверсии гексена-1 от времени в потоке для всех образцов. Согласно результатам, на всех катализаторах была достигнута 100%-ная конверсия. Все катализаторы, за исключением BETA, были стабильны как минимум в ходе 48 ч реакции. Дезактивация BETA может быть объяснена за счет структуры ее извилистых каналов, которые могут вызывать задержку соединений в порах, блокирующих кислотные центры.
Рис. 1.
Зависимости конверсии гексена-1 (а) и селективности образования моноалкилтолуолов (б) от времени для всех образцов, исследованных в реакторе с неподвижным слоем катализатора. Реакционные условия: 120°C, 2 МПа, LHSV = 15 ч–1, мольное соотношение толуол/гексен-1 = 20.

Как видно на рис. 1, селективность образования МА при 100%-ной конверсии была выше 95% для всех катализаторов. В случае катализатора BETA селективность по МА начала снижаться после 16 ч реакции из-за дезактивации катализатора. В табл. 2 показаны селективности образования МА и ДА при 100%-ной конверсии. Цеолит MOR является наиболее селективным по МА, возможно благодаря своим эллиптическим микропористым каналам (6.5 × 7.0 Å). На цеолите BETA достигается высокая селективность по МА, однако он быстро дезактивируется в потоке. Катализаторы REF и FAU обладают малой селективностью по МА из-за отсутствия конфигурационной селективности в аморфном катализаторе и большого размера пор цеолита FAU.
Таблица 2.
Селективность образования моноалкилтолуолов и диалкилтолуолов при 100%-ной конверсии на различных катализаторах
| Катализатор | Селективность по моноалкилтолуолам, % | Селективность по диалкилтолуолам, % |
|---|---|---|
| REF | 96.30 | 3.14 |
| BETA | 97.02 | 0.67 |
| FAU | 95.21 | 4.12 |
| MOR | 98.71 | 0.00 |
Как видно из табл. 2, во всех случаях образование ДА было относительно низким. Наибольшее значение селективности по ДА получено на катализаторе FAU. Это связано с наибольшей мезопористостью образца и наибольшим размером каналов FAU, которые позволяют образовываться крупным молекулам. Результаты, полученные на BETA и MOR, свидетельствуют об ограничении образования ДА в цеолитах из-за малого размера пор. В этой связи уместно обратить внимание на тот факт, что на катализаторе MOR диалкилтолуолы не образовывались.
Анализ состава моноалкилтолуолов. Результаты газовой хроматографии. Как видно на рис. S2 , в газовой хроматограмме реакционных продуктов существует две основные группы соединений: шесть интенсивных пиков и другие менее интенсивные пики, отнесенные к тяжелым соединениям. Результаты ГХ-МС свидетельствовали о том, что молекулярная масса шести основных пиков была 176 г/моль, что соответствует моноалкилированному толуолу с заместителем C6 (C13H20). Молекулярная масса, определенная для пиков с низкой интенсивностью, была 260 г/моль, что соответствует диалкилированному толуолу с двумя заместителями C6 (C19H32). Предполагаемая схема реакции показана на рис. S3 .
Хотя с помощью метода ГХ можно оценить количество каждого моноалкилтолульного соединения (табл. S1 ), полная идентификация состава продуктов данным методом невозможна. Таким образом, библиотека масс-спектров не позволила определить разные МА-изомеры, а спектры не предоставили убедительных доказательств для полной идентификации.
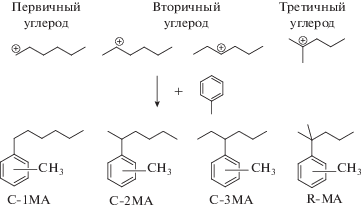
Результаты спектроскопии ядерно-магнитного резонанса. ЯМР-спектры продуктов реакции были чрезвычайно сложными, как минимум шесть разных основных соединений в каждом образце. Реакция алкилирования толуола гексеном-1 протекает по карбокатионному механизму [19]; следовательно, С−С-связь может образовываться между ароматическим кольцом и первичным, вторичным или третичным атомом углерода алифатической цепи, как показано на рис. 2. Кроме того, они могут присоединяться в орто-, мета- или пара-положения ароматического кольца относительно метильной группы. На 13C ЯМР-спектрах присутствуют как шесть сигналов, соответствующих ароматическому углероду, связанному с алифатической цепью, так и шесть сигналов, соответствующих ароматическому углероду, связанному с метильной группой (рис. S4 ), что подтверждает присутствие шести различных соединений. Оба спектра 1H и 13C были очень сложными с большим количеством сигналов (рис. S5 −S8).
Алкилтолуольные продукты с первичным (С-1МА) и третичным (П-MA) углеродом не были обнаружены. Поэтому не было триплетных сигналов в зоне δ 2.30−2.80, характерных для бензильного протона, приписываемого С-1МА. Соответственно, нельзя было наблюдать какие-либо синглетные сигналы при δ 1.25, которые должны были бы присутствовать у соединений П-МА. В действительности, сигналы при δ 1.25 являются дублетами. Аналогично, не были найдены олефиновые протоны в образцах, поэтому можно заключить, что димеризация гексена-1 не происходит. Поэтому единственным оставшимся реакционным путем было алкилирование толуола вторичным карбокатионом с зарядом на атомах С-2 и С-3. Для определения данных компонентов внимание в спектре 1H ЯМР было сфокусировано на область δ 2.0−3.5, в которой проявляются бензильные протоны алифатической цепи.
В С-2-моноалкилтолуольных соединениях (С-2МА) бензильные протоны связаны метильной и метиленовой группами. Отсутствие стерических препятствий должно было привести к сигналу в виде секступлета. С другой стороны, С-3-моноалкилтолуолы (С-3МА), в которых вращение связи должно быть более ограниченным, будут вызывать более сложный сигнал (dddd). В результате, существуют три С-2МА и три С-3МА соединения, что вероятно соответствует пара-, мета- и орто-положениям. На рис. 3 показаны все сигналы бензильных протонов, соответствующих образцу REF. Для подтверждения данной гипотезы были проведены COSY-эксперименты. Очевидно, что каждый сигнал бензильных протонов С-2МА был в паре с дублетом концевых метильных групп, существующих только в С-2МА молекулах (рис. S9 ). Поскольку было подтверждено, что эти сигналы возникают за счет С-2МА, другие сигналы были вследствие наличия С-3МА.
Рис. 3.
Фрагмент 3.05–2.1 1H ЯМР-спектра смеси продуктов REF, на котором можно определить по три сигнала (орто-, мета- и пара-) для двух групп (C-2 и C-3) соединений.

Были проведены COSY-эксперименты для идентификации сигналов орто-, мета- и пара-заместителей в С-2МА продуктах (рис. S10 ). C-2 сигналы были связанны с сигналом метильного заместителя толуола. Таким образом, сигнал при δ = 2.63–2.7 может быть отнесен к орто-алкилированному соединению. Сигнал при δ = 2.62–2.68, в сочетании с дублетным сигналом в зоне ароматического протона, соответствует пара-производному. Третий сигнал С-2 алкилатов, не обладающих данным взаимодействием, должен соответствовать мета-соединению. Поскольку сигналы бензильных протонов в С-3МА соединениях были менее интенсивными, чувствительность COSY-экспериментов была недостаточной. Кроме того, два сигнала перекрывались сигналами метильных групп толуола. Для того чтобы предотвратить данные проблемы, необходимо было провести HSQC-эксперименты На рис. S11 показано сравнительное соотношение между бензильными углеродами и протонами в С-2МА и С-3МА. Из-за схожести соотношения можно считать, что изолированные С-3 алкильные сигналы соответствуют мета-соединениям, а другие сигналы – пара- и орто-заместителей – перекрываются. HMBC-эксперимент (рис. S12 ) позволил подтвердить пара- и орто-сигналы в С-3МА. Первый сигнал – бензильного углерода – оказался связан с дублетом ароматических протонов, что характерно для пара-молекул. Другой сигнал бензильного углерода связан с метильными протонами толуола, поэтому данная молекула соответствует орто-продукту. Таким образом подтверждено, что другие сигналы при δ 2.82 в С-3 алкилате соответствуют мета-продукту. На рис. 4 показано окончательное распределение каждого соединения.
Рис. 4.
Распределение бензильных протонов в спектре 1H ЯМР реакционной смеси REF согласно результатам двумерных экспериментов.

После того, как сигналы были отнесены к различным соединениям, был проведен полуколичественный анализ сигналов ЯМР с помощью интегрирования (рис. S13 ). Результаты позволили узнать приблизительную долю каждого компонента в продуктах с каждым катализатором. Как видно из табл. 3, качественная информация, полученная методом ЯМР, может быть соотнесена с данными анализа ГХ.
Таблица 3.
Соотношение пиков ГХ со строением моноалкилтолуолов
| № пика | Соединение |
|---|---|
| 1 | 1-(Гексан-3-ил)-4-метилбензол |
| 2 | 1-(Гексан-2-ил)-3-метилбензол |
| 3 | 1-(Гексан-3-ил)-3-метилбензол |
| 4 | 1-(Гексан-2-ил)-4-метилбензол |
| 5 | 1-(Гексан-2-ил)-2-метилбензол |
| 6 | 1-(Гексан-3-ил)-2-метилбензол |
Селективность по моноалкилтолуольным изомерам. Как известно, стабильность карбокатиона увеличивается в ряду: первичный < вторичный < < третичный [20, 21]. В данном случае, карбокатионный интермедиат, образующийся в ходе реакции, должен быть вторичным. Хотя третичный карбокатион является более стабильным, скорость реакции алкилирования, вероятно, больше, чем скорость скелетной перегруппировки. С другой стороны, региоселективность данной реакции благоприятствует орто- и пара-замещению, тогда как образование мета-продукта является наименее вероятным [22, 23]. Орто-продукт статистически является более предпочтительным, чем пара-, однако пара-продукт менее затруднен стерически.
На рис. 5 показано различие распределения моноалкилтолуолов в продуктах реакции на каждом катализаторе. Во всех случаях доля С-2МА соединений превосходила долю С-3МА, особенно для более селективных катализаторов. Данный факт может быть вызван большей подвижностью алкильной цепи в С-2МА. Такая цепь может вращаться в С-2МА молекулах, что приводит к образованию менее крупной молекулы, чем С-3МА. По этой причине С-2МА может легче образоваться в порах катализатора, особенно в самых малых. В общем, среди всех С-2МА продуктов было больше орто- и пара-изомеров, чем мета-, особенно на более селективных катализаторах. Во всех случаях было больше С-2 орто-соединений.
Катализаторы REF и FAU обладали недостаточной селективностью; в их присутствии изомерные моноалкилтолуолы образовывались примерно в равном количестве. Напротив, BETA и MOR обладали высокой селективностью по отношению и к орто-, и к пара-С-2- продуктам. Эти результаты совпадают с данными по селективности по диалкилтолулам (табл. 2).
BETA был более избирателен по отношению к орто-С-2 возможно потому, что он является катализатором с наименьшим размером пор. Селективность по МА на BETA снижалась в ряду пара-С-2 > мета-С-2 > орто-С-3 > пара-С-3 > мета-С-3. По-видимому, С-3-продукты являются более объемными, чем С-2, из-за меньшей вращательной степени свободы алифатической цепи. Для MOR получены похожие результаты. Однако, этот катализатор был более избирательным, поскольку в его присутствии образовывалось большее количество двух соединений (орто- и пара-С-2), чем на других образцах. Это поведение может быть объяснено специфическим строением 12-членных каналов MOR, которые при диффузии выступают в качестве одномерных трубок. Более низкая селективность REF и FAU может быть вызвана их структурными свойствами. REF является аморфным катализатором, а FAU имеет длинные трехмерные цеолитные каналы. Кроме того, данный материал обладает большей удельной поверхностью и мезопористостью, чем другие цеолиты. Данные свойства FAU позволяют образовываться соединениям с более крупными молекулами [18].
Таким образом, все изученные катализаторы обеспечивали полную конверсию сырья в реакции алкилирования толуола и были стабильны в течение 48 ч за исключением BETA, который начал дезактивироваться через 16 ч, возможно из-за его извилистых каналов. Во всех случаях селективность образования моноалкилтолуолов (МА) была выше 95%, а селективность по диалкилтолуолам (ДА) – ниже 4.5%.
С помощью ЯМР-анализа было установлено, что МА образуются через С-2 и С-3 атомы алифатической цепи, присоединяясь в орто-, мета- и пара-положения. BETA и MOR были наиболее избирательны по МА, особенно по орто- и пара-С-2 соединениям. Такая избирательность может быть вызвана меньшим размером каналов данных катализаторов. В присутствии MOR образовывалось гораздо большее, чем на других образцах, количество орто- и пара-С-2 соединений с большей селективностью по МА; образования ДА не наблюдалось. Это явление может объясняться строением его эллиптических 12-членных каналов. На FAU и REF получено очень схожее распределение МА соединений, поскольку оба катализатора обладают низкими диффузионными ограничениями. FAU был менее селективным катализатором по МА и единственным, в присутствии которого образовывалось большое количество ДА. Причиной этого может быть широкопористая структура и большая мезопористость данного катализатора, что позволяет образовываться крупным молекулам.
Список литературы
Kirk-Othmer. Encyclopedia of Chemical Technology. Wiley, 2004. V. 2. P. 177−196.
Berna J., Almeida J., López I. // Patent CEPSA WO. 2006. № 108883 A1.
Almeida J., Berna J. // Patent CEPSA WO. 2007. № 104805 A1.
Berna J., Almeida J. // Patent CEPSA US. 2010. № 0305373 A1.
Mayerová J., Pawlesa J., Zilková N., Kosová G., Cejka J. // Stud. Surf. Sci. Catal. 2005. V. 158. P. 1945.
Cadenas M., Bringué R., Fité C., Iborra M., Ramírez E., Cunill F. // Appl. Catal. A Gen. 2014. V. 485. P. 143.
Rubin M.K., Chen P. // Patent Mobil Oil Corp US. 1990. № 4954325.
Rigoreau J., Laforge S., Gnep N.S., Guisnet M. // J. Catal. 2005. V. 236. P. 45.
Lucas N., Bordoloi A., Amrute A.P., Kasinathan P., Vinu A., Bohringer W., Fletcher J.C.Q., Halligudi S.B. // Appl. Catal. A Gen. 2009. V. 352. P. 74.
Da Z., Han Z., Magnoux P., Guisnet M. // Appl. Catal. A Gen. 2001. V. 219. P. 45.
Da Z., Magnoux P., Guisnet M. // Appl. Catal. A Gen. 1999. V. 182. P. 407.
Dong P., Li Z., Ji D., Wang X., Yun H., Du Z., Bian J., Li G.J. // J. Incl. Phenom. Macrocycl. Chem. 2018. V. 90. P. 149.
Wang R., Wan J., Li Y., Sun H. // Chem. Eng. Sci. 2015. V. 137. P. 59.
Craciun I., Reyniers M.-F., Marin G.B. // J. Mol. Catal. A Chem. 2007. V. 277. P. 1.
Nel R.J.J., De Klerk A. // Ind. Eng. Chem. Res. 2007. V. 46. P. 2902.
Martínez-Armero M. E., Moliner M., Sastre G., Rey F., Martínez C., Corma A. // J. Catal. 2016. V. 333. P. 127.
Meiaudeau P., Ben Taarit Y., Thangaraj A., Almeida J.L.G., Naccache C. // Catal. Today. 1997. V. 38. P. 243.
Baerlocher Ch., McCusker L.B., Olson D.H. Atlas of Zeolite Framework Types. Elsevier, Amsterdam, 2007.
Yamamoto Y., Itonaga K. // Chem.: Eur. J. 2008. V. 14. P. 10 705.
Arnett E.M., Hofelich T.C. // J. Am. Chem. Soc. 1983. V. 105. P. 2889.
Ferguson G.A., Cheng L., Bu L., Kim S., Robichaud D.J., Nimlos M.R., Curtiss L.A., Beckham G.T. // J. Phys. Chem. A. 2015. V. 119. P. 11 397.
Olah G.A., Olah J.A., Ohyama T. // J. Am. Chem. Soc. 1984. V. 106. P. 5284.
Hajra S., Maity S., Roy S.// Adv. Synth. Catal. 2016. V. 358. P. 2300.
Дополнительные материалы
- скачать ESM.docx
- Рис. S1-S13. Таблица S1.