Нефтехимия, 2020, T. 60, № 4, стр. 538-547
Влияние добавок водорода, монооксида углерода, синтез-газа и водяного пара на характеристики матричной конверсии богатых метан-кислородных смесей
В. И. Савченко 1, *, А. В. Никитин 1, 2, А. В. Озерский 1, 2, Я. С. Зимин 1, 2, И. В. Седов 1, 3, В. С. Арутюнов 1, 2, 3
1 Институт проблем химической физики РАН
142432 г. Черноголовка, Московской обл., Россия
2 Федеральный исследовательский центр химической физики им. Н.Н. Семенова РАН
119991 Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова, Химический факультет
119991 Москва, Россия
* E-mail: vsavch@icp.ac.ru
Поступила в редакцию 21.02.2020
После доработки 05.03.2020
Принята к публикации 11.03.2020
Аннотация
Проведено экспериментальное исследование и детальное кинетическое моделирование характеристик процесса матричной конверсии метан-кислородной смеси при введении в нее добавок водорода, монооксида углерода, синтез-газа и водяного пара. Показано, что наиболее существенное влияние на состав продуктов оказывает добавка водяного пара, снижающая выход ацетилена и одновременно увеличивающая соотношение Н2/СО. Получено хорошее согласие экспериментальных результатов и кинетического моделирования.
При конверсии (горении) богатых метан-кислородных смесей в конверторах матричного типа при температурах 1400–1600 К и мольных соотношениях метана и кислорода (1 : 0.6)–(0.8) [1–3] получают газовую смесь, содержащую Н2 и СО в соотношении 1.7–1.75 с примесью СО2 (до 5 об. %), непрореагировавшего метана (до 8 об. %) и ацетилена (2–3 об. %), образующегося при пиролизе части метана [4]. Процесс сопровождается заметным сажеобразованием. Ацетилен является предшественником образования сажи и других продуктов конденсации, поэтому снижение его содержания в получаемом газе является важной технологической задачей. Одним из эффективных способов снижения образования ацетилена в процессе горения богатых метан-кислородных смесей является добавка водяного пара [5, 6]. Было интересно исследовать влияние на характеристики процесса, особенно на содержание ацетилена в получаемом синтез-газе, и других добавок, в частности, основных продуктов процесса: водорода, СО и самого синтез-газа.
Известно [7–12], что добавки водорода промотируют горение углеводородов (УВ) в двигателях внутреннего сгорания. Присадки водорода к топливо-воздушным смесям позволяют существенно расширить пределы воспламенения, что обеспечивает снижение расхода основного топлива, особенно на малых нагрузках и режиме холостого хода, снижение выбросов несгоревших УВ и оксидов азота. Аналогично действие и синтез-газа.
Влияние синтез-газа, Н2 и СО на горение богатых метан-кислородных смесей исследовали в работах [13, 14], в которых показано, что в условиях установки статического типа при воспламенении с помощью пережигаемой проволоки или форкамерном зажигании при давлении 1.5 МПа и начальной температуре 300°С эти добавки снижают сажеобразование и повышают степень превращения метана до 99.5–99.7%. Проведенное автором [15] сравнение результатов гомогенного парциального окисления метан–кислородных смесей с α = [O2]/2[CH4] = 0.35 в различных реакторах, представленное в табл. 1, показало, что в условиях проточных установок различного типа показатели процесса существенно отличны от характеристик исследовательского статического реактора и сопоставимы с представленными выше аналогичными характеристиками для процесса матричной конверсии.
Таблица 1.
Сравнение состава смесей, получаемых при гомогенном парциальном окислении метан-кислородных смесей с α = 0.35 в реакторах различного типа по данным работ [2 и 15]
| Соединение | Концентрация, об. % | ||||
|---|---|---|---|---|---|
| статический реактор | проточный реактор | реактор с критическим сечением на базе ЖРД* | реактор с критическим сечением и с турбулизатором на базе ЖРД | матричный конвертор |
|
| H2 | 62.7 | 38.3 | 49.9 | 53.4 | 54.3 |
| CO | 33.8 | 25.6 | 26.0 | 28.3 | 31.3 |
| CO2 | 2.7 | 7.4 | 6.4 | 7.1 | 5.3 |
| CH4 | 0.8 | 22.7 | 11.6 | 6.1 | 7.2 |
| O2 | – | 2.4 | 2 | 1.0 | – |
| C2H6 | – | 0.2 | 0.2 | 0.1 | – |
| C2H4 | – | 1.6 | 2.0 | 1.3 | 0.6 |
| C2H2 | – | 1.9 | 1.8 | 2.8 | 1.3 |
| H2/CO | 1.9 | 1.5 | 1.9 | 1.9 | 1.7 |
| CO/CO2 | 12.5 | 3.5 | 4.1 | 4.0 | 5.9 |
Гомогенная конверсия богатых метан-кислородных смесей в присутствии паров воды позволяет существенно снизить сажеобразование при получении синтез-газа методом автотермического риформинга (ATR). Однако влияние паров воды на закономерности некаталитичекого гомогенного окисления таких смесей при высоких температурах в литературе освещено недостаточно.
Цель данной работы – теоретическое и экспериментальное исследование влияния добавок водорода, СО, синтез-газа и водяного пара на характеристики матричной конверсии богатых метан–кислородных смесей.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Термодинамический анализ распределения продуктов проводился с использованием программы “Терра”. В кинетических расчетах использовали механизм Curran et al. [17], расчеты проводили в программной среде Chemical Workbench для модели plug flow reactor [18] при изотермических условиях.
Эксперименты проводили на лабораторном конверторе, включающем два симметрично расположенных друг напротив друга матричных блока. Подобный дизайн конверторов был описан ранее в работах [1–5, 19]. В качестве окислителя использовали технический кислород (ГОСТ 5583–78). Расход метан-кислородной смеси составлял 10.3 мл/с (коэффициент избытка окислителя α ~ 0.5). Объем добавок водорода и моноокисида углерода в исходную смесь варьировали, соответственно, от 0 до 25% и от 0 до 15% относительно расхода метана. Анализ газообразных реагентов и продуктов проводили на газовом хроматографе “Кристалл 5000 М” с тремя параллельными аналитическими каналами, позволяющими одновременно регистрировать все основные компоненты газа. Погрешность измерения составляла 6 отн. %.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Термодинамический анализ
Реальное распределение продуктов при матричной конверсии углеводородных газов определяется кинетическими закономерностями окисления, протекающего по сложному радикально-разветвленному механизму. Однако предварительный термодинамический анализ позволяет оценить предельные концентрации продуктов, которые могут образовываться при достижении равновесия в заданных условиях проведения процесса.
С использованием программы “Терра” [16] рассчитано распределение равновесной концентрации продуктов в системе:
без добавок и с добавками Н2, СО и синтез-газа (Н2/СО = 1.7) в изотермических условиях.В табл. 2 представлены данные расчета равновесного выхода компонентов реакции в системе СН4 + 0.72 О2 + добавки → продукты при температуре 1600 К, величины Kр = $\frac{{[{\text{C}}{{{\text{O}}}_{2}}][{{{\text{H}}}_{{\text{2}}}}]}}{{[{\text{CO}}][{{{\text{H}}}_{{\text{2}}}}{\text{O}}]}},$ а также важнейшего технологического параметра – соотношения kр = $\frac{{[{{{\text{H}}}_{2}}]}}{{[{\text{CO}}]}}.$
Таблица 2.
Равновесный выход компонентов реакции в системе: СН4 + 0.72 О2 + добавки → Продукты при температуре 1600 К, моль на моль метана, Kр и соотношение kр = [H2/CO] (a = CO; b = Н2; c = СО2; d = Н2О)
| Равновесный выход компонентов реакции, моль на моль метана | СН4 + 0.72 О2 + добавки | |||||
|---|---|---|---|---|---|---|
| aр | bр | cр | dр | Kр | kр | |
| Без добавок | 0.930 | 1.630 | 0.070 | 0.370 | 0.331 | 1.75 |
| +0.25 CO + 0.425 H2 | 1.180 | 2.055 | 0.070 | 0.370 | 0.331 | 1.74 |
| +0.25 CO | 1.166 | 1.644 | 0.084 | 0.356 | 0.331 | 1.41 |
| +0.425 H2 | 0.942 | 2.043 | 0.058 | 0.382 | 0.331 | 2.17 |
| +1.0 H2O | 0.798 | 1.702 | 0.202 | 1.298 | 0.331 | 2.13 |
Как видно из табл. 2, при добавлении к исходным реагентам синтез-газа с соотношением Н2/СО, близком к получаемому в продуктах при равновесии, эта добавка не влияет на распределение продуктов. И это достаточно очевидно, так как при одних и тех же Kр и Н2/СО одинаковым должно быть и соотношение Н2О/СО2.
Ввод в виде добавки отдельных компонентов синтез-газа, увеличивая равновесный выход этого компонента примерно на величину вводимой добавки, мало сказывается на равновесном выходе остальных продуктов, а постоянство величины Kр поддерживается за счет изменения малой по значению величины выхода СО2.
Добавка водяного пара (1 моль Н2О на 1 моль СН4), как видно из табл. 2, оказывает более существенное влияние на равновесное распределение продуктов, увеличивая выход Н2 и СО2 и снижая выход СО, и тем самым существенно увеличивает соотношение Н2/СО.
Моделирование парциального окисления метана в присутствии добавок с использованием детальной кинетической схемы
Хотя в реальных условиях процесс матричной конверсии метана не является изотермическим, для упрощения анализа кинетическое моделирование проведено для такого режима. Учет неизотермичности процесса как в зоне горения метана, так и в постпламенной зоне не сильно влияет на общую физико-химическую картину процесса, больше сказываясь на его временных характеристиках.
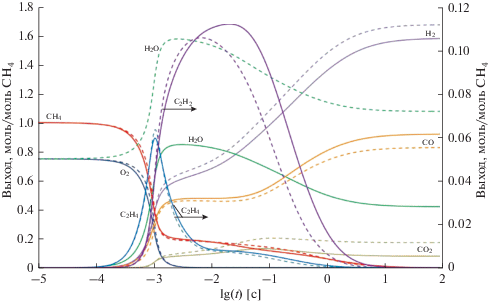
Детальное кинетическое моделирование позволяет проследить за изменением распределения продуктов в ходе реакции парциального окисления метана и за тем, как устанавливается равновесие в системе: СН4 + 2αО2 → Продукты. Для приведенных выше условий матричной конверсии (соотношение кислород : метан = 0.72 : 1, Т = 1600 К) кривые изменения выхода компонентов реакции при парциальном окислении метана для модели plug flow reactor в изотермическом режиме с добавкой 25% Н2 и 14.7% СО и без добавки представлены на рис. 1.
Рис. 1.
Изменение состава газовой смеси при парциальном окислении метана с добавкой (25% Н2 + 14.7% СО) по отношению к метану (пунктирные кривые) и без добавки (сплошные кривые). Соотношение О2/СН4 = 0.72 : 1, Т = 1600 K.

Представленные на рис. 1 расчетные кривые изменения состава газовой смеси как в отсутствие добавки, так и с добавкой синтез-газа, указывают на три характерные стадии гомогенного парциального окисления метана. Первая стадия быстрых реакций с участием кислорода (зона горения) завершается за очень малые времена (менее 10–2 с при 1600 К) его практически полной конверсией, в результате которой образуются СО, Н2, СО2 и Н2О, но в далеком от равновесия соотношении, а также продукты пиролиза метана: этилен и ацетилен и в незначительных количествах этан. Условно временем завершения первой стадии процесса можно считать время достижения конверсии кислорода на уровне 99.5%.
На второй (постпламенной) стадии протекают более медленные реакции паровой конверсии образовавшихся продуктов. Концентрация водорода существенно возрастает, и как показано в [19], величина $\frac{{{\text{[C}}{{{\text{O}}}_{{\text{2}}}}{\text{][}}{{{\text{H}}}_{{\text{2}}}}{\text{]}}}}{{{\text{[CO][}}{{{\text{H}}}_{{\text{2}}}}{\text{O]}}}}$ становится равной значению Кр при равновесии, хотя концентрации продуктов еще не достигают равновесных значений из-за неполного превращения ацетилена и неполной конверсии метана. Для приведенных условий процесса эта стадия протекает в интервале 10–2–10–1 с.
Окончательно равновесие устанавливается на третьей стадии, существенно более продолжительной по времени по сравнению с первыми двумя.
На основании кинетического расчета были получены материальные балансы по компонентам для реакции СН4 + 2αО2 → Продукты для первой и второй зон реакции и установлено влияние вводимых добавок на распределение продуктов. Данные расчетов приведены в табл. 3 и 4. В табл. 3 представлен материальный баланс для первой зоны горения (1) и второй постпламенной зоны (2) при проведении процесса в отсутствие добавок и в присутствии добавки синтез-газа в количестве 25% Н2 и 14.7% СО по отношению к метану в расчете на 100 молей исходной смеси.
Таблица 3.
Материальные балансы компонентов реакции (в расчете на 100 молей метана в исходной смеси) для процесса в отсутствие добавок и в присутствии добавки синтез-газа в количестве 25% Н2 и 14.7% СО по отношению к метану для зоны горения 1 и постпламенной зоны 2
| Выход продуктов, моль | В отсутствие синтез-газа | При добавке синтез-газа | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| вход в зону 1 | выход из зоны 1 | разность для зоны 1 | выход из зоны 2 | разность между зонами 2 и 1 | вход в зону 1 | выход из зоны 1 | разность для зоны 1 | выход из зоны 2 | разность между зонами 2 и 1 | |
| H2 | 0.0 | 63.5 | 63.5 | 97.5 | 34.0 | 25.0 | 77.0 | 52.0 | 112.3 | 35.3 |
| O2 | 72.0 | 0.3 | –1.7 | 0 | –0.3 | 72.1 | 0.3 | –71.7 | 0 | –0.3 |
| H2O | 0.0 | 82.4 | 82.4 | 64.9 | –17.5 | 0.0 | 87.1 | 87.1 | 69.1 | –18.0 |
| CO | 0.0 | 51.1 | 51.1 | 54.9 | 3.8 | 14.7 | 60.2 | 45.5 | 63.7 | 3.5 |
| CO2 | 0.0 | 4.8 | 4.8 | 12.1 | 7.3 | 0.0 | 5.2 | 5.2 | 12.9 | 7.7 |
| CH4 | 100.0 | 20.6 | –79.4 | 13.8 | –6.8 | 100.0 | 23.3 | –76.7 | 16.0 | –7.3 |
| C2H4 | 0.0 | 0.8 | 0.8 | 0.3 | –0.5 | 0.0 | 1.0 | 1.0 | 0.5 | –0.5 |
| C2H2 | 0.0 | 10.1 | 10.1 | 9.0 | –1.1 | 0.0 | 11.2 | 11.2 | 10.3 | –0.9 |
| lg(t) [с] | –2.3 | –0.9 | –2.4 | –1.0 | ||||||
Таблица 4.
Материальные балансы компонентов реакции (в расчете на 100 молей метана в исходной смеси) для процесса в присутствии добавки водорода и добавок синтез-газа в начало постпламенной зоны 2
| Выход продуктов, моль | При добавке синтез-газа в начало постпламенной зоны 2 (при значении lg (t, с) = –2.0) | При добавке Н2 в начало постпламенной зоны 2 (при значении lg (t, с) = –2.0) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| вход в зону 1 | выход из зоны 1 | ввод добавки синтез-газа в начало зоны 2 | выход из зоны 2 | разность для зоны 2 |
вход в зону 1 | выход из зоны 1 | ввод добавки Н2 | выход из зоны 2 | разность для зоны 2 | |
| H2 | 0.0 | 66.9 | 39.5 | 127.2 | 20.8 | 0.0 | 70.5 | 39.5 | 129.9 | 19.9 |
| O2 | 72.0 | 0.3 | – | 0 | –0.3 | 72.0 | 0.3 | – | 0 | –0.3 |
| H2O | 0.0 | 1.1 | – | 68.9 | –12.2 | 0.0 | 79.3 | – | 68.8 | –10.5 |
| CO | 0.0 | 1.4 | 23.3 | 74.4 | –0.3 | 0.0 | 51.2 | – | 55.6 | 4.4 |
| CO2 | 0.0 | 5.7 | – | 11.9 | 6.1 | 0.0 | 6.8 | – | 9.8 | 3.0 |
| CH4 | 100.0 | 19.9 | – | 15.8 | –4.1 | 100.0 | 19.0 | – | 15.3 | –3.7 |
| C2H4 | 0.0 | 0.5 | – | 0.4 | –0.1 | 0.0 | 0.45 | – | 0.45 | 0 |
| C2H2 | 0.0 | 10.5 | – | 9.7 | –0.8 | 0.0 | 10.5 | – | 9.0 | –1.5 |
| lg(t) [с] | –2.01 | –2.01 | –0.98 | – | –1.81 | –1.81 | –0.86 | – | ||
На основании данных, приведенных в табл. 3, уравнение баланса для зоны 1 в расчете на прореагировавшие метан и кислород имеет представленный ниже вид.
В отсутствие добавки:
с добавлением 25% Н2 + 14.7% СО по отношению к метану
Видно, что при введении добавки синтез-газа часть кислорода в зоне 1 расходуется на окисление дополнительно вводимого водорода, снижая его количество, идущее на окисление метана, что было показано нами в [4]. В результате этого снижается доля окисленного метана, снижается образование Н2 и СО, но увеличивается образование Н2О. Негативным фактором введения добавки синтез-газа является увеличение (хоть и небольшое) содержания наиболее нежелательной примеси – ацетилена. Из компонентов синтез-газа более негативно влияет добавка водорода, приводящая к отмеченному выше дополнительному расходу кислорода на его окисление и увеличению доли Н2О. Добавка СО несколько увеличивает содержание СО2, мало влияя на содержание С2Н2.
Это видно из следующих балансовых уравнений, полученных при анализе данных кинетического моделирования процесса в присутствии отдельно взятых добавок Н2 и СО:
добавка 25% Н2 по отношению к метану:
добавка 25% СО по отношению к метану:
Таким образом, добавление в исходную смесь синтез-газа и водорода приводит к небольшому увеличению количества ацетилена, то есть предшественникa сажи.
Вводимые добавки, проходя постпламенную зону 2, почти не оказывают влияния на итоговое распределение компонентов, что видно из табл. 3, и следующих примерных балансов в расчете на прореагировавшие в зоне 2 компоненты:
Учитывая, что введение синтез-газа и водорода в исходные реагенты приводит к дополнительному расходу кислорода на горение части вводимого водорода, нами был рассмотрен вариант влияния на распределение компонентов и образование ацетилена прямого ввода этих добавок в постпламенную зону, минуя зону горения. Полученные расчетные данные представлены в табл. 4.
Из табл. 4 видно, что введение добавок синтез-газа и водорода в начало постпламенной зоны 2 практически не влияет на кинетику образования продуктов реакции. Вводимые добавки следуют через зону 2 как бы “транзитом”, мало влияя на распределение продуктов, особенно на образование и расходование ацетилена, несколько увеличивая время достижения постоянства величины $\frac{{{\text{[C}}{{{\text{O}}}_{{\text{2}}}}{\text{][}}{{{\text{H}}}_{{\text{2}}}}{\text{]}}}}{{{\text{[CO][}}{{{\text{H}}}_{{\text{2}}}}{\text{O]}}}}.$
Экспериментальное исследование влияния добавок водорода и монооксида углерода на матричную конверсию метана в синтез-газ
Ранее экспериментально было показано, что добавление кислорода снижает выход ацетилена при окислительном крекинге легких алканов за счет увеличения доли УВ, вступающих в реакции окисления, а не термического пиролиза [20]. В данной работе было установлено (рис. 2), что добавки водорода до соотношения CH4/Н2 ~ 4 приводят к увеличению селективности образования ацетилена, так как из-за конкуренции между молекулами метана и водорода за кислород происходит увеличение доли метана, расходуемого в процессе пиролиза.
Рис. 2.
Зависимости селективностей (S) образования по углероду СО, ацетилена и СО2 от добавки Н2 в исходную смесь (по отношению к метану).

До добавки Н2 ~ 5% происходит уменьшение селективности образования СО и СО2 (рис. 2), что свидетельствует о снижении скорости окисления метана при добавках водорода в условиях матричной конверсии. Максимальная селективность образования ацетилена наблюдается для добавки Н2 = 5% , для которой симбатно снижается селективность образования СО. Снижение селективности образования ацетилена при добавках Н2 > 10% обусловлено, вероятно, изменением температурного режима работы конвертора. При этом значении, несмотря на увеличение расхода исходной смеси из-за введения добавки водорода, наблюдали повышение температуры входной стороны матрицы.
При добавках СО до значения ~6% происходит уменьшение концентрации СО при одновременном росте селективности образования СО2 (рис. 3), что свидетельствует о более высокой скорости реакции глубокого окисления СО до СО2 по сравнению со скоростью окислительных стадий конверсии метана в условиях матричного риформинга.
Рис. 3.
Зависимости концентрации C монооксида углерода в выходящем газе, селективностей (S) образования по углероду ацетилена и СО2 от добавки СО в исходную смесь по отношению к метану.

При этом происходит незначительное уменьшение селективности образования ацетилена, достигающей минимума при добавлении 5% СО. Увеличение концентрации СО в исходной смеси приводило к постепенному затуханию процесса. Так в экспериментах с добавлением более 16% СО мы уже наблюдали полный срыв пламени с поверхности матрицы и прекращение матричной конверсии.
Влияние добавок Н2О
На рис. 4 представлены результаты кинетического моделирования распределения компонентов в ходе реакции СН4 + 0.75 О2 → Продукты при 1600 К в отсутствие и в присутствии добавки 1 моля Н2О на 1 моль СН4. Видно, что в этом случае влияние добавки более существенно, чем в случае добавок синтез-газа и водорода. Снижение концентрации ацетилена особенно заметно для времени реакции 0.1–0.5 с, характерном для процесса матричной конверсии.
Рис. 4.
Изменение состава продуктов при парциальном окислении метана с добавкой 1 моля Н2О на 1 моль СН4 в исходной смеси (пунктирные кривые) и без добавки (сплошные кривые). Соотношение О2/СН4 = 0.75 : 1, Т = 1600 K.
Материальный баланс для зоны горения (в расчете на 100 молей прореагировавшего метана исходной смеси) может быть представлен следующими выражениями:
в отсутствие добавки Н2О:
при добавке Н2О (1 моль Н2О на 1 моль СН4):
Небольшое различие в распределении компонентов при добавке Н2О в пользу Н2 и СО2 связано, видимо, с небольшим смещением равновесия реакции водяного сдвига; при этом добавка Н2О практически не оказывает влияния на выход С2Н2 в зоне горения.
Для постпламенной зоны 2 материальные балансы компонентов реакции при проведении процесса в отсутствие добавок и в присутствии добавки водяного пара приведены в табл. 5.
Таблица 5.
Материальные балансы компонентов реакции (в расчете на 100 молей метана в исходной смеси) при проведении процесса в отсутствие добавок и в присутствии добавки водяного пара количестве 1 моля Н2О на 1 моль СН4 в исходной смеси для постпламенной зоны 2
| В отсутствие Н2О | При добавке Н2О | |||||
|---|---|---|---|---|---|---|
| вход в зону 2 | выход | разность | вход в зону 2 | выход | разность | |
| H2 | 62.8 | 101.6 | 38.8 | 67.1 | 112.4 | 45.3 |
| O2 | 0.2 | 0.0 | –0.2 | 0.2 | – | –0.2 |
| H2O | 84.8 | 66.4 | –18.4 | 156.9 | 129.5 | –27.4 |
| C2H4 | 1.5 | 0.5 | –1.0 | 1.3 | 0.4 | –0.9 |
| C2H2 | 10.1 | 8.3 | –1.8 | 10.4 | 5.2 | –5.2 |
| CO | 47.8 | 58.0 | 10.2 | 46.2 | 54.7 | 8.5 |
| CO2 | 8.5 | 12.8 | 4.3 | 10.7 | 20.4 | 9.7 |
| CH4 | 19.3 | 11.3 | –8.0 | 18.6 | 13.5 | –5.1 |
| lg (t) [с] | –2.3 | –0.8 | – | –2.3 | –0.8 | – |
Как следует из табл. 5, проведение процесса с добавкой воды (в данном случае 1 моль Н2О на моль СН4 в исходной смеси) приводит к большему расходу воды на паровую конверсию метана и продуктов реакции, и соответственно, к увеличению выхода Н2, снижению выхода СО и С2Н2. Соотношение $\frac{{{\text{[}}{{{\text{H}}}_{{\text{2}}}}{\text{]}}}}{{{\text{[CO]}}}}$ возрастает до 2.06 против 1.75 в отсутствие добавки.
Экспериментальное исследование матричной конверсии метан-кислородной смеси при соотношении СН4 : О2 = 1 : 0.75 показало [5], что введение добавки Н2О до соотношения метан/пар ~ 1.5 приводит к увеличению выхода водорода, так что соотношение $\frac{{{\text{[}}{{{\text{H}}}_{{\text{2}}}}{\text{]}}}}{{{\text{[CO]}}}}$ выше, чем при конверсии без добавки воды (2.0 по сравнению с 1.7). При этом конверсия метана практически не изменилась, но заметно уменьшился выход ацетилена [5].
ЗАКЛЮЧЕНИЕ
Экспериментально и детальным кинетическим моделированием определено влияние добавок водорода, монооксида углерода, синтез-газа и водяного пара на состав продуктов матричной конверсии богатых метан-кислородных смесей. Установлено, что добавки водорода, монооксида углерода и синтез-газа, как при их введении в исходную смесь так и в постпламенную, зону оказывают незначительное влияние на характеристики процесса, в то время как добавки водяного пара снижают выход ацетилена и увеличивают соотношение Н2/СО, существенно улучшая характеристики процесса. Результаты экспериментов с добавками водорода и монооксида углевода в исходную смесь хорошо согласуются с результатами кинетического моделирования: при матричной конверсии в присутствии этих добавок наблюдается увеличение селективности образования ацетилена за счет увеличения доли метана, расходуемого в результате пиролиза.
Список литературы
Arutyunov V.S., Shmelev V.M., Sinev M.Yu., Shapovalova O.V. // Chemical Engineering J. 2011. V. 176–177. P. 291.
Arutyunov V.S., Savchenko V.I., Sedov I.V., Fokin I.G., Nikitin A.V., Strekova L.N. // Chemical Engineering J. 2015. V. 282. P. 206.
Арутюнов В.С., Савченко В.И., Седов И.В., Шмелев В.М., Никитин А.В., Фокин И.Г., Эксанов С.А., Шаповалова О.В., Тимофеев К.А. // Журн. прикладной химии. 2016. Т. 89. № 11. С. 1450.
Савченко В.И., Шаповалова О.В., Никитин А.В., Арутюнов В.С., Седов И.В. // Журн. прикладной химии. 2018. Т. 91. № 9. С.1332.
Никитин А.В., Озерский А.В., Тимофеев К.А., Комаров И.К., Зимин Я.С., Седов И.В., Шмелев В.М., Арутюнов В.С. // Горение и взрыв. 2018. Т. 11. № 2. С. 18.
Nikitin A., Ozersky A, Savchenko V., Sedov I., Shmelev V., Arutyunov V. // Chemical Engineering J. 2019. V. 377. № 120833.
Gupta S.B., Biruduganti M., Bihari B., Sekar R. Natural Gas Fired Reciprocating Engines for Power Generation: Concerns and Recent Advances. 2012. Chapter 10. P. 211. https://doi.org/10.5772/45992. Available at: http://cdn.intechopen.com/pdfs-wm/40563.pdf
Иванов С.С., Тарасов М.Ю. // Нефтяное хозяйство. 2011. № 1. С. 102.
Houseman J., Cerini D.J. On-board hydrogen generator for a partial hydrogen injection internal combustion engine. 1974. Jet Propulsion Laboratory, California Institute of Technology. Contract No. NAS7-100, 74600.
Mobasheri R., Seddiq M., Peng Z.J. // International J. of Hydrogen Energy. 2018. V. 43. I. 3. P. 1875.
Niu R., Yu X., Du Y., Xie H., Wu H., Sun Y. // Fuel. 2016. V. 186. P. 792.
Kim J., Chun K. M., Song S., Baek Hong-Kil, Lee S. W. // International J. of Hydrogen Energy. 2017. V. 42. №. 39. P. 25 074.
Билера И.В., Буравцев Н.Н., Россихин И.В. // Журн. прикладной химии. 2020. Т. 93. № 3. С. 446.
Систер В.Г., Борисов А.А., Трошин К.Я., Билера И.В., Богданов В.А., Политенкова Г.Г., Колбановский Ю.А. // Химическая физика. 2006. Т. 25. № 1. С. 61.
Богданов В. А. Автореферат дис. на соискание звания к.х.н. “Процесс получения синтез-газа при горении сверхбогатых смесей метана и аппараты для его реализации”. МГУИЭ. 2007. https://new-disser.ru/_avtoreferats/01003307904.pdf (дата обращения 19.11.2019).
Trusov B.G. In: Proc. XIV Int. Symp. on Chemical Thermodynamics. 2002. St-Petersburg, Russia. P. 483.
Healy D., Kalitan D.M., Aul C.J., Petersen E.L., Bourque G., Curran H. J. // Energy and Fuels. 2010. V. 24. № 3. P. 1521.
URL: http://www.kintechlab.com/products/chemical-workbench/ сайт программы “Chemical WorkBench” (дата обращения: 07.10.2019).
Savchenko V.I., Nikitin A.V., Sedov I.V., Ozerskii A.V., Arutyunov V.S. // Chem. l Engineering Science. 2019. V. 207. P. 744.
Магомедов Р.Н., Никитин А.В., Савченко В.И., Ару-тюнов В.С. // Кинетика и катализ. 2014. Т. 54. № 6. С. 584.
Дополнительные материалы отсутствуют.


