Нефтехимия, 2020, T. 60, № 5, стр. 644-653
Каталитическое алкилирование адамантана пропиленом: квантово-химические расчеты и данные эксперимента
Н. И. Баранов 1, *, Р. Е. Сафир 1, Е. И. Багрий 2, К. В. Боженко 1, 3, А. Г. Чередниченко 1
1 Российский университет дружбы народов, Кафедра физической и коллоидной химии
117198 Москва, Россия
2 Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Россия
3 Институт проблем химической физики РАН
142432 Москва, г. Черноголовка, Россия
* E-mail: 1042182094@rudn.ru
Поступила в редакцию 19.11.2019
После доработки 02.04.2020
Принята к публикации 12.05.2020
Аннотация
Посредством квантово-химических расчетов в рамках метода функционала электронной плотности (DFT) исследован механизм взаимодействия адамантана с пропиленом. Показано, что основными продуктами алкилирования адамантана пропиленом в присутствии кислотных катализаторов являются углеводороды н-строения: 1-н-пропил- и 1-н-пропениладамантаны. Определены основные стадии алкилирования адамантана, геометрическое и электронное строение интермедиатов. Найдены термодинамические характеристики исследованных адамантанов и предложены механизмы протекания отдельных стадий их превращений. Полученные данные позволяют контролировать процесс получения замещенных адамантанов заданного строения, представляющих интерес для разработки эффективных энергоемких материалов, высокоплотных топлив и термостабильных полимеров.
Открытие в 1933 г. в нефти Годонинского месторождения Ландой и Махачеком насыщенного трициклического углеводорода (УВ) адамантана (С10Н16) положило начало химии нефтяных углеводородов алмазоподобного строения [1]. Необычные физико-химические свойства УВ этого типа – высокие плотность, термическая стабильность, липофильность, химическая активность способствовали многостороннему исследованию производных адамантана и получению на их основе термостабильных углеводородных топлив, смазочных масел, полимерных материалов, биологически активных соединений, лекарственных препаратов, среди которых известные противовирусные (амантадин, римантадин) и иммунотропные (кемантан, мемантин) препараты.
Следует отметить, что во второй половине 20-го века основное внимание исследователей уделялось производным самого адамантана [2]. В настоящее время особый интерес представляют полимантаны – объемные полимеры адамантана (диамондоиды или адамантаноиды). Это наноразмерные молекулы, содержащие несколько адамантильных каркасных фрагментов, которые также содержатся в нефтях и газоконденсатах. Благодаря своим уникальным свойствам, эти соединения и их производные рассматриваются как перспективные во многих областях, в том числе в энергетике, медицине, литографии, электронике, биотехнологии и т.д. [3–6]. Недавно был получен полимер на основе адамантана и пирена, который может использоваться для определения содержания таких взрывчатых веществ, как ди- и тринитротолуолы [7]. Покрытия на основе наноалмазов используются при разделении и очистке белков. Следует отметить, что из-за перспектив практического применения производных диамондоидов в области синтеза высокоэффективных лекарственных препаратов все основные реакции, приводящие к функционализации адамантаноидов различной молекулярной массы (от диамантана до ундекамантана), достаточно хорошо исследованы и запатентованы. При этом синтетические методы получения высших адамантаноидов (выше триамантана) отсутствуют и газовые конденсаты являются их единственным источником. Поэтому актуальной задачей является разработка методов синтеза этих соединений. В качестве возможных исходных соединений здесь могут рассматриваться моно- и полизамещенные непредельные производные адамантана, являющиеся объектом исследования в данной работе. Такое направление использования непредельных производных адамантана может оказаться не менее важным и значимым, чем их применение в качестве мономеров и полупродуктов в тонком органическом синтезе.
Известно, что адамантан – структурное звено наноалмаза, свойства которого сильно зависят от его размера. Эмпирическая формула соединений адамантанового ряда ─ C4n+ 6H4n+ 12, где n – число расположенных в каркасе атомов углерода. Молекула адамантана представляет собой тетраэдр, представленный тремя циклогексановыми фрагментами в конформации “кресло”. Структуры подобного строения являются достаточно жесткими и трудно деформируемыми [8]. Поскольку производные адамантана можно отнести к средним молекулам (содержат от 10 до 100 атомов), применение высокоточных ab initio методов требует большого количества машинного времени. Поэтому часто соответствующие расчеты проводят с помощью метода DFT либо используют полуэмпирические методы. В квантово-химическом исследовании адамантана и его производных выделяют два основных направления: детальное изучение электронной и геометрической структуры адамантана и его гомологов, расчет их ИК-спектров и т.д., а также исследование физико-химических свойств соединений на основе наноалмаза, структурной единицей которого является адамантан [6, 9, 10]. Так на основе квантово-химических расчетов было получено теоретическое обоснование реализации 2,4-метильных сдвигов при превращениях метиладамантилкатионов [11], а также выяснены механизмы отдельных стадий реакции алкилирования адамантана продуктами деструкции изооктана [12]. Образование предельных и непредельных продуктов присоединения происходит через стадию образования третичного адамантилкатиона. Одним из способов его образования в реакционной смеси является распад пентакоординированного иона карбония с выделением молекулярного водорода [12]. Много внимания уделено изучению электронного, геометрического строения и термодинамических функций замещенных адамантанов. В частности, были вычислены энтальпии образования двадцати кислородсодержащих производных адамантана [13]. Методом DFT рассчитано геометрическое и электронное строение кластеров наноалмаза и показано, что при увеличении размера кластера уменьшаются потенциал ионизации и высота энергетической щели. В случае кластеров с диаметром более 1 нм верхний слой представляет собой sp2-гибридизованные атомы углерода, т.е. является графитовым, при этом ядро представляет собой структуру алмаза [13]. Проводились расчеты геометрического и электронного строения производных адамантилиденадамантана [14], а также параметров ИК- и рамановских спектров адамантана [15] и перфторадамантана [16]. Было показано, что при переходе от адамантана к его фторированному аналогу происходит увеличение длины связей C–C на 0.013 Å [16]. В работе [17] методом DFT детально исследованы геометрическое строение, ИК- и рамановские спектры, термодинамические функции кремнийзамещенных производных адамантана C9SiH16 и Si10H16. Кроме частот гармонических колебаний рассчитывалась дипольная поляризуемость адамантана и его аналогов [18]. Более того, методом DFT изучена поверхность и внутренняя структура различных комплексов наноалмазов в форме октаэдров, усеченных октаэдров, кубооктаэдров и кубов [6].
В данной работе представлены результаты квантово-химических расчетов реакции алкилирования адамантана пропиленом, неожиданно оказавшейся пригодной для получения непредельных производных адамантана. Данная реакция рассматривается нами как модельная, с целью оценки возможности использования такого расчетного метода для предсказания реакционной способности и наиболее вероятных направлений превращения адамантана с участием других, более высокомолекулярных олефинов. Представляет интерес исследование механизма алкилирования адамантана различными алкенами, т.к. одними из продуктов реакции являются УВ непредельного строения, которые могут использоваться в дальнейшем в реакциях полимеризации. С этой целью в данной работе исследовано взаимодействие адамантана с пропиленом. Основными продуктами являются 1-н-пропил- и 1-н-пропениладамантаны, причем содержание последнего в реакционной смеси значительно меньше. При этом результаты квантово-химических расчетов реакций по синтезу и дальнейшим превращениям непредельных производных адамантана в настоящее время отсутствуют.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Расчеты с полной оптимизацией геометрии и анализ колебаний в нормальных координатах выполнены в программе Gamess US [19] в приближении B3LYP/6-31G*. Рассчитаны и изучены геометрические параметры веществ (адамантана, 1-н-пропиладамантана, 1-н-пропениладамантана, а также интермедиатов и переходных состояний реакции алкилирования адамантана пропиленом), распределение электронной плотности, термодинамические величины (внутренняя энергия, энтальпия, энтропия), изменения энергии при химических превращениях, частоты нормальных колебаний. Расчет ИК-спектров выполнен в приближении гармонического осциллятора. Доказательством того, что найденная структура относится к энергетическому минимуму, являлось отсутствие мнимых гармонических частот в ИК-спектре. Метод внутренней координаты реакции (IRC – intrinsic reaction coordinate) использовался для подтверждения соответствия переходного состояния определенной реакции. Термические поправки рассчитаны при температуре 298 К и давлении 1 атм. Расчет наиболее важных участков поверхности потенциальной энергии (кривых потенциальной энергии – ПК) выполнялся при изменении координаты реакции с шагом 0.1 Å и оптимизацией всех остальных структурных параметров реакционной системы. Визуализация результатов выполнена в программе Chemcraft [20].
Взаимодействие адамантана с пропиленом C3H6 характеризуется образованием целого ряда продуктов в зависимости от условий протекания реакции и свойств катализатора. При этом образование УВ нормального строения является более предпочтительным процессом по сравнению с образованием адамантанового аналога кумола – 1‑изопропиладамантана. Поэтому нами были рассмотрены два многостадийных процесса, приводящие к образованию 1-н-пропил- и 1-н-пропениладамантанов. В качестве катализатора рассмотрен хлорид алюминия в следующих формах: AlCl3 ⋅ HCl (участвует в отрыве гидрид-аниона от адамантана) и ${\text{AlCl}}_{4}^{ - }$ (участвует в образовании 1-н-пропениладамантана).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Алкилирование адамантана проходит через стадии, включающие взаимодействие ненасыщенного УВ (в данном случае, пропилена) с адамантилкатионом. Энергия отрыва гидрид-аниона от адамантана составляет: AdH → Ad+ + H–, ΔH = 267.9 ккал/моль. При использовании в качестве катализатора AlCl3 ⋅ HCl тепловой эффект химической реакции AdH + AlCl3 ⋅ HCl → Ad+ + + H2 + ${\text{AlCl}}_{4}^{ - }$ составляет ΔH = 84.9 ккал/моль.
Полные энергии всех рассчитанных систем приведены в табл. 1, а рассмотренные реакции и соответствующие им тепловые эффекты ─ в табл. 2.
Таблица 1.
Полные энергии (Еполн) рассчитанных молекул в приближении B3LYP/6-31G* в атомных единицах (а.е.)1. AdH – адамантан (С10H16), Ad+ – третичный адамантилкатион $\left( {{{{\text{C}}}_{{{\text{10}}}}}{\text{H}}_{{15}}^{ + }} \right)$
| Молекула | Еполн, а.е. | Молекула | Еполн, а.е. |
|---|---|---|---|
| AdH | –390.72683 | Ad–CH=CH–CH3(транс) | –507.43639 |
| Ad+ | –389.83816 | Ad–CH=CH–CH3(цис) | –507.42837 |
| H– | –0.46182 | Ad–CH–(CH3)2 | –508.66239 |
| H2 | –1.17548 | Ad–CH2–C+H–СH3 | –507.75875 |
| AlCl3 ⋅ HCl | –2084.03855 | Ad–(CH2)2–CH3 | –508.66512 |
| C3H6 | –117.90759 | Ad–CH2–CH2–CH3 ⋅ Ad+ | –898.50775 |
| Ad–CH2–C+H–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ | –2591.51566 | ${\text{AlCl}}_{4}^{ - }$ | −2083.61639 |
| Ad–C+H–CH2–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ | –2591.49190 |
Таблица 2.
Тепловые эффекты изученных химических реакций в ккал/моль
| № п/п | Реакция | ΔH, ккал/моль |
|---|---|---|
| 1 | AdH → Ad+ + H– | 267.9 |
| 2 | AdH + AlCl3 ⋅ HCl → Ad+ + H2 + ${\text{AlCl}}_{4}^{ - }$ | 84.9 |
| 3 | AdH + C3H6 → Ad–(CH2)2–CH3 | –19.3 |
| 4 | AdH + C3H6 → Ad–CH=СH–CH3(транс) + H2 | 14.2 |
| 5 | AdH + C3H6 → Ad–CH=CH–CH3(цис) + H2 | 19.2 |
| 6 | AdH + C3H6 → Ad–CH–(CH3)2 | –17.6 |
| 7 | Ad+ + C3H6 → Ad–CH2–C+H–CH3 | –8.2 |
| 8 | Ad–CH2–C+H–CH3 + Ad–H → Ad–(CH2)2–CH3 ⋅ Ad+ | –13.9 |
| 9 | Ad–(CH2)2–CH3 ⋅ Ad+ → Ad–(CH2)2–CH3 + Ad+ | 2.8 |
| 10 | Ad–CH2–C+H–CH3 + ${\text{AlCl}}_{4}^{ - }$ → Ad–CH2–C+H–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ | –88.2 |
| 11 | Ad–CH2–C+H–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ → Ad–C+H–CH2–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ | 14.9 |
| 12 | Ad–C+H–CH2–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ → Ad–CH=CH–CH3(транс) + AlCl3 ⋅ HCl | 10.6 |
| 13 | Ad–CH2–C+H–CH3 → Ad–CH=CH–CH3(цис) + H+ | 207.3 |
| 14 | Ad–CH2–C+H–CH3 + ${\text{AlCl}}_{4}^{ - }$ → Ad–CH=CH–CH3(цис) + AlCl3 ⋅ HCl | –57.6 |
| 15 | Ad–CH2–C+H–CH3 → Ad–CH=CH–CH3(транс) + H+ | 202.3 |
| 16 | Ad–CH2–C+H–CH3 + ${\text{AlCl}}_{4}^{ - }$ → Ad–CH=CH–CH3(транс) + AlCl3 ⋅ HCl | –62.6 |
Геометрические структуры основных продуктов химического превращения – 1-н-пропил- и 1-н-пропениладамантана представлены на рис. 1.
Рис. 1.
Геометрическая структура 1-н-пропиладамантана (а), 1-н-транс-пропениладамантана (б), 1-н-цис-пропенил-адамантана (в). Расстояния указаны в ангстремах (Å).

Ниже представлена схема реакций алкилирования адамантана в положение 1 пропиленом с образованием 1-н-пропиладамантана:
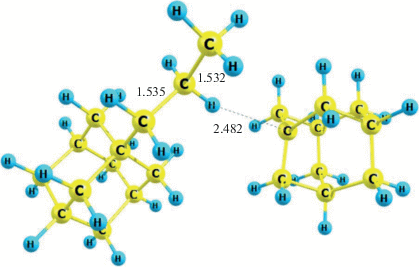
Как видно из табл. 2, где приведены тепловые эффекты стадий алкилирования адамантана пропиленом, стадии 2 и 3 образования пропиладамантана являются экзотермическими, а стадия 4 – эндотермической, соответственно номера 7, 8 и 9. в табл. 2. На стадии 3 образуется комплекс Ad–(CH2)2–CH3 ⋅ Ad+, представленный на рис. 2 (энергия комплексообразования ΔH = –13.9 ккал/моль). Данный комплекс распадается на 1-н-пропиладамантан и третичный адамантилкатион с тепловым эффектом ΔH = = 2.8 ккал/моль.
Рис. 2.
Геометрическая структура межмолекулярного комплекса Ad–(CH2)2–CH3 ⋅ Ad+. Расстояния указаны в ангстремах (Å).
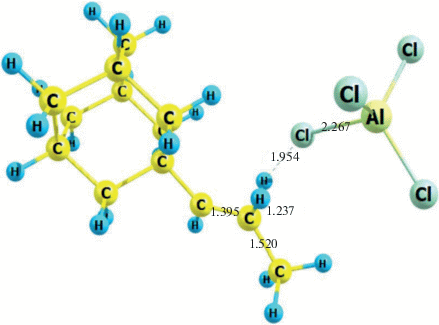
Катион Ad–CH2–C+H–CH3 (рис. 3) является основной реакционной частицей при алкилировании адамантана пропиленом. Его взаимодействие с еще одной молекулой адамантана позволяет получить 1-н-пропиладамантан, а с молекулой катализатора – 1-н-пропениладамантан. В работе [12] при исследовании реакции алкилирования адамантана изобутиленом показано, что процесс происходит с участием аналогичных структур, которые образуются безбарьерно. При расчете ПК образования катиона Ad–CH2–C+H–CH3 в качестве координаты реакции использовали длину связи R (С1–С2), которая изменялась от 1.51 до 4.11 Å с шагом 0.1 Å. При каждом фиксированном значении R(С1–С2) оптимизировались все структурные параметры катиона Ad–CH2–C+H–CH3. Как видно из рис. 4, процесс образования данного катиона протекает безбарьерно. При значении R (С1–С2) = 1.81 Å наблюдается минимум, соответствующий катиону Ad–CH2–C+H–CH3.
Рис. 3.
Геометрическая структура Ad–CH2–C+H–CH3. Расстояние R(С1–С2) использовалось в качестве координаты реакции Ad+ + C3H6 → Ad–CH2–C+H–CH3.Расстояния указаны в ангстремах (Å).

Рис. 4.
Зависимость изменения потенциальной энергии (ПК) реакции Ad+ + C3H6 → Ad–CH2–C+H–CH3. Шаг сканирования 0.1 Å.

На третьей стадии при присоединении второй молекулы адамантана происходит перенос гидрид-аниона на катион Ad–CH2–C+H–CH3, и данный комплекс эндотермически распадается на 1-н-пропиладамантан и 1-адамантилкатион с тепловым эффектом ΔH = 2.8 ккал/моль (табл. 2). Характерной особенностью реакции является отрыв гидрид-аниона от второй молекулы адамантана на стадии 3, в то время как для аналогичной реакции адамантана с изобутиленом интермедиат на этом этапе содержит водород, координированный между атомами углерода двух молекул без переноса гидрид-аниона [12].
Ниже представлена схема реакции алкилирования адамантана в положение 1 пропиленом с образованием 1-н-пропениладамантана:
Образование 1-н-пропениладамантана начинается со стадий 1 и 2 рассмотренного выше процесса образования 1-н-пропиладамантана. Как видно из табл. 2, на стадии 3 образуется комплекс Ad–CH2–C+H–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ (рис. 5) с тепловым эффектом ΔH = –88.2 ккал/моль. В данном комплексе атом хлора аниона тетрахлорида алюминия координируется с катионом Ad–CH2–C+H–CH3. Полученный комплекс не является переходным состоянием реакции образования 1-н-пропенил-адамантана, о чем свидетельствует отсутствие в его ИК-спектре мнимых частот.
Рис. 5.
Геометрическая структура интермедиата реакции образования 1-н-пропениладамантана, Ad–CH2–C+H–CH3 ⋅ · ${\text{AlCl}}_{4}^{ - }.$ Расстояния указаны в ангстремах (Å).
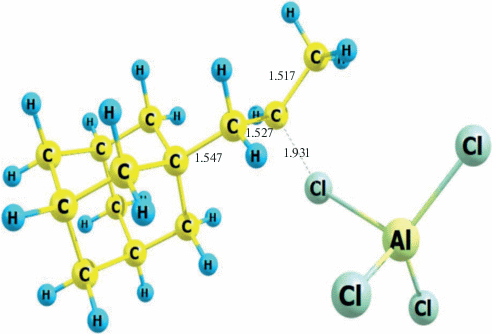
При расчете ПК стадии 4 в качестве координаты реакции использовали значение R (С1–H1), которое изменялось от 1.16 до 1.66 Å с шагом 0.1 Å (рис. 6). И при каждом фиксированном значении R (С1–H1) оптимизировали все остальные структурные параметры комплекса Ad–C+H–CH2–CH3 ⋅ ⋅ ${\text{AlCl}}_{4}^{ - }.$ Геометрическая структура переходного состояния данной стадии представлена на рис. 7. Комплекс Ad–CH2–C+H–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ превращается в комплекс Ad–C+H–CH2–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ (рис. 8) с энергией активации 15.4 ккал/моль. На стадии 5 происходит распад с образованием 1-н-пропениладамантана и комплекса хлорида алюминия c хлористым водородом AlCl3 ⋅ HCl.
Рис. 6.
Зависимость изменения потенциальной энергии (ПК) Ad–CH2–C+H–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ → Ad–C+H–CH2–CH3 ⋅ · ${\text{AlCl}}_{4}^{ - }.$ Шаг сканирования – 0.1 Å.

Рис. 7.
Геометрическая структура переходного состояния (TS) реакции Ad–CH2–C+H–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }$ → Ad–C+H–CH2–CH3 ⋅ ${\text{AlCl}}_{4}^{ - }.$ Расстояние R(С1–H1) использовалось в качестве координаты реакции. Еполн = –2591.49117 а.е.

Рассматривая реакцию Ad–CH2–CH+–CH3 → → Ad–CH=CH–CH3(транс) + H+ следует отметить, что для отделения протона необходима дополнительная энергия ΔН = 202.3 ккал/моль. При использовании катализатора (например, ${\text{AlCl}}_{4}^{ - }$ или другого акцептора протонов) отделение протона происходит с выделением энергии:
Таким образом, из полученных результатов следует, что образование насыщенных продуктов реакции (1-н-пропиладамантана) сопровождается выделением энергии, а ненасыщенного (1-пропениладамантана) без катализатора – поглощением энергии. Выход 1-н-пропениладамантана при увеличении температуры будет существенно меньше, чем 1-н-пропиладамантана, что и наблюдается в эксперименте (табл. 3). Ионное алкилирование адамантана осуществляется олефинами в присутствии различных катализаторов (ЦЕОКАР, алюмосиликаты, галогениды алюминия). В случае использования в качестве катализаторов галогенидов алюминия алкилирование происходит даже в мягких условиях (при температуре –10°С), продукты представляют собой смесь алкиладамантанов различной длины. При алкилировании низшими алкенами также образуются непредельные соединения, с увеличением молекулярной массы олефинов выход таких производных падает [2].
Таблица 3.
Продукты алкилирования адамантана пропиленом [1]
| Продукт | Содержание в реакционной смеси, мас. % | ||
|---|---|---|---|
| алюмосиликат типа Гудри, 280°C | ЦЕОКАР-2, 280°C | H2SO4/Al2O3, 190°C | |
| Адамантан (Ad) | 48 | 41 | 53 |
| 1-Пропенил-Ad | – | 6 | 29 |
| 1-н-Пропил-Ad | 28 | 28 | 6 |
| 2-н-Пропил-Ad | 3 | 2 | – |
| 1-Изопропил-Ad | 7.5 | 7.5 | 2 |
| 1,3-Дипропенил-Ad | – | – | 4 |
| Пропилпропенил-Ad и дипропил-Ad | 12 | 14 | 5.5 |
| 1-Гексил-Ad | 1.5 | 1.5 | 0.5 |
ЗАКЛЮЧЕНИЕ
Посредством квантово-химических расчетов (приближение B3LYP/6-31G*) изучены особенности механизмов каталитической реакции алкилирования адамантана пропиленом. Показано, что на первой стадии происходит образование третичного 1-адамантилкатиона, который впоследствии присоединяет пропилен. При взаимодействии образовавшегося катиона Ad–CH2–C+H–CH3 с молекулой адамантана образуется предельный УВ –1-н-пропиладамантан и генерируется новый 1-адамантилкатион, а при взаимодействии с молекулой катализатора образуется непредельный продукт реакции алкилирования – 1-н-пропениладамантан. Преимущественное образование 1-н-пропиладамантана объясняется термодинамическими особенностями рассмотренных реакций, что подтверждается проведенными расчетами. Увеличение кислотной силы катализатора и понижение температуры процесса будет способствовать выходу непредельного продукта в реакции каталитического алкилирования адамантана.
Список литературы
Landa S., Machacek V. // Coll. Czechosl. Chem. Commun. 1933. Vol. 5, № 1. P. 1–5. https://doi.org/10.1135/cccc19330001
Багрий Е.И. Адамантаны: получение, свойства, применение. М.: Наука, 1989. 264 с.
Gunawan M.A., Hierso J.C., Poinsot D., Fokin A.A., Fokina N.A., Tkachenko B.A., Schreiner P.R. // New J. Chem. 2014. V. 38. P. 28. https://doi.org/10.1039/C3NJ00535F
Нехаев А.И., Багрий Е.И., Максимов А.Л. // Нефтехимия. 2011. Т. 51. № 2. С. 97 [Petrol. Chemistry. 2011. V. 51. № 2. P. 86. https://doi.org/10.1134/S0965544111020095]
Новаков И.А., Орлинсон Б.С., Сабиров З.М., Уразбаев В.Н., Монаков Ю.Б. // Высокомолекулярные соединения. Серия Б. 1993. Т. 35. № 12. С. 2053.
Barnard A.S., Sternberg M. // J. Mater. Chem. 2007. № 17. P. 4811. https://doi.org/10.1039/b710189a
Wu H., Xu H., Tao F., Su X., Yu W.W., Lia T., Cui Y. // New J. Chem. 2018. № 42. P. 12 802. https://doi.org/10.1039/c8nj01881b
Kovalenko A., Yumusak C., Heinrichova P., Stritesky S., Fekete L., Vala M., Weiter M., Sariciftci N.S., Krajcovic J. // J. Mater. Chem. C. 2017. V. 5. P. 4716. https://doi.org/10.1039/C6TC05076J
Kamiya Katsumasa, Okada Susumu // Jpn. J. Appl. Phys. 2012. V. 51. P. 015 001. https://doi.org/10.1143/JJAP.51.015001
Datta A., Kirca M., Fu Y., To A.C. // Nanotechnology. 2011. V. 22. № 6. P. 065 706. https://doi.org/10.1088/0957-4484/22/6/065706
Борисов Ю.А., Багрий Е.И. // Доклады Академии наук. 2015. Т. 463. № 1. С. 54. [Dokl. Phys. Chem. 2015. V. 463. № 1. P. 141. https://doi.org/10.1134/S0012501615070015https://doi.org/10.7868/S0869565215190147
Багрий Е.И., Борисов Ю.А., Колбановский Ю.А., Максимов А.Л. // Нефтехимия. 2019. Т. 59. № 1. С. 64. [Petrol. Chemistry. 2019. V. 59. № 1. P. 66. https://doi.org/10.1134/S0965544119010067https://doi.org/10.1134/S0028242119010064
Зауэр Е.А., Зауэр З.О. // Журн. физической химии. 2009. Т. 83. № 4. С. 681 [Russ. J. Phys. Chem. A. 2009. V. 83. № 4. P. 582. https://doi.org/10.1134/S0036024409040128]
Rıza Abbasoğlu, Sevil Savaşkan Yılmaz // J. Mol. Struct.: THEOCHEM. 2002. V. 589. P. 431. https://doi.org/10.1016/S0166-1280(02)00278-6
Jensen J.O. // Spectrochim. Acta. A. 2004. V. 60. № 8–9. P. 1895. https://doi.org/10.1016/j.saa.2003.09.024
Kovács S.A., Szabó A. // J. Mol. Struct. 2000. V. 519. P. 13. https://doi.org/10.1016/S0022-2860(99)00278-1
Miranda W.D.S.A., Coutinho S.S., Tavares M.S., Moreira E., Azevedo D.L. // J. Mol. Struct. 2016. V. 1122. P. 299. https://doi.org/10.1016/j.molstruc.2016.05.103
Sauer S., Paidarová I., Čársky P., Čurík R. // Eur. Phys. J. D. 2016. V. 70. P. 105. https://doi.org/10.1140/epjd/e2016-70084-x
Schmidt M.W., Baldridge K.K., Boatz J.A., Elbert S.T., Gordon M.S., Jensen J.H., Koseki S., Matsunaga N., Nguyen K.A., Su S.J., Windus T.L., Dupuis M., Montgomery J.A. // J. Comput. Chem. 1993. V. 14. № 11. P. 1347. https://doi.org/10.1002/jcc.540141112
https://www.chemcraftprog.com/сайт программы Chemcraft (дата обращения 25.04.2019).
Дополнительные материалы отсутствуют.