Нефтехимия, 2020, T. 60, № 5, стр. 663-670
Особенности углекислотной конверсии метана в присутствии катализаторов на основе GdFeO3
Т. А. Крючкова 1, *, Т. Ф. Шешко 1, В. В. Кость 1, И. В. Числова 2, Л. В. Яфарова 2, И. А. Зверева 2, А. С. Лядов 1, 3, **
1 Российский университет Дружбы народов, Факультет физико-математических и естественных наук, кафедра физической и коллоидной химии
117198 Москва, Россия
2 Санкт-Петербургский государственный университет, Институт химии
198504 Санкт-Петербург, Россия
3 Институт нефтехимического синтеза им. А.В. Топчиева РАН
119991 Москва, Россия
* E-mail: kryuchkova-ta@rudn.ru
** E-mail: lyadov@ips.ac.ru
Поступила в редакцию 02.05.2020
После доработки 07.05.2020
Принята к публикации 12.05.2020
Аннотация
Изучены особенности протекания процесса углекислотной конверсии метана в присутствии перовскитоподобного сложного оксида состава GdFeO3, полученного несколькими способами (твердофазный, цитрат-нитратный и глицин-нитратный золь–гель). Установлено, что использование золь–гель метода приводит к формированию пористых катализаторов, состоящих из наноразмерных частиц. Значительные различия в морфологии и текстуре отражаются и на каталитических свойствах GdFeO3. Образец, полученный цитрат-нитратным золь–гель методом, позволяет с селективностью 90% превращать водород исходного метана в молекулярный водород. Было показано, что катализаторы на основе GdFeO3 сохраняют стабильность работы в течение длительного времени.
Углекислотная конверсия метана (УКМ) является эффективным способом получения синтез-газа:
Процесс УКМ протекает в присутствии катализаторов, содержащих различные переходные металлы (Ni, Ru, Rh, Pd и др.) [3–5]. Однако, большинство известных катализаторов подвержены быстрой дезактивации за счет отложения углерода на их поверхности, который образуется при крекинге метана [6]: CH4 → C + 2H2.
Таким образом, создание стабильно работающих в течение длительного времени каталитических систем – актуальная задача, стоящая перед исследователями. Известно, что каталитические системы на основе перовскитоподобных сложных оксидов являются устойчивыми в процессах, идущих при высоких температурах [7, 8], а метод синтеза может оказывать значительное влияние на каталитическую активность и селективность в отношении образования целевых продуктов [9]. Также известно, что введение редкоземельных элементов в каталитические системы позволяет в ряде случаев значительно увеличивать срок их службы [10–12]. Проведенные ранее исследования [13] показали, что сложный оксид состава GdFeO3 проявляет каталитическую активность в процессе УКМ. Других исследований перовскитных структур на основе гадолиния и железа в качестве катализаторов УКМ в литературе не было обнаружено.
Цель настоящей работы – изучение углекислотной конверсии метана в присутствии сложного оксида состава GdFeO3, полученного несколькими способами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез катализаторов
Синтез сложного оксида состава GdFeO3 осуществляли по золь–гель технологии при атмосферном давлении воздуха с использованием цитрат-нитратной и глицин-нитратной методик, а также методом твердофазного синтеза.
Цитрат-нитратный метод синтеза. В качестве исходных реагентов использовали Gd(NO3)3 · · 6H2O квалификации “х. ч.” (ТУ 6-09-4676-83), Fe(NO3)3 · 9H2O квалификации “ч.” (ТУ 6-09-02-553-96), лимонную кислоту и раствор аммиака. Стехиометрические количества исходных веществ Gd(NO3)3 · 6H2O и Fe(NO3)3 · 9H2O помещали в колбу и при перемешивании добавляли дистиллированную воду до тех пор, пока смесь не растворялась полностью. Затем добавляли двукратный избыток лимонной кислоты, и, после ее растворения при интенсивном перемешивании, по каплям дозировали раствор аммиака до значения pH 6. Полученный золь нагревали до 80–100°С и выдерживали при этой температуре до образования коричневого пористого сухого геля. Затем гель прокаливали при постепенном увеличении температуры от 100 до 450°С и выдерживали при этой температуре 2 ч.
Глицин-нитратный метод синтеза. Данная методика аналогична первой, за исключением того, что вместо лимонной кислоты и аммиака использовали глицин.
Твердофазный метод синтез. Получение оксида GdFeO3 методом твердофазного синтеза проводили по реакции:
Навески исходных веществ, Gd2O3 (марка ССТ с содержанием основного компонента 99.99%, предварительно прокаленный при 900°С в течение 4 ч) и Fe2O3 (марка “ч. д. а.”, просушенный при 300°С в течениe 2 ч) тщательно перетирали в агатовой ступке в течение одного часа. Затем смесь исходных веществ прессовали в таблетки массой 0.5 г и диаметром 0.7 см. Обжиг образцов проводили при 1300°С в течение 17 ч с последующей закалкой на воздухе.
Определение физико-химических характеристик катализаторов
Контроль полноты синтеза и формирования необходимых фаз осуществляли методом рентгенофазового анализа (РФА). Рентгенографические исследования проводили на дифрактометре Rigaku “MiniFlex II” при комнатной температуре с CuKα-излучением, интервал сканирования углов 2θ = 10°–60°, скорость сканирования – 5°/мин. Для идентификации фаз использовали базу данных PDF2.
Изучение морфологии и микроструктуры полученных образцов проводили с помощью сканирующего электронного микроскопа Zeiss Merlin с ускоряющим напряжением 10 кВ, который работает в режиме низкого вакуума и не требует напыления для непроводящих образцов. Аналитические возможности микроскопа расширены дополнительными приставками для рентгеновского микроанализа Oxford Instruments INCAx-act и системой регистрации дифракции обратнорассеянных электронов (EBSD) Oxford Instruments CHANNEL5.
Наличие и характер термических эффектов, возникающих при нагревании образцов, исследовали методом синхронного термического анализа на приборе Netzsch STA449 F1 Jupiter, сопряженным с квадрупольным масс-спектрометром Netzsch QMS 403 С Aeolos для анализа выделяющихся газов. Измерения проводили в диапазоне температур 298–1273 К со скоростью нагревания 10 К/мин.
Измерения свойств поверхности образцов осуществляли с помощью метода низкотемпературной адсорбции азота при Т = 77 К на приборе Nova 4200e (Quantachrome). Полученные изотермы адсорбции–десорбции были использованы для оценки величины удельной поверхности образцов по методу БЭТ, а также для оценки величины пор.
Состояния атомов железа во всех исследуемых образцах изучены с помощью Мёссбауэровской спектроскопии. Спектры были записаны при комнатной температуре на спектрометра Wissel (57Co в матрице родия с активностью 10 mKu), изомерные сдвиги были рассчитаны по отношению к α-Fe. Для оценки доли атомов железа в различном состоянии интенсивность сигналов была определена с точностью до коэффициента резонансного поглощения.
Изучение каталитической активности синтезированных катализаторов
Каталитическую активность синтезированных катализаторов в процессе УКМ определяли в проточной каталитической установке при атмосферном давлении и объемных скоростях 0.9–1.0 л/ч, в интервале температур 773–1223 К. В качестве реакционной смеси использовали смесь газов с соотношением компонентов СО2 : СН4 = 1 : 1. Навеска катализатора во всех экспериментах была равна 0.1 г.
Анализ продуктов реакции осуществляли хроматографическим методом на приборе Кристалл 2000 М (колонка с Porapak Q, детекторы по теплопроводности и пламенно-ионизационный). Значения конверсий и скоростей расходования метана и углекислого газа, скоростей образования продуктов реакции при каждой заданной температуре измеряли после достижения стационарного состояния, о котором судили по постоянству площадей хроматографических пиков. Конверсии (Xi) CH4 и CO2 рассчитывали по формуле:
(1)
${{X}_{i}}~\left( \% \right) = \frac{{{{n}_{{{\text{int}}}}} - {{n}_{{{\text{out}}}}}}}{{{{n}_{{{\text{int}}}}}}} \times 100\% ,$Селективности S в отношении водорода и монооксида углерода вычисляли по формулам (2) и (3), соответветственно:
(2)
${{S}_{{{{{\text{H}}}_{2}}}}}\left( \% \right) = \frac{{n~{{{\left( {{{{\text{H}}}_{2}}} \right)}}_{{{\text{produced}}}}}}}{{2n{{{({\text{C}}{{{\text{H}}}_{4}})}}_{{{\text{converted}}}}}}} \times 100{\text{\% }},$(3)
${{S}_{{{\text{CO}}}}}\left( \% \right) = \frac{{n~{{{\left( {{\text{CO}}} \right)}}_{{{\text{produced}}}}}}}{{n{{{({\text{C}}{{{\text{H}}}_{4}})}}_{{{\text{converted}}}}} + n{{{({\text{C}}{{{\text{O}}}_{2}})}}_{{{\text{converted}}}}}}} \times 100{\text{\% ,}}$Соотношение H2/CO определяли по формуле (4):
(4)
$\frac{{{{{\text{H}}}_{2}}}}{{{\text{CO}}}}{\text{соотошение}} = \frac{{n({{{\text{H}}}_{2}})}}{{n\left( {{\text{CO}}} \right)}}.$Ошибка в определении каждого компонента не превышала 5 отн. %.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Методом РФА (рис. 1) было установлено, что все синтезированные образцы являются однофазными, положения рентгеновских пиков соответствуют только фазе GdFeO3, которая имеет орторомбическую перовскитоподобную структуру и относится к пространственной группе Pbnm. Интенсивность дифракционных пиков несколько меняется в зависимости от методики получения сложного оксида. Для образцов, полученных золь–гель методом, наблюдается небольшое уширение пиков, что свидетельствует об образовании более мелких кристаллитов в процессе синтеза.
Рис. 1.
Дифрактограммы сложного оксида GdFeO3, полученного различными методами: 1 – твердофазный метод синтеза; 2 – цитрат-нитратный золь–гель метод; 3 – глицин-нитратный золь−гель метод (PDF2 01-072-9911).

На рис. 2 представлены микрофотографии синтезированных катализаторов. Образцы, полученные золь−гель методом, но с различными хелатными лигандами, имеют схожую морфологию: частицы имеют пористую структуру, вытянутую форму с длиной кристаллитов 100–200 нм и диаметром порядка 50 нм. Поверхность образца полученного твердофазным методом синтеза непористая и шероховатая, а сами частицы имеют четкую “огранку” и характеризуются размером около 10 мкм.
Рис. 2.
Микрофотографии GdFeO3, синтезированного различными методами: (а) твердофазный метод синтеза; (б) цитрат-нитратный золь–гель метод; (в) глицин-нитратный золь–гель метод.

В табл. 1 приведены значения средних размеров частиц, удельной площади поверхности и характеристики пористости для всех исследованных образцов. Было установлено, что образцы, синтезированные “керамическим” методом, находятся в субмикрокристаллическом состоянии, а полученные по золь–гель методу – в нанокристаллическом. Результаты определения удельной поверхности катализаторов, хорошо согласуются с данными микроскопии. Удельная поверхность образов, полученных золь–гель методом на порядок больше, чем у образца, синтезированного “керамическим” способом. Состояния атомов железа в сложных перовскитоподобных ферритах гадолиния были исследованы с помощью Мёссбауэровской спектроскопии. Для образцов GdFeO3, полученных золь–гель методом, обнаружено состояние атомов железа Fe3+ в двух полях различной симметрии, причем одно из них является магнитоупорядоченным, а второе – только квадрупольным. Возможно, наличие дополнительной формы железа может быть реализовано за счет искаженного кислородного окружения на поверхности сложных оксидов. Изучение спектра GdFeO3, полученного керамическим способом, показало, что атомы железа находятся в единственном состоянии – Fe3+, и оно имеет магнитное расщепление.
Таблица 1.
Текстурные характеристики и параметры Мессбауэровских спектров сложных оксидов GdFeO3
| Образец | Dcp, мкм | Sуд, м2/г | V, см3/г | ${{\bar {r}}_{{{\text{пор}}}}}{\text{,}}$ нм | Fen+ | δ, мм/с | χ, % |
|---|---|---|---|---|---|---|---|
| GdFeO3 (s-g citric) | 0.05 | 7.5 | 0.004 | 3.0 | Fe+3 | 0.12 | 6 |
| Fe+3 | 0.36 | 94 | |||||
| GdFeO3 (s-g glycine) | 0.04 | 4.4 | 0.003 | 2.4 | Fe+3 | 0.30 | 10 |
| Fe+3 | 0.37 | 90 | |||||
| GdFeO3 (ceramic) | ≈10 | 0.7 | – | – | Fe+3 | 0.36 | 100 |
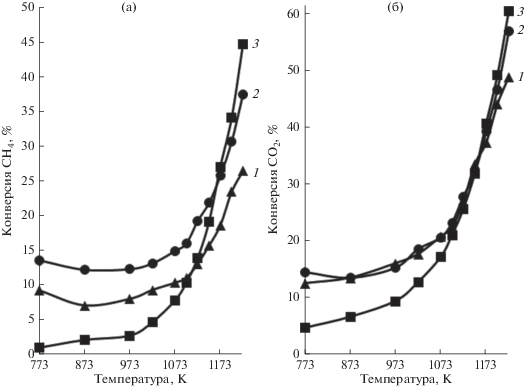
Все синтезированные образцы феррита гадолиния проявили каталитическую активность в процессе УКМ. Было установлено, что с повышением температуры активность катализаторов возрастает, о чем свидетельствует увеличение конверсии метана и диоксида углерода (рис. 3). В области высоких температур наибольшую активность проявил образец, полученный цитрат-нитратным золь–гель методом. Для него при 1223 К значения конверсий метана и СО2 достигали 45 и 60% соответственно, что почти в 1.5–2 раза превышала значения, полученные для образца, синтезированного твердофазным способом.
Рис. 3.
Зависимость конверсии метана (а) и диоксида углерода (б) от температуры в присутствии GdFeO3, синтезированного различными методами: 1 – твердофазный метод синтеза; 2 – глицин-нитратный золь−гель метод; 3 – цитрат-нитратный золь−гель метод.
Аналогичным образом меняется и селективность в отношении образования водорода и моноксида углерода с повышением температуры (табл. 2). Наибольшие показатели селективности были достигнуты при протекании процесса углекислотной конверсии метана в присутствии GdFeO3, полученного цитрат-нитратным золь−гель методом. Способ синтеза катализатора оказывает существенное влияние и на соотношение H2/CO. Выбор золь–гель метода при синтезе катализатора позволяет получать образцы, на которых образуется большее количество водорода в отходящем газе при прочих равных условиях проведения процесса.
Таблица 2.
Каталитические свойства GdFeO3, синтезированного различными методами, в процессе углекислотной конверсии метана
| Показатель | Температура, К | Катализатор | ||
|---|---|---|---|---|
| GdFeO3 (ceramic) | GdFeO3 (s-g glycine) | GdFeO3 (s-g citric) | ||
| S(H2), % | 1123 | 16 | 11 | 37 |
| 1173 | 28 | 24 | 46 | |
| 1223 | 38 | 40 | 56 | |
| S(CO), % | 1123 | 59 | 45 | 79 |
| 1173 | 71 | 60 | 88 | |
| 1223 | 75 | 66 | 90 | |
| H2/CO | 1123 | 0.18 | 0.23 | 0.28 |
| 1173 | 0.26 | 0.30 | 0.42 | |
| 1223 | 0.36 | 0.46 | 0.60 | |
Исследование стабильности работы катализаторов проводили в периодическом режиме (нагрев
катализатора до температуры эксперимента – Т = = 1173 К), выдерживание в изотермических условиях в течение 8–10 ч, охлаждение
в реакционной среде до комнатной температуры, повторение всех этапов в последующие
дни эксперимента, число циклов – 6). В качестве тестового образца был выбран наиболее
активный образец, полученный цитрат-нитратным золь−гель методом. На рис. 4 представлены временн е зависимости селективностей по водороду и монооксиду углерода. Видно, что феррит
гадолиния проявил высокую стабильность: каталитические характеристики сохранялись
неизменными более 50 ч работы в условиях реакции.
е зависимости селективностей по водороду и монооксиду углерода. Видно, что феррит
гадолиния проявил высокую стабильность: каталитические характеристики сохранялись
неизменными более 50 ч работы в условиях реакции.
Рис. 4.
Зависимость селективности по водороду, монооксиду углерода и балансу по углероду для GdFeO3 (s-g citric) от времени эксперимента.

Катализаторы после проведения каталитических экспериментов были изучены методом РФА. Было установлено, что, несмотря на достаточно жесткие условия (высокие температуры; окислительная атмосфера) катализа, структура сложных оксидов GdFeO3 и их фазовый состав остаются неизменным.
Сравнение данных СЭМ для исследованных образцов до и после каталитических испытаний позволяет сделать вывод, что в результате высокотемпературного процесса происходит некоторая агломерация с образованием иррегулярных более крупных частиц, приводящая к уменьшению удельной поверхности образцов, снижению пористости и появлению “шероховатости”. В качестве примера на рис. 5а и б представлены микрофотографии образцов GdFeO3 (s-g citric) до и после проведения каталитических испытаний. Некоторые изменения в текстурных характеристиках образцов, однако, не сказываются на их каталитических свойствах.
Рис. 5.
Микрофотографии GdFeO3, синтезированного цитрат-нитратным золь−гель методом: (а) исходный образец, (б) после катализа, (в) EDX-спектр поверхности после катализа.

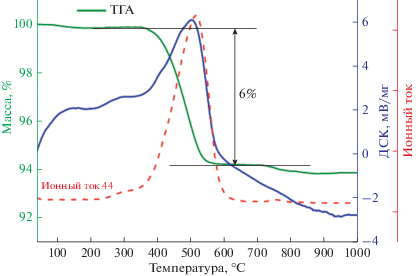
Элементный анализ (рис. 5в) демонстрирует наличие углерода на поверхности исследованных ферритов, причем его осаждение происходило неравномерно. Наличие пиков кремния принадлежит кварцу – инертной добавке. Данные термического анализа для GdFeO3 (s-g citric) после катализа представлены на рис. 6. На кривой изменения массы фиксируется один этап потери массы, находящийся в области температур 623–861 К, что соответствует выгоранию углерода с поверхности катализатора, при этом потеря массы составила 6%. Это также подтверждается масс-спектрометрией выделившихся газов. В отходящем газе при нагревании катализатора был обнаружен только углекислый газ.
Таким образом, в ходе проведенного исследования было установлено, что перовскитопободный сложный оксид состава GdFeO3 проявляет высокую каталитическую активность в процессе углекислотной конверсии метана при этом катализатор способен сохранять стабильность работы в течение длительного времени. Было показано, что способ синтеза оказывает существенное влияние на каталитические свойства. Так использование золь−гель метода по сравнению с твердофазным способом синтеза, позволяет не только повысить общую активность катализатора, но и в значительной степени увеличить селективность в отношении водорода, что в свою очередь приводит к повышению соотношения H2/CO в образующейся газовой смеси.
Список литературы
Yabe T., Sekine Y. // Fuel Processing Technology. 2018. V. 181. P. 187. https://doi.org/10.1016/j.fuproc.2018.09.014
Usman M., Wan Daud W.M.A., Abbas H.F. // Renewable and Sustainable Energy Reviews. 2015. V. 45. P. 710. https://doi.org/10.1016/j.rser.2015.02.026
Abdulrasheed A., Jalil A.A., Gambo Y., Ibrahim M., Hambali H.U., Shahul Hamid M.Y. // Renewable and Sustainable Energy Reviews. 2019. V. 108. P. 175. https://doi.org/10.1016/j.rser.2019.03.054
Aziz M.A.A., Setiabudi H.D., Teh L.P., Annuar N.H.R., Jalil A.A. // J. of the Taiwan Institute of Chemical Engineers. 2019. V. 101. P. 139. https://doi.org/10.1016/j.jtice.2019.04.047
Dębek R., Azzolina-Jury F., Travert A., Maugé F. // Renewable and Sustainable Energy Reviews. 2019. V. 116. Article 109427. https://doi.org/10.1016/j.rser.2019.109427
Takano A, Tagawa T., Goto S. // J. of тhe Japan Petroleum Institute. 1996. V. 39. № 2. P. 144. https://doi.org/10.1627/jpi1958.39.144
Xu X., Zhong Y., Shao Z. // Trends in Chemistry. 2019. V. 1. № 4. P. 410. https://doi.org/10.1016/j.trechm.2019.05.006
Маркова Е.Б., Лядов А.С., Курилкин В.В. // Журнал физ. химии. 2016. Т. 90. № 9. С. 1336 [Russian J. of Physical Chemistry. A. 2016. V. 90. № 9. P. 1752. https://doi.org/10.1134/S0036024416090193].https://doi.org/10.7868/S0044453716090193
Assirey E.A.R. // Saudi Pharmaceutical J. 2019. V. 27. № 6. P. 817. https://doi.org/10.1016/j.jsps.2019.05.003
Frontera P., Macario A., Malara A., Antonucci V., Modafferi V., Antonucci P.L. // Catalysis Today. 2019.https://doi.org/10.1016/j.cattod.2019.05.065
Zhang Y., Zhou Y., Shi J., Zhou S., Zhang Z., Zhang S., Guo M. // Fuel Processing Technology. 2013. V. 111. P. 94. https://doi.org/10.1016/j.fuproc.2013.02.001
Vu B.K., Song M.B., Ahn I.Y., Suh Y.-W., Shin E.W. // Catalysis Today. 2011. V. 164. P. 214. https://doi.org/10.1016/j.cattod.2010.10.007
Шешко Т.Ф., Шараева А.А., Пауэлл О.К., Серов Ю.М., Числова И.В., Яфарова Л.В., Королева А.В., Зверева И.А. // Наногетерогенный катализ. 2020. Т. 5. № 1. С. 17. https://doi.org/10.1134/S2414215820010128
Дополнительные материалы отсутствуют.