Нефтехимия, 2020, T. 60, № 5, стр. 671-678
Синтез катализатора, полученного с использованием металлорганических каркасов, для процесса Фишера–Тропша
H. Janani 1, *, A. Rezvani 1, **, A. A. Mirzaei 1, ***
1 Department of Chemistry, Faculty of Science, University of Sistan and Baluchestan
98135-674 Zahedan, Iran
* E-mail: halimehjanani@yahoo.com
** E-mail: rezvani2001ir@yahoo.ca
*** E-mail: mirzaei@hamoon.usb.ac.ir
Поступила в редакцию 10.04.2019
После доработки 24.04.2020
Принята к публикации 12.05.2020
Аннотация
750°C (скорость нагрева 2°C/мин) в течение 6 ч. После прокаливания образец представлял собой сыпучий пористый материал низкой плотности, состоящий из регулярных кубических кристаллов. Значения удельной поверхности и объема пор полученного – материала – 276 м2/г и 0.31 см3/г соответственно. Катализатор на основе Co–Ni–МОК обладает селективностью по углеводородам (УВ) с длинной цепью $\left( {{\text{С}}_{5}^{ + }} \right)$ – 52%, а по УВ с короткой цепью (C2–C4) – 30%. Относительно высокая активность (TOF = 2.08 с–1 при 340°C) объяснена высокой пористостью и большим размером пор катализатора, что облегчает диффузию УВ. Уникальные свойства данного катализатора, включающие структурные характеристики (высокая удельная поверхность, пористость, однородность и стабильность) позволяют ему быть активным катализатором синтеза Фишера–Тропша.
Металлорганические каркасы (МОК) – класс материалов, состоящих из ионов металла и органических лигандов. Они могут быть превращены в пористые структуры с помощью различных методов, таких как гидролиз, пиролиз, гидротермальная или сольвотермическая кристаллизация и др. В последнее время к разработке и производству МОК привлечено большое внимание ввиду их уникальных структурных и функциональных свойств [1–3]. Эти органо-неорганические гибридные материалы широко используют для хранения и разделения газов, в сенсорах и оптике, в медицине для транспорта лекарственных средств в организме человека, в нефтехимии, гетерогенном катализе и пр. [1–4]. В частности, катализ является одной из наиболее перспективных областей применения МОК. Данные материалы способны катализировать большое количество химических реакций с большой эффективностью. Материалы, полученные из МОК, обладают высокой пористостью, большой удельной поверхностью, большим объемом пор и большой дисперсностью металлических частиц, что необходимо для осуществления каталитического процесса.
Синтез Фишера–Тропша (СФТ) – широко известный каталитический процесс превращения синтез-газа (СО + Н2) в жидкие УВ. В результате реакции образуется смесь УВ различной молекулярной массы [5, 6]. Стандартные катализаторы СФТ содержат Fe, Ni, Co, Ru или Rh в качестве активного металла, при этом Fe и Co являются наиболее часто используемыми. Co-содержащие катализаторы характеризуются доступной ценой, высокой активностью, меньшим образованием CO2 и малой активностью в реакции водяного газа, поэтому они являются наиболее используемыми катализаторами промышленных процессов СФТ. Синтез биметаллических катализаторов, состоящих из двух и более металлических или оксидных фаз, из металлорганических каркасов является новым подходом, предоставляющим несколько преимуществ, таких как синергизм металлических компонентов, дисперсия металлических фаз и максимальная концентрация активных компонентов, что может привести к разработке “идеального” катализатора СФТ [7, 8]. В последнее время было установлено, что Fe- и Co-содержащие катализаторы СФТ, полученные из МОК, обеспечивают высокую степень превращения CO и высокую селективность процесса. Полученные из МОК катализаторы обладают высокой дисперсностью металлической фазы, заключенной в пористую матрицу, и высокой активностью в СФТ. Эти катализаторы были получены метода-ми пиролиза, гидролиза и сольвотермолиза [9, 10].
В данной работе для приготовления активного катализатора СФТ использовали биядерный металлорганический комплекс. Выбранный металлорганический каркас может быть приемлемым и перспективным для промышленной адаптации каталитической системы. В этой работе показан подход для приготовления активного и стабильного катализатора СФТ с использованием метода термоокислительной обработки смеси глицин–МОК. Этот способ синтеза основан на глицин-нитратном методе сжигания [11] и является альтернативным методом разработки новых активных катализаторов этого процесса. При этом для получения каталитической системы не используются промоторы и носители. Традиционные нанесенные катализаторы являются механически более стабильными и обладают большей каталитической активностью. Однако сильное взаимодействие между металлом и носителем может негативно влиять на их каталитическую активность. В зависимости от природы взаимодействия между металлом и носителем нанесенные катализаторы проявляют значительные различия в каталитических и адсорбционных свойствах. Взаимодействия металл–носитель влияют также на каталитическую активность и распределение продуктов реакции [12].
Для исключения влияния взаимодействия металл–носитель на каталитические характеристики был приготовлен и протестирован кобальтовый катализатор синтеза Фишера–Тропша с высокой концентрацией и дисперсностью активного компонента. При использовании этого катализатора была достигнута конверсия СО 75% и хорошая селективность образования тяжелых УВ. Он оказался одним из немногих, обладающих хорошей каталитической эффективностью в СФТ по сравнению с другими МОК-производными кобальтовыми катализаторами, хотя для его приготовления не использовали никакие дополнительные промоторы или носители [1–4, 10]. В данной работе показана возможность использования нового способа получения катализаторов для СФТ с высокой активностью и оптимальной селективностью, основанного на применении нового подхода к синтезу каталитической системы и подходящего прекурсора МОК.
Дополнительнпая информация по этой статье доступна по DOI для авторизованных пользователей (рисунки и табл.)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализатора. Металлорганический комплекс готовили согласно [13]. Моноядерный комплекс Сo синтезировали с помощью добавления 2-метил-2,4-бис(6-иминопиридин-2-ил)-1H-1,5-бензодиазепина к эквимолярному количеству дихлорида кобальта(II) в среде дихлорметан/этанол. Полученный комплекс реагировал с раствором дихлорида никеля(II) в этаноле с образованием Co–Ni-биядерного комплекса. Были получены желтые микрокристаллы с выходом 75%. Результаты элементного анализа, ИК-Фурье-спектроскопиии, УФ-спектроскопии МОК соответствовали литературным данным. Чистоту образца подтвердили методом рентгеновской дифракции монокристалла. Наблюдаемые полосы в ИК-Фурье-спектре образца (KBr, см–1): 3361, 1620 (νC=N), 1590, 1470, 1369, 1200, 808.1 и 769.1.
В дальнейшем полученный прекурсор МОК использовали для синтеза катализатора СФТ. Для этого 0.01 моль металлорганического комплекса и 0.04 моля глицина добавляли в дистиллированную воду. Полученную смесь перемешивали магнитной мешалкой при 60−70°C до тех пор, пока не образовывался гомогенный золь, который затем прокаливали в трубчатом реакторе при 750°C в течение 6 ч со скоростью нагрева 2°С/мин. После этого образец восстанавливали в токе H2 (60 мл/мин) при 400°C в течение 10 ч, а затем исследовали в реакции СФТ.
Испытание катализатора. Co–Ni-катализатор испытывали в СФТ в трубчатом микрореакторе из нержавеющей стали с неподвижным слоем катализатора при давлении 1 МПа. 1 г катализатора восстанавливали в токе H2 (60 мл/мин) при атмосферном давлении при 400°C в течение 10 ч. Затем водород отключали и снижали температуру до 200°C. При этой температуре увеличивали давление до 1.0 МПа. Испытание активности проводили в диапазоне температур 260−340°C в течение 10 ч при каждой температуре после установления равновесия в среде синтез-газа состава H2/CO = 2 (газовая смесь 32% CO, 63% H2, 5% N2) и объемной скорости подачи газа (GHSV) 3600 ч–1. Продукты реакции анализировали on line на газовом хроматографе, снабженном 10-ти ходовым краном (Supelco Сompany, Visi Model, USA) с простой петлей, детектором по теплопроводности, насадочной колонкой (Hayesep DB, Alltech Company) и ПИД. Селективность была рассчитана по углероду (рис. S1 ).
Изучение характеристик катализатора. Термогравиметрический анализ (ТГА) МОК проводили в среде воздуха в интервале температур от комнатной до 800°C (скорость нагрева 3°C/мин), используя термический анализатор BAHR-STA 503. Электронный спектр получали с помощью спектрофотометра JASCO 7850. ИК-Фурье спектр регистрировали с помощью ИК-Фурье спектрометра Perkin Elmer в таблетках KBr (рис. S2 ). Порошковую рентгеновскую дифракцию снимали с помощью рентгеновского дифрактометра Inel Equinox 3000 с CuKα-излучением. Удельную поверхность (БЭТ) определяли с помощью микрометрического адсорбционного газоанализатора (Quantachrome Instrument, model Nova 2000), используя азот (чистота 99.99%) в качестве анализируемого газа – образцы медленно нагревали в атмосфере азота от температуры −196 до 300°C в течение 6 ч. Микрофотографии образца (СЭМ), результаты рентгеноспектрального микроанализа (РСМА) и энергодисперсионной рентгеновской спектроскопии (ЭРС) получали с помощью сканирующего электронного микроскопа Philips XL30 (Netherland). Элементный анализ катализатора проводили с помощью атомно-адсорбционной спектроскопии (AAnalyst 200, Perkin Elmer) и масс-спектрометрии с индуктивно связанной плазмой (ИСП-МС) (Perkin Elmer’s NexION 2000 ICP Mass Spectrometer).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Физико-химические свойства МОК. Кристаллическая структура данного МОК состоит из одного катиона никеля(II), одного катиона кобальта(II), одной молекулы лиганда (2-метил-2,4-бис(6-иминопиридин-2-ил)-1H-1,5-бензодиазипин), одной молекулы этанола и четырех хлорид-ионов. Бидентантный лиганд связывает кобальт и никель. Центр кобальта принимает форму искаженной тригональной пирамиды. Экваториальное положение занимает азот (N(5)) пиридина и два хлорид-иона. Два других атома азота (N(4) и N(6)) находятся в аксиальной плоскости. Координационная геометрия никелевого центра – искаженный октаэдр. Полученные для МОК результаты ИК-Фурье-спектроскопии и элементного анализа согласуются с литературными данными [13]. Чистота образца была подтверждена с помощью порошковой рентгеновской дифракции. На кривой ТГА металлорганического каркаса находятся две области потери массы: первая (около 150°C) была отнесена к испарению этанола, а вторая (около 650°C) была отнесена к полному разрушению МОК. Таким образом, чтобы обеспечить полное восстановление металла, для прокаливания была выбрана высокая температура – 700°C (рис. S3 ).
Физико-химические свойства катализатора. Полученный катализатор был охарактеризован методами РФА, низкотемпературной адсорбции азота (БЭТ), сканирующей электронной микроскопии (СЭМ), рентгеноспектрального микроанализа (РСМА), энергодисперсионной рентгеновской спектроскопии (ЭРС) и атомно-адсорбционной спектроскопии (ААС).
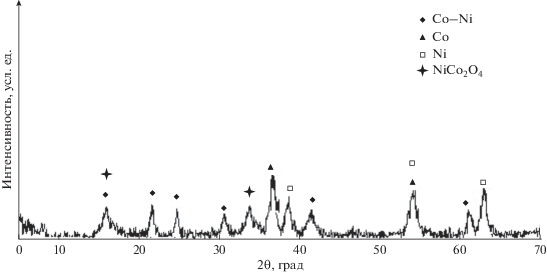
На рис. 1 показана дифрактограмма свежего катализатора, на которой присутствуют пики шпинельных смешанных оксидов металлов NiCo2O4, сплава Co–Ni и металлических (Co и Ni). Согласно дифрактограмме, смешанные оксиды металлов кристаллизуются в виде шпинели с пространственной группой симметрии Fd3m. Как показано на рис. 1, дифракционные пики сплава Co−Ni находятся при значениях угла 2θ равных 16°, 21.5°, 24.4°, 30.6°, 41.3° и 61°.
Данные результаты свидетельствуют о том, что металлические никель и кобальт восстанавливаются в виде сплава. Характерные дифракционные пики слабые и широкие, что свидетельствует о малых размерах и большой дисперсности металлических частиц. В табл. 1 приведены размеры частиц сплава Co–Ni, металлических фаз и шпинелеподобного оксида, полученные с помощью уравнения Дебая–Шеррера [14]. Размеры частиц сплава Co–Ni, металлических фаз Ni, Co и NiCo2O4 находятся в диапазоне 12–30 нм, что свидетельствует о высокой удельной поверхности частиц и их устойчивости к агломерации. После реакции размеры частиц сплава Co–Ni и металлических фаз Ni и Co увеличиваются до 22 и ~40–46 нм соответственно. В литературе сообщалось, что размер частиц сплава Co–Ni меньше, чем размер отдельных металлических частиц Ni и Co; данный факт свидетельствует о большей стабильности частиц сплава Co–Ni к агломерации, чем у отдельных металлических частиц [15]. Эти результаты согласуются с результатами низкотемпературной адсорбции азота, СЭМ и РСМА, свидетельствующими о том, что более пористая структура приводит к большей удельной поверхности образца. Такая большая удельная поверхность обеспечивает большую степень дисперсности образца.
Таблица 1.
Размер частиц (нм), определенный по результатам рентгенофазового анализа
| Образец | Co–Ni | Ni | Co | NiCo2O4 |
|---|---|---|---|---|
| До реакции | 12 | 25 | 30 | 15 |
| После реакции | 22 | 40 | 46 | 23 |
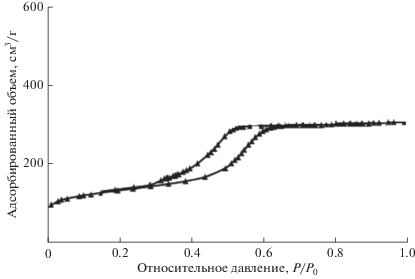
Согласно результатам адсорбции азота, удельная поверхность по БЭТ и общий объем пор катализатора составляют 276 м2/г и 0.31 см3/г соответственно. Изотерма адсорбции/десорбции азота катализатора имеет резкий изгиб при относительном давлении 0.5 (рис. 2) и соответствует IV типу изотермы с петлей гистерезиса (тип H3) между кривыми адсорбции и десорбции, что свидетельствует о наличии мезопористых полостей с очень широким распределением по размеру. В таком большом объеме пор катализатора могут существовать более активные для протекания целевой реакции металлические центры. Больший размер пор катализатора (20 нм) может облегчать диффузию УВ с длинной цепью. Эти результаты согласуются с данными о среднем размере пор, полученными из ширины пиков в рентгеновских исследованиях. Меньший размер частиц приводит к большей удельной поверхности. Кроме того, более развитая удельная поверхность может привести к лучшему распределению частиц. Вместе с тем, широкие мезопоры также благоприятны для облегчения диффузии газа, что приводит к большей каталитической активности [10]. Эти результаты подтверждают данные СЭМ и РСМА.
Сканирующая электронная микроскопия в комбинации с элементным картированием (РСМА и ЭРС) дают дополнительную информацию о морфологии прекурсора МОК и соответствующего ему катализатора, полученного из МОК. Очевидно, что кристаллы прекурсора МОК имеют ярко выраженную кубическую структуру (рис. 3а). В ходе прокаливания в трубчатом реакторе морфологические характеристики катализатора, синтезированного из МОК, полностью меняются и он превращается в высокопористый и сыпучий материал с низкой плотностью (рис. 3б), что делает его подходящим для применения в катализе. На рис. 4 показаны результаты РСМА для катализатора. Распределение Co и Ni полностью однородно и неизменно на атомном уровне.
Для анализа элементного состава поверхности был проведен дополнительный комбинационный ЭРС-анализ. ЭРС-спектр катализатора (рис. 5) демонстрирует наличие атомов Co, Ni, C и N в образце, что подтверждается данными порошковой рентгеновской дифракции. Методом атомно-адсорбционной спектроскопии (AAnalyst 200, Perkin Elmer, USA) было определено содержание Co и Ni в катализаторе. Эти данные сопоставлены с результатами ИСП-МС (Perkin Elmer’s NexION 2000 ICP Масс-спектрометр) анализа (22.38% Co и 21.97% Ni). Результаты атомно-адсорбционной спектроскопии свидетельствуют о большой концентрации металла и превосходной дисперсии Co и Ni (44.35%) на поверхности катализатора. Также, согласно элементному анализу, в полученном катализаторе содержатся азот, кислород и углерод (45.18% С, 5.41% О и 5.06% N).
Испытания активности катализатора. Полученный из МОК катализатор испытали в реакции СФТ при давлении 1 МПа и H2/CO = 2. В табл. 2 представлено распределение продуктов и значения каталитической активности. Активность катализатора исследовали в диапазоне температур 260−340°C. Стоит отметить, что при температурах ниже 260°C конверсия CO была мала (~40%). Степень превращения CO увеличивалась почти линейно с увеличением температуры реакции. Активность протекания реакции, очевидно, возрастает при повышении температуры. При 320°C конверсия CO возрастает до 75%, что свидетельствует о высокой активности синтезированного катализатора в реакции СФТ [2, 9, 10, 16]. Отмеченная высокая степень превращения CO на катализаторе связана с большим значением удельной поверхности (согласно данным БЭТ), большой концентрацией металлов (основываясь на результатах элементного анализа и РСМА) и пористой текстурой катализатора (подтвержденной СЭМ). Более того, большой размер пор данного катализатора может способствовать ускорению диффузии газа в углеродной матрице и, тем самым, увеличивать каталитическую активность (согласно результатам сорбции N2). Также очевидна более высокая, по сравнению с другими кобальтовыми системами на основе МОК, селективность катализатора. Поскольку в СФТ CO превращается в CO2 и УВ (C1–Cn), а ${\text{С}}_{5}^{ + }$-продукты являются летучими жидкостями, они зачастую остаются в реакторе и не определяются с помощью ГХ. При 320°C селективность по ${\text{С}}_{5}^{ + }$-УВ достигла 52%, а селективность по олефинам с короткой цепью (C2–C4) была 30.3%. Обычно Co–Ni-катализаторы СФТ имеют более высокую селективность по отношению к УВ с длинной цепью. Полученные нами результаты каталитической активности значительно выше, чем у большинства катализаторов СФТ, известных из литературы [2, 9, 10, 16–18]. Согласно литературным данным, азотсодержащие частицы поверхности катализатора являются важным компонентом его структуры. Известно, что именно эта часть поверхности рассматривается в качестве донора электронов для интенсификации процесса адсорбции–диссоциации CO и селективности образования конечных продуктов в СФТ. Кроме того, присутствие азотсодержащих фрагментов в каталитической структуре изменяет валентное состояние кобальта и, таким образом, способствует синтезу УВ с короткой цепью. Сильное электростатическое взаимодействие оказывает значительное влияние на физико-химические свойства частиц кобальта, особенно на его способность к восстановлению. Электростатическое взаимодействие оксида кобальта и азотсодержащих фрагментов катализатора может приводить к тому, что восстановление оксидов будет происходить за счет освобождения атомов кислорода из решетки. Об аналогичных явлениях сообщалось в работах [9, 10, 19–22].
Таблица 2.
Активность катализатора, синтезированного из МОК, в реакции СФТ
| Температура, °C | Конверсия CO, % | Селективность по углеводородам, % | TOF, с–1 | |||
|---|---|---|---|---|---|---|
| C2–C4 | ${\text{С}}_{5}^{ + }$ | CH4 | селективность по CO2, % | |||
| 260 280 300 320 340 |
48 51 63 75 75 |
26.0 27.5 28.1 30.3 30.8 |
39.6 46.0 48.4 51.8 51.9 |
14.0 14.8 15.2 15.7 16.6 |
9.8 6.4 4.1 1.2 0.4 |
1.33 1.41 1.75 2.08 2.08 |
| Значение суммы селективностей ниже, чем 100%. Это может быть связано с гипотетической потерей летучей части ${\text{С}}_{5}^{ + }$ и это значение систематически возрастает при уменьшении температуры. | ||||||
Стабильность катализатора исследовали в 200-часовом пробеге при 320°C, 1 МПа, H2/CO = 2 и GHSV 3600 ч–1. В ходе эксперимента активность катализатора и селективность по УВ значительно не изменялись. Текстурные свойства также приводят к превосходной стабильности катализатора. Согласно результатам сорбции N2, у данного катализатора большой размер пор. Широкие мезопоры дополнительно увеличивают каталитическую активность, поскольку они ускоряют диффузию газа внутрь углеродной матрицы, вызывая тем самым отсрочку дезактивации катализатора. Противоположно этому, в узких порах катализатора после образования УВ продукты покрывают активные центры, и, таким образом, происходит дезактивация катализатора.
Наряду с образованием активных фаз, важными характеристиками данного катализатора, полученного из МОК, являются высокое содержание металла, высокая пористость и большое значение удельного объема пор. Катализатор с такими свойствами может служить в качестве “идеального” катализатора процесса Фишера–Тропша.
Как показывают результаты данной работы, каталитическая активность связана с физико-химическими характеристиками катализатора. На свойства катализатора зачастую влияют два фактора: метод приготовления и природа прекурсора. Вышеупомянутые результаты подчеркивают влияние метода приготовления на каталитические свойства и активность в реакции СФТ. Мы сравнили наш катализатор со множеством моно- и гетеро-биметаллических кобальтсодержащих катализаторов, приготовленных различными методами. Многие характеристики и достигнутые результаты для данного катализатора сопоставимы с предыдущими работами, хотя необходимо отметить и достигнутые нами новые результаты. Так, например, стабильность катализатора была выше (200 ч работы без значительных изменений активности по сравнению со 102 [2] и 50 ч [23]). Данный катализатор обладает большей селективностью по отношению к УВ с короткой цепью (селективность по C2–C4 равна 30%) по сравнению с другими кобальтсодержащими катализаторами (6 [2], 14 [8], 22 [17] и 11% [18]). Этот катализатор также обеспечивал относительно высокую селективность по ${\text{С}}_{5}^{ + }$ (примерно 52%) в сравнении с другими кобальтсодержащими катализаторами (10 [8], 54 [17] и 49.83% [18]). Было рассчитано значение TOF для рассматриваемого катализатора (табл. 2) и оно сравнимо (или больше), чем значения TOF, полученные на других катализаторах, синтезированных из МОК (TOF = 0.019, 0.031, 0.028 [2], 0.027, 0.091 [9] и 0.07, 0.11 с–1 [16]). Степень превращения CO на данном катализаторе (75%) также выше по сравнению с опубликованными ранее значениями: 15.8 [2], 30 [10], 44.5 [8], 16 [17] и 37.34% [18]. Приведенные выше результаты свидетельствуют о том, что данный катализатор очень перспективен в СФТ, в отличие от других синтезированных из МОК кобальтсодержащих катализаторов.
Таким образом, в данной работе в качестве металлорганической каркасной структуры для синтеза активного Co–Ni-катализатора СФТ был использован гетероядерный Co–Ni-комплекс. Катализатор СФТ, полученный из МОК, был приготовлен с помощью термоокислительной обработки смеси глицин–МОК. Синтез был осуществлен без подложки или какого-либо промотора, что привело к высокому содержанию металлической фазы (44.35 мас. %) в катализаторе. Полученный с помощью данного метода катализатор содержал большое количество металлических наночастиц (22.38 мас. % Co, 21.97 мас. % Ni) с высокой дисперсностью. Физико-химические характеристики и результаты каталитической активности свидетельствуют о том, что синтезированный катализатор проявляет заметную активность (TOF = 2.08 с–1) и высокую селективность по ${\text{С}}_{5}^{ + }$-соединениям (52%). Результаты, представленные в данной работе, показывают, что метод приготовления катализатора, основанный на термоокислительной обработке смеси глицин–МОК, является хорошим способом получения высокодисперсных наночастиц металлов в пористой матрице с высокой активностью в СФТ. Насколько нам известно, данный монолитный МОК-катализатор является одним из наиболее активных и стабильных катализаторов СФТ. Его активность связана с увеличением удельной поверхности диспергированных наночастиц, структурой и большим объемом пор полученного катализатора. Мы обнаружили, что указанный метод синтеза привел к необходимым для металлических катализаторов свойствам, таким как пористая структура, высокая концентрация, стабильность и активность, о которых не сообщалось ранее, поэтому он может быть использован для производства промышленных катализаторов.
Список литературы
Jiao L., Wang Y., Jiang H.L., Xu Q. // Adv. Mater. 2018. V. 30. P. 37.
Sun X., Suarez A.I.O., Meijerink M., Van Deelen T., Ould-Chikh S., Zečević J., Gascon J. // Nat. Commun. 2017. V. 8. P. 1680.
Cui Y., Li B., He H., Zhou W., Chen B., Qian G. // Acc. Chem. Res. 2016. V. 49. P. 483.
Majewski M.B., Peters A.W., Wasielewski M.R., Hupp J.T., Farha O.K. // ACS Energy Lett. 2018. V. 3. P. 598.
Almeida L.C., Echave F.J., Sanz O., Centeno M.A., Arzamendi G., Gandia L.M., Montes M. // Chem. Eng. J. 2011. V. 167. P. 536.
Pour A.N., Housaindokht M.R., Zarkesh J., Tayyari S.F. // J. Ind. Eng. Chem. 2010. V. 16. P. 1025.
Yan X., Huang Q., Li B., Xu X., Chen Y., Zhu S., Shen S. // J. Ind. Eng. Chem. 2013. V. 19. P. 561.
Janani H., Rezvani A.R., Grivani G.H., Mirzaei A.A. // J. Inorg. Organomet. Polym. Mater. 2015. V. 25. P. 1169.
An B., Cheng K., Wang C., Wang Y., Lin W. // ACS Catal. 2016. V. 6. P. 3610.
Qiu B., Yang C., Guo W., Xu Y., Liang Z., Ma D., Zou R. // J. Mater. Chem. A. 2017. V. 5. P. 8081.
Wang Y., Zhu J., Zhang L., Yang X., Lu L., Wang X. // Mater. Lett. 2006. V. 60. P. 1767.
Vannice M.A., Garten R.L. // J. Catal. 1980. V. 66. P. 242.
Zhang S., Xing Q., Sun W.H. // RSC Adv. 2016. V. 6. P. 72 170.
Ciambelli P., Cimino S., De Rossi S., Faticanti M., Lisi L., Minelli G., Turco M. // Appl. Catal., B. 2000. V. 24. P. 243.
Wang Z., Wang C., Chen S., Liu Y. // Int. J. Hydrogen Energy. 2014. V. 39. P. 5644.
Santos V.P., Wezendonk T.A., Jaén J.J.D., Dugulan A.I., Nasalevich M.A., Islam H.U., Koeken A.C. // Nat. Commun. 2015. V. 6. P. 6451.
Ye J., Haiquan S., Fenghua B., Yong D., Yulong Z. // Appl. Organometal. Chem. 2009. V. 23. P. 86.
Shanghong Z., Dongping D., Fenghua B., Haiquan S. // J. Rare Earth. 2011. V. 29. P. 349.
Fu T., Liu R., Lv J., Li Z. // Fuel Process. Technol. 2014. V. 122. P. 49.
He L., Weniger F., Neumann H., Beller M. // Angew. Chem. Int. Ed. 2016. V. 55. P. 12582.
Yang Z., Guo S., Pan X., Wang J., Bao X. // Energy Environ. Sci. 2011. V. 4. P. 4500.
Yang Y.F., Jia L.T., Hou B., Li D.B., Wang J.G., Sun Y.H. // J. Phys. Chem. C. 2014. V. 118. P. 268.
Schulte H.J., Graf B., Xia W., Muhler M. // Chem. Cat. Chem. 2012. V. 4. P. 350.
Дополнительные материалы
- скачать ESM.zip
- Архив с дополнительными материалами к статье