Нейрохимия, 2019, T. 36, № 4, стр. 327-338
Влияние гипотермии на некоторые структурно-функциональные характеристики лактатдегидрогеназы мозга крыс
Р. А. Халилов 1, А. М. Джафарова 1, С. И. Хизриева 1, В. Р. Абдуллаев 1
1 Дагестанский государственный университет
Махачкала, Россия
Поступила в редакцию 27.08.2018
После доработки 14.11.2018
Принята к публикации 22.11.2018
Аннотация
Исследованы активность и некоторые физико-химические параметры ЛДГ мозга крыс в норме и гипотермии. Обнаружено, что при гипотермии активность ЛДГ мозга крыс повышается, причем это повышение в очищенном от балластных белков ферментативном препарате менее выражено. Исследование собственной флуоресценции ЛДГ показало снижение интенсивности общей флуоресценции ЛДГ, в которое основной вклад вносят остатки триптофана. При этом анализ вторых производных спектров флуоресценции выявил, что гипотермия затрагивает триптофанилы, локализованные на периферии молекулы ЛДГ. Исследование кинетики связывания флуоресцентного зонда АНС с ЛДГ показало наличие, по крайне мере, двух типов участков связывания зонда, отличающихся по полярности. Гипотермия приводит к снижению интенсивности флуоресценции АНС, уменьшению числа участков связывания, повышению констант диссоциации зонда и смещению позиции перегиба на графике температурной зависимости флуоресценции АНС в область более высоких температур. При этом исследование содержания сульфгидрильных и карбонильных групп в молекуле ЛДГ позволяет предположить, что одной из причин изменения активности и спектральных характеристик ЛДГ мозга гипотермированных крыс является модификация фермента активными формами кислорода.
Лактатдегидрогеназа (ЛДГ, КФ 1.1.1.27) – это ключевой фермент гликолитического пути окисления углеводов, стоящий на стыке аэробного и анаэробного метаболизма [1]. ЛДГ представляет собой тетрамерный фермент, который осуществляет взаимопревращение пирувата в лактат и восстановленного никотинамидадениндинуклеотида (НАДН) в окисленный (НАД+) [2]. Благодаря способности регенерировать НАД+ ЛДГ становится особо важным ферментом в условиях недостатка кислорода, поскольку позволяет ускорить поток углерода через гликолитический путь окисления [3].
Множество исследователей указывают на то, что основная функция ЛДГ заключается не сколько в восстановлении пирувата или окисление лактата, сколько в регуляция соотношения НАД+/НАД·Н, поскольку именно оно влияет на скорость многих каталитических реакций, а также на транскрипцию генов, связанных с метаболизмом и циркадианными ритмами [4–6]. Однако, ЛДГ может выполнять и множество других неклассических функций [2]. Предполагается, что ЛДГ принимает участие в клеточном цикле [7] и регуляции активности АТФ-зависимого K+ канала [8].
Особое внимание привлекает вопрос о функциональной значимости различных изоформ ЛДГ в мозге. Согласно теории астроцитарно-нейронного лактатного шатла, в мозге глюкоза метаболизируется астроцитами с помощью фермента ЛДГ5 до лактата. Затем лактат секретируется в межклеточное простанство, транспортируется в нейроны, в которых он, метаболизируясь ЛДГ1 в пируват, выступает в качестве основного источника энергии [9]. Было обнаружено, что нейроны в период своей высокой частотной активности преимущественно в качестве энергетического субстрата используют лактат, а не глюкозу [10]. Более детальные исследования показали, что лактат в мозге может функционировать как сигнальная молекула через рецептор 1-гидроксикарбоновой кислоты (HCAR1) [11] и, обладая способностью к достаточно быстрой диффузии на большие дистанции, выполнять роль “объемного” глио- и нейротрансмиттера [12]. Кроме того, лактат может модулировать активность нейронов, действуя на NMDA-рецепторы и G-белок-связывающие рецепторы [13].
Перечисленное многообразие различных физиологических и биохимических процессов, прямо или опосредованно связанных с активностью ЛДГ, предполагает необходимость изучения молекулярных механизмов функционирования этого фермента при различных физиологических состояниях организма, в частности, при гипотермии.
Ранее нами было показано, что при умеренной (30°С) кратковременной (30 мин) гипотермии активность ЛДГ в мозге существенно повышается. При этом исследование кинетических характеристик позволило предположить, что обнаруженные изменения эффективности катализа фермента обусловлены его структурными модификациями [14, 15]. Однако, молекулярные механизмы этих модификаций до сих пор остаются неизвестными. Одной из наиболее вероятных причин изменений структуры фермента за короткий период достижения гипотермического состояния (30 мин) представляется модификация его активными формами кислорода (АФК). Известно, что умеренная гипотермия, являясь экстремальным состоянием для гомойотермного организма, сопровождается стрессорной реакцией, которая провоцирует окислительный стресс – процесс, связанный с активацией окислительно-восстановительных реакций и, соответственно, интенсификацией свободнорадикальных процессов [16, 17].
Структурные модификации ЛДГ радикалами кислорода можно обнаружить по изменениям некоторых eе физико-химических параметров. В качестве таковых могут выступать как показатели собственной и зондовой флуоресценции фермента, так и маркеры его окислительной модификации. Целью данной работы явилось исследование влияния умеренной кратковременной гипотермии на собственную флуоресценцию ЛДГ мозга крыс, кинетику связывания ферментом флуоресцентного зонда – 8-анилино-1-нафталинсульфоновой кислоты (АНС) и содержание сульфгидрильных и карбонильных групп.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования. Исследования проводили на белых беспородных крысах (обоих полов) массой 150–200 г. Животные содержались в условиях вивария на обычном рационе. Время проведения экспериментов (с 9 до 12 ч) строго соблюдалось, во избежание влияния суточных колебаний на результат эксперимента. Животные были разбиты на две группы (по 8 животных в каждой): 1) интактный контроль, 2) кратковременная умеренная гипотермия (30°С)
Моделирование гипотермических состояний. Гипотермическое состояние вызывали наружным охлаждением животных в плексигласовых камерах с рубашкой, через которую циркулировала холодная (5°С) вода. Температуру тела крыс снижали равномерно со скоростью 0.25°С/мин. В этих условиях за 25–30 мин температура тела животного достигала 30°С, после чего производилась декапитация (кратковременная умеренная гипотермия). Температуру тела крыс измеряли в прямой кишке на глубине 4–5 см ректальным цифровым термометром MS6501.
Выделение и очистка ЛДГ. Из мозга декапитированных крыс методом дифференциального центрифугирования получали безмитохондриальный цитозоль. Очистку фермента от белков цитозоля производили методом фракционирования с помощью сульфата аммония. Обессоливание очищенного ферментативного препарата производили с помощью гель-хроматографии на сефадексе G-50. Дальнейшую очистку препарата производили посредством его хроматографии на карбоксиметилцеллюлозе (КМ-целлюлозе) и последующей аффинной элюции. С этой целью, раствор белка наносили на колонку с КМ-целлюлозой, уравновешенную фосфатным буфером рН 7.2. Затем колонку промывали 100 мл этого же буфера, а после буфером рН 8.0. При этом элюировались различные примесные белки, а ЛДГ осталась связанной с носителем. Через колонку пропускали 5–6 объемов буфера. При этом каждый раз изменяли оптическую плотность элюата при 280 нм. Когда оптическая плотность элюта уже переставала уменьшаться, на колонку наносили буферы, элюирующие только ЛДГ. При этом в каждой полученной фракции определи активность ЛДГ и содержание белка. В исследование были включены фракции, имеющие наиболее высокую активность ЛДГ [18].
Определение активности очищенной ЛДГ. Активность ЛДГ определяли по убыли содержания НАДН в реакционной смеси в результате энзиматического восстановления пирувата в лактат, что регистрировалось спектрофотометрически (на длине волны 340 нм в течение 2 мин). Реакционная смесь содержала 2.4 мл 0.1 М фосфатного буфера (рН 7.4), 0.3 мл раствора пирувата натрия (“Sigma”, США), 0.3 мл 1 мМ раствора НАДН2 (“Sigma”, США) и 0.05 мл ферментативного препарата, содержащего 25 мкг белка. Активность ЛДГ выражали в наномолях НАДН, окисленного в результате ферментативной реакции за 1 мин на 1 мг белка (нмоль/мин мг белка).
Определение белка. Содержание белка определяли по методу Лоури [19].
Определение содержания карбонильных групп. Содержание карбонильных групп в ферментативном препарате определяли по реакции их с 2,4‑динитрофенилгидразином (“Sigma”, США) [20]. Расчет производили с использованием коэффициента молярной экстинкции 22 000 (М/л)–l cм–1. Уровень карбонильных групп выражали в нмолях на мг белка.
Определение содержания SH-групп. Содержание SH-групп в ферментативном препарате измеряли колориметрическим методом, по реакции их с 5,5'-дитио-бис-2-нитробензойной кислотой (“Sigma”, США) [21]. Концентрацию выражали в нмолях на мг белка, с использованием коэффициента молярного поглощения 13 600 (М/л)–l cм–1.
Измерение собственной флуоресценции ЛДГ. Измерения собственной флуоресценции лактатдегидрогеназы проводили на сперктрофлуориметре Hitachi F-7000 (Япония) с автоматической коррекцией спектров. Спектр флуоресценции снимали в диапазоне 290 нм ≤ λ ≤ 400 нм при длине волны возбуждения 280 нм (суммарная флуоресценция) и 295 нм (триптофановая флуоресценция). Обработку спектров производили в программе Origin 8.6.
Исследование зондовой флуоресценции лактатдегидрогеназы. В качестве флуоресцентного зонда использовали зонд 1-анилинонафталин-8-сульфат (АНС) (Sigma). В работе использовали ферментативный препарат, содержание белка в котором составляет 0.05 мг/мл, 1 мл суспензии, содержащей фермент, инкубировали с зондом 15 с на магнитной мешалке. Исследования проведены на спектрофлюориметре Hitachi F7000, λвозб = 360 нм и λэмис в диапазоне 400–550 нм.
Исследование зависимости интенсивности флуоресценции от концентрации АНС, инкубированной с препаратом ЛДГ, проводили в диапазоне концентраций зонда 2.5–25 мкМ при температуре 25°С.
Для исследования температурной зависимости ферментативный препарат инкубировали с АНС при его концентрации 12.5 мкМ в диапазоне температур инкубации 5–50°С.
По полученным спектрам флуоресценции АНС определяли оптимум интенсивности флуоресценции зонда. Затем строили графики зависимости оптимума интенсивности флуоресценции от концентрации зонда в пробе. Для расчета константы диссоциации зонда использовали нелинейный многомерный регрессионный анализ, применяя в опции “нелинейное оценивание” y = = $y_{{\max }}^{*}$ [ANS]/(Kd + [ANS]), где y – это интенсивность флуоресценции, а ymax – это максимальная интенсивность флуоресценции [22].
Статистическая обработка результатов. Обработку данных произведена с помощью однофакторного дисперсионного анализа (ANOVA) с использованием пакета Statistica. Достоверность различия определяли с помощью критерия Фишера на уровне значимости P = 0.05. Среднестатистические спектры флуоресценции получали путем усреднения спектральных линий, полученных в повторных экспериментах (n = 8) с использованием Фурье фильтрации (по 5 точкам). Каждая кривая на графиках концентрационной зависимости и температурной зависимости интенсивности флуоресценции АНС – среднее 8-ми независимых экспериментов. Данные в табл. 1 приведены в виде: среднее ± ошибка среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Ранее все наши исследования активности и кинетических характеристик ЛДГ были произведены, используя в качестве источника фермента безмитохондриальный цитозоль [14, 15]. Для более детального изучения структурно-функциональных параметров фермента, возникла необходимость в очистке фермента от балластных белков. Исследование показало, что активность очищенной ЛДГ мозга крыс, измеренная при концентрации пирувата равной 3.2 мМ (оптимальная концентрация), при умеренной гипотермии увеличивается на 50.1%. При этом повышение активности неочищенной ЛДГ, локализованной в безмитохондриальном цитозоле, при гипотермии составляет 64.6% от уровня контроля (табл. 1).
Таблица 1.
Активность ЛДГ в безмитохондриальном цитозоле и очищенном ферментативном препарате мозга крыс в норме и гипотермии (M ± m, n = 8)
| Источник фермента | Активность ЛДГ, нмоль/мин мг белка | |
|---|---|---|
| в норме | при гипотермии | |
| Безмитохондриальный цитозоль | 208.0 ± 16.21 | 342.4 ± 12.76* |
| Очищенный препарат | 5986.13 ± 162.3 | 8986.2 ± 224.3* |
Для выяснения возможных механизмов изменения активности очищенной ЛДГ была использована флуоресцентная спектроскопия. Результаты анализа интенсивности суммарной (λвозб = 280 нм) и триптофановой (λвозб = 295 нм) флуоресценции ЛДГ в диапазоне эмиссии от 290 до 450 нм представлены на рис. 1 и 2.
Рис 1.
Спектры суммарной флуоресценции и вторые производные спектров (2ПФ) суммарной флуоресценции ЛДГ мозга крыс в норме и гипотермии (спектры: 1 – контроль, 2 – гипотермия; вторые производные спектров: 3 – контроль, 4 – гипотермия).
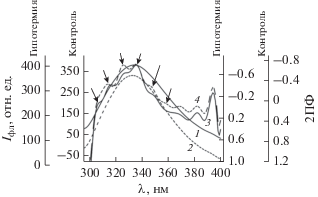
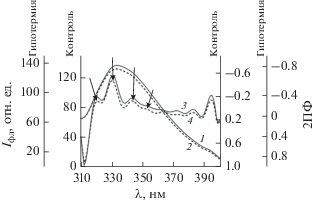
Рис. 2.
Спектры триптофановой флуоресценции и вторые производные спектров триптофановой флуоресценции ЛДГ мозга крыс в норме и гипотермии (спектры: 1 – контроль, 2 – гипотермия; вторые производные спектров: 3 – контроль, 4 – гипотермия).
Как видно из рис. 1, максимум интенсивности суммарной флуоресценции ЛДГ наблюдается при λ = 333 нм, что может свидетельствовать об основном вкладе в спектр флуоресценции белка остатков триптофана [23]. Это возможно в том случае, когда основная масса триптофановых остатков ЛДГ находится примерно в одинаковом гидрофобном или в достаточно жестком окружении. Было показано, что ядро молекулы ЛДГ отличается достаточно высокой степенью гидрофобности [6]. В полученных спектрах флуоресценция остатков тирозина не обнаруживается, так как значительная доля энергии возбуждения с остатков тирозина мигрирует на триптофанилы и высвечиваться в качестве триптофанового компонента [24]. При умеренной гипотермии происходит незначительное снижение интенсивности суммарной флуоресценции фермента, при этом, изменений в характере спектров (полуширине спектра, ассиметрии спектра) не наблюдается.
Для анализа спектров флуоресценции были проанализированы не только исходные спектры, но и их вторые производные. Вторые производные спектров флуоресценции, по сравнению с исходными спектрами, дают возможность получить более детальную информацию о состоянии микроокружения триптофана в белках, а также разделить вклад тирозиновой и триптофановой флуоресценции в суммарном спектре [23].
Анализ вторых производных суммарной флуоресценции ЛДГ выявил основной отрицательный пик в области 338 нм и плечи в области 327 нм, 352 нм, которые соответствуют флуоресценции триптофана, а также плечи в области 307 нм, 312 нм, соответствующих флуоресценции тирозина. Гипотермия способствует формированию выраженного пика флуоресценции тирозина в области 312 нм и появлению четкого пика при 327.
На рис. 2 изображены спектры триптофановой флуоресценции ЛДГ мозга крыс в контроле и при гипотермии. Как видно из рисунка, при гипотермии триптофановая флуоресценция белков мембран незначительно снижается, при этом характер спектров существенных изменений не претерпевает.
На вторых производных спектра триптофановой флуоресценции ЛДГ контрольных животных обнаруживаются основной отрицательный пик на 330 нм и дополнительные пики на 320 (соответствующие трипофанилам, находящися в гидрофобном окружении) и 345 нм (соответствующий триптофанилам, доступным полярному растворителю). Кратковременная гипотермия приводит к формированию плеча на 355 нм. Полученные данные свидетельствуют о том, что гипотермия затрагивает триптофанилы, локализованные на переферии молекулы ЛДГ, тогда как триптофановые остатки в центре глобулы не меняют свою локализацию. Таким образом, данные собственной флуоресценции ЛДГ свидетельствуют об определенных изменениях, как в структуре самих хромофоров фермента, так и в его пространственной конфигурации.
Одним из наиболее информативных методов исследования конформационного состояния биомолекул является метод флуоресцентного зондирования. Широкое применение для характеристики структурно-динамических свойств белковых молекул нашел флуоресцентный зонд АНС [25]. Известно, что в воде АНС имеет очень низкий квантовый выход, тогда как в комплексе с белками и липидами он многократно увеличивается [26]. Таким образом, квантовый выход флуоресценции АНС зависит от полярности его окружения и увеличивается в гидрофобных средах. Это позволяет использовать АНС в качестве чувствительного индикатора фолдинга/дефолдинга белка, его конформационных изменений, состояния расплавленной глобулы белка. Все эти состояния макромолекулы модифицируют параметры связывания АНС, что отражается на его спектральных характеристиках [27].
Для расчета кинетических параметров связывания АНС с ЛДГ мозга контрольных и гипотермированных крыс нами была исследована концентрационная зависимость интенсивности флуоресценции АНС в диапазоне концентраций 2.5–25 мкМ при инкубации зонда с ферментативным препаратом. Из рис. 3, где приведены соответствующие спектры флуоресценции АНС, видно, что характер спектров и положение максимума флуоресценции зависят от концентрации зонда.
Рис 3.
Спектры флуоресценции АНС, инкубированной с ЛДГ мозга крыс, при различных концентрациях зонда: 1 – 2.5, 2 – 5.0, 3 – 7.5, 4 – 10.0, 5 – 12.5, 6 – 15.0, 8 – 17.5, 9 – 22.5, 10 – 25.0 мкМ. Стрелками указаны длины волн, на которых интенсивность флуоресценции АНС максимальна.
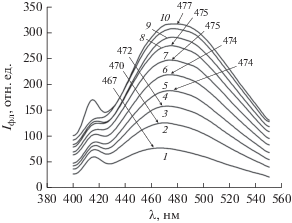
Особое внимание привлекает тот факт, что с повышением концентрации зонда происходит смещение максимума интенсивности флуоресценции в длинноволновую область. Так максимум интенсивности флуоресценции при концентрации АНС 2.5 мкМ соответствует длине волны испускания 467 нм, а при концентрации АНС 25 мкМ – 477 нм, таким образом, смещение в длинноволновую область составляет 10 нм. Это может обусловлено различиями в полярности окружения связанного с белком зонда, что, свидетельствует о гетерогенности сайтов связывания АНС на белковой молекуле. Исследование позволяет предположить наличие как минимум двух типов участков связывания зонда, имеющих различное сродство к АНС, одни из которых обеспечивают более полярное окружение зонда, а другие менее полярное. Это подтверждается наличием двух обособленных отрицательных пиков во вторых производных спектров флуоресценции АНС (рисунок не приведен).
На рис. 4 представлена зависимость максимума интенсивности флуоресценции АНС от его концентрации. Оказалось, что она носит нелинейный характер и представлена двумя пересекающимися в окрестностях одной точки прямыми. Из рисунка видно, что с повышением концентрации зонда интенсивность флуоресценции его линейно увеличивается, однако в области концентрациях 10–12.5 мкМ происходит изменение характера концентрационной зависимости и она становится менее выраженной. Исследование показало, при гипотермии интенсивность флуоресценции АНС, инкубированного с ЛДГ, снижается во всем диапазоне исследованных концентраций зонда. Наличие двух линейных участков на концентрационной кривой также свидетельствует в пользу предположения о наличии как минимум двух различных участков связывания.
Рис. 4.
Концентрационная зависимость флуоресценции АНС при инкубации с ЛДГ мозга крыс в норме и при гипотермии: 1 (◼) контроль, 2 (⚫) гипотермия.
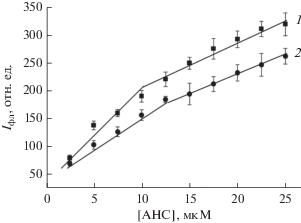
Для каждого линейного участка представленного графика зависимости, методом регрессионного многомерного нелинейного анализа, используя в опции “нелинейное оценивание” уравнение y = $y_{{\max }}^{*}$[ANS]/(Кd + [ANS]) (где y – это интенсивность флуоресценции, а ymax – это максимальная интенсивность флуоресценции, Кd – константа диссоциации) [22], были рассчитаны кинетические параметры связывания зонда – ymax и Кd ymax – это величина, которая зависит от числа мест связывания зонда (N) и, таким образом, может опосредованно отражать это число.
Из табл. 2 видно, что константы диссоциации двух гетерогенных сайтов связывания АНС ЛДГ мозга крыс в норме существенно отличаются: Kd2 больше Kd1 в 2.29 раз. Соответственно отличается и кажущееся число центров связывания АНС (N1 и N2). Так участков первого типа связывания меньше таковых второго типа на 31.9%.
Таблица 2.
Кинетические параметры связывания АНС с ЛДГ мозга крыс в норме и при гипотермии (M ± m, n = 8)
| Состояние животного | N1, усл. ед. | N2, усл. ед. | Kd1, мкМ | Kd2, мкМ |
|---|---|---|---|---|
| Контроль | 352.4 ± 20.4 | 584.8 ± 36.8 | 7.45 ± 0.22 | 17.10 ± 0.92 |
| Гипотермия | 257.5 ± 10.7* | 480.5 ± 18.7* | 9.78 ± 0.34* | 21.84 ± 1.47* |
Гипотермия способствует снижению кажущегося числа участков связывания АНС и повышению значений констант диссоциации. Из табл. 2 видно, что снижение N1 составляет 21.8%, а N2 составляет 17.8%. При этом повышение Kd1 составляет 31.2%, а Kd2 – 27.8%.
Была исследована температурная зависимость связывания АНС с ЛДГ, оцениваемая по интенсивности флуоресценции зонда в диапазоне температур его инкубации от 5 до 50°С. Обнаружено, что в координатах Аррениуса она аппроксимирована двумя пересекающимися в окрестностях одной точки прямыми. Из рис. 5 видно, что с повышением температуры инкубации зонда с ЛДГ интенсивность флуоресценции уменьшается до некоторой критической температуры (в контроле 33.34 ± 1.12). Дальнейшее повышение температуры приводит к тому, что интенсивность флуоресценции начинает слабо зависеть от температуры и даже имеет тенденцию к положительному характеру.
Рис. 5.
Температурная зависимость флуоресценции АНС при инкубации с ЛДГ мозга крыс в норме и при гипотермии: 1 (◼) контроль, 2 (⚫) гипотермия.
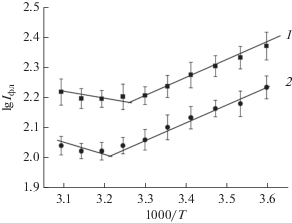
Кривая температурной зависимости флуоресценции АНС при гипотермии расположена существенно ниже таковой в норме, то есть интенсивность флуоресценции АНС при инкубации его с ЛДГ мозга гипотермированных крыс меньше таковой контроля. Графики демонстрируют и тот факт, что зависимость интенсивности флуоресценции зонда от температуры при гипотермии крыс становится выраженнее, при этом наблюдается смещение точки излома в область более высоких температур (38.52 ± 1.52; P < 0.05).
Обнаруженные при гипотермии снижение интенсивности флуоресценции АНС, добавленной к препарату ЛДГ, повышение констант диссоциации, уменьшение числа мест связывания зонда, изменение характера температурной зависимости могут свидетельствовать о структурных изменениях в молекуле фермента. Гипотетически, определенную роль в этой модификации могут играть АФК, генерация которых гипотермии усиливается.
Окисление боковых радикалов белков приводит к образованию таких продуктов, как карбонильные группы и дисульфиды, которые используются в качестве маркеров окислительного повреждения белков [27]. Содержание дисульфидов увеличивается вследствие окисления сульфгидрильных групп остатков цистеина. Таким образом, по содержанию сульфгидрильных и карбонильных групп в молекуле фермента можно судить о степени ее окислительной модификации при патологических состояниях организма.
Исследование показало, что содержание сульфгидрильных групп в очищенной ЛДГ мозга крыс незначительно (на 21.5%) снижается (табл. 3). При этом концентрация карбонильных групп увеличивается на 49.8%.
Таблица 3.
Содержание сульфгидрильных и карбонильных групп в препарате ЛДГ мозга крыс при гипотермии (M ± m; n = 8)
| Состояние животного | Содержание SH-групп, нмоль/мг белка | Содержание карбонильных групп, нмоль/мг белка |
|---|---|---|
| Контроль | 760.66 ± 45.98 | 85.24 ± 4.97 |
| Умеренная гипотермия | 597.86 ± 14.97* | 127.93 ± 8.01* |
ОБСУЖДЕНИЕ
Исследование показало, что при умеренной кратковременной гипотермии активность ЛДГ в безмитохондриальном цитозоле мозга крыс увеличивается, что соответствует полученным нами раннее экспериментальным данным [14, 15]. Интересно то, что очистка ЛДГ приводит к снижению выраженности эффекта гипотермии на регистрируемую in vitro активность фермента. Это может свидетельствовать в пользу предположения о влиянии на активность фермента гипотермированных животных некоторых растворимых факторов, освобождение от которых в процессе очистки, привело к снижению активности фермента. Гипотетически, в качестве таких факторов могли бы выступать, например, шапероны. Так было обнаружено, что при акклимации рыб шапероны способствуют формированию различных конформеров ЛДГ [29]. Известно, что гипотермия способствует повышению уровня шаперона Hsp70 [30].
В качестве другого потенциального кандидата, обратимо связывающися с ЛДГ и отделяющегося при его очистке, может быть предложен β-аланин. Известно, что уровень β-аланина при стрессе в различных тканях организма увеличивается [31]. Оказалось, что он обладает шапероно-подобной активностью и может in vitro подавлять термоитактивацию ЛДГ [32].
Кроме того, следует принять во внимание тот факт, что ЛДГ in vivo функционируют в составе гликолитического метаболона. [33]. Показано, что ЛДГ, глицеральдегид 3-фосфатдегидрогеназа и альдолаза образуют ассоциаты с F-актином [34]. Предположим, что при гипотермии произошли какие-либо химические модификации связанных с ЛДГ белков метаболона, которые привели к сопряженному изменению конформации фермента, позволяющему увеличить скорость катализа. В таком случае отделение в процессе фракционирования ЛДГ от других цитоплазматических белков также могло стать одной из причин наблюдаемых нами различий в эффектах гипотермии на скорость катализа очищенной и неочищенной ЛДГ. Следует отметить, что различия эти не столь значительны и составляют всего лишь 14.5%. Это означает, что вклад легко отделяющихся в процессе очистки фермента растворимых факторов в суммарное изменение его активности при гипотермии невесом.
Повышение эффективности катализа ЛДГ при гипотермии может происходит либо за счет перераспределения изоформ фермента в мозге, либо за счет структурных модификаций в самих молекулах фермента. В мозге обнаружены все пять известных изоферментных форм ЛДГ, среди которых наиболее высоким содержанием и функциональной значимостью отличаются ЛДГ1 и ЛДГ5, распределение которых в различных клетках и субклеточных структурах мозга не одинаково. Согласно теории астроцитарно-нейронного лактатного шатла, в мозге глюкоза метаболизируется астроцитами с помощью ЛДГ5 до лактата. Затем лактат транспортируется в нейроны, в которых он, метаболизируясь ЛДГ1 в пируват, выступает в качестве основного источника энергии [9]. При этом, в исследовании O’Бриен и сотр. [35] было экспериментально продемонстрированно, что в синаптосомах мозга содержание ЛДГ1 в 5 раз больше, чем в цитозоле кортикальных нейронов или астроцитов. Напротив, содержание ЛДГ5 в синаптозоле незначительно, а в цитозоле нейронов составляет 37.5%. Авторы показали, что в цитозоле нейронов спектр изоформ ЛДГ проявляет сходство со спектром изоформ ЛДГ в астроцитах. Таким образом, существует дифференциальная субклеточная локализация изоформ ЛДГ в телах нейронов и субклеточных терминалях. В терминалях из-за чрезвычайно высокой функциональной активности преобладает ЛДГ1 для быстрого превращения лактата, поступающего из соседних клеток глии или из тела нейрона, в пируват. Часть ЛДГ1 локализована в митохондриях и непосредственно там с высокой скоростью участвует в окислении лактата в пируват. Митохондриальная ЛДГ локализована на внешней стороне внутренней мембраны митохондрий и связана с интегральным белком внутренней мембраны – монокарбоксилатным транспортером 1, который ассоциирован с гликопротеидом базигином (CD147) и цитохром-с-оксидазой [36]. Какую же изоформу ЛДГ преимущественно содержит полученный нами ферментативны препарат? Поскольку митохондрии и синаптосомы (содержащие основную долю ЛДГ1) осаждались на определенном этапе дифференциального центрифугирования, мы предполагаем, что исследованный нами препарат содержит, главным образом, содержит ЛДГ5.
Гипотетически, при гипотермии могло бы произойти перераспределение изоферментных форм ЛДГ в мозге вследствие изменения уровня их экспрессии или, напротив, протеосомной деградации. Однако, временные рамки гипотермии (состояние умеренной гипотермии достигалось за 30 мин), в какой-то мере, эту возможность ограничивают. Кроме того, снижение температуры млекопитающих значительно замедляет генерацию АТФ, влияя на скорости всех синтетических реакций [37]. Экспериментально показано, что при гипотермии экспрессия многих белков подавлена [38, 39]. При гипотермии может снижаться не только скорость синтеза белков, но и скорость их протеосомной деградации. Это может быть обусловлено тем, что основная машина деградации белка в клетке, протеасома, тоже является АТФ-зависимой [40].
Поскольку вероятность количественной регуляции активности ЛДГ мозга крыс при гипотермии очень мала, можно предположить, что обнаруженные изменения активности ЛДГ, скорее всего, с модификацией уже существующих молекул ЛДГ. Механизмы регуляции активности ЛДГ млекопитающих до сих пор остаются недостаточно раскрытыми. Срочная регуляция, следы которой остаются и in vitro, скорее всего, осуществляется посредством химической модификации фермента, например, путем фосфорилирование/дефосфорилирование ферментного белка. Было обнаружено, что онкогенные сигналы повышают активность ЛДГ опухолевых клеток млекопитающих, действуя через рецептор тирозинкиназы FGFR1, прямо фосфорилирующей ЛДГ по остаткам тирозина – Y10 и Y83 [41]. Исследование Чжао и сотрудников раскрыло ключевую роль ацетилирования в посттрансляционной модификации ЛДГ опухолевых клеток поджелудочной железы [42]. Ранее было показано, что фосфорилирование ЛДГ может происходить не только в трансформированных, но и в нормальных клетках. Особая роль при этом отводится не тирозиновым, а Са/калмодулин-зависимым протеинкиназам [43].
Одной из наиболее вероятных причин модификации структуры ЛДГ при гипотермии может стать окисление отдельных аминокислотных остатков посредством АФК [17]. Снижение температуры тела гомойотермных организмов вызывает стрессорную реакцию, которая включает в себя вначале сократительный термогенез, сменяющуюся на управляемый гормонами несократительный термогенез. Общим эффектом этих реакций является интенсификация потребления кислорода и повышение активности окислительного метаболизма. Возникающие при этом вазоконстрикция, увеличение вязкости крови, сдвиг кривой диссоциации оксигемоглобина влево приводят к снижению доступности кислорода для тканей – гипоксии [44, 45]. Активация окислительного метаболизма на фоне гипоксии и ацидоза способствует развитию окислительного стресса и повышенной продукции АФК [16, 17, 46]. Литературные данные свидетельствуют об интенсификации образования АФК и нарушении прооксидантно-антиоксидантного баланса в тканях при гипотермии, что стимулирует окислительную модификацию клеточных липидов и белков [46]. Известно, что белки в силу особенностей своего строения являются одними из основных мишеней АФК [47].
Литературные данные относительно эффекта АФК на активность ЛДГ противоречивы, поскольку в экспериментах были использованы отличающиеся по своему составу среды, генерирующие АФК. Так было показано, что в среде Фентона, содержащей ионы Cu2+ (100 мкМ) и перекись водорода (0.525%) активность фермента значительно снижается [48]. Однако in vivo концентрации АФК отличаются от тех, что используются в модельных системах, поэтому их эффекты на активность фермента тоже могут отличаться. Так у ящерицы Uromastyx aegyptius при акллимации к холоду обнаружена положительная корреляция между активностью ЛДГ и содержанием свободных радикалов. В связи с этим предположено, что свободные радикалы способствуют активации ЛДГ [49]. Результаты нашего исследования некоторых структурно-функциональных характеристик ЛДГ тоже позволяют предположить, что обнаруженные при гипотермии изменения активности ЛДГ являются результатом ее окислительной модификации.
Исследование спектральных характеристик ЛДГ показало, что при гипотермии интенсивность собственной суммарной флуоресценции снижается, причем основной вклад в это снижение вносит триптофановая флуоресценция. Снижение триптофановой флуоресценции может объясняться изменением конформации белков, вследствие которой при разворачивании глобулы хромофорные группы триптофановых остатков становятся более доступными для молекул воды с растворенными в ней тушителями [50]. С другой стороны, снижение триптофановой флуоресценции может быть обусловлено его непосредственным окислением АФК. Известно, что триптофановые остатки являются наиболее чувствительными к модификации в условиях окислительного стресса [28].
Было обнаружено, что W248 локализован в активном центре фермента и принимает участие в связывании субстрата [51]. Окисление его, скорее всего, привело бы к снижению активности фермента. Следовательно, гипотермия затрагивает не глубоко локализованные остатки триптофана, а лишь периферические. Действительно вторые производные спектров флуоресценции свидетельствуют о том, что изменения при гипотермии происходят только в более длинноволновой области спектра, относящейся к флуоресценции тех остатков триптофана, которые находятся ближе к поверхности белковой молекулы.
Интересно то, что при гипотермии во вторых производных спектров суммарной флуоресценции наблюдается отчетливый пик тирозиновой флуоресценции. Учитывая известный факт, что спектры флуоресценции хромофоров тирозина по положению и форме практически не отличаются при значительных отклонениях свойств окружения [24], наблюдаемые изменения могут быть обусловлены тем, что расстояние между остатками тирозина и триптофана увеличилось, а это может свидетельствовать о конформационных изменениях структуры белка. Об изменении конформации ЛДГ могут свидетельствовать и изменения характера и места локализации пиков на графиках вторых производных трипофановой флуоресценции, указывающих на то, что доступность этого хромофора для растворителя увеличивается.
О структурной модификации ЛДГ может свидетельствовать и параметры зондовой флуоресценции. Исследование кинетики связывания АНС с ЛДГ позволило предположить наличие как минимум двух гетерогенных сайтов. Повышение интенсивности флуоресценции АНС при ее инкубации с белком, прежде всего, объясняются гидрофобностью сайтов связывания и ограниченной подвижностью зонда в гидрофобных “карманах” белка [52]. Однако, помимо гидрофобных взаимодействий с находящимися в “карманах” белка ароматическими аминокислотами, зонд может связываться с помощью электростатических взаимодействий с переферическими аминокислотами молекулы фермента. Эти взаимодействия формируются между отрицательно заряженной сульфоновой группой АНС с положительно заряженными аминокислотами, например, гистидином, лизином или аргинином [53]. Было показано, что для стабилизации ионных пар необходимы дополнительные силы, такие как ван-дер-ваальсовы взаимодействия. Вместе с тем, при измерении стационарной флуоресценции обнаружено, что вклад во флуоресценцию АНС от внешних сайтов связывания гораздо меньше, чем от глубоколежащих гидрофобных сайтов [25].
Кинетический анализ флуоресценции АНС также демонстрирует наличие как минимум двух отличающихся по полярности сайтов связывания. Данный факт, скорее всего, является следствием связывания АНС как с гидрофобными “карманами” белка (имеющих более высокое сродство к зонду), так и с остатками положительно заряженных аминокислот (имеющих более низкое сродство к зонду). Гидрофобные участки связывания создают менее полярное окружение зонду, и, возможно, имеют к АНС более высокое сродство. Поэтому они быстрее насыщаются при более низких концентрациях субстрата и характеризуются относительно низкими значениями констант диссоциации. Напротив, внешние положительно заряженные аминокислотные сайты обеспечивают более полярное окружение зонду и имеют к нему меньшее сродство. Поэтому они насыщаются при более высоких концентрациях зонда и характеризуются относительно высокими значениями констант диссоциации. Исследование показало, что при гипотермии интенсивность флуоресценции АНС снижается. Это снижение обусловлено как повышением константы диссоциации АНС, так и уменьшением числа мест его связывания.
Исследование зависимости интенсивности флуоресценции АНС от температуры инкубации его с ЛДГ было предпринято исходя из следующего предположения: в диапазоне температур 5–50°С могут происходить существенные конформационные изменения в молекуле фермента, которые могут отразиться на характере связывании его с АНС-зонда, достаточно часто используемого для изучения конформационных изменений в белках. Если гипотеза о химической модификации ЛДГ при гипотермии верна, то ферменты из мозга гипотермированных и интактных крыс должны обладать разной чувствительностью к температуре. Таким образом, структурные модификации ЛДГ при гипотермии могут отражаться на характере конформационных изменений ЛДГ в широком температурном диапазоне, о которых можно судить по изменению интенсивности флуоресценции АНС.
Наше исследование показало, что в различных температурных диапазонах характер зависимости интенсивности флуоресценции АНС от температуры его инкубации с ферментом, существенно отличается. Так в области низких температур по мере повышения температуры инкубации интенсивность флуоресценции АНС снижается, вместе с тем как в области высоких она изменяется лишь незначительно.
Столь такой неординарный характер температурной зависимости флуоресценции АНС, скорее всего, может быть обусловлен изменениями силы и характера слабых взаимодействий, что также может тоже свидетельствовать о гетерогенности участков связывания АНС. Каждый тип участков (полярные и неполярные) отличается по природе слабых взаимодействий с зондом, от суммарного вклада которых зависит весь характер зависимости флуоресценции зонда от температуры его инкубации. В исследовании Бегатолли с сотр. [54] было показано наличие двух различимых сайтов связывания АНС с сывороточным альбумином – сайт с высоким сродством, расположенный в более гидрофобном окружении, и низким сродством, в котором связывание анионного зонда АНС с белком регулируется электростатическим притяжением.
Известно, что гидрофобные взаимодействия с повышением температуры усиливаются, поэтому следовало бы ожидать повышения интенсивности флуоресценции зонда (связывающегося с гидрофобными “карманами” белка) с повышением температуры его инкубации. Поскольку результаты нашего исследования, напротив, демонстрируют снижение интенсивности флуоресценции АНС в диапазоне более низких температур (в контроле – 5.0–33.34°С), это может свидетельствовать о более значимом вкладе в связывание зонда электростатических взаимодействий, а не гидрофобных. Такое предположение основано на работе Латипова и сотр. [55]. В ней было исследовано влияние температуры на взаимодействие АНС с интерлейкином-1 и показано, что при 25°C значения Kd для АНС меньше, чем при 37°C. Это, по мнению авторов, отражает ослабление взаимодействий лиганд–белок из-за повышенных тепловых колебаний и указывает на то, что в ассоциации АНС-интерлейкин-1 доминируют не гидрофобные взаимодействия, которые, как ожидается, должны были бы увеличиваться с температурой, а электростатические взаимодействия, которые с повышением температуры убывают.
Гипотермия способствует снижению интенсивности флуоресценции АНС и в области высоких температур и в области низких. Это свидетельствует о том, что изменения при гипотермии претерпевают как гидрофобные участи связывания, так и полярные участки связывания. Обнаруженное нами повышение обеих констант диссоциации зонда при гипотермии подтверждают это предположение.
Можно привести и другое объяснение неординарному характеру температурной зависимости флуоресценции АНС, инкубированной с ЛДГ. С повышением температуры инкубации молекула ЛДГ становится более разрыхленной и в ней уменьшается число гидрофобных углублений (“карманов”). По мнению Матулиса и соавт., флуоресценция АНС связана, главным образом, с локализацией АНС в области таких углублений в молекуле белка. Авторы указывают на то, что АНС, связавшийся с поверхностными заряженными группировками белка, не флуоресцирует. Денатурация белка сопровождается уменьшением количества гидрофобных “карманов”, что способствует снижению количества участков связывания АНС и, соответственно, снижению интенсивности его флуоресценции [56]. Исходя их этих соображений, можно предположить, что с повышением температуры инкубации структура молекулы ЛДГ становится менее плотно упакованной, в ней уменьшается количество гидрофобных углублений, с которыми связывается АНС, поэтому интенсивность флуоресценции снижается до определенной критической температуры, выше которой количество гидрофобных карманов уже не изменяется. Поскольку молекулы ЛДГ контрольных и гипотермированных, гипотетически могут отличаться по структуре, динамика их разрыхления по мере повышения температуры инкубации тоже может отличаться, что отражается на характере температурной зависимости интенсивности флуоресценции АНС.
Снижение флуоресценции АНС, инкубированной с ЛДГ гипотермированных животных, может быть обусловлено окислением ароматических аминокислот, формирующих гидрофобные “карманы” фермента или же изменением конформации ЛДГ, например, компактизацией, изменяющей доступность АНС к гидрофобным карманам. Данные собственной флуоресценции ЛДГ свидетельствуют о снижении при гипотермии интенсивности ее триптофановой флуоресценции. Причем, это снижение может быть связано как с окислением триптофана, так и его экспозицией на поверхность белка вследствие конформационного перехода, а также и с увеличением расстояния между остатками тирозина и триптофана, что значительно снижает вероятность индуктивно-резонансного переноса энергии на триптофанилы. Наиболее вероятным объяснением, удовлетворяющим как данным собственной, так и данным зондовой флуоресценции ЛДГ, представляется все-таки окисление остатков триптофана АФК, образующимися при гипотермии.
Поскольку АНС может взаимодействовать не только с гидрофобными сайтами белка, но и положительно заряженными аминокислотами, например, гистидином, лизином или аргинином [53], модификация этих аминокислот при гипотермии может оказать существенный эффект на спектральные характеристики зонда. Известно, что в результате металлкатализируемого окисления пролиновых, аргининовых, лизиновых, гистидиновых остатков аминокислот, образуются их карбонильные производные [28, 57]. По сравнению с другими формами окислительной модификации белков, механизм их карбонилирования гораздо сложнее, и эта реакция необратима [58]. Поэтому карбонильные группы могут белков являться надежными маркерами окислительной модификации.
Результаты нашего исследования свидетельствуют о повышении содержания карбонильных групп в белках, что может явиться одной из причин снижения интенсивности флуоресценции АНС в растворе ЛДГ мозга гипотермированных крыс. Известно, что остатки R171 и H195, локализованные глубоко от поверхности фермента в активном центре ЛДГ, играют важную роль в катализе [6]. Обнаружено, что их химические модификации могут привести к существенному снижению активности фермента [59]. Поскольку в нашем случае активность ЛДГ повышается, это позволяет предположить, что окислению посредством АФК подвергаются только находящиеся на поверхности, положительно заряженные аминокислотные остатки.
Помимо карбонильных групп, другим важным маркером окислительной модификации мембранных белков является уровень сульфгидрильных (тиоловых) групп, принадлежащих остаткам цистеина. Тиоловые группы играют ключевую роль в структуре и катализе ферментов; однако из-за их реактивной природы, они часто являются мишенями свободных радикалов [60, 61]. В условиях окислительного стресса SH-группы белков депротонируются с образованием дисульфидов. Причем это окисление может носить обратимый характер [28]. Несмотря на то, что остатки цистеина не принимают прямое участие в катализе, они могут играть важную роль в формировании функционально значимой конформации ЛДГ [59]. Было показано, что модификация пяти ключевых остатков цистеина в молекуле ЛДГ свободными радикалами способствует изменению ее пространственной конфигурации [62].
Наше исследование демонстрирует снижение уровня тиоловых групп в молекулах ЛДГ при гипотермии, однако при этом активность фермента увеличивается. Следует обратить особое внимание на то, что разница по содержанию сульфгидрильных групп в ЛДГ контрольных крыс и гипотермированных незначительна, а карбонильных групп достаточна высока. При этом тиоловые группы белков является более реакционоспособными, потому в совокупности формируют одно из звеньев неферментативной антиоксидантной системы организма. Причиной наблюдаемого дисбаланса маркеров окислительной модификации может быть обратимый характер окисления остатков цистеина, осуществляемый с помощью антиоксидантов, в частности глутатиона. Ранее было обнаружено, что содержание глутатиона в мозге при кратковременной умеренной гипотермии снижается [16, 46]. Можно предположить, что определенная доля глутатиона расходуется на регенерацию функционально важных тиоловых групп ЛДГ.
Таким образом, полученные нами экспериментальные данные по собственной флуоресценции ЛДГ, кинетики и термодинамике связывания ферментом флуоресцентного зонда АНС, содержанию сульфгидрильных групп и карбонильных производных позволяют сделать заключение о том, что одной из причин изменения активности ЛДГ при гипотермии может стать ее модификация свободными радикалами.
Список литературы
Qiu L., Gulotta M., Callender R. // Biophys. J. 2007. V. 93. P. 1677–1686.
Valvona C.J., Fillmore H.L., Nunn P.B., Pilkington G.J. // Brain Pathol. 2016. V. 26. P. 3–17.
Fields P.A., Kim Y.S., Carpenter J.F., Somero G.N. // J. Exp. Biol. 2002. V. 205. P. 1293–1303.
Cantó C., Gerhart-Hines Z., Feige J.N., Lagouge M., Noriega L., Milne J.C., Elliott P.J., Puigserver P., Auwerx J. // Nature. 2009. V. 458. P. 1056–1060.
He H., Lee M.C., Zheng L.L., Zheng L., Luo Y. // Biosci. Rep. 2013. V. 33. № 2. P. 187–197.
McClendon S., Zhadin N., Callender R. // Biophys. J. 2005. V. 89. № 3. P. 2024–2032.
Rong Y., Wu W., Ni X., Kuang T., Jin D., Wang D., Lou W. // Tumour Biol. 2013. V. 34. P. 1523–1530.
Crawford R.M., Budas G.R., Jovanović S., Ranki H.J., Wilson T.J., Davies A.M., Jovanović A. // EMBO J. 2002. V. 21. P. 3936–3948.
Tarczyluk M., Nagel D., O’Neil J., Parri H., Tse E., Coleman M., Hill E.J. // J. Cereb. Blood Flow Metab. 2013. V. 33. P. 1386–1393.
Baltan S. // Metab. Brain Dis. 2015. V. 30. P. 25–30.
Mosienko V., Teschemacher A., Kasparov S. // J. Cereb. Blood Flow Metab. 2015. V. 35. P. 1069–1075.
Riske L., Thomas R.K., Baker G.B., Dursun S.M. // Ther. Adv. Psychopharm. 2017. V. 7. № 2. P. 85–89.
Sotelo-Hitschfeld T., Niemeyer M.I., Machler Ph., Ruminot I., Lerchundi R., Wyss M., Stobart J., Fernández-Moncada I., Valdebenito R., Garrido-Gerter P., Contreras-Baeza Y., Schneider B.L., Aebischer P., Lengacher S., San Martín A., Le Douce J., Bonvento G., Magistretti P.J., Sepúlveda F.V., Weber B., Barros L.F. // J. Neurosci. 2015. V. 35. № 10. P. 4168–4178.
Халилов Р.А., Джафарова А.М., Джабраилова Р.Н., Хизриева С.И. // Нейрохимия. 2016. Т. 33. № 2. С. 169–179.
Халилов Р.А., Джафарова А.М., Хизриева С.И. // БЭБиМ. 2017. Т. 163. № 3. С. 313–317
Alva N., Palomeque J., Teresa C. Alva N., Palomeque J., Carbonell T. // Oxidative Medicine and Cellular Longevity. 2013. V. 2013. P. 10.
Blagojević D. // Free radical biology in hypothermia. In: Systems Biology of Free Radicals and Antioxidants / Ed. Laher I. Berlin: Springer-Verlag, 2014. P. 376–392.
Северин С.Е., Соловьева Г.А. // Практикум по биохимии. М.: МГУ, 1989. 509 с.
Lowry D.H., Rosembrough H.J., Farr A.L. // J. Biol. Chem. 1951. V. 193. P. 265–275.
Арутюнян А.В., Дубинина Е.Е., Зыбина Н.Н. // Методы оценки свободнорадикального окисления и антиоксидантной системы организма: методические рекомендации. СПб.: ИКФ “Фолиант”, 2000. 104 с.
Habeeb A.F.S.A. // Meth. Enzymol. 1972. V. 34. P. 457–464.
Schönbrunn E., Eschenburg S., Luger K., Kabsch W., Amrheini N. // PNAS. 2000. V. 97. № 12. P. 6345–6349.
Онищенко Е.Н., Дюбко Т.С., Семенченко А.Ю. // Актуальные проблемы медицины и биологии: cб. научн. трудов. Киев, 2004. С. 106–117.
Дюбко Т.С. // Вісник Харк. нац. універ. ім. В.Н. Каразіна. Сер: Біологія. 2006. Вып. 3. № 729. С. 221–231.
Gasymov O.K., Glasgow B.J. // Biochim. Biophys. Acta. 2007. V. 1774. № 3. P. 403–411.
Добрецов Г.Е. // Флуоресцентные зонды в исследовании клеток, мембран и липопротеинов. М.: Наука, 1989. 227 с.
Celej M.S., Dassieb S.A., Freire E., Bianconid M.L., Fidelio G.D. // Bioch. Bioph. Acta. 2005. V. 1750. P. 122–133.
Дубинина Е.Е. // Продукты метаболизма кислорода в функциональной активности клеток. Жизнь и смерть, созидание и разрушение. СПб.: Мед. Пресс, 2006. 400 с.
Place S.P., Hofmann G.E. // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2005. V. 288. P. 1195–1202.
Shintani Y., Terao Y., Ohta H. // Stroke Res. Treat. 2011. Article ID 809874. 9 pages https://doi.org/10.4061/2011/809874
Walther M. // Comp. Biochem. Physiol. Part A. Mol. Integr. Physiol. 2002. V. 133. P. 179–190.
Mehta A.D., Seidler N.W. // J. Enzyme Inhibit. Med. Chem. 2005. V. 20. № 2. P. 199–203.
Menard L., Maughan D., Vigoreaux J. // Biology. 2014. V. 3. P. 623–644.
Forlemu N.Y., Njabon E.N., Carlson K.L., Schmidt E.S., Waingeh V.F., Thomasson K.A. // Proteins. 2011. V. 79. № 10. P. 2813–2827.
O’Brien J., Kla K.M., Hopkins I.B., Malecki E.A., McKenna M.C. // Neurochem. Res. 2007. V. 32. P. 597–607.
Hashimoto T., Brooks G.A. // Medicine and Science in Sports and Exercise. 2008. V. 40. № 3. P. 486–494.
Erecinska M., Thoresen M., Silver I.A. // J. Cereb. Blood Flow Metab. 2003. V. 23. P. 513–530.
Whittington R.A., Bretteville A., Virág L., Emala C.W., Maurin T.O., Marcouiller F., Julien C., Petry F.R., El-Khoury N.B., Morin F., Charron J., Planel E. // Scientific Reports. 2013. V. 3. P. 1–8.
Oda T., Shimizu K., Yamaguchi A., Satoh K., Matsumoto K. // Cryobiology. 2012. V. 65. P. 104–112.
Princiotta M.F., Finzi D., Qian S.B., Gibbs J., Schuchmann S., Buttgereit, F., Bennink J.R., Yewdell J.W. // Immunity. 2003. V. 18. № 3. P. 343–354.
Fan J., Hitosugi T., Chung T.W, Xie J., Ge Q., Gu T.L., Polakiewicz R.D., Chen G.Z., Boggon T.J., Lonial S., Khuri F.R., Kang S., Chen J. // Mol. Cell Biol. 2011. V. 31. № 24. P. 4938–4950.
Zhao D., Zou S.W., Liu Y., Zhou X., Mo Y., Wang P., Xu Y.H., Dong B., Xiong Y., Lei Q.Y., Guan K.L. // Cancer Cell. 2013. V. 23. P. 464–476.
Yasykova M.Y., Petukhov S.P., Muronetz V.I. // Biochemistry. 2000. V. 65. № 10. P. 1192–1196.
Липина О.В., Луговой В.И. // Биофизика. 1996. V. 41. № 3. P. 678–679.
Martini W.Z. // Metab. Clinic. Exp. 2007. V. 56. P. 214–221.
Эмирбеков Э.З., Кличханов Н.К. // Свободно-радикальные процессы и состояние мембран при гипотермии. Ростов-на-Дону: Южного федерального университета, 2011. 200 с.
Муравлева Л.Е., Молотов-Лучанский В.Б., Клюев Д.А., Бакенова Р.А., Култанов Б.Ж., Танкибаева Н.А., Койков В.В., Омарова Г.А. // Фундаментальные исследования. 2010. № 1. С. 74–78.
Tangkosakul T., Tantimongcolwat T., Isarankura-Na-Ayudhya C., Mejare M., Bülow L., Prachayasittikul V. // EXCLI J. 2009. V. 8. P. 1–11.
Al-Johany A.M., Haffor A.S. // J. Medical Sciences. 2007. V. 7. P. 408–412.
Lakowicz J.R. // Photochem. Photobiol. 2000. V. 72. № 4. P. 421–437.
Kolappan S., Shen D.L., Mosi R., Sun J., McEachern E.J., Vocadloa D.J., Craiga L. // Acta Cryst. 2015. V. 71. P. 185–195.
Collini M., D’Alfonso L., Baldini G. // Protein Sci. 2000. V. 9. P. 1968–1974.
Hawe A., Sutter M., Jiskoot W. // Pharmac. Res. 2008. V. 25. № 7. P. 1487–1499.
Bagatolli L.A., Kivatinitz S.C., Aguilar F., Soto M.A., Sotomayor P., Fidelio G.D. // J. Fluoresc. 1996 . V. 6. № 1. P. 33–40.
Latypov R.F., Liu D., Gunasekaran K., Harvey T.S., Razinkov V.I., Raibekas A.A. // Protein Sci. 2008. V. 17. № 4. P. 652–663.
Matulis D., Baumann C.G., Bloomfield V.A., Lovrien R.E. // Biopolymers. 1999. V. 49. P. 451–458.
Фомина М.А., Абаленихина Ю.В. // Способ комплексной оценки содержания продуктов окислительной модификации белков в тканях и биологических жидкостях: методические рекомендации. Рязань: РИО РязГМУ, 2014. 60 с.
Dalle-Donne I., Ross R., Guistarini D., Milzani A., Colombo R. // Clin. Chim. Acta. 2003. V. 329. P. 23–38.
Yanbin Z., Zheng W., Baoyu Q., Xicheng W. // Tsinghua Sci. Technol. 2003. V. 8. № 4. P. 428–433.
Giles N.M., Watts A.B, Giles G.I, Fry F.H., Littlechild J.A., Jacob C. // Chem. Biol. 2003. V. 10. № 8. P. 677–693.
Poole L.B. // Free Radic. Biol. Med. 2015. V. 80. P. 148–157.
Boike L. An Analysis of Oxidative Damage to Lactate Dehydrogenase in Context of Neurodegeneration and Catechol-Based Phenolic Antioxidant Chemistry. Undergrad. Honors Theses, 2017. https://publish.wm.edu/ honorstheses/1144.
Дополнительные материалы отсутствуют.


