Нейрохимия, 2020, T. 37, № 1, стр. 460-53
Развитие депрессивноподобного состояния крыс под влиянием хронического ультразвукового воздействия сопровождается снижением уровня экспрессии генов субъединиц ГАМКА-рецептора в мозге
А. В. Горлова 1, Д. А. Павлов 1, 3, В. М. Ушакова 1, Е. А. Зубков 2, Я. А. Зоркина 2, А. Ю. Морозова 2, А. Н. Иноземцев 1, В. П. Чехонин 2
1 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
2 Национальный медицинский исследовательский центр психиатрии и наркологии им. В.П. Сербского
Москва, Россия
3 Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
Поступила в редакцию 04.12.2018
После доработки 09.04.2019
Принята к публикации 15.04.2019
Аннотация
В работе изучали количественное изменение компонентов ГАМКергической системы крыс линии Sprague–Dawley в ультразвуковой модели депрессивноподобного состояния, вызванного хроническим воздействием ультразвуковых частот 20–45 кГц, чередующихся непредсказуемым образом. Исследовали экспрессию генов GABRA1, GABRA2, GABRA3 и GABRB2, кодирующих субъединицы α1, α2, α3 и β2 ГАМКА-рецепторов, соответственно, в гиппокампе, префронтальной коре, среднем мозге и миндалине после 1-й, 2-й и 3-й нед. стрессирования. Было установлено снижение уровня относительной экспрессии генов GABRA1, GABRA2 и GABRA3, выраженное в разной мере в разных структурах мозга в зависимости от продолжительности ультразвукового воздействия. Снижение относительной экспрессии генов GABRA1 и GABRA3 наблюдалось уже после 1 нед. хронического ультразвукового воздействия, в то время как снижение относительной экспрессии гена GABRA2 – только после 3 недель аналогичного воздействия. Уровень относительной экспрессии гена GABRB2 оставался без изменений. Таким образом, впервые исследовалась динамика генной экспрессии субъединиц ГАМКА-рецепторов, сопровождающая различные этапы формирования депрессивноподобного состояния крыс, что позволило выявить зависимость зарегистрированных изменений от продолжительности стрессового воздействия.
ВВЕДЕНИЕ
В настоящее время более чем у 350 млн чел. по всему миру диагностировано депрессивное расстройство [1], что делает изучение механизмов его формирования актуальной проблемой современности [2]. Для изучения механизмов развития депрессии используют разнообразные модели депрессивноподобного состояния экспериментальных животных, основанные, как правило, на непосредственном физическом воздействии на животное [3]. В данной работе использовали модель хронического воздействия ультразвуковых частот [4, 5]. Ее стрессовое влияние основывается на противоположной эмоциональной и мотивационной нагрузке, которую несут подающиеся случайным образом ультразвуковые частоты, одни из которых (20–25 кГц) ассоциированы с отрицательным эмоциональным состоянием грызунов, а другие (40–45 кГц) – с положительным [6, 7]. Преимущество этой модели перед другими заключается в том, что она приводит к развитию состояния информационной неопределенности, наиболее приближенного к причинам стресса у человека [8].
Существуют различные теории патогенеза депрессивного расстройства, наиболее известной из которых является теория дисбаланса моноаминергических систем мозга [9], однако точные причины развития клинической депрессии до сих пор неясны. При этом в последнее время все чаще внимание исследователей привлекает роль ГАМКергической системы в патогенезе депрессивного расстройства. В частности, отмечается важная роль ионотропного ГАМКА-рецептора, отвечающего за быструю ингибиторную трансмиссию [10, 11]. Так, было установлено, что нарушение функционирования ряда субъединиц данного рецептора, в том числе α1–4, β1–2 и γ1-субъединиц, предположительно ассоциировано с депрессивными нарушениями [12, 13]. Наиболее интересными для исследования структурами головного мозга представляются гиппокамп, префронтальная кора, средний мозг и миндалина, поскольку изменение их функционирования наиболее часто ассоциировано с развитием депрессивного расстройства [14–16]. Учитывая сказанное выше, целью работы стала проверка нашего предположения об изменении относительной экспрессии генов, кодирующих субъединицы α1, α2, α3 и β2 ГАМКА-рецепторов в гиппокампе, префронтальной коре, среднем мозге и миндалине крыс с депрессивноподобным состоянием, индуцированным хроническим ультразвуковым воздействием.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проводили на самцах крыс линии Sprague–Dawley из питомника лабораторных животных “Пущино”. В начале эксперимента возраст животных составлял 2.5–3 мес. На протяжении всего опыта животные содержались в индивидуальных поликарбонатных клетках размером 30 × 20 × 15см при постоянной температуре 23°С, контролируемом прямом освещении в режиме 12 : 12 ч и свободным доступом к воде и пище. Содержание крыс и все экспериментальные процедуры были выполнены в соответствии с международными правилами обращения с животными (Директива 2010/63 Европейского сообщества от 22 сентября 2010 г.). Было задействовано 3 опытные группы животных и группа контроля (по 10 особей в каждой группе). Опытные группы подвергались воздействию ультразвуковых волн частотой 20–45 кГц, подающихся случайным образом в течение 1, 2 и 3 нед.
Ультразвуковое воздействие производили с помощью УЗ-генератора (Weitech, Wavre, Belgium). Диапазон излучаемых частот составлял 20–45 кГц; уровень звукового давления на расстоянии 1.5 м равнялся 80 дБ.
Через сутки после окончания ультразвуковой экспозиции проводили поведенческое тестирование. Все тесты проводили в дневное время с 10 до 13 ч. Поведение животных во всех тестах регистрировали с помощью цифровой видеокамеры и анализировали, используя компьютерную программу RealTimer (“Открытая наука”, Россия). Использовались следующие поведенческие тесты:
Тест на предпочтение раствора сахарозы. В течение 24 ч крысам одновременно был предоставлен доступ к выбору между двумя идентичными поилками, одна из них содержала 1%-ый раствор сахарозы, а другая — обычную воду. Расположение поилок менялось через 12 ч, чтобы исключить эффект предпочтения места. Предпочтение раствора сахарозы вычисляли по следующей формуле: Предпочтение = (масса потребленного раствора сахарозы/суммарная масса потребленной жидкости) × 100%. Потребление воды и раствора сахарозы было оценено путем взвешивания поилок до и после окончания эксперимента.
Тест “Социального взаимодействия”. В домашнюю клетку тестируемого животного на 10 мин помещали ювенильного самца крыс линии Sprague–Dawley (возрастом 4–5 нед.). Регистрировали суммарное время социальных (обнюхивание партнера, груминг и следование) контактов между экспериментальными животными.
Модифицированный тест “Принудительного плавания”. Крысу помещали в стеклянный цилиндр высотой 45 см и диаметром 20 см, на 30 см заполненный водой, температура которой составляла 24°С. После 2 мин адаптации в течение 6 мин регистрировали суммарную длительность иммобильности (отсутствия активных движений). Воду меняли после каждого животного.
Через сутки после окончания тестирования животных глубоко наркотизировали (5% р-р кетамина, 200 мг/кг, внутрибрюшинно), затем проводили декапитацию, извлекали головной мозг и на холодной подложке выделяли гиппокамп, префронтальную кору, средний мозг и миндалину. Структуры помещали в раствор RNAlater (Qiagen, Германия) и хранили при 4°С до выделения тотальной РНК. Выделение тотальной РНК из ткани проводили с помощью TRI REAGENT (MRC, США) по протоколу производителя. Концентрацию тотальной РНК в полученных образцах измеряли с помощью спектрофотометра NanovuePlus (GE Healthcare, США). Обратную транскрипцию проводили с помощью набора производства компании “ЕВРОГЕН” (Россия), используя амплификатор Applied Biosystems 2720 Thermal Cycler (Thermo Fisher Scientific, США). При обратной транскрипции использовали 1000 нг тотальной РНК. ПЦР в реальном времени проводили при помощи амплификатора StepOnePlus (Applied Biosystems, Thermo Fisher Scientific, США). Для исследования были выбраны гены GABRA1, GABRA2, GABRA3 и GABRB2, а в качестве референсного гена − ген GAPDH. Референсный ген был выбран на основе предыдущих публикаций, посвященных исследованию генной экспрессии мозга экспериментальных животных, подвергающихся хроническому ультразвуковому воздействию [4, 17], где была продемонстрирована низкая вариабельность данного гена в лимбических структурах мозга. Последовательности праймеров, представленные в табл. 1, были получены с использованием программы BeaconDesigner 7 (Premier Biosoft International, США) и синтезированы в компании “Евроген” (Россия). Перед постановкой ПЦР в реальном времени кДНК разводили в 5 раз до концентрации 200 нг/мкл. Для каждого праймера измерялась эффективность ПЦР, составившая 95–98%. ПЦР в реальном времени проводили с использованием интеркалирующего красителя SYBR Green Master Mix (Applied Biosystems, Thermo Fisher Scientific, США) при следующих условиях: первичная денатурации при температуре 95°С в течение 4 минут, денатурация – при температуре 95°С в течение 20 с, отжиг и элонгация – при температуре 62°С в течение 1 мин 30 с. Все реакции повторялись в течение 40 циклов. Реакцию осуществляли в объеме 10 мкл, используя 1 мкл исследуемой кДНК. При каждом исследовании реакцию ставили в трех повторах. Эксперимент проводили в двух повторах. Относительный уровень экспрессии целевых генов рассчитывали по формуле 2–ΔΔСt ± 2±SEM [18]. Значение порогового цикла (Ct) соответствует относительному количеству целевой РНК. Уровень экспрессии генов опытных групп сравнивался с уровнем их экспрессии группы контроля.
Таблица 1.
Последовательности праймеров для исследуемых генов
| Праймер | Последовательность |
|---|---|
| GABRA1 | |
| -forward | GACAAGCCCGTGATGAAGAAA |
| -reverse | TCCTCGTGAAGACAGTGGTG |
| GABRA2 | |
| -forward | CTGAAGTCTCCACCAACATCTAT |
| -reverse | AACCGCTCGTCTTTCCATTT |
| GABRA3 | |
| -forward | TGCCATATTCAATCTTGTCTATT |
| -reverse | TGCTGCCACTATTATCTACT |
| GABRB2 | |
| -forward | CCACAATCAATACCCATCTCC |
| -reverse | GCCATAAAGACAAAGACAAAGC |
| GAPDH | |
| -forward | AAACCCATCACCATCTTCCA |
| -reverse | GTAGACTCCACGACATACTCAG |
Данные по измерению показателей относительной экспрессии генов выражали как Mean ± SEM. Предварительно был проведен тест Колмогорова–Смирнова, результаты которого не отрицали нормальность распределения данных. Для статистической обработки данных использовали однофакторный дисперсионный анализ ANOVA с последующим post hoc анализом Fisher’s LSD test. Статистически значимыми считались различия при p < 0.05. Для статистического анализа использовалась программа GraphPadPrism 6.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
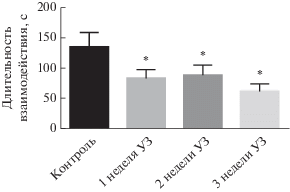
Поведенческое тестирование. Только две и более недель хронического ультразвукового воздействия привели к статистически значимому снижению предпочтения сахарозы (F3,36 = 4.02, p < 0.05, one-way ANOVA, рис. 1) и увеличению длительности иммобильности в тесте “Принудительного плавания” (F3,36 = 3.35, p < 0.05, one-way ANOVA, рис. 2). При этом снижение продолжительности социальных контактов в тесте “социального взаимодействия” было зарегистрировано уже через одну неделю ультразвукового воздействия (F3.36 = 6.99, p < 0.05, one-way ANOVA, рис. 3).
Рис. 1.
Предпочтение крысами сахарозы было снижено по сравнению с контрольной группой через 2 нед. и 3 нед. (p < 0.05, post hoc Fisher’s LSD test) хронического ультразвукового воздействия.
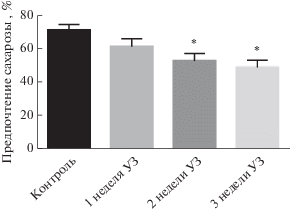
Рис. 2.
Длительность иммобильности была увеличена по сравнению с контрольной группой через 2 нед. и 3 нед. (p < 0.05, post hoc Fisher’s LSD test) хронического ультразвукового воздействия.
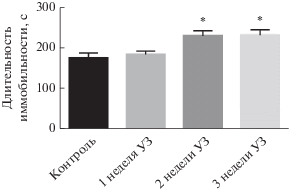
Рис. 3.
Длительность социального взаимодействия крыс с ювенильными самцами была снижена по сравнению с контрольной группой через 1 нед., 2 нед. и 3 нед. (p < 0.05, post hoc Fisher’s LSD test) хронического ультразвукового воздействия.
Исследование относительной генной экспрессии. В нашем исследовании ультразвуковое воздействие вызвало существенное снижение экспрессии гена GABRA1, кодирующего субъединицу α1 ГАМКА-рецепторов. При этом сроки и выраженность развития статистически значимого снижения экспрессии данного гена были различны в разных структурах. Так, в гиппокампе и префронтальной коре снижение экспрессии наблюдалось уже после 1 недели ультразвукового воздействия и сохранялось во всех экспериментальных группах, т.е. на всех рассмотренных сроках ультразвукового воздействия. В отличие от этого, в среднем мозге и миндалине снижение экспрессии гена GABRA1 наблюдалось только после 2 нед. стрессового воздействия (табл. 2).
Таблица 2.
Относительная экспрессия гена GABRA1. Данные представлены как Mean ± SEM. Для анализа использована one-way ANOVA с последующим post hoc анализом Fisher’s LSD test
| Структура мозга/группа | Контроль | 1 неделя УЗ | 2 недели УЗ | 3 недели УЗ |
|---|---|---|---|---|
| Гиппокамп (F3,36 = 6.19, p < 0.05) |
1.06 ± 0.13 | 0.27 ± 0.12 p < 0.05 vs контроль |
0.44 ± 0.15 p < 0.05 vs контроль |
0.55 ± 0.19 p < 0.05 vs контроль |
| Префронтальная кора (F3,36 = 6.01, p < 0.05) |
1.11 ± 0.29 | 0.39 ± 0.12 p < 0.05 vs контроль |
0.43 ± 0.12 p < 0.05 vs контроль |
0.37 ± 0.12 p < 0.05 vs контроль |
| Средний мозг (F3,36 = 4.09, p < 0.05) |
1.16 ± 0.22 | 0.78 ± 0.18 | 0.53 ± 0.11 p < 0.05 vs контроль |
0.52 ± 0.16 p < 0.05 vs контроль |
| Миндалина (F3,36 = 3.73, p < 0.05) |
1.32 ± 0.19 | 1.28 ± 0.27 | 0.58 ± 0.14 p < 0.05 vs контроль |
0.55 ± 0.14 p < 0.05 vs контроль |
Влияние ультразвукового воздействия на относительную экспрессию гена GABRA2, кодирующего субъединицу α2 ГАМКА-рецептора, оказалось выраженным слабее по сравнению с его влиянием на относительную экспрессию гена GABRA1 (табл. 3). Так, в гиппокампе, в отличие от гена GABRA1, ни один из рассматриваемых сроков ультразвукового воздействия не привел к изменению экспрессии гена GABRA2. При этом в префронтальной коре также наблюдалось снижение экспрессии гена GABRA2 уже после одной недели ультразвукового стресса.
Таблица 3.
Относительная экспрессия гена GABRA2. Данные представлены как Mean ± SEM. Для анализа использована one-way ANOVA с последующим post hoc анализом Fisher’s LSD test
| Структура мозга/группа | Контроль | 1 неделя УЗ | 2 недели УЗ | 3 недели УЗ |
|---|---|---|---|---|
| Гиппокамп (F3,36 = 0.98, p > 0.05) |
1.11 ± 0.14 | 1.84 ± 0.52 | 1.53 ± 0.57 | 1.31 ± 0.47 |
| Префронтальная кора (F3,36 = 6.94, p < 0.05) |
1.33 ± 0.25 | 0.5 ± 0.13 p < 0.05 vs контроль |
0.72 ± 0.23 p < 0.05 vs контроль |
0.66 ± 0.19 p < 0.05 vs контроль |
| Средний мозг (F3,36 = 3.45, p < 0.05) |
1.08 ± 0.34 | 1.17 ± 0.3 | 0.66 ± 0.13 | 0.12 ± 0.05 p < 0.05 vs контроль |
| Миндалина (F3,36 = 4.76, p < 0.05) |
1.22 ± 0.22 | 1.28 ± 0.25 | 0.57 ± 0.14 | 0.38 ± 0.07 p < 0.05 vs контроль |
Другое отличие заключалось в том, что в среднем мозге и миндалине снижение экспрессии гена GABRA2 проявилось только после 3 нед. хронического ультразвукового воздействия.
Аналогично уровню экспрессии гена GABRA1 и в отличие от уровня экспрессии гена GABRA2, экспрессия гена GABRA3, кодирующего субъединицу α3 ГАМКА-рецепторов, снизилась в гиппокампе и префронтальной коре после 1 нед. ультразвукового воздействия (табл. 4). Снижение экспрессии гена GABRA3 также наблюдалось в среднем мозге, но только после 3 нед. ультразвукового воздействия. При этом в миндалине, в отличие от результатов, полученных при изучении экспрессии генов GABRA1 и GABRA2, не наблюдалось статистически значимого изменения экспрессии гена GABRA3 ни на одном из сроков ультразвукового воздействия.
Таблица 4.
Относительная экспрессия гена GABRA3. Данные представлены как Mean ± SEM. Для анализа использована one-way ANOVA с последующим post hoc анализом Fisher’s LSD test
| Структура мозга/группа | Контроль | 1 неделя УЗ | 2 недели УЗ | 3 недели УЗ |
|---|---|---|---|---|
| Гиппокамп (F3,36 = 9.17, p < 0.05) |
1.10 ± 0.13 | 0.38 ± 0.16 p < 0.05 vs контроль |
0.36 ± 0.13 p < 0.05 vs контроль |
0.45 ± 0.25 p < 0.05 vs контроль |
| Префронтальная кора (F3,36 = 7.25, p < 0.05) |
1.04 ± 0.16 | 0.42 ± 0.17 p < 0.05 vs контроль |
0.45 ± 0.11 p < 0.05 vs контроль |
0.41 ± 0.15 p < 0.05 vs контроль |
| Средний мозг (F3,36 = 3.88, p < 0.05) |
1.12 ± 0.1 | 1.02 ± 0.35 | 0.98 ± 0.23 | 0.24 ± 0.13 p < 0.05 vs контроль |
| Миндалина (F3,36 = 0.78, p > 0.05) |
1.14 ± 0.17 | 0.98 ± 0.28 | 1.13 ± 0.25 | 0.93 ± 0.19 |
В целом, изменения экспрессии гена GABRA3 оказались менее выраженными, чем изменения экспрессии гена GABRA1, но более выраженными, чем изменения экспрессии гена GABRA2.
В отличие от активности всех рассмотренных ранее генов, кодирующих субъединицы α1, α2 и α3, активность гена GABRB2, кодирующего субъединицу β2 ГАМКА-рецепторов, оказалась не ассоциирована с развитием депрессивноподобного состояния в данной модели, поскольку уровень его относительной экспрессии не изменился ни в одной структуре и ни на одном из рассмотренных сроков ультразвукового воздействия (табл. 5).
Таблица 5.
Относительная экспрессия гена GABRB2. Данные представлены как Mean ± SEM. Для анализа использована one-way ANOVA с последующим post hoc анализом Fisher’s LSD test
| Структура мозга/группа | Контроль | 1 неделя УЗ | 2 недели УЗ | 3 недели УЗ |
|---|---|---|---|---|
| Гиппокамп (F3,36 = 0.23, p > 0.05) |
1.02 ± 0.16 | 1.1 ± 0.18 | 0.9 ± 0.26 | 0.88 ± 0.33 |
| Префронтальная кора (F3,36 = 1.16, p > 0.05) |
1.09 ± 0.14 | 0.99 ± 0.27 | 1.02 ± 0.24 | 0.86 ± 0.17 |
| Средний мозг (F3,36 = 0.81, p > 0.05) |
1.06 ± 0.1 | 0.94 ± 0.23 | 0.85 ± 0.14 | 0.89 ± 0.24 |
| Миндалина (F3,36 = 1.24, p > 0.05) |
1.17 ± 0.19 | 0.92 ± 0.25 | 1.1 ± 0.11 | 0.98 ± 0.19 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Роль ГАМКергической системы в патогенезе депрессивного расстройства остается менее изученной по сравнению с системами моноаминовых нейромедиаторов. Однако ряд исследований указывает на ее взаимосвязь с развитием как клинической депрессии человека, так и депрессивноподобного состояния экспериментальных животных. В частности, имеются подтверждения роли различных субъединиц ГАМКА-рецепторов в развитии депрессивноподобного состояния грызунов, однако в основном соответствующие исследования проводились на мышах и крысах, нокаутных по гену, кодирующему какую-либо субъединицу данного рецептора [19, 20]. Таким образом, наблюдается недостаток изучения роли данных субъединиц у животных со стресс-индуцированным депрессивноподобным состоянием. В связи с этим, представляют интерес полученные нами данные с использованием новой модели депрессивноподобного состояния.
Тест вынужденного плавания долгое время рассматривался как модель “поведенческого отчаяния” – еще одного характерного симптома депрессивноподобного состояния [21]. Увеличение времени иммобильности (отсутствия активных попыток выбраться из наполненного водой цилиндра) в данном тесте рассматривается как пассивная стратегия борьбы со стрессовой ситуацией и наблюдается при развитии депрессивноподобного состояния [22]. Однако в настоящее время рядом исследователей оспаривается трактовка этой процедуры как теста на определение депрессивноподобного состояния грызунов [23], поэтому в настоящей работе также был проведены другие поведенческие тесты, в том числе тест на развитие ангедонии, считающийся наиболее достоверным методом определения депрессивноподобного состояния у грызунов. Так, наличие ангедонии означает снижение способности получать удовольствие [24]. У грызунов данное состояние выражается в том числе в снижении предпочтения к раствору сахара, поскольку в норме грызуны предпочитают потреблять подслащенный раствор, в то время как при наличии депрессивноподобного состояния это предпочтение снижается или отсутствует [25]. В данной работе изменения поведения были зарегистрированы в обоих тестах и только спустя 2 нед. ультразвукового воздействия. При этом уже после 1 нед. ультразвукового воздействия было обнаружено нарушение социального поведения самцов крыс, выражающееся в снижении длительности социальных контактов.
Интересно, что снижение относительной генной экспрессии субъединиц ГАМКА-рецептора также было зарегистрировано уже после 1 нед. ультразвукового воздействия. При этом наиболее чувствительной к стрессовому воздействию в данной модели оказалась субъединица α1 ГАМКА-рецептора, поскольку снижение относительной экспрессии кодирующего ее гена GABRA1 наблюдалось во всех изучаемых структурах мозга.
В отличие от гена GABRA1, уровень относительной экспрессии генов GABRA2 и GABRA3 снижался не во всех исследуемых структурах. Так, снижение экспрессии гена GABRA2, кодирующего α2-субъединицу, произошло только в среднем мозге и миндалине, а снижение экспрессии гена GABRA3, кодирующего α3-субъединицу, только в среднем мозге и префронтальной коре. Таким образом, в целом в данной работе наблюдалось стресс-индуцированное снижение количественных компонентов ГАМКергической системы, однако её реакция в ответ на ультразвуковое воздействие в разных структурах мозга оказалась неодинаковой.
Кроме того, исследование динамики снижения относительной экспрессии генов, кодирующих субъединицы ГАМКА-рецепторов, в ответ на ультразвуковое воздействие позволило установить различные временные интервалы, в которые происходят эти изменения. Так, снижение экспрессии гена GABRA1 наблюдалось уже после 1 нед. хронического ультразвукового воздействия, в то время как снижение экспрессии гена GABRA2 развивалось только после 3 нед. аналогичного воздействия. Таким образом, продолжительность стрессового воздействия может различным образом влиять на функционирование ГАМКергической системы.
Полученные нами данные могут способствовать объяснению некоторых противоречий, полученных ранее другими авторами. Так, в исследовании, посвященном влиянию на функционирование ГАМКергической системы крыс стресса, вызванного вынужденным плаванием, говорится о снижении экспрессии генов, кодирующих различные субъединицы ГАМКА-рецепторов, в том числе субъединицы α1 и α2 [26]. При этом в другом исследовании не было выявлено изменения экспрессии генов, кодирующих α1- и α2-субъединицы ГАМКА-рецептора в мозге крыс, подвергнутых процедуре хронического непредсказуемого стресса [27]. Вероятно, подобные отличия в полученных результатах могут быть связаны со сложной зависимостью развития нарушений функционирования различных компонентов ГАМКергической системы, для выяснения которой требуется продолжать исследования в этом направлении.
Таким образом, в нашей работе наблюдалась тенденция к стресс-индуцированному снижению экспрессии генов, кодирующих субъединицы α1, α2 и α3 ГАМКергических рецепторов, подобно тому, как это было отмечено в клинических исследованиях [12, 28]. Данный эффект был обнаружен нами во всех выбранных для исследования структурах мозга и проявился одновременно с поведенческими чертами депрессивноподобного состояния. Однако при этом наблюдалась различная вовлеченность структур в реакции на стрессовое воздействие. Полученные данные могут оказаться важными при сравнении моделей депрессивноподобного состояния, различающихся по длительности стрессового воздействия, и для исследования зависимости развивающихся молекулярных изменений от продолжительности действия стресса в целом.
ВЫВОДЫ
1) Ультразвуковое воздействие, вызывающее развитие депрессивноподобного состояния у крыс, приводит к снижению функции ГАМКергической системы, выраженному в снижении уровня относительной экспрессии генов GABRA1, GABRA2, GABRA3. В уровне экспрессии гена GABRB2 изменений обнаружено не было. 2) Наличие и выраженность изменений, индуцированных воздействием ультразвука переменных частот, зависит от продолжительности стрессового воздействия и структуры мозга.
Список литературы
Kessler R., Aguilar-Gaxiola S., Alonso J., Chatterji S., Lee S., Ormel J., Üstün B., Wang P. // Epidemiol. Psichiatr. Soc. 2009. V. 18. P. 23–33.
Григорьян Г.А., Гуляева Н.В. // Журн. высш. нерв. деят. 2015. Т. 65. № 6. С. 643–660.
Duman C.H. // Vitam. Horm. 2010. V. 82. P. 1–21.
Morozova A., Zubkov E., Strekalova T., Kekelidze Z., Storozeva Z., Schroeter C.A., Lesch K.P., Cline B.H., Chekhonin V. // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2016. V. 68. P. 52–63.
Горлова А.В., Павлов Д.А., Ушакова В.М., Зубков Е.А., Морозова А.Ю., Иноземцев А.Н., Чехонин В.П. // Бюлл. эксп. биол. и мед. 2017. Т. 163. № 3. С. 271–274.
Brudzynski S. // Behav. Brain Res. 2007. V. 182. P. 261–273.
Litvin Y., Blanchard C., Blanchard R. // Behav. BrainRes. 2007. V. 182. P. 166–172.
Морозова, А.Ю., Зубков Е.А., Сторожева З.И., Кекелидзе З.И., Чехонин В.П. // Бюлл. эксп. биол. и мед. 2012. Т. 154. № 12. С. 705–708.
Mansari M., Guiard B., Chernoloz O., Ghanbari R., Katz N., Blier P. // CNS Neurosci. Ther. 2010. V. 16. P. 1–17.
Olsen R.W., Sieghart W. // Neuropharmacology. 2009. V. 56. P. 141–148.
Gunther U., Benson J., Benke D., Fritschy J.M., Reyes G., Knoflach F., Crestani F., Aguzzi A., Arigoni M., Lang Y., Bluethmann H., Mohler H., Luscher B. // Proc. Natl. Acad. Sci. USA. 1995. V. 92. P. 7749–7753.
Fatemi S.H., Folsom T.D., Rooney R.J., Thuras P.D. // Transl. Psychiatry. 2013. Published online. https://doi.org/10.1038/tp.2013.46
Smith K.S., Rudolph U. // Neuropharmacology. 2012. V. 62. P. 54–62.
Sapolsky R. // Proc. Natl. Acad. Sci. USA. 2001. V. 98. P. 12320–12322.
Coryell W., Nopoulos P., Drevets W., Andreasen N. // American J. Psychiatry. 2005. V. 162. P. 1706–1712.
Hamilton J., Siemer M., Gotlib I. // Mol. Psychiatry. 2008. V. 13. P. 993–1000.
Pavlov D., Bettendorff L., Gorlova A., Olkhovik A., Kalueff A., Ponomarev E., Inozemtsev A., Chekhonin V., Lesch K.P., Anthony D.C., Strekalova T. // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2019. V. 90. P. 104–116.
Livak K.J., Schmittgen T.D. // Methods. 2001. V. 25. P. 402–408.
Shen Q., Lal R., Luellen B.A., Earnheart J.C., Andrews A.M., Luscher B. // Biological. Psychiatry. 2010. V. 68. P. 512–520.
Earnheart J.C., Schweizer C., Crestani F., Iwasato T., Itohara S., Mohler H., Luscher B. // J. Neuroscience. 2007. V. 27. P. 3845–3854.
Castagné V., Moser P., Porsolt R.D. Methods of Behavior Analysis in Neuroscience, 2nd edition. CRC Press/Taylor & Francis. 2009.
Slattery D.A., Cryan J.F. // Nature protocols, 2012. V. 7. P. 1009–1014.
Molendijk M., de Kloet E.R. // Behav. Brain. Res. 2019. V. 365. P. 1–10.
Moreau J. // Dialogues Clin. Neurosci. 2002. V. 4. P. 351–360.
Overstreet D.H. // Modeling depression in animal models // Methods Mol. Biol. 2012. V. 829. P. 125–144
Maguire J. // Front. Cell Neurosci. 2014. V. 8. P. 157–169.
Verkuyl J.M., Hemby S.E., Joëls M. // Eur. J. Neurosci. 2004. V. 20. P. 1665–1673.
Rocha L., Alonso-Vanegas M., Martínez-Juárez I.E., Orozco-Suárez S., Escalante-Santiago D., Feria-Romero I.A., Zavala-Tecuapetla C., Cisneros-Franco J.M., Buentello-García R.M., Cienfuegos J. // Front. Cell Neurosci. 2015. V. 8. P. 442.
Дополнительные материалы отсутствуют.


