Нейрохимия, 2020, T. 37, № 1, стр. 750-79
Содержание моноаминов нейротрансмиттеров в варолиевом мосту при экспериментальном синдроме посттравматических стрессорных расстройств
В. Э. Цейликман 1, М. В. Комелькова 1, М. С. Лапшин 1, О. Б. Цейликман 1, М. Н. Карпенко 2, Н. С. Пестерева 2, Е. Б. Манухина 1, 3, 4, Г. Ф. Дауни 1, 4, М. В. Кондашевская 5
1 ФГАОУ Южно-Уральский государственный университет
(Национальный исследовательский университет)
Челябинск, Россия
2 ФГБНУ “Институт экспериментальной медицины”
Санкт-Петербург, Россия
3 ФГБНУ “Научно-исследовательский институт общей патологии и патофизиологии”
Москва, Россия
4 Отдел физиологии и анатомии, Центр наук о здоровье, Университет Северного Техаса
Форт, Уэрт, США
5 ФГБНУ “Научно-исследовательский институт морфологии человека”
Москва, Россия
Поступила в редакцию 20.11.2018
После доработки 27.03.2019
Принята к публикации 30.05.2019
Аннотация
При синдроме посттравматических стрессорных расстройств (ПТСР) развитие тревожной симптоматики коррелирует с повышением содержания норадреналина и дофамина и снижением содержания серотонина в лимбических структурах головного мозга. К сожалению, не известен характер изменений уровня моноаминов-нейротрансмиттеров в таких стволовых структурах мозга, как варолиев мост, хотя известно о его поражении у больных ПТСР. Целью исследования являлось определение содержания моноаминов-нейротрансмиттеров и их метаболитов в варолиевом мосту в условиях экспериментального синдрома постравматических стрессорных расстройств. Для воспроизведения симптомов ПТСР использовалась модель предаторного стресса, осуществляемая путем контакта крыс с запахом кошки. Уровень тревожности определялся в тесте приподнятый крестообразный лабиринт. Путем высокоэффективной жидкостной хроматографии определяли концентрации норадреналина, дофамина и его метаболита диоксифенилуксусной кислоты. Установлено, что в условиях экспериментального ПТСР в варолиевом мосту снижалось содержание норадреналина. При этом содержание дофамина и серотонина не претерпело значимых изменений. Получены отрицательные корреляции содержания норадреналина с индексом тревожности. В варолиевом мосту отсутствовали типичные для ПТСР изменения уровня моноаминов-нейротрансмиттеров. В отличие от лимбических структур здесь наблюдалось не повышение, а снижение уровня норадреналина при неизменном уровне других моноаминов и их метаболитов.
ВВЕДЕНИЕ
Посттравматическое стрессовое расстройство (ПТСР) является психическим заболеванием, которое развивается после того, как организм подвергнется опасному для жизни травматическому опыту. Для ПТСР характерны долгосрочные симптомы непрерывного переживания травматического события, избегание стимулов, связанных с травмой, и повышенным возбуждением [1].
В настоящее время интенсивно изучаются патофизиологические механизмы ПТСР, в особенности его нейробиологические и нейрохимические проявления, среди которых в первую очередь выделяют повышение активности амигдалы при одновременном снижении активности префронтальной коры, стриатума и гиппокампа, изменение уровня моноаминов-нейротрансмиттеров в различных регионах головного мозга [2]. В частности, установлено, что в этих структурах наблюдается повышенный уровень норадреналина и дофамина при сниженном уровне серотонина. Среди структур головного мозга, на которых сфокусированы исследования ПТСР, варолиев мост является явным аутсайдером. Между тем он играет главную роль основной магистрали, через который проходят все восходящие и нисходящие пути, связывающие передний мозг со спинным мозгом, с мозжечком и другими структурами ствола. Поэтому поражение варолиевого моста при ПТСР может неблагоприятно отразиться не только на поведенческой активности, но и на состоянии автономной нервной системы в целом. Согласно данным волюмометрического анализа головного мозга для больных ПТСР характерна редукция серого вещества в варолиевом мосту [3]. Для понимания механизма этого повреждения мозга полезно оценить такие нейрохимические изменения в варолиевом мосту, как изменение содержания моноаминов-нейротрансмиттеров и сопоставить эти сдвиги с симптомами ПТСР. Для решения этой задачи можно эффективно использовать экспериментальную модель ПТСР у животных. Ранее была показана способность предаторного стресса, являющегося валидизированной моделью ПТСР, существенно модулировать уровень моноаминов-нейротрансмиттеров в различных структурах головного мозга [4]. Целью данного исследования являлось изучение в варолиевом мосту крыс изменений содержания норадреналина, дофамина, серотонина, а также продуктов метаболизма дофамина и серотонина с последующим корреляционным анализом этих показателей с уровнем тревожности.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено в осенне-зимний период на 40 половозрелых самцах крыс Вистар (питомник Столбовая, исходная масса тела 220 ± 25 г), содержавшихся в отдельных клетках по 5 особей. Все экспериментальные процедуры проводили в соответствии с регламентом декларации ЕС от 2010 г. об использовании лабораторных животных.
Было сформировано две группы животных: 1-ая группа – контрольные крысы; 2-ая группа – крысы с ПТСР. В этом исследовании использовалась нами модифицированная и валидированная модель предаторного стресса [5], создаваемая путем экспозиции запаха хищника в виде кошачьей мочи в течение 10 мин. В исходной модели предаторного стресса использовалась однократная экспозиция стрессора. Наша модификация выражалась в многократном увеличении количества ежедневных экспозиций кошачьей мочой до 10 с последующим содержанием 14 сут в обычных условиях. В отличие от однократного стрессирования, предложенный нами вариант позволил дополнительно воспроизвести в эксперименте типичное для больных ПТСР снижение уровня глюкокортикоидов при наличии характерного для исходной модели ПТСР тревожного симптома, и нейрохимических изменениях в различных структурах мозга. На 15 сут осуществлялось тестирование поведенческой активности животного в приподнятом крестообразном лабиринте (ПКЛ). В тесте ПКЛ регистрировали в течение 600 с: время нахождения в открытых и закрытых рукавах, а также число заходов в открытые и закрытые рукава.
В тот же день животные умерщвлялись хлорат-гидратным наркозом. Из черепной коробки извлекался головной мозг. Варолиев мост отделялся от остальных структур мозга в соответствии с рекомендациями [6]. Образцы варолиевого моста хранились в жидком азоте до востребования. С помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) определяли содержание норадреналина, дофамина, серотонина, а также метаболита дофамина диоксифенилуксусной кислоты (ДОФУК) и метаболита серотонина 5‑гидроксииндолилуксусной кислоты (5ГИУК). Подготовка проб проводилась гомогенизированием образцов в 0.1 М хлорной кислоте и центрифугированием со скоростью 10 000 g при 4°С в течение 30 мин. На анализ брали 20 мкл образца. ВЭЖХ проводили в изократических условиях с использованием обращённо-фазовой колонки (длина алкильной цепи C18) с последующей электрохимической детекцией. Количественное определение уровня моноаминов проводили с применением метода внешнего стандарта. Состав подвижной фазы: 75 мМ фосфатный буфер, содержащий 2мМ лимонной кислоты (pH 4.6); 0,1 мМ октансульфоновой кислоты и 15% ацетонитрила (V/V). Электрохимическая детекция осуществлялась стеклоуглеродным электродом при +700 мВ. Статистический анализ осуществляли, используя пакет прикладных программ Statistica 8.0. и непараметрический критерий Манна–Уитни. Результаты выражали как Me (Qн; Qв) – медиана, нижний и верхний квартили. Для выявления статистической зависимости вычисляли коэффициент корреляции Спирмена. Различия считали значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Регистрация поведения крыс в ПКЛ позволила выявить ряд изменений, свидетельствующих о развитии повышенной тревожности. Это выражалось в повышении длительности нахождения животных в закрытых рукавах ПКЛ, снижении времени, проведенного в открытых рукавах, а также числа заходов в открытые рукава (табл. 1).
Таблица 1.
Показатели поведенческой активности у крыс при экспериментальном ПТСР
| Показатели | Контроль (n = 9) | ПТСР (n = 7) |
|---|---|---|
| Время в открытых рукавах, с | 184.24 (125.1; 280.2) |
107.7(*) (20.1; 185.2) |
| Время в закрытых рукавах, с | 375.0 (305; 453) |
458.7(*) (314; 544) |
| Количество заходов в открытые рукава | 5.0 (4; 5) |
2.0(*) (2; 3) |
| Количество заходов в закрытые рукава | 4 (2;6) |
6.5 (5; 10) |
Согласно данным ВЭЖХ, влияние ПТСР на содержание моноаминов-нейротрансмиттеров в варолиевом мосту выражалось в редукции содержания норадреналина (табл. 2). Как видно из табл. 2, у стрессированных животных содержание норадреналина в варолиевом мосту снизилось на 35.7% по сравнению с контролем. После завершения предаторного стресса отсутствовали статистически значимые изменения содержания серотонина, его метаболита 5-гидроксииндолацетата и метаболического индекса серотонина, выражавшегося в отношении 5-гидроксииндолацетата к серотонину. Данный метаболический индекс принято рассматривать как косвенный показатель обратного захвата серотонина. Аналогично, у крыс в условиях ПТСР отсутствовали значимые изменения содержания дофамина, однако метаболический индекс дофамина снижался.
Таблица 2.
Содержание моноаминов-нейротрансмиттеров и их метаболитов в варолиевом мосту при экспериментальном ПТСР
| Показатели | Контроль (n = 9) | ПТСР (n = 7) |
|---|---|---|
| Норадреналин, пг/мг ткани | 217.2 (212; 226) |
138.1(*) (132; 143) |
| Дофамин, пг/мг ткани | 60 (54; 68) |
65 (60; 66) |
| Диоксифенилацетат, пг/мг ткани | 22 (21; 24) |
20 (20; 21) |
| Метаболический индекс дофамина | 0.39 (0.33; 04) |
0.31(*) (0.3; 0.33) |
| Серотонин, пг/мг ткани | 425 (422; 453) |
440 (416; 486) |
| 5 гидроксилиндолилацетат, пг/мг ткани | 418 (386; 436) |
421 (397; 457) |
| Метаболический индекс серотонина | 0.96 (0.86; 0.99) |
0.92 (0.88; 0.99) |
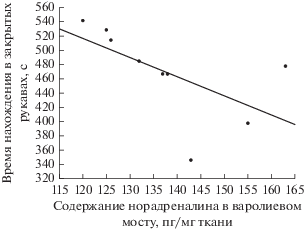
Корреляционный анализ позволил выявить у крыс, испытывающих тревожную симптоматику ПТСР, положительную корреляцию между временем нахождения в открытых рукавах крестообразного лабиринта и содержанием норадреналина (rs = 0.692; p = 0.045) (рис. 1). Также обнаружена обратная корреляционная зависимость между содержанием норадреналина и временем нахождения в темных рукавах крестообразного лабиринта (rs = –0.713; p = 0.039) (рис. 2).
Рис. 1.
Корреляционная зависимость между содержанием норадреналина и временем нахождения в открытых рукавах крестообразного лабиринта у крыс с ПТСР-подобным состоянием.
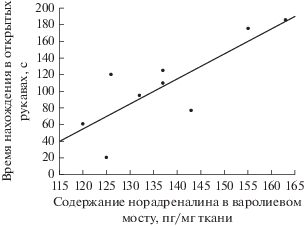
Рис. 2.
Корреляционная зависимость между содержанием норадреналина и временем нахождения в закрытых рукавах крестообразного лабиринта у крыс с ПТСР-подобным состоянием.
Таким образом, в условиях экспериментального ПТСР характер изменений уровня норадреналина диаметрально противоположен вектору, типичному для других регионов головного мозга. Прежде всего, представление о приросте содержания норадреналина в различных структурах головного мозга считается атрибутивным признаком ПТСР [2, 4, 7]. В условиях предаторного стресса прирост содержания норадреналина отмечен в префронтальной коре и в гиппокампе. В экспериментальной модели ПТСР, которая была воспроизведена путем повторного воздействия фут-шоком, усиливалась норадренергическая активность в миндалине [8]. Повышенная норадренергическая активность в миндалине вносит свой вклад в повышенной возбудимости, характерной для животной модели ПТСР. Причем именно этот нейромедиатор несет ответственность за развитие тревожной симптоматики. Прирост содержания норадреналина связывают с повышением его синтеза в Locus Coeruleus при ПТСР. Другим возможным механизмом является снижение уровня его катаболизма в нервных терминалях. В пользу этого свидетельствуют данные о снижении каталитической активности МАО-А в головном мозге крыс, испытывающих ПТСР. Однако синтез норадреналина осуществляется исключительно в Locus Coeruleus. Поэтому весьма затруднительно связать сниженный уровень норадреналина в варолиевом мосту с угнетением его синтеза. Маловероятно, что сниженный уровень норадреналина обусловлен активацией МАО-А в варолиевом мосту. Экспрессия МАО-А усиливается глюкокортикоидами, а для этой модели ПТСР характерны сниженный уровень кортикостерона и сниженный уровень активности МАО-А [9, 10]. По нашему мнению, сниженный уровень норадреналина обусловлен ослаблением импульсов в варолиев мост с проекций норадренергических нейронов. Возможно, за счет этого усиливается норадренергическая импульсация других регионов головного мозга, таких как амигдала, префронтальная кора, гиппокамп, где и наблюдется повышение уровня норадреналина.
В отличие от других регионов головного мозга, для варолиевого моста не характерны изменения уровней серотонина и дофамина. Поддержание этих нейромедиаторов на контрольном уровне можно также рассматривать как специфические особенности нейрохимического статуса варолиевого моста в условиях ПТСР. Полученные результаты свидетельствуют о том, что стабилизация уровня дофамина здесь связана с ингибированием его метаболизма. Принято рассматривать метаболический индекс дофамина как показатель, характеризующий уровень его обратного захвата. Вероятно, в условиях ПТСР в варолиевом мосту снижен уровень обратного захвата дофамина пресинаптическими нейронами, где, собственно говоря, и локализованы ключевые ферменты метаболизма дофамина.
Полученные результаты демонстрируют перспективность дальнейших исследований варолиевого моста в условиях ПТСР. В последующих экспериментах предстоит выяснить в какой степени результаты экспериментальных исследований комплементарны клиническим данным о редукции варолиевого моста и как обнаруженные изменения уровня нейротрансмиттеров соотносятся с апоптозом нейронов в варолиевом мосте.
ЗАКЛЮЧЕНИЕ
Основной новизной нашей работы является обнаружение сниженного содержания норадреналина в варолиевом мосту при ПТСР. В этом контексте варолиев мост обладает уникальными нейрохимическими изменениями, а точнее, диаметрально противоположными по отношению к таким хорошо изученным структурам мозга, как амигдала, гиппокамп и префронтальная кора. Полученные корреляции между содержанием норадреналина в варолиевом мосту и уровнем тревожности указывают на перспективность дальнейших исследований, направленных на изучении роли этой стволовой структуры мозга в механизмах развития ПТСР.
Список литературы
Kessler R.C. // J. Clin. Psychiatry. 2000. V. 61. Suppl. 5. P. 4–12.
Pitman R.K., Rasmusson A.M., Koenen K.C., Shin L.M., Orr S.P., Gilbertson M.W., Milad M.R., Liberzon I. // Nat. Rev. Neurosci. 2012. V. 13. P. 769–787.
Carrion V.G., Weems C.F., Watson C., Eliez S., Menon V., Reiss A.L. // Psychiatry Res. Neuroimaging. 2009. V. 172. P. 226–234.
Sherin J.E., Nemeroff C.B. // Dialogues Clin. Neurosci. 2011. V. 13. P. 263–278.
Manukhina E.B., Tseilikman V.E., Tseilikman O.B., Komelkova M.V., Kondashevskaya M.V., Goryacheva A.V., Lapshin M.S., Platkovskii P.O., Alliluev A.V., Downey H.F. // J. Appl. Physiol. 2018. V. 125. P. 931–937.
Paxinos G., Watson C. // The Rat Brain in Stereotaxic Coordinates, 7th Edn. San Diego, CA: Academic Press, 2013, 472 p.
Wilson C.B., Ebenezer P.J., McLaughlin L.D., Francis J. // PLoS One. 2014. V. 9. № 2. e89104. P. 1–7.
Ronzoni G., Del Arco A., Mora F., Segovia G. // Psychoneuroendocrinology. 2016. V. 70. P. 1–9.
Кондашевская М.В, Цейликман В.Э., Манухина Е.Б., Downey H.F., Комелькова М.В., Лапшин М.С., Самойлов Е.А., Алилуев А.В, Курганов А.С., Мальцева Н.В., Цейликман О.Б. // Рос. физиол. журн. им. И.М. Сеченова. 2017. Т. 103. № 7. С. 808–818.
Цейликман В.Э., Лапшин М.С., Комелькова М.В., Цейликман О.Б., Деев Р.В., Попков П.Н., Платковский П.О. // Рос. физиол. журн. им. И.М. Сеченова. 2018. Т. 104. № 2. С. 156–163.
Дополнительные материалы отсутствуют.


