Нейрохимия, 2020, T. 37, № 3, стр. 257-262
Индукция белка-транспортера гликопротеина-P в гематоэнцефалическом барьере как способ профилактики паркинсонического синдрома
М. М. Градинарь 1, И. В. Черных 1, А. В. Щулькин 1, А. С. Есенина 1, Е. Н. Якушева 1
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Рязанский государственный медицинский университет им. акад. И.П. Павлова”
Министерства здравоохранения Российской Федерации
Рязань, Россия
Поступила в редакцию 12.12.2019
После доработки 10.02.2020
Принята к публикации 16.02.2020
Аннотация
В работе оценена перспектива индукции белка-транспортера гликопротеина-Р (Pgp) в гематоэнцефалическом барьере для профилактики развития паркинсонического синдрома, вызванного введением нейротоксина − ротенона. Исследование выполнено на 48 крысах-самцах. 1-й серии подкожно вводили масло подсолнечное (1 мл/кг) курсом 28 дней; 2-й серии внутрижелудочно вводили рифампицин (20 мг/кг) дважды в день в течение 14 суток для индукции функционирования Pgp; 3-й серии подкожно вводили ротенон (2.5 мг/кг) 1 раз в день в течение 28 дней для моделирования паркинсонического синдрома; 4-й серии вводили рифампицин (20 мг/кг) в течение 7 дней, а затем ротенон (2.5 мг/кг) совместно с рифампицином курсом 28 дней. У животных оценивали развитие признаков паркинсонизма, методом иммуноферментного анализа определяли содержание дофамина в среднем мозге и стриатуме и количество Pgp в среднем мозге. Установлено, что введение ротенона приводило к развитию признаков паркинсонизма и снижению концентрации дофамина в стриатуме и среднем мозге, при этом количество Pgp в среднем мозге достоверно не изменялось по сравнению с контрольными животными. При введении рифампицина отмечалось увеличение количества Pgp в среднем мозге, при этом признаки паркинсонизма отсутствовали, а концентрация дофамина в стриатуме и среднем мозге не изменялась по сравнению с серией контроля. Совместное введение рифампицина и ротенона приводило к уменьшению выраженности признаков паркинсонизма, повышению уровня дофамина в стриатуме и среднем мозге и увеличению количества Pgp в среднем мозге по сравнению с крысами, получавшими только ротенон. Результаты эксперимента свидетельствуют о способности рифампицина замедлять прогрессирование паркинсонизма, вызванного введением ротенона, что, вероятно, обусловлено снижением проникновения нейротоксина в головной мозг. Таким образом, индукция функционирования белка-транспортера Pgp может рассматриваться как способ профилактики развития паркинсонического синдрома нейротоксического генеза, однако требуются дальнейшие исследования с применением других нейротоксинов и индукторов Pgp.
ВВЕДЕНИЕ
Болезнь Паркинсона – хроническое прогрессирующее нейродегенеративное заболевание центральной нервной системы, одной из причин которого является дисфункция гематоэнцефалического барьера (ГЭБ) с нарушением структуры плотных контактов и дизрегуляцией белков-транспортеров, приводящая к накоплению нейротоксинов в головном мозге [1].
Гликопротеин-P (Pgp, ABCB1-белок) − один из переносчиков, локализованный в эндотелиоцитах ГЭБ, представляющий собой эффлюксный АТФ-зависимый трансмембранный белок, препятствующий проникновению из крови в головной мозг большого числа эндогенных и экзогенных веществ различной химической структуры, в том числе нейротоксинов [2, 3].
Ряд исследований продемонстрировал угнетение функционирования Pgp в ГЭБ и снижение его протекторной функции в качестве одного из патогенетических звеньев болезни Паркинсона [4–6]. Можно предположить, что индукция активности Pgp в ГЭБ позволит снизить проницаемость нейротоксинов-субстратов данного белка-транспортера в головной мозг и, соответственно, замедлить или предотвратить повреждение нейронов черной субстанции.
Целью исследования была оценка перспективы индукции белка-транспортера Pgp в ГЭБ среднего мозга крыс для профилактики развития паркинсонического синдрома, вызванного введением нейротоксина–ротенона.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено на 48 крысах-самцах Вистар массой 280–320 г в соответствии с правилами лабораторной практики (приказ МЗ РФ № 199н от 1 апреля 2016 г.).
Протокол исследования был рассмотрен и утвержден на заседании Комиссии по контролю за содержанием и использованием лабораторных животных № 11 от 29.01.2018 г.
Все животные были разделены на 2 группы. Первая группа включала животных, у которых в среднем мозге и стриатуме определяли концентрацию дофамина, вторая группа представлена крысами, у которых оценивали количество Pgp в среднем мозге.
Каждая группа была разделена следующим образом:
1) Контрольные животные (n = 6), которым подкожно вводили масло подсолнечное в дозе 1 мл/кг курсом 28 дней, которое фильтровали и стерилизовали через фильтрующую насадку из ацетата целлюлозы с префильтром с диаметром пор 0.2 мкм (“Corning”, США) и подогревали до температуры 35°С. Стерильное подсолнечное масло использовали также для приготовления масляного раствора ротенона.
2) Животные (n = 6), которым внутрижелудочно вводили суспензию рифампицина (“Белмедпрепараты”, Республика Беларусь) в дозе 20 мг/кг в крахмальном клейстере дважды в день в течение 14 сут [7] для индукции функционирования Pgp в ГЭБ.
3) Животные (контроль патологии, n = 9), которым подкожно вводили масляный раствор (содержащий 2% диметилсульфоксида) ротенона (“Sigma”, США) в дозе 2.5 мг/кг 1 раз в день в течение 28 дней для моделирования паркинсонического синдрома [8, 9].
4) Животные (n = 8), которым внутрижелудочно вводили суспензию рифампицина в дозе 20 мг/кг в крахмальном клейстере дважды в день в течение 7 дней, а затем в течение 28 дней – ротенон подкожно в дозе 2.5 мг/кг один раз в сутки совместно с внутрижелудочным введением рифампицина в дозе 20 мг/кг два раза в день.
Летальность при введении ротенона (в 3-й и 4-й сериях эксперимента) составила 29.4%, поэтому в итоговое исследование в каждую группу было включено по 6 животных из числа выживших.
У животных всех серий оценивали основные (наличие гипо-, бради- и олигокинезии, постуральная нестабильность, неустойчивая походка) и дополнительные (ригидность мышц, тремор покоя, нарушение равновесия) признаки паркинсонизма по трехбальной шкале, где 1 балл соответствовал низкой степени выраженности признака, 2 балла – средней степени, 3 балла – высокой степени, после чего рассчитывали суммарную выраженность признаков паркинсонизма [10].
Крыс выводили из эксперимента декапитацией под внутривенным золетиловым наркозом в дозе 30 мг/кг массы (“Золетил 100”, “Virbac C.A.”, Франция).
У животных первой группы методом иммуноферментного анализа (ELISA kit “Cloud-Clone Corp”, Китай) определяли содержание дофамина в среднем мозге и стриатуме. Для этого образцы тканей гомогенизировали на гомогенизаторе DIAX 900 (“Heidolph”, Германия) при 26 000 об./мин в фосфатном буфере (pH 7.2) на холоде в соотношении 1 : 10 в течение 1 мин, затем центрифугировали при 1750 g 10 мин. Анализировали надосадочный слой. Количество дофамина рассчитывали в пересчете на массу ткани, взятую для исследования.
У крыс второй группы методом иммуноферментного анализа (ELISA kit “BlueGene”, Китай) определяли количество Pgp в среднем мозге. Образцы тканей гомогенизировали на гомогенизаторе DIAX 900 при 26 000 об./мин в фосфатном буфере (pH 7.2) на холоде в соотношении 1 : 1 в течение 1 мин, затем подвергали трехкратному замораживанию–размораживанию при –20°С для разрушения цитоплазматических мембран, а затем центрифугировали при 1500 g 15 мин. Анализировали надосадочный слой. Количество транспортера рассчитывали в пересчете на общую массу белка, которую определяли по методу Брэдфорда (“Themofisher” kit, Германия).
Статистическую обработку результатов проводили с использованием программы “Statsoft Statistica 7.0 (США)". Характер распределения данных определяли по критерию Шапиро–Уилка. При нормальном распределении статистическую значимость различий оценивали с помощью теста ANOVA, попарные сравнения выполняли с помощью критерия Тьюки. При распределении данных, отличном от нормального, различия между сериями оценивали с помощью критерия Крускала–Уоллиса. При уровне значимости менее 0.05 проводили парное сравнение параметров с помощью критерия Манна–Уитни с поправкой Бонферонни. Данные представлены в виде среднего арифметического ± стандартное отклонение при нормальном распределении данных или медианы, нижнего и верхнего квартилей при распределении данных, отличном от нормального.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В настоящем исследовании паркинсонический синдром моделировали подкожным ведением ротенона. Ротенон является липофильным пестицидом из семейства изофлавоноидов, систематическое введение которого вызывает подавление активности митохондриального комплекса I. Данные биохимические изменения приводят к избирательной дегенерации дофаминергических нейронов нигростриатума с последующим ограничением дофаминергической нейротрансмиссии в головном мозге и нарушениям двигательных функций, характерным для болезни Паркинсона [11].
Введение ротенона в дозе 2.5 мг/кг 1 раз в день в течение 28 сут приводило к развитию типичных признаков паркинсонизма (табл. 1): снижалась двигательная активность, появлялись постуральная нестабильность, неустойчивость походки, ригидность мышц и тремор покоя, нарушалось равновесие. Суммарный балл выраженности признаков паркинсонизма составил 8 (6; 10) и достоверно превышал показатели контрольных животных (p < 0.05) (табл. 1).
Таблица 1.
Признаки выраженности паркинсонизма
| Серия/ показатель |
Введение масла подсолнечного (серия 1) |
Введение рифампицина (серия 2) |
Введение
ротенона (серия 3) |
Введение рифампицина
и ротенона (серия 4) |
|---|---|---|---|---|
| Гипо-, бради- и олигокинезия, баллы | 0 (0; 0) | 0 (0; 0) | 1 (1; 2)* | 0 (0; 0)# |
| Постуральная нестабильность, баллы | 0 (0; 0) | 0 (0; 0) | 1 (1; 2)* | 1 (1; 1)* |
| Неустойчивость походки, баллы | 0 (0; 0) | 0 (0; 0) | 1 (0; 2) | 1 (1; 1)* |
| Ригидность мышц, баллы | 0 (0; 0) | 0 (0; 0) | 2 (1; 2)* | 1 (0; 1) |
| Тремор покоя, баллы | 0 (0; 0) | 0 (0; 0) | 1 (1; 2)* | 1 (0; 1) |
| Оценка равновесия, баллы | 0 (0; 0) | 0 (0; 0) | 2 (2; 3)* | 1 (1; 1)*, # |
| Суммарное значение, баллы | 0 (0; 0) | 0 (0; 0) | 8 (6; 10)* | 4,5 (3,5;5)*, # |
Концентрация дофамина в серии введения ротенона в стриатуме и среднем мозге снижалась на 92.8 и 67.2% (p < 0.05) соответственно по сравнению с показателями контроля (рис. 1). В то же время количество Pgp в среднем мозге достоверно не изменялось, что свидетельствует об отсутствии динамики экспрессии данного белка-транспортера при моделировании паркинсонизма введением ротенона (рис. 2).
Рис. 1.
Влияние ротенона и рифампицина на концентрацию дофамина в среднем мозге (среднее и стандартное отклонение). Примечание: к – контроль, рф – рифампицин, рт – ротенон; * достоверные различия с контрольной серией (p < < 0.05); # достоверные различия с показателями животных, получавших ротенон (p < 0.05).
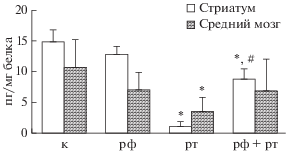
Рис. 2.
Влияние ротенона и рифампицина на концентрацию гликопротеина-Р в среднем мозге (медиана, верхний и нижний квартили). Примечание: к – контроль, рф – рифампицин, рт – ротенон; * достоверные различия с контрольной серией (p < 0.05); # достоверные различия с показателями животных, получавших ротенон (p < 0.05).
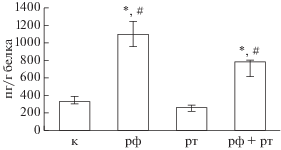
Введение классического индуктора Pgp рифампицина в дозе 20 мг/кг в течение 14 суток приводило к увеличению количества белка-транспортера в среднем мозге на 230.2% (p < 0.05) по сравнению с показателями контрольных животных, что свидетельствует о повышении экспрессии Pgp (рис. 2). Признаки паркинсонизма у животных отсутствовали, а концентрация дофамина в среднем мозге и стриатуме достоверно не изменялась по сравнению с контрольными крысами (табл. 1, рис. 1). Таким образом, в данной серии было показано индуцирующее влияние рифампицина на Pgp в ГЭБ.
Предварительное введение рифампицина в дозе 20 мг/кг в течение 7 дней перед введением ротенона, а затем совместно с нейротоксином в течение 28 дней также приводило к повышению количества Pgp в среднем мозге по сравнению с показателями контрольных животных на 135.8% (p < 0.05), а по сравнению со значениями крыс, получавших только ротенон, − на 202.8% (p < 0.05) (рис. 2).
У экспериментальных животных данной серии уменьшалась выраженность признаков паркинсонизма по сравнению с крысами, получавшими только ротенон (табл. 1), суммарный балл выраженности признаков паркинсонизма снизился на 43.7% (p < 0.05) (табл. 1).
Уровень дофамина в стриатуме у животных четвертой серии составлял 8.77 ± 1.64 пг/мг ткани, что в 8.27 раза превосходило аналогичный показатель третьей серии (контроль патологии) (p < 0.05), однако оставался ниже значений нормы в 1.69 раза (p < 0.05) (рис. 1). В среднем мозге введение индуктора Pgp рифампицина совместно с ротеноном приводило к нормализации концентрации дофамина, значения данного показателя достоверно не отличались от показателей контроля (серия 1).
Известно, что ротенон является субстратом Pgp, как и ряд других нейротоксинов [12], т.е. степень его проникновения в головной мозг, а, следовательно, и нейротоксичность зависят от интенсивности эффлюкса данным белком-транспортером. Снижение функционирования Pgp в ГЭБ может привести к аккумуляции в головном мозге нейротоксинов − субстратов белка-транспортера и, как следствие, способствовать развитию нейрогенеративных процессов [13].
Для оценки перспективности индукции Pgp в ГЭБ с целью профилактики развития паркинсонизма животным совместно с ротеноном вводили классический индуктор Pgp − рифампицин. Рифампицин является непрямым индуктором функционирования Pgp, активирующим экспрессию транскрипционного фактора − прегнан-Х-рецептора (PXR) [14, 15]. Поскольку воздействие данного индуктора на синтез транспортера развивается постепенно, введение рифампицина крысам начинали за 7 дней до использования ротенона и продолжали параллельно с ним.
Снижение выраженности признаков паркинсонизма и одновременное повышение уровня дофамина в стриатуме и среднем мозге крыс при совместном введении рифампицина и ротенона по сравнению с животными, получавшими только ротенон, свидетельствует о способности рифампицина замедлять прогрессирование паркинсонизма, обусловленного воздействием нейротоксина. Поскольку в серии совместного применения рифампицина и ротенона количество Pgp в среднем мозге увеличивается, по сравнению с серией изолированного введения ротенона, противопаркинсонический эффект рифампицина, вероятнее всего, обусловлен снижением проникновения субстрата Pgp ротенона в головной мозг.
Способность повышать активность белка-транспортера выявлена у ряда лекарственных средств (дексаметазона, карбамазепина, морфина, рифампицина, фенитоина, ретиноевой кислоты, фенотиазина), однако данные препараты обладают широким спектром фармакологических эффектов, а также нежелательных лекарственных реакций, что препятствует их применению в качестве индукторов Pgp. Таким образом, актуальным является поиск селективного индуктора белка-транспортера в ГЭБ и его исследование в качестве средства для профилактики паркинсонизма нейротоксического генеза, например, у лиц, по роду своей профессиональной деятельности, контактирующих с токсическими веществами.
Список литературы
Desai B.S., Monahan A.J., Carvey P.M., Hendey B. // Cell. Transplant. 2007. V. 16. P. 285–299.
Abdullahi W., Davis T.P., Ronaldson P.T. // AAPS J. 2017. V. 19. № 4. P. 931–939.
Черных И.В., Щулькин А.В., Гацанога М.В., Попова Н.М., Есенина А.С., Градинарь М.М., Якушева Е.Н. // Наука молодых (ERUDITIO JUVENIUM). 2019. Т. 7. № 3. С. 46–52.
Черных И.В., Щулькин А.В., Мыльников П.Ю., Гацанога М.В., Есенина А.С., Градинарь М.М., Якушева Е.Н. // Росс. мед.-биол. вестн. 2019. Т. 27. № 2. С. 150–160.
Guhaniyogi J., Brewer G. // Gene. 2001. V. 265. № 1–2. P. 11–23.
Bauer M., Wulkersdorfer B., Karch R., Philippe C., Jager W., Stanek J. // Br. J. Clin. Pharmacol. 2017. V. 83. № 9. P. 1991–1999.
Rana S.V., Pal R., Vaiphie K., Singh K. // Mol. Cell. Biochem. 2006. V. 289. № 1–2. P. 39−47.
Воронков Д.Н., Дикалова Ю.В., Худоерков Р.М. // Анналы неврологии. 2013. Т. 7. № 2. С. 34–38.
Миронов А.Н. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М.: Гриф и К, 2012. 944 с.
Воронина Т.А., Вальдман Е.А., Неробкова Л.Н. // Ведомости Научного центра экспертизы и государственного контроля лекарственных средств. 1999. № 1. Режим доступа: http://www.drugreg.ru/Doc/ Vedomosti/0999-1/Vedomosti0999-1_4-3.htm. (дата обращения: 30.08.2019).
Begley D.J. // Curr. Pharm. Des. 2004. V. 10. № 12. P. 1295–1312.
Lacher S.E., Skagen K., Veit J., Dalton R., Woodah E.L. // J. Pharmacol. Exp. Ther. 2015. V. 355. № 1. P. 99–107.
Erdo F., Krajcsi P. // Front Aging Neurosci. 2019. V. 11. P. 196. Published online July 30, 2019.
Черных И.В., Щулькин А.В., Мыльников П.Ю., Гацанога М.В., Попова Н.М., Якушева Е.Н. // Нейрохимия. 2019. Т. 36. № 1. С. 1–5.
Rasmussen M.K., Daujat-Chavanieu M., Gerbal-Chaloin S. // Toxicol. Lett. 2017. V. 277. P. 1–8.
Дополнительные материалы отсутствуют.


