Нейрохимия, 2020, T. 37, № 4, стр. 350-357
Активация серотониновой системы медиальной префронтальной коры звуковыми сигналами опасности
Н. Б. Саульская 1, О. Э. Марчук 1, М. А. Пузанова 1, Н. А. Трофимова 1
1 Институт физиологии им. И.П. Павлова Российской академии наук
Санкт-Петербург, Россия
Поступила в редакцию 14.04.2020
После доработки 19.04.2020
Принята к публикации 21.04.2020
Аннотация
На крысах линии Спрег-Доули методом внутримозгового микродиализа показано, что предъявление животным условного звукового сигнала (CS+), ранее сочетавшегося с неизбегаемым электрокожным раздражением, (тест на проявления условнорефлекторного страха) сопровождается подъемом уровня внеклеточного серотонина в медиальной префронтальной коре и вызывает замирание животных (показатель страха). Предъявление крысам дифференцировочного звукового сигнала (CS–), не ассоциируемого с болевым раздражением (тест на генерализацию страха), тоже приводило к подъему уровня внеклеточного серотонина в медиальной префронтальной коре, но характеризовалось меньшим замиранием животных. Такие изменения отсутствовали у животных контрольной группы (те же процедуры, но без электрокожного раздражения). Введение в медиальную префронтальную кору селективного ингибитора обратного захвата серотонина флуоксетина (1 мкМ) увеличивало подъемы уровня внеклеточного серотонина в этой области, вызываемые предъявлением CS+ и CS–. Такое фармакологическое воздействие не влияло на замирание на CS+ и на CS– в ходе этих тестов, но удлиняло периоды неподвижности в межсигнальных интервалах при предъявлениях CS+, но не CS–. Данные свидетельствуют, что активация серотониновой системы медиальной префронтальной коры потенциально опасными условными сигналами, но не безопасными дифференцировочными сигналами, участвует в регуляции защитного поведение в периоды ожидания звуковых сигналов.
ВВЕДЕНИЕ
Изучение механизмов страха является актуальной задачей нейрофизиологии, поскольку патология системы страха лежит в основе ряда стресс-зависимых психиатрических расстройств [1]. Основные модели страха базируются на классическом (Павловском) обусловливании: животному предъявляют нейтральные условные сигналы в сочетании с неизбегаемым болевым раздражением (выработка условной реакции страха – УРС). В результате такие сигналы, предъявленные изолированно, начинают вызывать врожденные защитные реакции – замирание, вегетативные изменения и др. (проявления страха) [2]. С использованием этих моделей показано, что одной из ключевых структур системы страха является медиальная префронтальная кора (мПК), функции которой связывают с поддержанием условнорефлекторного страха, его угашением и контролем генерализации страха [см. 3, 4, 5].
Значимую роль в работе мПК играет серотонин-ергический вход из дорсального и медианного ядер шва. Серотонин регулирует импульсную активность, возбудимость, а также пластичности нейронов мПК [6, 7] и оказывает влияние на функции этой области, в том числе, связанные с механизмами страха [8]. А именно, установлена активация серотонинергической системы мПК обстановочными сигналами опасности [9], показано вовлечение 5-HT1A и 5-HT2A рецепторов серотонина мПК в контроль проявлений страха обстановки [10, 11], продемонстрировано, что степень вовлеченности и рецепторные механизмы участия серотониновой системы мПК в регуляции проявлений страха, зависят от индивидуального уровня тревожности животных [11, 12].
Все эти данные получены на простых моделях страха, в которых животным предъявляют только сигналы, ассоциированные с болевым раздражением. Вместе с тем, появляется все больше сведений о важной роли мПК в дискриминации опасных и безопасных сигналов [13–16]. Дефицит этого процесса, предположительно связанный с дефицитом Павловского дифференцировочного торможения, приводит к генерализации страха, выражающейся в проявлениях страха на безопасные стимулы. Роль серотонина мПК в механизмах генерализации/специализации страха изучена мало, хотя серотониновая система целого мозга вовлечена в этот процесс [17, 18]. Ранее мы продемонстрировали вклад активации серотониновой системы мПК, наблюдаемой во время выработки УРС, в формирование генерализованного страха [19, 20]. Вместе с тем не исследовано, меняется ли активность серотониновой системы мПК при проявлениях генерализованного и условнорефлекторного страха в ходе реализации УРС с дискриминационным компонентом, и если да, то влияют ли такие изменения на проявления генерализованного и условнорефлекторного страха в этих тестах.
Цель работы заключалась в изучении участия серотонинергической системы мПК в регуляции проявлений условнорефлекторного страха, вызываемого звуковыми сигналами, ранее сочетавшимися с болевым раздражением, и в регуляции проявлений генерализованного страха, вызываемого безопасными дифференцировочными сигналами в ходе реализации УРС с дискриминационным компонентом. Для этого методом прижизненного внутримозгового микродиализа, во-первых, исследованы изменения уровня внеклеточного серотонина в мПК при предъявлении животным условных и дифференцировочных звуковых сигналов, ассоциируемых и не ассоциируемых с болевым раздражением, соответственно. Во-вторых, изучено влияние фармакологической активации серотонинреактивной системы мПК локальными введениями флуоксетина, селективного ингибитора обратного захвата серотонина, на изменения уровня внеклеточного серотонина в мПК и на замирание животных в ходе этих тестов. Таких сведений в литературе нет.
МЕТОДЫ ИССЛЕДОВАНИЯ
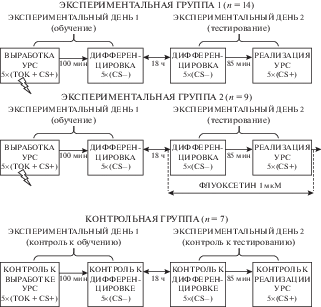
Работа выполнена на 30 крысах-самцах линии Спрег-Доули массой 320–380 г из биоколлекции “Коллекция лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН. Эксперименты проводили в соответствии с международными нормами гуманного обращения с экспериментальными животными (директива Евросоюза № 86/609/EEC). Крысам под наркозом (рометар, 1.4 мг/100 г массы и золетил, 5 мг/100 г массы, внутримышечно) унилатерально имплантировали концентрические диализные канюли в мПК, как ранее описано [21]. Эксперименты проводили на второй и третий день после имплантации канюль (рис. 1). В начале каждого экспериментального дня животное помещали в дневную домашнюю клетку и начинали диализную перфузию мПК искусственной спинномозговой жидкостью (ИСМЖ) [21] со скоростью 1 мкл/мин. Крысы были разделены на три группы: две экспериментальных и одну контрольную. В первый день экспериментов (этап обучения) у животных экспериментальной группы 1 (n = 14) и экспериментальной группы 2 (n = 9) вырабатывали УРС с дискриминационным компонентом, как описано ранее [20]. Коротко, каждую крысу помещали в условнорефлекторную камеру с решетчатым покрытием пола на 5 мин, где раз в минуту предъявляли звуковой условный сигнал (CS+) – непрерывный тон (1000 Гц, 10 с), который сочетали на последней секунде звучания с электрокожным раздражением лап (1.5 мА, 1 с). После этого животное возвращали в дневную домашнюю клетку. Через 100 мин проводили дифференцировочную сессию, целью которой было познакомить животных с безопасными сигналами: крысу помещали на 5 мин в дифференцировочную камеру, где раз в минуту предъявляли дифференцировочный сигнал (CS–) – прерывистый тон (1000 Гц, 10 с), но без электрокожного раздражения. Через 5 мин крысу возвращали в дневную домашнюю клетку. На этом этап обучения заканчивался. С животными контрольной группы проделывали те же процедуры, но без электрокожного раздражения.
На следующий день (экспериментальный день 2 – этап тестирования) животных помещали в дневную домашнюю клетку и начинали диализную перфузию мПК. После стабилизационного периода (1.5 ч) собирали 5 порций диализата (по 15 мин каждая). Затем каждое животное экспериментальной группы 1 помещали в дифференцировочную камеру на 5 мин и проводили дифференцировочную сессию (дифференцировка – тест на генерализацию УРС) также, как в первый день экспериментов. Через 85 мин после ее окончания животное тестировали на выработанность УРС, для чего крысу помещали на 5 мин в условнорефлекторную камеру, где раз в минуту предъявляли условный сигнал (CS+, 10 с), но без электрокожного раздражения (реализация УРС). Затем крысу возвращали в дневную домашнюю клетку на 70 мин, после чего эксперимент завершали.
Животным экспериментальной группы 2 во второй день эксперимента после сбора фоновых порций диализата в ИСМЖ для перфузии мПК добавляли селективный ингибитор обратного захвата серотонина флуоксетин (1 мкМ, “Sigma”, США) и собирали 4 порции диализата (по 15 мин). Флуоксетин был выбран потому, что его локальное введение позволяет имитировать естественную активацию серотонинового входа мПК, а использованный в работе метод микродиализа дает возможность количественно оценить эффективность такого введения. После сбора 4 порций диализата на фоне введения флуоксетина в мПК проводили дифференцировку и реализацию УРС, как описано выше для экспериментальной группы 1. Животные контрольной группы во второй день экспериментов были подвергнуты таким же процедурам, как и крысы экспериментальной группы 1.
Диализат (пятнадцатиминутные порции) собирали и анализировали на содержание серотонина в течение всего экспериментального дня 2. Во время тестов проводили видеорегистрацию поведения на персональном компьютере с помощью веб-камеры (“Logiteсh”, Китай). Регистрировали время замирания (с) на условный (CS+) или дифференцировочный (CS–) сигналы – параметр, отражающий степень выработанности УРС на звуковой сигнал и степень ее генерализации, соответственно. Кроме того, регистрировали время неподвижности (с) животных в межсигнальных интервалах – показатель, характеризующий ожидание звукового сигнала.
Уровень серотонина в диализате мПК определяли методом высокоэффективной жидкостной хроматографии с электрохимической детекцией. Использовали хроматографическую систему (“Shimadzu”, Германия) и параметры хроматографического анализа, описанные нами ранее [20]. Регистрацию и обработку хроматограмм осуществляли в режиме реального времени (МультиХром 1.72, “Амперсенд”, Россия). Содержание серотонина в каждой диализной пробе выражали в нМ/л, а затем – в процентах по отношению к собственному среднему фоновому уровню перед тестом. По завершении экспериментов животных подвергали эвтаназии (рометар, 1.4 мг/100 г массы, золетил, 5 мг/100 г массы, внутримышечно, уретан, 0.2 г/100 г массы, внутрибрюшинно). Мозг извлекали и помещали в водный раствор формалина (10%, V/V) для последующего морфологического контроля попаданий. В обработку были включены крысы с локализацией диализного участка канюль в мПК (преимущественно прелимбическая кора).
Статистическую обработку проводили с использованием статистического пакета SigmaStat (3.0). Данные выражали как среднее ± ошибка среднего (n), где n – количество животных. Сравнение изменений уровня внеклеточного серотонина относительно фона осуществляли методом однофакторного дисперсионного анализа (фактор – время; F-критерий). За ним следовало сравнение изменений в отдельных временны́х точках относительно фона по t-критерию Бонферрони (post-hoc тест). Межгрупповое сравнение и сравнение между разными тестами проводили методом двухфакторного дисперсионного анализа (первый фактор – группа или тест, второй фактор – время, F-критерий) с последующим сравнением групп в конкретных временны́х точках по t-критерию Бонферрони. Сравнение параметров поведения осуществляли с помощью t-критерия Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Фоновый уровень серотонина в диализате мПК составлял в этих экспериментах 0.17 ± 0.01 (30) нМ, что близко к нашим прежним результатам [20] и данным литературы [22].
Предъявление животным экспериментальной группы 1 на этапе тестирования (экспериментальный день 2) дифференцировочного сигнала CS–, не ассоциируемого с болевым раздражением, (дифференцировка) сопровождалось подъемом уровня внеклеточного серотонина в мПК относительно фона перед тестом (рис. 2а; F(9,117) = 9.8, p < < 0.001). Такой подъем отсутствовал у животных контрольной группы в ходе контрольного теста к дифференцировке (рис. 2а; F(9,54) = 0.43, p = 0.91). Межгрупповое сравнение показало, что изменения уровня серотонина в мПК в ходе дифференцировки у животных экспериментальной группы 1 были достоверно выше, чем этот показатель у крыс контрольной группы (F(9,190) = 4.7, p < 0.001).
Рис. 2.
Изменения уровня внеклеточного серотонина в мПК: а – в ходе дифференцировочной сессии (Дифференцировка) и во время контрольного теста к дифференцировке (контроль); б – в ходе реализации УРС (реализация УРС) и контрольного теста к реализации УРС (контроль). По оси абсцисс – время, мин; по оси ординат – уровень серотонина, % к фону; разброс на графиках – ошибка среднего; черные стрелки – начало тестов; ** p < 0.001 – при сравнении с фоном; + p < 0.001 – при межгрупповом сравнении.
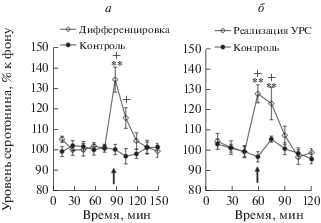
Предъявление крысам экспериментальной группы 1 условного сигнала CS+, ранее сочетавшегося с болевым раздражением (реализация УРС), тоже вызывало подъем уровня внеклеточного серотонина в мПК относительно фона перед тестом, наблюдаемый во время и после теста (рис. 2б; F(7,91) = 8.7, p < 0.001). Такой подъем не наблюдался у животных контрольной группы (рис. 2б; F(7,42) = = 1.8, p = 0.11). По данным двухфакторного дисперсионного анализа, изменения уровня внеклеточного серотонина в мПК у крыс экспериментальной группы 1 в ходе реализации УРС были достоверно выше, чем этот показатель у крыс контрольной группы в ходе контрольного теста к реализации УРС (F(7,152) = 3.1, p = 0.004), но они не отличались значимо от изменений уровня внеклеточного серотонина в мПК у этих же животных во время дифференцировки (F(7,208) = 0.32, p = 0.77).
Введение на второй день эксперимента в мПК крысам экспериментальной группы 2 селективного ингибитора транспортеров серотонина флуоксетина (1 мкМ) увеличивало уровень внеклеточного серотонина в этой области (максимум 151 ± ± 11% (9)) относительно фона перед введением (рис. 3; F(8,64) = 10.9, p < 0.001), что близко к нашим прежним результатам [20] и свидетельствует о фармакологической стимуляции серотониновой системы мПК данной дозой флуксетина. Такое введение увеличивало подъем уровня внеклеточного серотонина в мПК, вызываемый дифференцировочной сессией (рис. 3). А именно, дифференцировочная сессия, проводимая на фоне введения флуоксетина в мПК, сопровождалась ростом уровня внеклеточного серотонина в мПК (максимум 182 ± 12% (9)) относительно собственного фона перед введением (F(10,80) = 22.5, p < 0.001). Такое увеличение было достоверным относительно уровня серотонина непосредственно перед данным поведенческим тестом, увеличенного введением флуоксетина, (F(7,56) = 4.0, p = 0.001), а также, по данным двухфакторного дисперсионного анализа, относительно изменений уровня внеклеточного серотонина в мПК в ходе дифференцировки у животных экспериментальной группы 1, не подвергавшихся введению флуоксетина (рис. 3; максимум 134 ± 6% (14); F(10,231) = 10.2, p < 0.001).
Рис. 3.
Изменения уровня внеклеточного серотонина в мПК в ходе дифференцировочной сессии и реализации УРС у животных с введением в мПК 1 мкМ флуоксетина (флуоксетин) и у крыс без введения этого препарата (без введения). * p < 0.05; ** p < 0.001 – при сравнении с фоном; + p < 0.001 при межгрупповом сравнении; # p < 0.05; ## p < 0.01; ### p < 0.001 – при сравнении с уровнем серотонина перед данным тестом. Белая стрелка – начало введения флуоксетина. Горизонтальная линия – период введения флуоксетина. Остальные обозначения, как на рис. 2.
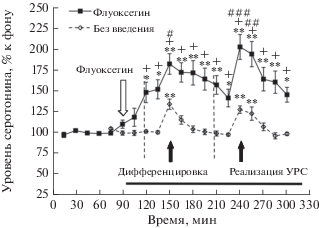
Межгрупповое сравнение показало, что введение 1 мкМ флуоксетина в мПК животным экспериментальной группы 2, кроме того, увеличивает подъем уровня внеклеточного серотонина в этой области, вызываемый реализацией УРС (рис. 3; F (6,147) = 2.5, p = 0.03), с 127 ± 4% (14) (максимальный подъем у животных экспериментальной группы 1 без введения препарата) до 202 ± 15% (9) (максимум у крыс экспериментальной группы 2, подвергавшихся введению флуоксетина в мПК). Такой подъем, наблюдаемый во время реализации УРС на фоне введения флуоксетина, был достоверен относительно уровня серотонина перед данным поведенческим тестом (F(6,48) = 6.5 p < < 0.001), а также относительно фонового уровня серотонина в мПК перед введением препарата (F(9,72) = 22.6, p < 0.001).
Тестирование животных на проявления страха (замирание) во время дифференцировочной сессии и реализации УРС показало, что крысы экспериментальных групп (с введением и без введения флуоксетина в мПК) не различались между собой по уровню замирания на дифференцировочный сигнал CS– (рис. 4а; t = 0.6, p = 0.6 p = 0.6), а также на потенциально опасный условный сигнал CS+ (рис. 4а; t = 0.5, p = 0.6). При этом замирание животных каждой экспериментальной группы на CS+ было достоверно выше, чем замирание животных этой же группы на CS– (t = 4.1, p < 0.001 для экспериментальной группы 1; t = 5.7, p < 0.001 для экспериментальной группы 2). То есть в ходе тестирования животные экспериментальных групп 1 и 2 отличали сигнал опасности (CS+) от безопасного дифференцировочного сигнала (CS–).
Рис. 4.
а – Время замирания (с) на дифференцировочный (CS–) и условный (CS+) сигналы и б – время неподвижности (с) в межсигнальных интервалах во время дифференцировочной сессии (CS– тест) и реализации УРС (CS+ тест) у животных с введением (флуоксетин) и без введения (без введения) 1 мкМ флуоксетина в ходе этих тестов, а также у крыс контрольной группы (контроль). * p < 0.05; ** p < 0.001 – при сравнении с данным параметром у животных контрольной группы; + p < 0.05 при сравнении с данным параметром у крыс, не подвергавшихся введению флуоксетина; # p < 0.001 – при сравнении с соответствующим параметром крыс этой же группы при реализации УРС.
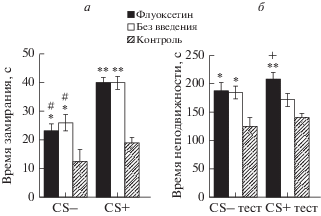
Кроме того, замирание животных обеих экспериментальных групп на CS+ и CS– было выше уровня неподвижности животных контрольной группы в ходе соответствующего контрольного теста (рис. 4а; для CS+: t = 4.4, p < 0.001 и t = 8.5, p < 0.001, для экспериментальных групп 1 и 2 соответственно; для CS–: t = 2.5, p = 0.02 и t = 2.2, p = 0.04, для экспериментальных групп 1 и 2 соответственно). Все это свидетельствует о статистически значимом уровне проявлений страха во время реализации УРС на звуковой условный сигнал у животных экспериментальных групп 1 и 2 и о значительной генерализации этой условнорефлекторной реакции.
Анализ межсигнального поведения животных показал, что крысы экспериментальных групп 1 и 2, соответственно, не подвергавшиеся и подвергавшиеся введению флуоксетина в мПК, не различались по уровню неподвижности в интервалах между CS- во время дифференцировочной сессии (рис. 4б; 183 ± 11 с (14) для группы 1 и 187 ± 15 с (9) для группы 2; t = 0.19, p = 0.86). Однако во время реализации УРС крысы экспериментальной группы 2 с введением флуоксетина в мПК характеризовались большей продолжительностью периодов неподвижности в интервалах между CS+ (207 ± 11с (9)) по сравнению с крысами экспериментальной группы 1 без введения флуоксетина в мПК (171 ± ± 11 с (14); t = 2.2, p = 0.04). Причем длительность периодов неподвижности животных обеих экспериментальных групп в интервалах между CS– была больше, чем этот показатель крыс контрольной группы в ходе контрольного теста к дифференцировке (рис. 4б; (t = 2.4, p = 0.03 и t = 2.2, p = 0.04, для экспериментальных групп 1 и 2 соответственно).
Животные экспериментальной группы 2 с введениями флуоксетина в мПК тоже характеризовались большим уровнем неподвижности в интервалах между CS+ по сравнению с этим показателем крыс контрольной группы (рис. 4б; t = 4.4, p < 0.001). В то же время, уровень неподвижности в интервалах между CS+ у животных экспериментальной группы 1 не отличался значимо от этого показателя крыс контрольной группы, хотя тенденция (t = 1.9, p = 0.07) имела место.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее установлено, что выработка и реализация УРС, моделирующие формирование и проявления страха, сопровождаются активацией серотониновой системы ряда структур системы страха [см. 8]. Однако функциональное значение таких изменений в отдельных структурах мозга изучено недостаточно. По нашим прежним данным, полученным в микродиализных экспериментах, в ходе выработки УРС на звуковой условный сигнал (CS+) происходит активация серотониновой системы мПК, проявляющаяся в увеличении уровня внеклеточного серотонина в этой области [19, 20]. Причем локальное фармакологическое усиление такой активации введением в мПК во время выработки УРС флуоксетина (1 мкМ), ингибитора обратного захвата серотонина, приводит через сутки к усилению замирания животных на безопасный дифференцировочный звуковой сигнал (CS–) (показатель генерализации УРС) при неизменности замирания тех же животных на CS+ [19]. Эти данные впервые показали, что функциональная роль активации серотонинергической системы мПК, наблюдаемой при выработке УРС, связана с контролем генерализации формирующегося страха, но не с формированием условнорефлекторного страха на звуковой сигнал (CS+).
В настоящей работе продемонстрировано, что не только выработка УРС на звуковой сигнал, но и реализация этой условнорефлекторной реакции (предъявлении CS+, ранее сочетавшегося с болевым раздражением), сопровождается подъемом уровня внеклеточного серотонина в мПК. Такой подъем отсутствует у животных контрольной группы (те же процедуры, но без болевого раздражения в первый день экспериментов), то есть он является результатом выработки УРС и не связан с активационным стрессом, вызываемым пересадкой животных и другими процедурами. Подобные изменения активности серотониновой системы в ответ на предъявление звуковых сигналов опасности в ходе реализации УРС были выявлены в амигдале [23], но в мПК, насколько нам известно, ранее показаны не были.
Результаты настоящего исследования свидетельствуют, что сопровождающая реализацию УРС активация серотониновой системы мПК, видимо, не участвует в регуляции проявлений условнорефлекторного страха (замирание на CS+) в ходе этого теста, поскольку введение флуоксетина (1 мкМ) в мПК животных экспериментальной группы 2, почти вдвое увеличивающее, фоновый и вызываемый реализацией УРС подъем уровня внеклеточного серотонина в мПК, не оказывает влияния на длительность замирание на CS+ в ходе этого теста (рис. 4а). Вместе с тем, такое введение удлиняет периоды неподвижности в межсигнальных интервалах (рис. 4б), что видимо говорит об участии наблюдаемой нами серотониновой активации мПК в подготовительной фазе реализации УРС на CS+, связанной c мобилизацией внимания на ожидании звукового сигнала опасности. Эти ранее неизвестные данные расширяют сведения об участии мПК в регуляции УРС в ходе растянутых во времени событий (следовые и отсроченные УРС) [24] и свидетельствуют о возможном вкладе серотониновых сигналов мПК в такую регуляцию.
Известно, что селективные ингибиторы обратного захвата серотонина (SSRI), к которым относится флуоксетин, широко используемые для лечения посттравматических стрессовых расстройств, тревожности и депрессии, в начале терапии могут действовать противоположным образом, ухудшая симптомы [25]. В соответствии с этим, на животных показано, что однократное системное введение флуоксетина усиливает проявления страха при предъявлении звуковых сигналов, ранее сочетавшихся с болевым раздражением [26]. Наши результаты, приведенные выше, позволяют заключить, что такой эффект флуоксетина, по всей видимости, не реализуется за счет воздействия на серотониновую систему мПК.
Ранее, с использованием иммуноцитохимической визуализации маркеров нейронной активации (экспрессия генов Arc/Arg 3.1 и Homer 1a) в мПК выявлены нейроны, активируемые при предъявлении как потенциально опасных (CS+), так и безопасных (CS–) звуковых сигналов (CS+/CS– нейроны), и это, как предполагают, является нейронным коррелятом генерализации УРС [14]. Полученные в работе данные свидетельствуют, что еще одним показателем генерализации УРС в мПК может быть активация серотонинового входа этой области безопасными дифференцировочными сигналами. Об этом свидетельствует продемонстрированный нами подъем уровня внеклеточного серотонина в мПК при проявлениях генерализованного страха (замирание на CS–) во время дифференцировочной сессии, который не отличается значимо от роста этого показателя при проявлениях условнорефлекторного страха (замирание на CS+) во время реализации УРС. Такой подъем не наблюдается у животных контрольной группы и, на наш взгляд, отражает генерализацию УРС, проявляющуюся не только на поведенческом (замирание) и нейронном (активация CS+/CS– нейронов), но и на нейрохимическом уровне.
Важно отметить, что животные экспериментальной группы 1 в ходе тестирования на проявления генерализованного и условнорефлекторного страха различают сигналы опасности (CS+) и безопасные дифференцировочные стимулы (CS–), что выражается в большем уровне замирания на CS+ по сравнению с замиранием на CS– (рис. 4а). Вместе с тем, эти тесты сопровождаются примерно одинаковым подъемом уровня внеклеточного серотонина в мПК (рис. 2а, б). Этот факт свидетельствует, что между замиранием на звуковые сигналы в ходе этих тестов и подъемом уровня внеклеточного серотонина видимо нет прямого соответствия. Такое предположение находит подтверждение в другом результате работы, показавшем, что введение флуоксетина (1 мкМ) в мПК ходе дифференцировочной сессии, увеличивающее фоновый и вызываемый предъявлением CS– уровень внеклеточного серотонина в этой области, не влияет на длительность замирания на CS– (рис. 4а). Более того, такое фармакологическое воздействие не изменяет уровень неподвижности в интервалах между предъявленными CS–, хотя, как описано выше, увеличивает этот показатель в интервалах между CS+ во время реализации УРС (рис. 4б). Эти ранее неизвестные данные свидетельствуют о вкладе показанной в работе серотониновой активации мПК в организацию защитного поведения в периоды ожидания потенциально опасных звуковых сигналов, но не безопасных дифференцировочных стимулов. Такая селективность позволяет предположить, что активация серотониновой системы мПК возможно является необходимым, но не достаточным фактором для регуляции этих реакций, и требуется кооперативное участия в этом других процессов, активируемых опасными, но не безопасными стимулами. Для проверки этого предположения нужны дальнейшие исследования.
ЗАКЛЮЧЕНИЕ
Полученные в работе новые данные, во-первых, свидетельствуют, что при дискриминации опасных и безопасных стимулов, сопровождающейся генерализацией реакции страха, происходит активация серотониновой системы мПК как потенциально опасными, так и заведомо безопасными звуковыми сигналами. Во-вторых, они впервые демонстрируют, что серотониновая активация мПК, запускаемая условными сигналами, ассоциируемыми с опасностью (но не безопасными дифференцировочными сигналами) регулирует защитное поведение животных в периоды ожидания звуковых сигналов. Результаты вносят вклад в понимание особенностей участия медиальной префронтальной коры и ее серотониновой системы в регуляции проявлений страха в ситуациях, требующих дифференцированной трактовки мотивационной значимости предъявляемых стимулов.
Список литературы
Kessler R.C., Chiu W.T., Demler O., Walters E.E. // Arch. Gen. Psychiatry. 2005. V. 62. № 6. P. 617–627.
Maren S. // Annu. Rev. Neurosci. 2001. V. 24. P. 897–931.
Rozeske R.R., Valerio S., Chaudun F., Herry C. // Genes Brain Behav. 2015. V. 14. № 1. P. 22–36.
Саульская Н.Б. // Успехи физиол. наук. 2018. Т. 49. № 4. С. 12–29.
Sangha S., Diehl M.M., Bergstrom H.C., Drew M.R. // Neurosci. Biobehav. Rev. 2020. V. 108. P. 218–230.
Puig M.V., Artigas F., Celada P. // Cereb. Cortex. 2005. V. 15. № 1. P. 1–14.
Meunier C.N., Amar M., Lanfumey L., Hamon M., Fossier P. // Neuropharmacology. 2013. V. 71. P. 37–45.
Bauer E.P. // Beh. Brain. Res. 2015. V. 277. P. 68–77.
Hashimoto S., Inoue T., Koyama T. // Eur. J. Pharmacol. 1999. V. 378. № 1. P. 23–30.
Almada R.C., Coimbra N.C., Brandao M.L. // Neuroscience. 2015. V. 284. № 11. P. 988–997.
Leon L.A., Castro-Gomes V., Zarate-Guerrero S., Corredor K., Mello Crus A.P., Brandao M.L., Cardenas F.P., Landreira-Fernandez J. // Front. Behav. Neurosci. 2017. V. 11. № 117. P. 1–13.
Ferreira R., Nobre M.J. // Neurosci. 2014. V. 268. P. 159–158.
Sangha S., Robinson P.D., Greba Q. // Neuropsychopharmacology. 2014. V. 39. P. 2105–2113.
Grosso A., Santoni G., Manassero E. Renna A., Sacchetti B. // Nature Communication. 2018. V. 9. № 1. Art. 1214. P. 1–12.
Rozeske R.R., Jercog D., Karalis N., Chaudun F., Khoder S., Girard D., Winke N., Herry C. // Neuron. 2018. V. 97. № 4. P. 898–910.
Scarlata M.J., Lee S.H., Lee D., Kandigian S.E., Hiller A.J., Dishart J.G., Mintz G.E., Wang Z., Coste G.I., Mousley A.L., Soler I., Lawson K., Ng A.J., Bezek J.L., Bergstrom H.C. // Sci. Report. 2019. V. 9. Art. 6730.
Klemenhagen K.C., Gordon J.A., David D.J. Hen R., Gross C.T. // Neuropsychopharmacology. 2006. V. 31. № 1. P. 101–111.
Pedraza L.K., Sierra R.O., Giachero M., Nunes-Souza W., Lotz F.N., de Oliveira Alvares L. // Translational Psychiatry. 2019. V. 9. № 1. Art. 53.
Саульская Н.Б., Марчук О.Э. // Росс. физиол. журн. 2018. Т. 108. № 4. С. 466–476.
Саульская Н.Б., Марчук О.Э. // Журн. высш. нерв. деят. 2019. Т. 69. № 3. С. 342–352.
Саульская Н.Б., Судоргина П.В. // Журн. высш. нерв. деят. 2015. Т. 65. № 3. С. 372–381.
Mork A., Russel R.V., de Jong I.E.M., Smagin G. // Europ. J. Pharmacol. 2017. V. 799. P. 1–6.
Yokoyama M., Suzuki E., Sato N., Maruta S., Watanabe S., Miyaoka H. // Neurosci. Lett. 2004. V. 379. № 1. P. 37–41.
Gilmartin M.R., Balderston N.L., Helmstetter F.J. // Trends Neurosc. 2014. V. 37. № 8. P. 455–464.
Spigset O. // Drag Saf. 1999. V. 20. № 3. P. 277–287.
Burghardt N.S., Bush D.E., McEwen B.S., LeDoux J.E. // Biol. Psychiatry. 2007. V. 62. № 10. P. 1111–1118.
Дополнительные материалы отсутствуют.