Нейрохимия, 2021, T. 38, № 1, стр. 43-51
Серотониновые 5-HT1A, 5-HT2A и 5-HT7 рецепторы в мозге мышей линии BTBR-модели аутизма
А. Я. Родный 1, Е. А. Куликова 1, Е. М. Кондаурова 1, В. С. Науменко 1
1 Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук
Новосибирск, Россия
Поступила в редакцию 06.05.2020
После доработки 08.06.2020
Принята к публикации 06.07.2020
Аннотация
Расстройства аутистического спектра (РАС) являются одной из самых больших эпидемиологических проблем человечества. Несмотря на огромные усилия научного сообщества, механизмы, лежащие в основе РАС, далеки от понимания. Данные о роли серотониновой (5-НТ) системы мозга в развитии РАС скудны и противоречивы. В данной работе мы исследовали функциональный ответ и экспрессию 5-HT1A, 5-HT2A и 5-HT7 рецепторов в структурах мозга мышей линии BTBR, широко используемой в качестве модели аутизма. Мыши BTBR продемонстрировали значительное снижение опосредованной 5-HT1A рецепторами гипотермической реакции по сравнению c мышами линии C57BL/6J. При этом существенной разницы между мышами линий BTBR и C57BL/6J как по уровню мРНК гена 5-HT1A рецептора, так и по уровню белка рецептора во всех исследуемых структурах мозга обнаружено не было. Функциональный ответ 5-HT2A рецепторов, так же как и уровень белка 5-НТ2А рецепторов у мышей линии BTBR и у мышей линии C57BL/6J не различались. Однако уровень мРНК гена 5-HT2A рецепторов был снижен в гиппокампе мышей BTBR. Функциональная активность, уровень мРНК и белка 5-НТ7 рецепторов у мышей BTBR были неизменны в сравнении с мышами линии C57BL/6J. Таким образом, было показано, что функциональная активность 5-HT1A рецепторов значительно снижена в мозге мышей линии BTBR без существенных изменений экспрессии 5-НТ1А рецепторов. При этом изменена экспрессия гена 5‑НТ2А рецептора при неизменной функциональной активности и уровне белка 5-НТ2А рецепторов. Экспрессия и функциональный ответ 5-НТ7 рецепторов не отличались в исследованных структурах мозга изучаемых линий мышей.
ВВЕДЕНИЕ
Количество пациентов с расстройствами аутистического спектра (РАС) постоянно растет [1]. РАС возникают в результате нарушения развития мозга и характеризуются ярко выраженным нарушением социального взаимодействия и повторяющимися действиями [2]. Несмотря на интенсивные исследования, причины этих расстройств далеки от полного понимания. В настоящее время данные, полученные как с помощью нейровизуализации, так и на посмертных образцах мозга больных РАС, указывают на вовлечение в механизмы этих расстройств серотониновой (5-HT) системы мозга [3].
Известно, что 5-HT система участвует в регуляции различных типов поведения, включая социальное поведение [3]. Такая полифункциональность 5-HT системы основана на существовании многочисленных рецепторов, опосредующих действие нейротрансмиттера в мозге. Наиболее изучаемым членом семейства серотониновых рецепторов является 5-HT1A рецептор. Этот рецептор сопряжен с Gi-белком и ингибирует аденилатциклазу при активации. 5-HT1A рецепторы, являясь ключевыми регуляторами серотониновой системы мозга, [4] могут локализоваться как пост-, так и пресинаптически. Пресинаптические 5-HT1A рецепторы регулируют секрецию 5-HT в синаптической щели [5]. Кроме того, 5-HT1A рецепторы вовлечены в регуляцию различных физиологических функций и психопатологических расстройств [6]. В то же время функциональное состояние 5-НТ1А рецепторов может контролироваться другими серотониновыми рецепторами. Так, например, 5-HT2A рецептор может формировать гетеродимеры с 5-HT1A рецептором [7] и влиять на его функционирование [8, 9]. 5-HT7 рецептор также способен формировать гетеродимеры с 5-HT1A рецептором, значительно влияя на функцию последнего [10, 11].
5-HT2A рецепторы привлекают к себе внимание ученых, поскольку вовлечены в механизмы различных психопатологий [12]. Эти рецепторы сопряжены с Gq-белком и активируют фосфолипазу С при активации [5]. У взрослых людей с РАС методом однофотонной эмиссионной компьютерной томографии было показано снижение плотности 5-HT2A рецепторов в поясной извилине, лобной и височной коре [13], хотя более поздние исследования с помощью позитронно-эмиссионной томографии показали противоречивые результаты [14]. Снижение числа сайтов связывания 5-HT1A и 5-HT2А рецепторов было выявлено в коре задней части поясной извилины и коре веретенообразной извилины в посмертных образцах ткани головного мозга у молодых людей с диагнозом аутизм [15]. В то же время значительно более высокий уровень мРНК гена 5-HT2A рецептора был обнаружен в тромбоцитах детей, страдающих аутизмом [16]. Также в посмертных образцах ткани головного мозга пациентов с аутизмом было показано снижение радиолигандного связывания серотонина с 5-HT1A рецепторами [3]. Еще один интенсивно изучаемый в последнее время 5-HT7 рецептор сопряжен с Gs-белком и активирует аденилатциклазу при активации [5]. Несмотря на вовлечение 5-НТ7 рецепторов в регуляцию функциональной активности 5-НТ1А рецепторов, прямых доказательств участия 5-НТ7 рецепторов в механизмах РАС нет [17]. В то же время исследования однонуклеотидных полиморфизмов в генах 5-HT2A [18–20] и 5-НТ7 [21] рецепторов указывает на связь между этими рецепторами и РАС.
Для более глубокого исследования механизмов РАС и, в частности, роли 5-НТ системы в данных расстройствах очень важно использовать адекватные модели заболевания. Широко используемой моделью РАС являются мыши линии BTBR T Itpr3/J (BTBR). Мыши линии BTBR демонстрируют основные поведенческие характеристики, определяющие РАС, в том числе нарушение социальных взаимодействий и повторяющееся, стереотипное поведение [22]. Показано, что плотность 5-HT нейронов увеличивается в среднем мозге и уменьшается в гиппокампе мышей BTBR. Кроме того, уровень 5-HT в мозге этих животных также снижается в гиппокампе [23, 24]. Селективный ингибитор обратного захвата серотонина – флуоксетин – и неселективный агонист 5-HT1A рецепторов – буспирон – повышают интенсивность социального взаимодействия у мышей BTBR. При этом способность активировать G-белок у 5-НТ1А рецепторов гиппокампа мышей BTBR выше, чем у мышей линии C57BL/6J, хотя по плотности 5-НТ1А рецепторов мыши не различаются [24]. Показано, что блокада 5-HT2A рецептора в стриатуме снижает частоту повторений стереотипного поведения [25] и улучшает когнитивную деятельность [26] у мышей BTBR.
Однако функциональное состояние 5-HT1A, 5-HT2A и 5-HT7 рецепторов, а также экспрессия этих рецепторов в мозге мышей BTBR до сих пор не изучены. В связи с этим целью данного исследования было изучение функциональной активности 5-HT1A, 5-HT2A и 5-HT7 рецепторов и их экспрессии в мозге BTBR мышей по сравнению с мышами линии C57BL/6J.
МАТЕРИАЛЫ И МЕТОДЫ
Животные. Эксперименты были проведены на взрослых (2–3 мес.) самцах мышей линий BTBR (весом 28 ± 1 г) и C57BL/6J (весом 27 ± 0.3 г). Все процедуры проводили с 15:00 до 18:00 ч. Животных содержали в клетках Optimice® в стандартных условиях (20–22°C), свободный доступ к еде и воде, 12-часовой цикл свет/темнота). За два дня до выведения из эксперимента мышей рассаживали в индивидуальные клетки для снятия групповых эффектов. После чего мышей декапитировали, на льду выделяли кору, гиппокамп и область ядер шва среднего мозга, замораживали структуры мозга в жидком азоте и хранили при –80°С до процедуры выделения общей РНК и белка. Работы с животными проводили с использованием ресурсов Центра генетических ресурсов лабораторных животных ИЦиГ СО РАН (уникальный идентификатор проекта RFMEFI62119X0023).
Дизайн эксперимента. В исследовании использовалось по 24 животных каждого генотипа. По 8 животных каждой линии для проведения молекулярных исследований, по 8 животных каждой линии для оценки функциональной активности 5-НТ1А рецепторов, после этого через 3 суток им проводили также исследование функциональной активности 5-НТ2А рецепторов, а также по 8 животных каждой линии для исследования функциональной активности 5-НТ7 рецепторов.
Оценка функциональной активности 5-HT рецепторов. Функциональную активность 5-HT1A рецепторов оценивали по выраженности гипотермического ответа на острое введение агониста 5-НТ1А рецепторов 8-OH-DPAT (8-гидрокси-2-(ди-n-пропиламино)тетралин, Sigma Aldrich , США) (1 мг/кг, в/бр) [27, 28]. По данным, полученным ранее [29], этот лиганд можно рассматривать как селективный агонист 5-HT1A рецепторов. Температура тела была измерена ректально при помощи KJT термометра (Hanna Instruments, Сингапур) с ректальным датчиком для мышей (Physitemp Instruments, Clifton NJ, США). Выраженность гипотермического ответа выражали в разнице между начальной температурой тела и температурой, измеренной через 20 мин после инъекции препарата (ΔT, °C).
Функциональная активность 5-HT2A рецепторов была оценена по количеству встряхиваний головой (head-twitches), вызванных введением агониста 5‑НТ2А рецепторов DOI ((±)–1–(2,5-диметокса-4-йодофенил)2-аминопропан гидрохлорид) (1 мг/кг, в/бр) [30]. Подсчет встряхиваний головой начинали через 5 мин после введения препарата и продолжали в течение 20 мин.
Функциональную активность 5-HT7 рецепторов определяли по интенсивности гипотермического ответа на введение селективного агониста 5-НТ7 рецепторов LP44 (4-[2-(метилтио)фенил]-N-(1,2,3,4-тетрагидро-1-нафталенил)-1-пиперазингексамид гидрохлорид) (20.5 нмоль, i.c.v.) [29]. Соединение растворяли в стерильной воде и вводили в левый боковой желудочек мозга (i.c.v.) путем микроинъекции с помощью стереотаксической установки TSE (Германия) по следующим координатам: –0.5 for AP, –1.6 mm for L, 2 mm for DV [31]. Животных предварительно усыпляли, помещая в пары диэтилового эфира на 20–30 с [32]. Используемая доза препарата (20.5 нмоль) была установлена в исследовании, проведенном нами ранее [29]. Выраженность гипотермического ответа выражали в разнице между начальной температурой тела и температурой, измеренной через 20 мин после инъекции препарата (ΔT, °C).
ОТ-ПЦР в реальном времени. Экспрессию генов определяли с помощью количественного метода обратной транскрипции с последующей полимеразной цепной реакцией (ОТ-ПЦР), разработанного в нашей лаборатории [33–35]. Для амплификации кДНК исследуемых генов использовали пары специфических праймеров (табл. 1 ). Для количественного анализа уровня мРНК генов использовали два типа стандартов: внешний и внутренний. Внутренний стандарт (мРНК гена rPol2) применяли для контроля обратной транскрипции в качестве основы для расчета уровня мРНК исследуемых генов. В предварительных опытах не были выявлены различия в уровне мРНК гена rPol2 в исследуемых структурах мозга. Внешним стандартом служила серия разведений выделенной из печени мыши ДНК с известной концентрацией, что позволило контролировать ПЦР и определять число копий мРНК исследуемых генов в образцах. Экспрессия генов представлена как отношение количества кДНК исследуемых генов к 100 копиям кДНК гена rPol2.
Вестерн-блот анализ. Уровни рецепторов были оценены в коре, гиппокампе и среднем мозге. Подготовка образцов и количественная оценка белковых полос были выполнены, как обсуждалось ранее [36]. Мы использовали следующие первичные антитела: поликлональные кроличьи анти-5-HT1A рецептор (52 кДа, разбавление 1 : 1000; abcam ab85615, Abcam, Великобритания), поликлональные кроличьи анти-5-HT2A рецептор (52 кДа, разбавление 1 : 300; Novus NBP1-49172, Novus Biologicals, США), моноклональные кроличьи анти-5-HT7 рецептор (54 кДа, разбавление 1 : 500; abcam ab128892, Abcam, Великобритания), моноклональные анти-GAPDH, конъюгированные с пероксидазой хрена (37 кДа, разбавление 1 : 500; sc-47724; Santa Cruz Biotechnology Inc., США) при 4°C на ночь и вторичные козьи анти-кролик IgG-HRP (разбавление 1 : 10 000; sc-2004, Santa Cruz Biotechnology Inc., США) в течение 2 ч при комнатной температуре. Количество белка рецептора оценивается как процент интенсивности флуоресценции полосы рецептора к флуоресценции полосы GAPDH.
Таблица 1.
Нуклеотидные последовательности праймеров и их характеристики
| Ген | Нуклеотидная последовательность | Тотж, °C | Длина продукта ПЦР, п.н. |
|---|---|---|---|
| Htr1a | F 5'-ctgtgacctgtttatcgccctg-3'R 5'-gtagtctatagggtcggtgattgc-3' | 62 | 200 |
| Htr2a | F 5'-agaagccaccttgtgtgtga-3'R 5'-ttgctcattgctgatggact-3' | 61 | 169 |
| Htr7 | F5'-ggctacacgatctactccaccg-3'R5'-cgcacactcttccacctccttc-3' | 65 | 198 |
| rPol2 | F 5'-tgtgacaactccatacaatgc-3'R 5'-ctctcttagtgaatttgcgtact-3' | 60 | 194 |
РЕЗУЛЬТАТЫ
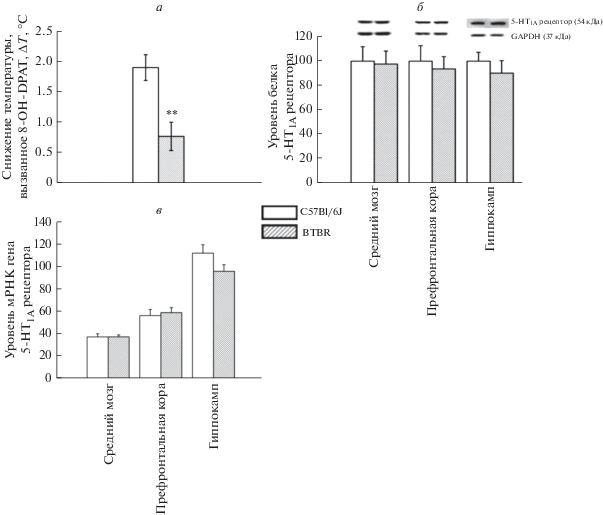
Между мышами линий BTBR и C57BL/6J было обнаружено существенное различие в функциональной активности 5-HT1A рецепторов. Острое введение агониста 5-НТ1А рецепторов 8-OH-DPAT в дозе 1.0 мг/кг вызвало значительный гипотермический ответ у мышей C57BL/6J, в то время как у мышей BTBR опосредованная 5-НТ1А рецепторами гипотермическая реакция была значительно менее выражена (F1,13 = 12.93, p < 0.01) (рис. 1a). В то же время не было обнаружено влияния генотипа на экспрессию гена, кодирующего 5-НТ1А рецепторы во всех исследованных структурах мозга (F1,13 < 1 для среднего мозга; F1,10 < 1 для коры; F1,9 = 2.20, p > 0.05 для гиппокампа) (рис. 1в). Также между мышами линий BTBR и C57BL/6J не было обнаружено разницы по уровню белка 5-НТ1А рецептора во всех исследованных структурах мозга (F1,14 < 1 для среднего мозга; F1,11 = 3.52, p > 0.05 для коры; F1,10 < 1 для гиппокампа) (рис. 1б).
Рис. 1.
a – Функциональный ответ 5-HT1A рецептора, оцененный по интенсивности гипотермического ответа на введение 8-OH-DPAT (1 мг/кг, в/бр) у мышей C57BL/6J и BTBR. Выраженность гипотермического ответа представлена как разница между начальной температурой тела и температурой, измеренной через 20 мин после введения 8-OH-DPAT; б – Уровень белка 5-HT1A рецептора в среднем мозге, префронтальной коре и гиппокампе мышей C57BL/6J и BTBR. Уровень белка рецептора 5-HT1A нормализовался на GAPDH. в – Уровень мРНК гена 5-HT1A в среднем мозге, префронтальной коре и гиппокампе мышей C57BL/6J и BTBR. Экспрессия гена представлена как количество копий кДНК рецептора отнесенное на 100 копий кДНК гена rPol2, которую использовали в качестве калибратора. Все значения представлены в виде m ± SEM. N ≥ 5. ** p < 0.01 по сравнению с C57BL/6J.
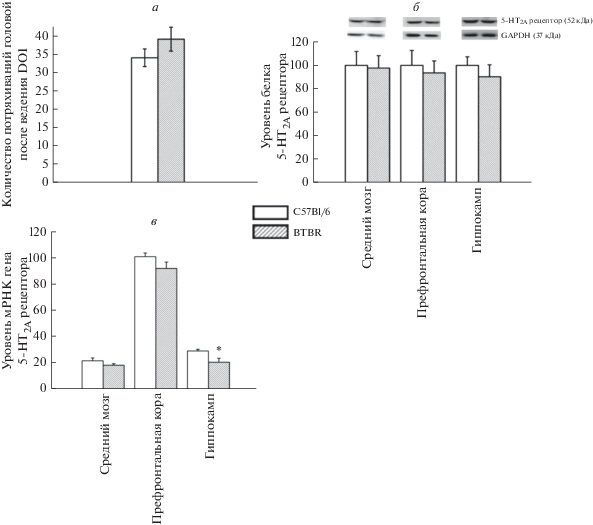
Мыши линии BTBR не отличались от контрольных мышей C57BL/6J по функциональной активности 5-HT2A рецепторов. Острое введение агониста 5-НТ2А рецепторов DOI в дозе 1 мг/кг вызвало сходное количество встряхиваний головой у мышей обеих исследованных линий (F1,12 = 1.56, p > 0.05) (рис. 2a). Также не было обнаружено изменений в уровне белка 5-НТ2А рецепторов во всех исследованных структурах мозга (F1,13 < 1; для коры, F1,14 < 1, для гиппокампа и F1,13 < 1, для среднего мозга) мышей линии BTBR (рис. 2б). В коре (F1,14 = 2.6, p > 0.05) и среднем мозге (F1,13 = 1.9, p > 0.05) не было обнаружено различий и по уровню мРНК гена 5-НТ2А рецептора. Однако уровень мРНК гена 5-HT2A рецептора был снижен в гиппокампе мышей BTBR по сравнению с мышами линии C57BL/6J (F1,10 = 8.4, p < 0.05) (рис. 2в).
Рис. 2.
a – Функциональный ответ 5-HT2A рецептора, оцененный по количеству встряхиваний головой, вызванных введением DOI (1 мг/кг, в/бр), у мышей C57BL/6J и BTBR; б – Уровень белка 5-HT2A рецептора в среднем мозге, префронтальной коре и гиппокампе мышей C57BL/6J и BTBR. Уровень белка рецептора 5-HT2A нормализовался на GAPDH. в – Уровень мРНК гена 5-HT2A рецепторов в среднем мозге, префронтальной коре и гиппокампе мышей C57BL/6J и BTBR. Экспрессия гена представлена как количество копий кДНК рецептора, отнесенное на 100 копий кДНК гена rPol2, которую использовали в качестве калибратора. Все значения представлены в виде m ± SEM. N ≥ 6. * p < 0.05 по сравнению с C57BL/6J.
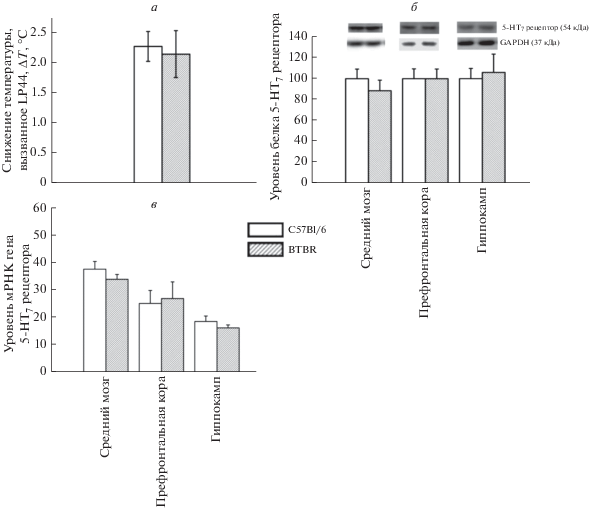
Между мышами BTBR и C57BL/6J не было обнаружено различий как в функциональном ответе 5-HT7 рецепторов (F1,14 < 1) (рис. 3a), так и в уровне мРНК (F1,14 < 1; для коры, F1,13 < 1; для гиппокампа и F1,13 = 1.3; p > 0.05 для среднего мозга) (рис. 3в) и уровне белка 5-НТ7 рецепторов (F1,13 < 1; для коры, F1,13 < 1; для гиппокампа и F1,14 < 1; для среднего мозга) (рис. 3б).
Рис. 3.
a – Функциональный ответ 5-HT7 рецептора, оцененный по интенсивности гипотермического ответа на введение LP44 (20.5 нмоль, i.c.v.) у мышей C57BL/6J и BTBR. Выраженность гипотермического ответа представлена как разница между начальной температурой тела и температурой, измеренной через 20 мин после введения LP44; б –Уровень белка 5-HT7 рецептора в среднем мозге, префронтальной коре и гиппокампе мышей C57BL/6J и BTBR. Уровень белка рецептора 5-HT7 нормализовался на GAPDH; в – Уровень мРНК гена 5-HT7 рецепторов в среднем мозге, префронтальной коре и гиппокампе мышей C57BL/6J и BTBR. Экспрессия гена представлена как количество копий кДНК, рецептора отнесенное на 100 копий кДНК гена rPol2, которую использовали в качестве калибратора. Все значения представлены в виде m ± SEM. N ≥ 6.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Мыши линии BTBR являются наиболее широко используемой моделью РАС, демонстрирующей высокую валидность [22]. В данном исследовании мы впервые продемонстрировали, что у мышей линии BTBR снижена функциональная активность 5-HT1A рецепторов, что отражается в снижении выраженности гипотермической реакции в ответ на введение агониста 5-HT1A рецепторов – 8-OH-DPAT. При этом мыши BTBR не отличаются от мышей линии C57BL/6J по уровню мРНК и белка 5-HT1A рецепторов во всех исследованных структурах мозга.
Поскольку функциональный ответ 5-НТ1А рецепторов оценивался по выраженности гипотермической реакции в ответ на активацию рецептора, можно предположить, что изменения в выраженности снижения температуры тела отражают не чувствительность рецепторов, а нарушение в системе терморегуляции у мышей BTBR. Однако отсутствие изменений в опосредуемом 5-НТ7 рецепторами гипотермическом ответе дает основание заключить, что система терморегуляции у мышей BTBR функционирует сходным с мышами C57BL/6J образом.
Ранее было показано, что способность активировать G-белок у 5-НТ1А рецепторов гиппокампа мышей BTBR выше, чем у мышей линии C57BL/6J, хотя по плотности 5-НТ1А рецепторов эти мыши не различаются [24]. Наши данные о сниженной функциональной активности при неизменной экспрессии 5-HT1A рецепторов в мозге мышей BTBR позволяют предположить компенсаторный характер повышения эффективности активации G-белка 5-НТ1А рецепторами в мозге мышей BTBR. Также следует отметить, что сниженная функциональная активность 5-HT1A рецепторов согласуется и с фармакологическими данными, демонстрирующими, что агонист 5-HT1A рецепторов – буспирон – повышает интенсивность социальных взаимодействий у мышей BTBR [24].
Можно предположить, что выявленное нами снижение функциональной активности 5-HT1A рецепторов у мышей BTBR может быть связано с изменениями в цепи передачи сигнала рецептора или с посттрансляционной регуляцией его функции. Недавно мы показали, что посттрансляционное пальмитоилирование 5-HT1A рецептора играет решающую роль в регуляции функционирования рецепторов и, как следствие, в механизмах депрессивно-подобного поведения животных и депрессии у человека [37]. Нарушение пальмитоилирования 5-HT1A рецепторов может объяснить снижение функционального ответа рецепторов без существенных изменений их экспрессии. Другим возможным механизмом наблюдаемого изменения функционального ответа 5-HT1A рецепторов у мышей BTBR является гетеродимеризация 5-HT1A и 5-HT7 рецепторов. Ранее было показано, что гетеродимеризация 5-HT1A и 5-HT7 рецепторов усиливает интернализацию 5-HT1A рецепторов, что приводит к снижению их функционального ответа, но не оказывает влияния на функциональную активность 5-НТ7 рецепторов [10, 11, 38, 39]. И в данной работе также не было обнаружено изменений в функциональной активности и экспрессии 5-НТ7 рецепторов в структурах мозга мышей линии BTBR.
Известно, что блокада 5-НТ2А рецепторов при помощи антагонистов приводит к снижению повторений стереотипного поведения и улучшению когнитивной деятельности у мышей линии BTBR [25, 26]. Принимая во внимание эти данные, можно предположить, что обнаруженное в данной работе снижение уровня мРНК 5-НТ2А рецепторов в гиппокампе мышей BTBR направлено на облегчение патологического поведения у этих мышей. Кроме того, наши результаты отчасти согласуются с данными о снижении плотности рецепторов 5-HT2A у пациентов с РАС [13].
Интересно отметить, что среди трех исследованных в работе рецепторов 5-НТ системы мозга изменения были обнаружены в двух. Причем если для 5-НТ1А рецепторов было обнаружено снижение функциональной активности без вовлечения генетической регуляции, то для 5-НТ2А рецепторов, напротив, было показано снижение уровня мРНК без существенных изменений уровня белка и функциональной активности рецептора.
ВЫВОДЫ
Таким образом, мыши BTBR, наряду с аутистическими поведенческими чертами [22], демонстрируют снижение функциональной активности 5‑HT1A рецепторов при их неизменной экспрессии, что, однако, хорошо согласуется с литературными данными о роли рецептора 5-HT1A в социальном дефиците, связанном с аутизмом. Полученные нами результаты позволяют предположить изменения в посттрансляционной модификации и/или регуляции функционального состояния 5-HT1A рецепторов. Кроме того, у мышей линии BTBR снижен уровень мРНК 5-HT2A рецепторов в гиппокампе без существенных изменений в функциональной активности и уровне белка 5-НТ2А рецепторов. В то же время экспрессия и функциональный ответ 5-НТ7 рецепторов у мышей BTBR не отличался от мышей линии C57BL/6J во всех исследованных структурах мозга.
Список литературы
Emberti Gialloreti L., Curatolo P. // Frontiers in neurology. 2018. V. 9. № 9. P. 670.
Myers S.M., Johnson C.P. // Pediatrics. 2007. V. 120. № 5. P. 1162–1182.
Muller C.L., Anacker A.M.J., Veenstra-VanderWeele J. // Neuroscience. 2016. V. 321. № 3. P. 24–41.
Popova N.K., Naumenko V.S. // Rev. Neurosci. 2013. V. 24. № 2. P. 191–204.
Barnes N.M., Sharp T. // Neuropharmacology. 1999. V. 38. № 8. P. 1083–1152.
Hall M.D., el Mestikawy S., Emerit M.B., Pichat L., Hamon M., Gozlan H. // J. Neurochem. 1985. V. 44. № 6. P. 1685–1696.
Borroto-Escuela D.O., Narvaez M., Ambrogini P., Ferraro L., Brito I., Romero-Fernandez W., Andrade-Talavera Y., Flores-Burgess A., Millon C., Gago B., Narvaez J.A., Odagaki Y., Palkovits M., Diaz-Cabiale Z., Fuxe K. // Molecules. 2018. V. 23. № 6. P. 1341–1357
Naumenko V.S., Bazovkina D.V., Kondaurova E.M., Zubkov E.A., Kulikov A.V. // Genes, brain, and behavior. 2010. V. 9. № 5. P. 519–524.
Naumenko V.S., Bazovkina D.V., Kondaurova E.M. // Zh. Vyssh. Nervn. Deyat. im. I.P. Pavlova. 2015. V. 65. № 2. P. 240–247.
Renner U., Zeug A., Woehler A., Niebert M., Dityatev A., Dityateva G., Gorinski N., Guseva D., Abdel-Galil D., Frohlich M., Doring F., Wischmeyer E., Richter D.W., Neher E., Ponimaskin E.G. // J. Cell Science. 2012. V. 125. № Pt 10. P. 2486–2499.
Naumenko V.S., Popova N.K., Lacivita E., Leopoldo M., Ponimaskin E.G. // CNS Neurosci. Ther. 2014. V. 20. № 7. P. 582–590.
Carhart-Harris R.L., Nutt D.J. // J. Psychopharmacol. 2017. V. 31. № 9. P. 1091–1120.
Murphy D.G., Daly E., Schmitz N., Toal F., Murphy K., Curran S., Erlandsson K., Eersels J., Kerwin R., Ell P., Travis M. // Am. J. Psychiatry. 2006. V. 163. № 5. P. 934–936.
Girgis R.R., Slifstein M., Xu X., Frankle W.G., Anagnostou E., Wasserman S., Pepa L., Kolevzon A., Abi-Dargham A., Laruelle M., Hollander E. // Psychiatry Res. 2011. V. 194. № 3. P. 230–234.
Oblak A., Gibbs T.T., Blatt G.J. // Autism research: official j. of the International Society for Autism Research. 2013. V. 6. № 6. P. 571–583.
Kazek B., Huzarska M., Grzybowska-Chlebowczyk U., Kajor M., Ciupinska-Kajor M., Wos H., Marszal E. // Acta Neurobiol. Exp. 2010. V. 70. № 2. P. 232–238.
Ciranna L., Catania M.V. // Front. Cell. Neurosci. 2014. V. 8. № 8. P. 250.
Hranilovic D., Blazevic S., Babic M., Smurinic M., Bujas-Petkovic Z., Jernej B. // Psychiatry Res. 2010. V. 178. № 3. P. 556–558.
Cho I.H., Yoo H.J., Park M., Lee Y.S., Kim S.A. // Brain Res. 2007. V. 1139. № 30. P. 34–41.
Abdelrahman H.M., Sherief L.M., Alghobashy A.A., Abdel Salam S.M., Hashim H.M., Abdel Fattah N.R., Mohamed R.H. // Research in developmental disabilities. 2015. V. 36C. P. 485–490.
Helsmoortel C., Swagemakers S.M., Vandeweyer G., Stubbs A.P., Palli I., Mortier G., Kooy R.F., van der Spek P.J. // Am. J. Med. Genet., Part B. 2016. V. 171. № 8. P. 1049–1056.
Stephenson D.T., O’Neill S.M., Narayan S., Tiwari A., Arnold E., Samaroo H.D., Du F., Ring R.H., Campbell B., Pletcher M., Vaidya V.A., Morton D. // Mol. Autism. 2011. V. 2. № 1. P. 7.
Lau A.A., Tamang S.J., Hemsley K.M. // J. Inherited Metab. Dis. 2018. V. 41. № 4. P. 669–677.
Gould G.G., Hensler J.G., Burke T.F., Benno R.H., Onaivi E.S., Daws L.C. // J. Neurochem. 2011. V. 116. № 2. P. 291–303.
Amodeo D.A., Rivera E., Cook E.H., Jr., Sweeney J.A., Ragozzino M.E. // Genes, brain, and behavior. 2017. V. 16. № 3. P. 342–351.
Amodeo D.A., Jones J.H., Sweeney J.A., Ragozzino M.E. // Autism research: official j. of the International Society for Autism Research. 2014. V. 7. № 5. P. 555–567.
Overstreet D.H., Rezvani A.H., Knapp D.J., Crews F.T., Janowsky D.S. // Psychiatr. Genet. 1996. V. 6. № 3. P. 107–117.
Popova N.K., Naumenko V.S., Plyusnina I.Z., Kulikov A.V. // J. Neurosci. Res. 2005. V. 80. № 2. P. 286–292.
Naumenko V.S., Kondaurova E.M., Popova N.K. // Neuropharmacology. 2011. V. 61. № 8. P. 1360–1365.
Green A.R., Heal D.J. // Neuropharmacology of serotonin / Ed Green A.R. Oxford: Oxford University, 1985. P. 326–365.
Slotnick B.M., Leonard C.M. // A stereotaxic atlas of the albino mouse forebrain, Rockville, Maryland: U.S. Department of Health, Education and Welfare, 1975. P. 174.
Kondaurova E.M., Naumenko V.S., Popova N.K. // Neurosci. Lett. 2012. V. 522. № 1. P. 52–56.
Kulikov A.V., Naumenko V.S., Voronova I.P., Tikho-nova M.A., Popova N.K. // J. Neurosci. Methods. 2005. V. 141. № 1. P. 97–101.
Naumenko V.S., Kulikov A.V. // Mol. Biol. 2006. V.40. № 1. P. 37–44.
Naumenko V.S., Osipova D.V., Kostina E.V., Kulikov A.V. // J. Neurosci. Methods. 2008. V. 170. № 2. P. 197–203.
Kulikova E.A., Khotskin N.V., Illarionova N.B., Sorokin I.E., Bazhenova E.Y., Kondaurova E.M., Volcho K.P., Khomenko T.M., Salakhutdinov N.F., Ponimaskin E., Naumenko V.S., Kulikov A.V. // Neuroscience. 2018. V. 394. № 1. P. 220–231.
Gorinski N., Bijata M., Prasad S., Wirth A., Abdel Galil D., Zeug A., Bazovkina D., Kondaurova E., Kulikova E., Ilchibaeva T., Zareba-Koziol M., Papaleo F., Scheggia D., Kochlamazashvili G., Dityatev A., Smyth I., Krzystyniak A., Wlodarczyk J., Richter D.W., Strekalova T., Sigrist S., Bang C., Hobuss L., Fiedler J., Thum T., Naumenko V.S., Pandey G., Ponimaskin E. // Nat. Commun. 2019. V. 10. № 1. P. 3924.
Popova N.K., Ponimaskin E.G., Naumenko V.S. // Ross. Fiziol. Zh. im. I.M. Sechenova. 2015. V. 101. № 11. P. 1270–1278.
Kondaurova E.M., Bazovkina D.V., Naumenko V.S. // Mol. Biol. 2017. V. 51. № 1. P. 157–165.
Дополнительные материалы отсутствуют.


