Нейрохимия, 2021, T. 38, № 3, стр. 249-256
Оксид азота тормозит функциональную активацию серотониновой системы медиальной префронтальной коры при формировании страха и уменьшает его генерализацию
Н. Б. Саульская 1, М. А. Бурмакина 1, Н. А. Трофимова 1
1 Институт физиологии им. И.П. Павлова Российской академии наук
Санкт-Петербург, Россия
Поступила в редакцию 01.02.2021
После доработки 03.02.2021
Принята к публикации 04.02.2021
Аннотация
Ранее мы показали, что выработка условной реакции страха (модель формирования страха) сопровождается подъемом уровня внеклеточного серотонина в медиальной префронтальной коре, усиливающим будущую генерализацию страха. Цель работы – исследовать возможный вклад в такую регуляцию NO-серотонинового взаимодействия. На крысах линии Спрег-Доули методом прижизненного внутримозгового микродиализа показано, что введение в медиальную префронтальную кору методом диализной инфузии донора NO диэтиламин ноноата (1 мМ) увеличивает уровень внеклеточного серотонина в этой области в первые 30 мин введения с последующим постепенным снижением этого показателя. Такое введение предотвращает подъем уровня внеклеточного серотонина в медиальной префронтальной коре, вызываемый выработкой условной реакции страха (сочетание условного звукового сигнала (CS+) с неизбегаемым болевым раздражением), и приводит через сутки к уменьшению замирания животных на дифференцировочный звуковой сигнал (CS–), не ассоциируемый с болевым раздражением (показатель генерализованного страха), не влияя на замирание тех же животных на условный сигнал (CS+), ранее сочетавшийся с болевым раздражением (показатель условнорефлекторного страха). Полученные данные впервые свидетельствуют, что при формировании условной реакции страха нитрергические сигналы в медиальной префронтальной коре тормозят функциональную активацию серотониновой системы, уменьшая ее вклад в формирование генерализованного страха.
ВВЕДЕНИЕ
Медиальная префронтальная кора (мПК) рассматривается в литературе в качестве центрального звена адаптивного контроля страха [см. 1–3], регулирующего его неоправданные проявления. Нарушение такого контроля при инактивации мПК или ее выходных путей в экспериментальных моделях страха на животных [4, 5], а также у пациентов с посттравматическим стрессовым расстройством [6] выражается, в частности, в усилении проявлений страха на безопасные стимулы (генерализация страха). Данные литературы свидетельствуют, что регуляция этой корковой областью генерализации страха связана с формированием и/или консолидацией дифференцировочной памяти и зависит от активации НМДА рецепторов на пирамидных нейронах мПК [7, 8]. Активность этих нейронов находится под контролем нескольких нейромодуляторных систем. Ранее мы показали, что две из них, серотонинергическая и нитрергическая, задействованы в контроле генерализации страха, причем оказывают на нее противоположные по знаку влияния [9–12]. В частности, по нашим данным, полученным в микродиализных экспериментах, обе эти системы мПК усиливают свою активность при выработке условной реакции страха (УРС – сочетание условных звуковых сигналов CS+ с неизбегаемым болевым раздражением) [10, 12]. Причем степень такой активации у конкретного животного влияет на степень последующей генерализации страха: чем сильнее активирована серотониновая система мПК во время выработки УРС [9] или чем меньше активирована ее нитрергическая система [12], тем сильнее будут впоследствии проявления генерализованного страха (замирание на безопасные дифференцировочные стимулы). Однако не известно, насколько независимы такие изменения активностей названных систем мПК во время выработки УРС, не исследовано, может ли нитрергическая система мПК в ходе формирования страха влиять на активность серотониновой системы мПК, изменяя тем самым ее вклад в генерализацию страха.
С использованием различных методических подходов продемонстрировано, что NO регулирует синтез, высвобождение и обратный захват серотонина в ряде отделов ЦНС [см. 13, 14]. Показано участие NO-серотонинового взаимодействия в контроле тревожности [15], депрессивного поведения [14] и агрессивности [16]. Однако сведения о роли NO-серотониновых влияний в генерализации страха ограничены. А именно, установлено, что мыши с генным нокаутом нейронной NO синтазы, с одной стороны, характеризуются повышенной генерализацией страха [17], а с другой стороны, демонстрируют сниженный метаболизмом серотонина и увеличение его тканевого уровня в ряде областей мозга, включая кору [16]. Сопоставление этих данных, полученных в разных исследованиях, позволяет предполагать, что чрезмерная генерализация страха у животных с генным нокаутом нейронной NO синтазы может быть опосредована хотя бы частично дисфункцией серотониновой системы ЦНС, вызываемой недостатком NO. Вместе с тем, сведения о роли локальных NO-зависимых серотониновых механизмов мПК в регуляции генерализации страха отсутствуют.
Цель настоящей работы заключалась в изучении возможного вклада NO-серотонинового взаимодействия в мПК в регуляцию этой корковой областью генерализации страха. Для этого, методом прижизненного внутримозгового микродиализа, во-первых, исследованы эффекты введения в мПК донора NO диэтиламин ноноата (1 мМ) на изменения уровня внеклеточного серотонина в этой области, вызываемые выработкой УРС, во-вторых, изучено влияния такого введения, осуществляемого во время выработки УРС, на формирование и генерализацию этой условнорефлекторной реакции, оцениваемых по замиранию животных (показатель страха) при предъявлении условных сигналов (CS+), ранее сочетавшихся с болевым раздражением, и дифференцировочных сигналов (CS–), не ассоциируемых с болевым раздражением соответственно. Таких сведений в литературе нет.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на крысах-самцах линии Спрег-Доули массой 270–350 г из биоколлекции “Коллекция лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН. Эксперименты проводили в соответствии с международными нормами гуманного обращения с экспериментальными животными (директива Евросоюза № 86/609/EEC). Крысам под наркозом (рометар, 1.4 мкг/100 г массы и золетил, 5 мг/100 г массы, внутримышечно) имплантировали диализные канюли в мПК, как описано ранее [12]. Эксперименты с применением микродиализа проводили на второй и третий день после имплантации канюль. Животных разделяли на 2 группы: группа “Без введения” (n = 10) и группа “DEA NONO” (n = 9). Схема эксперимента приведена на рис. 1. В первый экспериментальный день (этап обучения) крыс обеих групп тестировали в течение 10 мин в установке “Открытое поле” для выяснения исходного уровня подвижности животных перед обучением. Регистрировали горизонтальную активность (пересечения границ секторов установки) и количество стоек. Затем каждое животное помещали в дневную домашнюю клетку и начинали перфузию мПК искуственной спинномозговой жидкостью (ИСМЖ) со скоростью 1 мкл/мин, используя диализный насос SP-300 (Next Advanced, США). После периода стабилизации (1.5 ч) собирали 5 фоновых порций диализата (по 15 мин каждая). Далее у крыс группы “Без введения” вырабатывали УРС с дискриминационным компонентом, как ранее описано [9]. Коротко, крысу сначала помещали в условнорефлекторную камеру с решетчатым полом на 5 мин, где с интервалом в 1 мин ей предъявляли условный стимул (CS+) – тон (1000 Гц, 10 с), сочетаемый на последней секунде с электрокожным раздражением лап (0.5 мА, 1 с) (выработка УРС). Далее животное возвращали в дневную домашнюю клетку и через 70 мин проводили дифференцировочную сессию 1 – крысу помещали в дифференцировочную камеру на 5 мин, где 1 раз в минуту предъявляли дифференцировочный сигнал (CS–) – прерывистый тон (1000 Гц, 10 с), без электрокожного раздражения. На этом этап обучения заканчивали. Затем животное возвращали в дневную домашнюю клетку на 55 мин, после чего эксперимент завершали.
Рис. 1.
Схема эксперимента. CS+ – условный звуковой сигнал; CS– – дифференцировочный звуковой сигнал.
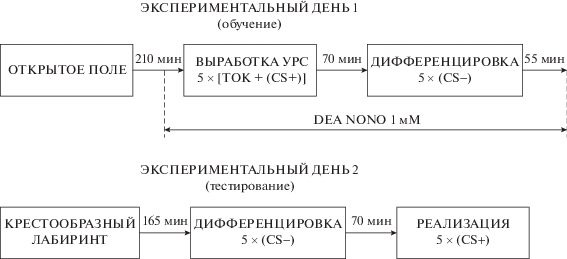
Животным группы “DEA NONO” после сбора фоновых порций диализата в ИСМЖ для перфузии мПК добавляли донор NO – диэтиламин ноноат (DEA NONO, 1 мМ; Sigma, США) и собирали 3 порции диализата. Затем у крыс этой группы сначала вырабатывали УРС, а спустя 70 мин проводили дифференцировочную сессию 1, как описано для группы “Без введения”. Через 55 мин после ее окончания перфузионную жидкость, содержащую DEA NONO, заменяли на ИСМЖ и в течение 30 мин производили дополнительную перфузию мПК для устранения остатков препарата. На этом эксперимент завершали.
На следующий день (экспериментальный день 2, этап тестирования) животных обеих групп тестировали в приподнятом крестообразном лабиринте, как ранее описано [10]. Регистрировали время пребывания (с) и амбулацию (пересечения секторов) в открытых и закрытых рукавах, количество стоек в закрытых рукавах и количество свешиваний в открытых рукавах. После этого крысу пересаживали в дневную домашнюю клетку и начинали диализную перфузию мПК. После стабилизационного периода собирали 5 фоновых порций диализата. Затем с животными обеих групп сначала проводили дифференцировочную сессию 2 (тест на генерализацию УРС), как и в первый день эксперимента, а через 70 мин после нее – реализацию УРС (тест на выработанность УРС). В ходе реализации УРС крысу помещали в условнорефлекторную камеру на 5 мин, где 1 раз в минуту предъявляли CS+ (10 с) без электрокожного раздражения. Далее животное возвращали в дневную домашнюю клетку на 70 мин, после чего эксперимент завершали.
На протяжении всего периода экспериментов диализат собирали каждые 15 мин и анализировали на содержание серотонина. Поведенческие тесты сопровождались видеорегистрацией поведения на персональном компьютере (веб-камера “Logiteсh”, Китай). Во время дифференцировочной сессии 2 и реализации УРС (этап тестирования) регистрировали длительность замирания (с) на условный (CS+) и дифференцировочный (CS–) сигналы – параметры, характеризующие степень выработанности УРС и степень ее генерализации соответственно, а также длительность замирания в межсигнальных интервалах (с). Для каждой крысы вычисляли коэффициент генерализации УРС – процентное отношение длительности замирания на СS– к длительности замирания на CS+.
В отдельных экспериментах у крыс (n = 13) с имплантированными в мПК диализными канюлями исследовали эффекты введения в мПК DEA NONO (1 мМ) на чувствительность к электрокожному раздражению. Части животных (n = 7) в мПК в течение 45 мин водили 1 мМ DEA NONO, добавляя препарат в перфузионную жидкость. Оставшимся животным (n = 6) состав перфузионной жидкости не меняли. Затем каждую крысу помещали в камеру с решетчатым покрытием пола и определяли пороги чувствительности к току (мкА), как ранее описано [10].
Уровень серотонина в диализате мПК определяли методом высокоэффективной жидкостной хроматографии с электрохимической детекцией (Shimadzu, Германия), как ранее описано [10]. Регистрацию и обработку хроматограмм осуществляли с помощью программы МультиХром 1.72 (Амперсенд, Россия). Содержание серотонина в каждой диализной пробе выражали в нМ/л, а затем – в процентах по отношению к собственному среднему фоновому уровню. После завершения экспериментов производили забой животных (рометар, 1.4 мг/100 г массы, золетил, 5 мг/100 г массы, внутримышечно, уретан, 0.2 г/100 г массы, внутрибрюшинно). Мозг извлекали для проведения морфологического контроля попаданий. В обработку были включены крысы с локализацией канюли в мПК.
Статистическую обработку проводили с использованием статистического пакета SigmaStat (3.0). Данные выражали как среднее ± ошибка среднего (n), где n – количество животных. Сравнение изменений уровня внеклеточного серотонина относительно фона осуществляли методом однофакторного дисперсионного анализа (фактор – время; F-критерий). Затем проводили сравнение изменений в отдельных временны́х точках относительно фона по t-критерию Бонферрони (post hoc тест). Межгрупповое сравнение осуществляли методом двухфакторного дисперсионного анализа (первый фактор – группа, второй фактор – время, F-критерий) с последующим сравнением групп в конкретных временны́х точках по t‑критерию Бонферрони. Сравнение параметров поведения проводили при помощи t-критерия Стьюдента. Коэффициент корреляции вычисляли по методу Пирсона (SigmaStat (3.0).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Животные экспериментальных групп не различались перед началом экспериментов по активности в тесте “Открытое поле”. Горизонтальная активность: группа “DEA NONO” – 52 ± 13 (9) пересечения; группа “Без введения” – 52 ± 12 (10) пересечения; (t = 0.05; p = 0.97). Стойки: группа “DEA NONO” – 10 ± 2 (9), группа “Без введения” – 6 ± 1 (9); (t = 1.6; p = 0.13).
Фоновый уровень внеклеточного серотонина в диализате мПК составлял у животных группы “DEA NONO” 0.20 ± 0.02 (9) нМ в первый день и 0.18 ± 0.02 (9) нМ во второй день экспериментов, а у крыс группы “Без введения” – 0.19 ± 0.01 (10) нМ в первый день и 0.18 ± 0.01 (10) нМ во второй день экспериментов. Не было выявлено влияния группы (F(1,34) = 0.06, p = 0.8), дня эксперимента (F(1,34) = 1.02, p = 0.3) и взаимодействия этих факторов (F(1,34) = 0.10, p = 0.8) на данный показатель.
Выработка УРС с дискриминационным компонентом (этап обучения) у животных группы “Без введения” сопровождалась подъемом уровня внеклеточного серотонина в мПК относительно фонового уровня перед тестированием (рис. 2; F(13,117) = 8.2, p < 0.001) в ходе обоих тестов – выработки УРС (максимум 129 ± 5%, длительность 30 мин) и дифференцировочной сессии 1 (максимум 112 ± 5%, длительность 15 мин), что соответствует ранее полученным нами данным [10].
Рис. 2.
Изменения уровня внеклеточного серотонина в мПК в ходе выработки УРС и дифференцировочной сессии 1 (этап обучения) у животных с введением в мПК 1 мМ DEA NONO (“DEA NONO + Выработка УРС”) и у крыс без введения этого препарата (“Выработка УРС”). Разброс на графиках – ошибка среднего; белая стрелка – начало введения DEA NONO; черные стрелки – начало тестов; горизонтальная линия – период введения DEA NONO. * – p < 0.05; ** – p < 0.05; *** – p <0.001 – при сравнении с фоном; + – p < 0.05; +++ – p < 0.001 – при межгрупповом сравнении. # ‒ p < 0.05; ## – p < 0.001 – при сравнении с уровнем серотонина непосредственно перед тестом “Выработка УРС” у животных группы “DEA NONO”.
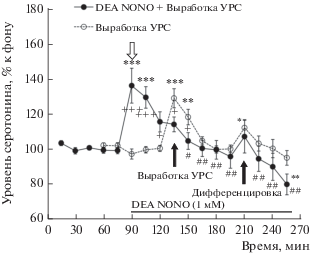
Введение в мПК перед выработкой УРС 1 мМ DEA NONO вызывало временный (30 мин) подъем уровня внеклеточного серотонина в мПК (максимум 136 ± 10%) относительно фона перед ведением (рис. 2; F(7,56) = 10.7, p < 0.001). Затем уровень внеклеточного серотонина мПК постепенно снижался (рис. 2; F(11,88) = 9.2, p < 0.001) и в конце первого дня экспериментов становился ниже фоновых значений (80 ± 6%; t = 3.9; p < 0.01). Корреляционный анализ, охватывающий весь период введения препарата, подтвердил отрицательную корреляционную зависимость между уровнем внеклеточного серотонина в мПК и временем от начала введения DEA NONO в эту область (r = –0.58; p < 0.001).
Выработка УРС у животных группы “DEA NONO”, осуществляемая на фоне введения в мПК 1мМ DEA NONO, не вызывала изменений уровня внеклеточного серотонина в мПК относительно этого показателя непосредственно перед тестом (рис. 2; t = 0.19; p = 1.00, t-критерий Бонферрони), а также по сравнению с фоновым уровнем серотонина перед введением препарата (t = 2.1; p = 1.00). Дифференцировочная сессия 1 у животных с введениями 1 мМ DEA NONO тоже не приводила к достоверным изменениям уровня серотонина в мПК относительно этого показателя перед тестом (рис. 2; t = 2.0; p = 1.00) и перед введением DEA NONO (рис. 1; t = 1.7; p = 1.00).
По данным двухфакторного дисперсионного анализа, изменения уровня внеклеточного серотонина во время выработки УРС у животных группы “DEA NONO” были ниже, чем этот показатель крыс группы “Без введения” (рис. 2; F(13,238) = = 5.8, p < 0.001).
В целом, эти данные показывают, что введение 1 мМ DEA NONO в мПК в ходе обучения предотвращает подъем уровня внеклеточного серотонина в этой области, вызываемый выработкой УРС.
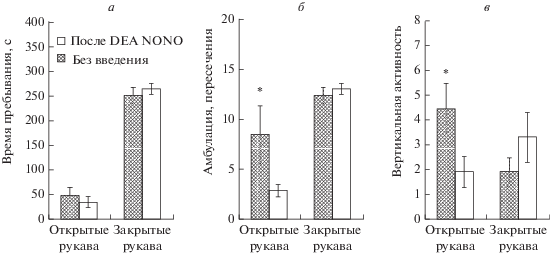
Тестирование животных обеих групп в крестообразном лабиринте, проводимое на следующий день после выработки УРС показало, что крысы группы “DEA NONO”, подвергавшиеся накануне введению в мПК 1 мМ DEA NONO, не отличаются от крыс группы “Без введения” по времени пребывания в закрытых и открытых рукавах лабиринта (рис. 3а), а также по амбулации (рис. 3б) и вертикальной активности (рис. 3в) в закрытых рукавах. Однако крысы группы “DEA NONO” демонстрировали большую горизонтальную и вертикальную исследовательскую активность в открытых рукавах лабиринта (рис. 3б, в).
Рис. 3.
а – время пребывания (с), б – амбулация (пересечения), в – вертикальная активность (свешивания/стойки) в открытых и закрытых рукавах крестообразного лабиринта животных, подвергавшихся (“После DEA NONO”) и не подвергавшихся (“Без введения”) во время выработки УРС введению в мПК 1 мМ DEA NONO. * – p < 0.05 – при сравнении с этим показателем у животных группы “Без введения”.
Предъявление животным группы “Без введения” на этапе тестирования (второй день экспериментов) безопасных дифференцировочных сигналов (CS–) в ходе дифференцировочной сессии 2 и потенциально опасных условных сигналов (CS+) во время реализации УРС сопровождалось подъемом уровня внеклеточного серотонина в мПК в ходе обоих тестов (рис. 4, F(14,112) = 5.7, p < 0.001), что соответствует ранее полученным нами данным [18].
Рис. 4.
Изменения уровня внеклеточного серотонина в мПК в ходе дифференцировочной сессии и реализации УРС (этап тестирования) у животных, подвергавшихся (“После DEA NONO”) и не подвергавшихся (“Без введения”) во время выработки УРС введению в мПК 1 мМ DEA NONO. Остальные обозначения, как на рис. 2.
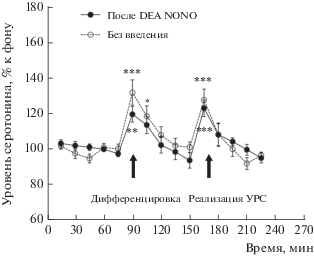
Животные группы “DEA NONO”, подвергнутые во время выработки УРС (первый день экспериментов) введению в мПК 1 мМ DEA NONO, демонстрировали на следующий день (этап тестирования) рост уровня внеклеточного серотонина в мПК в ходе дифференцировочной сессии 2 и реализации УРС (рис. 4, F(14,126) = 9.0, p < 0.001). Причем выраженность таких изменений у животных группы “DEA NONO” не отличалась, по данным двухфакторного дисперсионного анализа, от изменений этого показателя крыс группы “Без введения” в ходе соответствующих тестов (рис. 4, F(14,126) = 0.96, p = 0.49).
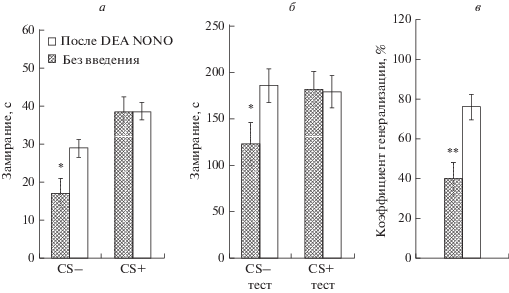
Анализ поведения животных на этапе тестирования показал, что крысы группы “DEA NONO” характеризуются меньшей длительностью замирания на безопасный дифференцировочный сигнал (CS–) (рис. 5а; t = 2.6; p = 0.02), меньшим временем неподвижности в межсигнальных интервалах (рис. 5б; t = 2.2; p = 0.04) в ходе дифференцировочной сессии 2, а также меньшим коэффициентом генерализации УРС (рис. 5в; t = 3.4; p = 0.003) по сравнению с крысами группы “Без введения”. Однако животные групп “DEA NONO” и “Без введения” не различались по уровню замирания на потенциально опасный условный сигнал (CS+) (рис. 5а; t = 0.008; p = 0.99) и по уровню неподвижности в межсигнальных интервалах (рис. 5б; t = 0.078; p = 0.94) в ходе реализации УРС.
Рис. 5.
а – время замирания на дифференцировочный (CS–) и условный (CS+) сигналы, б – время неподвижности (с) в межсигнальных интервалах во время дифференцировочной сессии (CS– тест) и реализации УРС (CS+ тест), в – коэффициент генерализации УРС (%) у животных, подвергавшихся (“После DEA NONO”) и не подвергавшихся (“Без введения”) во время выработки УРС введению в мПК 1 мМ DEA NONO. * – p < 0.05; ** – p < 0.01 – при сравнении с этим показателем крыс группы “Без введения”.
Порог чувствительности к электрокожному раздражению крыс с введением в мПК в течение 45 мин 1 мМ DEA NONO составил 186 ± 9 мкА (7), что не отличалось значимо от величины этого показателя у животных без введения препарата (170 ± 10 мкА (6); t = 1.1; p = 0.28).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Данные литературы свидетельствуют, что системные введения ингибиторов NO синтазы увеличивают тканевый уровень и уменьшают метаболизм серотонина в ряде отделов ЦНС, включая фронтальную кору [19] (но см. [20]). К таким же эффектам приводит генный нокаут нейронной NO синтазы [16], о чем упоминалось во введении. Более того, по данным микродиализных экспериментов, введения в дорсальное ядро шва донора NO S-нитрозо-N-пеницилламина (SNAP, 5 мМ) и ингибитора нейронной NO синтазы 7-нитроиндазола (1 мМ) оказывают соответственно активационные и тормозные влияния на высвобождение серотонина во фронтальной коре [21]. Все это говорит об участии нитрергической системы ЦНС в контроле активности коркового звена серотониновой системы. Вместе с тем не известно, происходит ли такое NO-серотониновое взаимодействие в самой коре или же его эффекты на корковом уровне опосредованы другими структурами мозга, например, ядрами шва, о чем свидетельствуют данные, процитированные выше [21]. Не исследовано, воздействуют ли локальные нитрергические сигналы на высвобождение серотонина в мПК, хотя морфологические предпосылки такого взаимодействия существуют. В частности, показано, что в серотониновых волокнах, иннервирующих мПК, нейронная NO-синтаза колокализована с белками транспортеров серотонина [22], активность которых является важным регулятором пула внеклеточного серотонина и доступности серотонина для его рецепторов.
Значимым результатом работы явилось то, что в ней показаны влияния активации нитрергической системы мПК на активность ее серотониновой системы. А именно, продемонстрировано, что введения в мПК донора NO DEA NONO (1 мМ) увеличивает фоновый уровень внеклеточного серотонина в мПК в первые 30 мин введения с последующим угасанием такого активационного эффекта и перерастанием его в тормозной (снижение уровня внеклеточного серотонина в мПК в конце введения препарата). Следует подчеркнуть, что в литературе продемонстрированы как тормозные, так и активационные эффекты NO на высвобождение серотонина в зависимости от области мозга или концентрации NO, создаваемой NO донорами, что связывают с множественностью мишеней NO. В частности, в экспериментах, использующих push-pull канюльную соперфузию мозга, установлены активационные влияния введения в гипоталамус в течение 10 мин 0.4 мМ DEA NONO и других NO доноров на уровень внеклеточного серотонина в этой структуре, но тормозные эффекты таких введений при концентрации NO доноров 0.1 мМ [23]. Похожие закономерности показаны методом микродиализа для ядер шва при введении в эту область SNAP (5–0.5 мМ, 30 мин) [21]. Полученные в настоящей работе данные позволяют предполагать, что еще одним фактором, влияющим на знак эффекта экзогенного NO на активность серотониновой системы, по крайней мере в мПК, может быть длительность нитрергической стимуляции этой области, в ходе которой активационные эффекты NO на уровень внеклеточного серотонина трансформируются в тормозные.
Важным проявлением тормозного действия NO на серотониновую нейротрансмиссию в мПК является показанное в работе NO-зависимое торможение функциональной активности серотониновой системы мПК, поскольку ведение в эту область 1 мМ DEA NONO в течение 45 мин предотвращает подъем уровня внеклеточного серотонина в мПК, вызываемый выработкой УРС. Ранее мы установили, что величина такого подъема влияет на степень последующей генерализации УРС [9–11]. Об этом, в частности, свидетельствует тот факт, что введение в мПК ингибитора обратного захвата серотонина флуоксетина, существенно увеличивающее вызываемый выработкой УРС подъем уровня внеклеточного серотонина в мПК, усиливает впоследствии замирание животных на дифференцировочный сигнал, не ассоциируемый с болевым раздражением (CS–), не влияя при этом на замирание животных на условный сигнал (CS+), ранее сочетавшийся с болевым раздражением [10]. Основным результатом настоящей работы являются данные, согласно которым снижение под действием DEA NONO активации серотониновой системы мПК, вызываемой выработкой УРС, ослабляет будущую генерализацию УРС, что проявляется в уменьшении замирания животных на этапе тестирования на безопасный CS–, при неизменности замирания на потенциально опасный CS+. Эти ранее неизвестные данные впервые свидетельствуют, что в ходе формирования УРС нитрергические сигналы в мПК могут тормозить функциональную активацию ее серотониновой системы, уменьшая ее вклад в формирование генерализованного страха.
Ранее мы показали, что выработка УРС сопровождается значительным и длительным увеличением продукции NO в мПК, о чем свидетельствует NO-синтаза-зависимый подъем в этой области уровня внеклеточного цитруллина (сопродукта синтеза NO) [12]. Причем такая эндогенная нитрергическая активация мПК, видимо, ограничивает будущую генерализацию страха, поскольку она выше у животных с низкой генерализацией УРС и ниже у крыс с высокой генерализацией УРС [12]. Результаты настоящей работы, во-первых, подтверждают это предположение, демонстрируя, что в мПК во время выработки УРС не только эндогенные, но и экзогенные нитрергические сигналы уменьшают генерализацию УРС. Во-вторых, они демонстрируют, что одним из механизмов NO-зависимого сдерживания генерализации страха могут быть тормозные влияния NO на серотониновую систему мПК в ходе формирования страха.
Следует подчеркнуть, что показанные в работе отсроченные эффекты DEA NONO на замирание животных при предъявлении безопасного CS– не являются следствием влияния этого препарата на чувствительность к болевому раздражению во время обучения (рис. 5в) и на способность замирать на этапе тестирования, поскольку они не наблюдались у тех же крыс при предъявлении (рис. 5а) и ожидании (рис. 5б) потенциально опасного CS+. Маловероятно, что они вызваны неспецифическими изменениями подвижности животных, поскольку мы не обнаружили влияние этого препарата на двигательную активность в закрытых (безопасных) рукавах приподнятого крестообразного лабиринта (рис. 3б, в). При этом введение DEA NONO в мПК во время выработки УРС увеличивало через сутки горизонтальную и вертикальную активность (но не длительность пребывания) в открытых рукавах крестообразного лабиринта (рис. 3), т.е. усиливало исследовательское поведение, дающее потенциальные конкурентные преимущества, без увеличения степени риска (время в тревожном окружении). Такие результаты, совместно с данными о селективном торможении генерализации УРС у крыс, ранее подвергавшихся введению DEA NONO, позволяют говорить об оптимизирующем действии длительной нитрергической стимуляции мПК в ходе формирования страха на эти формы поведения.
Важно отметить, что в наших экспериментах введения DEA NONO проводили за сутки до тестирования на проявления тревожности (крестообразный лабиринт) и страха (CS+/CS– тесты). Вместе с тем, по данным литературы и нашим прежним результатам, полученным при введении фармакологических препаратов во время тестирования, нитрегические сигналы мПК оказывают анксиогенное действие, усиливая проявления тревожности [24] и страха обстановки [25, 26]. То есть поведенческие эффекты стимуляции или блокады нитрергической системы мПК, видимо, зависят от того, когда произведено фармакологическое воздействие – в ходе стресса, порождающего страх, или позже, когда память о пережитом стрессе уже сформирована и консолидирована.
ЗАКЛЮЧЕНИЕ
В работе показаны ранее неизвестные данные, что при формировании условной реакции страха нитрергическая система мПК может тормозить функциональную активацию ее серотониновой системы. Причем такое NO-зависимое торможение сопровождается селективным снижением генерализации формирующегося страха, проявляющимся в уменьшении замирания животных (показатель страха) на безопасные дифференцировочные сигналы, но не на опасные условные сигналы. Данные впервые свидетельствуют, что NO-серотониновое взаимодействие в мПК может служить механизмом, обеспечивающим координированное участие в контроле генерализации страха нитрергической и серотонинергической систем мПК, разнонаправленно регулирующих этот процесс.
Список литературы
Arnsten A.F., Raskind M.A., Taylor F.B., Connor D.F. // Neurobiol. Stress. 2015. V. 1. P. 89–99.
Rozeske R.R., Valerio S., Chaudun F., Herry C. // Genes Brain Behav. 2015. V. 14. № 1. P. 22–36.
Саульская Н.Б. // Успехи физиол. наук. 2018. Т. 49. № 4. С. 12–29.
Xu W., Sudhof T.C. // Science. 2013. V. 339. № 6125. P. 1290–1295.
Rozeske R.R., Jercog D., Karalis N., Chaudun F., Khoder S., Girard D., Winke N., Herry C. // Neuron. 2018. V. 97. № 4. P. 898–910.
Kaczkurkin A.N., Burton P.C., Chazin S.M., Manbeck A.B., Espenses-Sturges T., Cooper S.E., Sponheim S.R., Lissek S. // Am. J. Psychiatry. 2017. V. 174. № 2. P. 125–134.
Vieira P.A., Corches A., Lovelace J.W., Westbrook K.B., Mendoza M., Korzus E. // Neurobiol. Learn. Mem. 2015. V. 119. P. 52–62.
Bayer H., Bertoglio L.J. // Sci. Report. 2020. V. 10. Art. 15827.
Саульская Н.Б., Марчук О.Э. // Росс. физиол. журн. 2018. Т. 104. № 4. С. 466–476.
Саульская Н.Б., Марчук О.Э. // Журн. высш. нерв. деят. 2019. Т. 69. № 3. С. 342–352.
Саульская Н.Б., Марчук О.Э. // Росс. физиол. журн. 2020. Т. 106. № 12. С. 1541–1552.
Саульская Н.Б., Судоргина П.В. // Журн. высш. нерв. деят. 2015. Т. 65. № 3. С. 372–381.
Ghasemi M., Claunch J., Niu K. // Progress in Neurobiology. 2019. V. 173. P. 54–97.
Zhou Q.G., Zhua X.H., Nemesb A.D., Zhu D.Y. // IBRO Reports. 2018. V. 5. P. 116–132.
Maximino C., Lima M.G., Batista E.J.O., Oliveira R.R.H.M., Herculano A.M. // Neurosci. Lett. 2015. V. 588. P. 54–56.
Chiavegatto S., Dawson V.L., Mamounasi L.A., Koliatsos V.E., Dawson T.M., Nelson R.J. // Proc. Natl. Acad. Sci. USA. 2001. V. 98. № 3. P. 1277–1281.
Pavesi E., Heldt S.A., Fletcher M.L. // Learn. Mem. 2013. V. 20. № 9. P. 482–490.
Саульская Н.Б., Марчук О.Э., Пузанова М.А., Трофимова Н.А. // Нейрохимия. 2020. Т. 37. № 4. С. 350–357.
Karolewicz B., Paul I.A., Antkiewicz-Michaluk L. // Pol. J. Pharmacol. 2001. V. 53. № 6. P. 587–596
Dunn A.J. // Neurochem. Int. 1998. V. 33. № 6. P. 551–557.
Smith J.C.E., Whitton P.S. // Neurosci. Lett. 2000. V. 291. № 1. P. 5–8.
Lu Y., Simpson K.L., Weaver K.J., Lin R.C.S. // Anat. Rec. (Hoboken). 2010. V. 293. № 11. P. 1954–1965.
Kaehler S.T., Singewald N., Sinner C., Philippu A. // Brain. Res. 1999. V. 835. № 2. P. 346–349.
Vila-Verde C., Marinho A.L., Guimaraes F.S. // Neurosci. 2016. V. 320. № 1. P. 30–42.
Resstel L.B., Correa F.M., Guimaraes F.S. // Cereb. Cortex. 2008. V. 18. № 9. P. 2027–2035.
Саульская Н.Б., Судоргина П.В. // 2016. Росс. физиол. журн. 2016. Т. 102. № 10. С. 1165–1175.
Дополнительные материалы отсутствуют.


