Нейрохимия, 2021, T. 38, № 3, стр. 228-234
Нейростероиды и депрессивные состояния
Д. А. Жуков 1, Е. П. Виноградова 2
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Биологический факультет СПбГУ
Санкт-Петербург, Россия
Поступила в редакцию 25.03.2021
После доработки 15.04.2021
Принята к публикации 16.04.2021
Аннотация
Нейростероидами называют стероиды, которые способны быстро менять возбудимость нейронов, взаимодействуя с мембранными рецепторами, преимущественно с ГАМК/А рецепторным комплексом. Нейростероиды синтезируются как в ЦНС, так и в периферических тканях, из которых попадают в мозг с системным кровотоком. Нейростероиды участвуют в регуляции эмоций и поэтому могут быть важны для формирования депрессивных состояний. Изучение нейростероидов открывает возможности новых подходов к лечению депрессивных состояний.
Механизмы формирования депрессивных расстройств, в первую очередь большой депрессии и постравматического стрессорного расстройства (ПТСР) далеки от полного понимания исследователями. Моноаминовая теория этиологии этих расстройств, увязывающая патологию с дефицитом норадреналин-, дофамин- и серотонинергических систем ЦНС, подтверждается лишь частично. К лекарственной терапии оказывается чувствительны лишь 30–50% больных [1], поэтому внимание исследователей проблемы депрессий привлекают и другие механизмы в ЦНС, в частности, нейростероиды (НС).
Стероидные гормоны синтезируются не только в периферических железах – коре надпочечников, гонадах и плаценте – но и в ЦНС. Впервые это было показано группой Э.Э. Болье в начале 1980-х годов [2, 3]. Оказалось, что НС взаимодействуют с рецепторами ГАМК типа А (ГАМК/А-рц) [4, 5], модулируя их активность подобно барбитуратам [6, 7] и бензодиазепинам [8] и проявляя анксиолитическое, седативное и противосудорожное действие [9]. Таким образом было показано, что седативный эффект системного введения прогестерона, описанный Гансом Селье еще в 1941 г. [10, 11] имеет центральный механизм.
Открытие взаимодействия НС с ГАМК/А-рц было существенным шагом в физиологии, поскольку до этого считалось, что стероиды свободно проникают в клетку и взаимодействуют с рецепторами в цитозоле, перемещаясь затем в ядро, где модулируют процесс трансляции. Такие “классические” эффекты стероидов проявляются полностью только через несколько часов после взаимодействия стероида с клетками-мишенями, а при взаимодействии с рецепторами, расположенными в клеточной мембране, гормоны могут проявлять свои эффекты спустя секунды.
БИОСИНТЕЗ НЕЙРОСТЕРОИДОВ
Основными НС млекопитающих являются следующие: прегнанолон, аллопрегнанолон (ALLO), прегненолон, дегидроэпиандростерон (DHEA), тетрагидродезоксикортикостерон (THDOC), андростерон, андростандиол (рис. 1).
Рис. 1.
Схема биосинтеза нейростероидов (по [71]). 3α-HSD – 3α-гидроксистероид дегидрогеназа, 5α-Reductase – 5α-редуктаза, 17KSR – 17-кетостероид редуктаза, P450 – цитохромы.
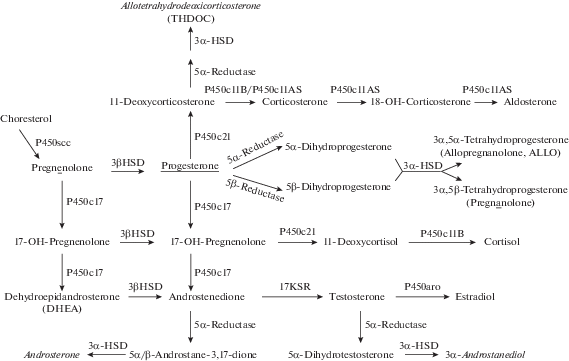
Разумеется, в ЦНС могут свободно проникать и те стероиды, которые синтезируются в периферических эндокринных железах и подвергаются дальнейшему метаболизму в печени и коже – органах с высокой активностью обоих восстановительных ферментов синтеза НС [12]. Поэтому к НС можно отнести не только те стероиды, которые синтезируются в ЦНС. С определенными оговорками можно относить к НС и прогестерон, и эстрадиол, поскольку обнаружены места связывания этих “классических” стероидных гормонов с клеточными мембранами [13–16]. Некоторые авторы называют “НС” только синтезируемые в ЦНС стероиды, а для обозначения всех мембранотропных стероидов независимо от места их синтеза используют термин “нейроактивные стероиды” [17–19]. Но в данном обзоре мы будем использовать традиционный термин “НС” в широком смысле.
Повторим, что главная особенность НС – взаимодействие с рецепторами, расположенными на клеточных мембранах, в том числе и синаптических, что обеспечивает негеномные эффекты этих гормонов, в частности, модуляцию синаптической передачи.
Места синтеза НС в ЦНС многочисленны. У грызунов и у человека это нейроны и глиальные клетки коры больших полушарий, гиппокампа, обонятельной луковицы, миндалины и таламуса, а также клетки Пуркинье мозжечка. В этих структурах локализованы ключевые ферменты биосинтеза большинства НС: 5α-редуктаза и 3α-гидроксистероид дегидрогеназа [20–26] (рис. 1). Поскольку активность 3α-гидроксистероид дегидрогеназы много выше активности 5α-редуктазы, этот последний фермент определяет скорость синтеза НС [9]. Помимо упомянутых двух ферментов, в астроцитах и нейронах экспрессируется и цитохром расщепления боковой цепи холестерина (Р450scc), превращающий холестерин в прегненолон, необходимый для синтеза всех НС [27].
Биосинтез НС контролируется белком-транслокатором (18 kDa), который раньше называли периферическим или митохондриальным бензодиазепиновым рецептором [28, 29]. Этот белок-транслокатор широко представлен в периферических тканях и в головном мозге. Он в основном расположен во внешней митохондриальной мембране и переносит холестерин во внутреннюю мембрану митохондрий [30]. Активация этого белка определенными лигандами облегчает поступление холестерина внутрь митохондрий и тем самым повышает доступность холестерина для Р450scc, фермента, расположенного во внутренней митохондриальной мембране. Селективные лиганды этого белка-транслокатора могут стимулировать биосинтез НС в головном мозге [31, 32], подтверждая важную роль белка-транслокатора в нейростероидогенезе.
Молекулы НС могут подвергаться сульфатированию. Присоединение сульфат-иона меняет фармакодинамические свойства НС [33]. Так прегнанолон – это один из модуляторов ГАМК/А-рц, тогда как прегнанолон-сульфат – модулятор НМДА рецепторов [34–37].
ОСНОВНЫЕ ФУНКЦИИ НЕЙРОСТЕРОИДОВ
НС связаны с процессами нейрогенеза, миелинизации, нейропротекции и синаптической пластичности и, соответственно, с функциями обработки информации, обучения и памяти [38–43]. НС участвуют в формировании ряда поведенческих, психических и неврологических расстройств, таких как шизофрения [44, 45], эпилепсия [46, 47], нарушения памяти, в том числе и при болезни Альцгеймера [48]. Помимо ГАМК/А-рц НС взаимодействуют с НМДА и АМПА рецепторами глутаматергической системы [34, 49, 50], но основное внимание к НС обусловлено их способностью взаимодействовать с ГАМК/А-рц и участвовать тем самым в регуляции эмоций, вовлекаясь таким образом в формирование тревожных и депрессивных состояний.
Основная причина депрессивных расстройств – стресс. НС участвуют в стрессорной реакции, в частности в регуляции активности гипофиз-адреналовой системы (ГАС). У крыс и мышей уровни ALLO и THDOC возрастают во время острого стресса [51–53] как в крови, так и в мозге [52]. У человека уровень ALLO увеличивается после введения кортикотропин-рилизинг гормона (КРГ) или АКТГ [54], а также во время стресса в эксперименте, или же после стрессогенного жизненного события [55, 56]. На животных моделях показано, что хронический стресс приводит к уменьшению концентрации ALLO в крови [57], а введение ALLO восстанавливает нормальное функционирование ГАС [58]. Предварительное введение крысам прогестерона, ALLO и THDOC уменьшает вызванный стрессом подъем АКТГ и кортикостерона в крови [59, 60]. Введение ALLO снижает экспрессию мРНК КРГ в парвентрикулярном ядре гипоталамуса и ослабляет проявления тревоги в поведении, вызванные введением КРГ [61]. Соответственно, иммуннонейтрализация ALLO увеличивает вызванный стрессом подъем кортикостерона в крови [62]. В то же время введение THDOC в паравентрикулярное ядро увеличивает стрессорный ответ [63]. На животных моделях большой депрессии и ПТСР показан сниженное содержание ALLO в миндалине, гиппокампе и медиальной префронтальной коре [64–67], структурах, связанных, как известно, с формированием эмоций.
Эти и подобные результаты свидетельствуют об участии НС в регуляции стрессорной активности ГАС как на уровне гипоталамуса, так и на уровне экстрагипоталамических структур, участвующих в организации как эндокринного, так и эмоционального компонента стрессорной реакции и, как следствие, в формировании депрессивных состояний.
НЕЙРОСТЕРОИДЫ КАК МАРКЕРЫ ДЕПРЕССИИ
Тревожные и депрессивные состояния у людей сопровождаются сниженным содержанием НС в крови и в других тканях. У пациентов с социальной фобией обнаружено сниженное содержание прегненолон-сульфата в крови [68]. DHEA-сульфат и прегненолон-сульфат снижены в крови при депрессии у ВИЧ-инфицированных пациентов [69]. Экзаменационный стресс у аспирантов сопровождается снижением концентрации ALLO в плазме крови, а также снижением рецепторного связывания бензодиазепинов форменными элементами крови [56]. У пациентов с ПТСР снижена концентрация DHEA в крови [70]. Примечательно, что, если у больных ПТСР симптомы отрицательно коррелируют с содержанием ALLO в спинномозговой жидкости, такой корреляции не обнаружено у здоровых людей, имевших в анамнезе схожие психотравмирующие события, но у которых ПТСР не развился [71]. Содержание ALLO и прегнанолона снижено у больных униполярной депрессией как в спинномозговой жидкости [72], так и в крови [73]. Эти показатели увеличивались, приближаясь к норме, после лечения антидепрессантами, ингибирующими обратный захват серотонина [74]. Посмертное исследование мозга депрессивных больных показало сниженную активность 5α-редуктазы в префронтальной коре [24] и сниженное содержание ALLO в медиальной орбитальной фронтальной коре [75].
Таким образом, содержание НС в тканях может служить дополнительным биологическим маркером большой депрессии и ПТСР [19, 76], что практически важно, поскольку субъективные жалобы таких больных характерны и для многих других психических болезней.
НЕЙРОСТЕРОИДЫ КАК ПОТЕНЦИАЛЬНЫЕ АНТИДЕПРЕССАНТЫ
На животных моделях депрессии и ПТСР неоднократно показано, что введение НС ускоряет восстановление нормального поведения животных. Так, андростандиол уменьшает проявление тревоги и улучшает память у мышей [77], препятствует возрастному нарастанию симптомов тревожности, депрессии и когнитивного дефицита у старых самцов мышей, тогда как тестостерон не имеет такого эффекта [78]. У крыс на модели депрессии, вызванной хроническим стрессом длительного опыта поражений при социальных контактах, показан анксиолитический эффект DHEA – время и количество социальных контактов у животных восстанавливаются [70]. Введение DHEA самцам крыс увеличивает устойчивость стрессорной системы, т.е. увеличивает скорость возвращения концентрации кортикостерона к базальным значениям по окончании стрессорного воздействия [70].
DHEA, вероятно, наиболее важный НС человека, поскольку в головном мозге его концентрация выше, чем в крови [79], несмотря на синтез этого стероида в гонадах и в коре надпочечников. Испытания DHEA в клинике депрессий дают основания для того, чтобы смотреть на этот НС как на перспективный антидепрессант [80]. Однако, метаанализ 14 публикаций делает такой оптимизм осторожным [81]. Таковы же результаты испытаний и ALLO для лечения большой депрессии и ПТСР [19].
Одна из причин неотчетливого терапевтического эффекта в недостаточном объеме выборок, и в том, что помимо НС и плацебо больные принимают одновременно и другие лекарственные препараты: соли лития, антидепрессанты, седативные и анксиолитические препараты, антипсихотики и стимуляторы.
Наибольший успех достигнут в лечении депрессий у женщин, возникающих при резком падении продукции прогестерона, прежде всего при послеродовой депрессии и при предменструальном синдроме (ПМС) и предменструальном дисфорическом расстройстве (ПМДР) [82, 83]. ПМДР (PMDD, premenstrual dysphoric disorder) включено в DSM-5 [84], согласно которому в предшествующие менструации дни должны проявляться пять психологических или соматических симптомов. Если же присутствует только один из них, то заболевание квалифицируется как ПМС.
Как уровень прогестерона, так и уровень его основного метаболита ALLO низок во время менструации и фолликулярной фазы менструального цикла. Вслед за прогестероном, ALLO растет в лютеиновую фазу и быстро снижается перед менструацией. Регулярное воздействие на организм такого фактора, как резкое падение уровня этих половых гормонов может быть ключевым фактором этиологии ПМДР [85, 86]. Результаты экспериментов на животных дают основания для такого предположения.
На модели ПМДР, основанной на подавлении содержания прогестерона в организме, у крыс нарушается социальное взаимодействие и развивается ангедония, что характерно для ПМДР [87]. У крыс и у мышей резкая отмена хронического введения прогестерона сопровождается увеличением тревоги и изменением функций ГАМК/А-рц [86–88]. У двух линий крыс, селектированных по поведенческому признаку, различия в тревожности соответствовали различиям в уровне прогестерона в крови как в стадию проэструса, так и диэструса [89]. У крыс снижение уровня прогестерона во время диэструса сопровождается изменением количества ГАМК/А-рц в околоводопроводном сером веществе, структуре, связанной с регуляцией эмоций [90, 91].
Есть все основания считать, что подобные феномены связаны не с самим прогестероном, а с его метаболитом ALLO [92]. Уровень тревожности у страдающих ПМС соответствует соотношению концентраций ALLO и прогестерона в крови [55]. Тяжесть симптомов ПМС отрицательно коррелирует с концентрацией ALLO, но не прогестерона [93]. Возможно, что при ПМДР нарушается взаимодействие ALLO с ГАМК/А-рц или же меняется биосинтез ALLO.
Несмотря на то, что внимание исследователей феномена ПМДР и ПМС привлечено к прогестерону и ALLO, результаты этих работ пока не дошли до клиники. Применение селективных ингибиторов обратного захвата серотонина остается “золотым стандартом” терапии ПМС и ПМДР [94].
Иначе обстоит дело с послеродовой депрессией, которая отмечается у 10–20% женщин. Поскольку многократно увеличенная во время беременности продукция прогестерона и ALLO резко падает после родов, этот гормональный сдвиг – очевидный кандидат на причину послеродовой депрессии [95]. При послеродовой депрессии содержание ALLO в крови снижено [96]. Ослабление симптомов послеродовой депрессии соотносится с изменением содержания ALLO в крови [97].
Синтетическое производное ALLO брексанолон под названием Zulresso используется для лечения послеродовой депрессии. Положительный эффект у 70% пациенток отмечен уже через 2–3 дня после начала лечения и сохраняется по крайней мере на протяжении месяца [97, 98]. Быстрый эффект брексанолона – существенное достоинство в сравнении с ингибиторами обратного захвата серотонина, проявляющими антидепрессивный эффект только после многонедельного приема. Высокая стоимость препарата не дает возможность провести широкие исследования для лечения других депрессивных расстройств [99]. Еще один недостаток брексанолона в том, что он применяется исключительно парентерально. Разработанное для перорального введения синтетическое производное ALLO – SAGE-217 – показал при клинических испытаниях тоже быстрый, но умеренный позитивный эффект у депрессивных больных [100, 101].
ЗАКЛЮЧЕНИЕ
Много не до конца ясного еще остается в вопросах о роли НС в патогенезе депрессивных расстройств, о механизмах регуляции биосинтеза НС в ЦНС и об удельной роли НС, синтезируемых в ЦНС, и поступающих в мозг с системным кровотоком. Укажем на некоторые интересные экспериментальные факты, требующие изучения и разъяснения.
Если проявление ПМДР однозначно связано с резким снижением концентрации прогестерона и, соответственно, ALLO, то каковы причины исчезновения симптомов ПМДР при наступлении менструации? Продукция прогестерона остается такой же низкой, как и, вероятно, концентрация ALLO, но аффект быстро нормализуется. Происходит ли сенситизация ГАМК/А-рц, активируются ли ГАМК-ергическая система другими механизмами, или же анксиолитический эффект при наступлении менструации связан с активацией других систем (эндогенных опиатов, эндоканнабиноидов, эндованиллоидов)?
Хорошо известно, что симптомы ПМДР усиливаются при избытке соли в диете [102]. Скорее всего это связано с торможением синтеза минералкортикоида дезоксикортикостерона, метаболит которого THDOC позитивно модулирует ГАМК/А-рц. Непонятно, этот эффект связан с изменением синтеза минералкортикоидов в коре надпочечников или же концентрация ионов натрия также влияет на синтез THDOC в ЦНС?
Острый стресс вызывает рост концентрации ALLO в крови [55, 56, 103, 104], но у женщин с ПМДР такой подъем ALLO не наблюдается [55]. Каковы механизмы этого феномена? Вероятно, это обусловлено нарушением биосинтеза ALLO, но каким именно? Известна различная активность двух ключевых ферментов биосинтеза НС у мужчин и у женщин. При ПТСР у женщин снижается активность 3α-гидроксистероид дегидрогеназы, а у мужчин – 5α-редуктазы [71, 105, 106]. Обусловлено ли это разным актуальным гормональным фоном или же это одно из врожденных половых различий?
С половыми различиями стрессорной реакции связывают DHEA-сульфат, введение которого кастрированным самцам восстанавливает у них мужской тип стрессорной реакции, т.е. быстрое возвращение кортикостерона к норме, тогда как тестостерон такого эффекта не оказывает [70]. Между тем, содержание DHEA у мужчин и у женщин примерно одинаковое [107]. Связан ли DHEA и у человека с половыми различиями стрессорной реакции и большей подверженности женщин депрессивным расстройствам?
В заключение обзора напомним, что механизмы действия НС не сводятся только к модуляции ГАМК/А-рц [15]. С другой стороны, в формировании депрессивных состояний важна роль и других веществ стероидной природы, в частности, витамина D [108]. Исследователям важно помнить, что болезни как нозологические категории, несмотря на схожую клиническую картину, могут иметь в своей основе различные нейрохимические механизмы.
Список литературы
Chávez-Castillo M., Núñez V., Nava M., Ortega Á., Rojas M., Bermúdez V., Rojas-Quintero J. // Adv. Pharmacol. Sci. 2019. 2019:7943481.
Corpéchot C., Robel P., Axelson M., Sjövall J., Baulieu E.E. //.Proc. Natl. Acad. Sci. USA. 1981. V. 78. P. 4704–4707.
Corpéchot C., Synguelakis M., Talha S., Axelson M., Sjövall J., Vihko R., Baulieu EE., Robel P. // Brain Res. 1983. V. 270. P. 119–25.
Majewska M.D., Harrison N.L., Schwartz R.D., Barker J.L., Paul S.M. // Science. 1986. V. 232. P. 1004–1007.
Majewska M.D., Schwartz R.D. // Brain Res. 1987. V. 404. P. 355–360.
Harrison N.L., Vicini S., Barker J.L. // J. Neurosci. 1987. V. 7. P. 604–609.
Peters J.A., Kirkness E.F., Callachan H., Lambert J.J., Turner A.J. // Br. J. Pharmacol. 1988. V. 94. P. 1257–1269.
Choi D.W., Farb D.H., Fischbach G.D. // Nature. 1977. V. 269. P. 342–344.
Reddy D.S. // Prog. Brain Res. 2010. V. 186. P. 113–137.
Selye H. // Proc. Soc. Exp. Biol. Med. 1941a. V. 46. P. 116–121.
Selye H. // J. Pharmacol. Exp. Ther. 1941b. 73. P. 127–141.
Do Rego J.L., Seong J.Y., Burel D., Leprince J., Luu-The V., Tsutsui K., Tonon M.C., Pelletier G., Vaudry H. // Front. Neuroendocrinol. 2009. V. 30. P. 259–301.
Rudolph L.M., Cornil C.A., Mittelman-Smith M.A., Rainville J.R., Remage-Healey L., Sinchak K., Micevych P.E. // J. Neurosci. 2016. V. 36. P. 11449–11458.
Balthazart J., Choleris E., Remage-Healey L. // Horm. Behav. 2018. V. 99. P. 1–8.
González-Orozco J.C., Camacho-Arroyo I. // Front. Neurosci. 2019. V. 13. P. 503.
Zhang M., Weiland H., Schöfbänker M., Zhang W. // Int. J. Mol. Sci. 2021. V. 22. P. 1485.
Baulieu E.E., Robel P. // J. Steroid. Biochem. Mol. Biol. 1990. V. 37. P. 395–403.
Paul S.M., Purdy R.H. // FASEB J. 1992. V. 6. P. 2311–2322.
Maguire J. // Front. Cell Neurosci. 2019. V. 13. P. 83.
Griffin L.D., Mellon S.H. // Proc. Natl. Acad. Sci. USA. 1999. V. 96. P. 13512–13517.
Penning T.M., Jin Y., Heredia V.V., Lewis M. // J. Steroid Biochem. Mol. Biol. 2003. V. 85. P. 247–255.
Agís-Balboa R.C., Pinna G., Zhubi A., Maloku E., Veldic M., Costa E., Guidotti A. // Proc. Natl. Acad. Sci. USA. 2006. V. 103. P. 14602–14607.
Agís-Balboa R.C., Pinna G., Costa E., Guidotti A. // PNAS. 2007. V. 104. P. 18736–18741.
Agis-Balboa R.C., Guidotti A., Pinna G. // Psychopharmacology (Berl). 2014. V. 231. P. 3569–3580.
Pinna G., Agis-Balboa R., Pibiri F., Nelson M., Guidotti A., Costa E. // Neurochem. Res. 2008. V. 33. P. 1990–2007.
Pibiri F., Nelson M., Costa E., Guidotti A., Pinna G. // PNAS. 2008. V. 105. P. 5567–5572.
Patte-Mensah C., Kappes V., Freund-Mercier M.J., Tsutsui K., Mensah-Nyagan A.G. // J. Neurochem. 2003. V. 86. P. 1233–1246.
Costa E., Guidotti A. // Life Sci. 1991. V. 49. P. 325–344.
Korneyev A., Pan B.S., Polo A., Romeo E., Guidotti A., Costa E. // J Neurochem. 1993. V. 61. P. 1515–1524.
Papadopoulos V., Baraldi M., Guilarte T.R., Knudsen T.B., Lacapère J.J., Lindemann P., Norenberg M.D., Nutt D., Weizman A., Zhang M.R., Gavish M. // Trends Pharmacol. Sci. 2006. V. 27. P. 402–409.
Auta J., Romeo E., Kozikowski A., Ma D., Costa E., Guidotti A. // J. Pharmacol. Exp. Ther. 1993. V. 265. P. 649–656.
Rupprecht R., Rammes G., Eser D., Baghai T.C., Schüle C., Nothdurfter C., Troxler T., Gentsch C., Kalkman H.O., Chaperon F., Uzunov V., McAllister K.H., Bertaina-Anglade V., La Rochelle C.D., Tuerck D., Floesser A., Kiese B., Schumacher M., Landgraf R., Holsboer F., Kucher K. // Science. 2009. V. 325. P. 490–493. Erratum in: Science. 2009. V. 325. P. 1072.
Mueller J.W., Gilligan L.C., Idkowiak J., Arlt W., Foster P.A. // Endocr. Rev. 2015. V. 36. P. 526–563.
Wu F.S., Gibbs T.T., Farb D.H. // Mol. Pharmacol. 1991. V.40. P. 333–336.
Bowlby M.R. // Mol. Pharmacol. 1993. V. 43. P. 813–9.
Park-Chung M., Wu F.S., Purdy R.H., Malayev A.A., Gibbs T.T., Farb D.H. // Mol. Pharmacol. 1997. V. 52. P. 1113–1123.
Vyklicky V., Smejkalova T., Krausova B., Balik A., Korinek M., Borovska J., Horak M., Chvojkova M., Kleteckova L., Vales K., Cerny J., Nekardova M., Chodounska H., Kudova E., Vyklicky L. // J. Neurosci. 2016. V. 36. P. 2161–2175.
Flood J.F., Morley J.E., Roberts E. // Proc. Natl. Acad. Sci. USA. 1995. V. 92. P. 10806–10810.
Smith C.C., Martin S.C., Sugunan K., Russek S.J., Gibbs T.T., Farb D.H. // Mol Pharmacol. 2014a. V. 86. P. 390–398.
Smith C.C., Gibbs T.T., Farb D.H. // Psychopharmacology (Berl). 2014b. V. 231. P. 3537–3556.
Scullin C.S., Partridge L.D. // Hippocampus. 2012. V. 22. P. 2184–2198.
Reddy D.S., Gangisetty O., Wu X. // Brain Res. 2017. V. 1659. P. 142–147.
Schüle C., Nothdurfter C., Rupprecht R. // Prog. Neurobiol. 2014. V. 113. P. 79–87.
Marx C.E., Lee J., Subramaniam M., Rapisarda A., Bautista D.C., Chan E., Kilts J.D., Buchanan R.W., Wai E.P., Verma S., Sim K., Hariram J., Jacob R., Keefe R.S., Chong S.A. // Psychopharmacology (Berl). 2014. V. 231. P. 3647–3662.
Kreinin A., Bawakny N., Ritsner M.S. // Clin. Schizophr. Relat. Psychoses. 2017. V. 10. P. 201–210.
Herzog A.G. // Neurology. 1986. V. 36. P. 1607–1610.
Reddy D.S. // Horm Behav. 2013. V. 63. P. 254–266.
Ratner M.H., Kumaresan V., Farb D.H. // Front. Endocrinol. 2019. V. 10:169.
Wu F.S., Gibbs T.T., Farb D.H. // Mol. Pharmacol. 1990. V. 37. P. 597–602.
Borowicz K.K., Piskorska B., Banach M., Czuczwar S.J. // Front. Endocrinol. (Lausanne). 2011. V. 2:50.
Purdy R.H., Morrow A.L., Moore P.H., Paul, S.M. // Proc. Natl. Acad. Sci. USA. 1991. V. 88. P. 4553–4557.
Barbaccia M.L., Serra M., Purdy R.H., Biggio G. // Neuroster. Brain Funct. 2001. V. 46. P. 243–272.
Akk G., Covey D.F., Evers A.S., Steinbach J.H., Zorumski C.F., Mennerick S. // Pharmacol. Ther. 2007. V. 116. P. 35–57.
Genazzani A.R., Petraglia F., Bernardi F., Casarosa E., Salvestroni C., Tonetti A., Nappi R.E., Luisi S., Palumbo M., Purdy R.H., Luisi M. // J. Clin. Endocrinol. Metab. 1998. V. 83. P. 2099–2103.
Girdler S.S., Straneva P.A., Light K.C., Pedersen C.A., Morrow A.L. // Biol. Psychiatry. 2001. V. 49. P. 788–797.
Droogleever Fortuyn H.A., van Broekhoven F., Span P.N., Bäckström T., Zitman F.G., Verkes R.J. // Psychoneuroendocrinology. 2004. V. P. 1341–1344.
Serra M., Sanna E., Mostallino M.C., Biggio G. // Eur. Neuropsychopharmacol. 2007. V. 17. P. 1–11.
Evans J., Sun Y., McGregor A., Connor B. // Neuropharmacology. 2012. V. 63. P. 1315–1326.
Owens M.J., Ritchie J C., Nemeroff, C.B. // Brain Res. 1992. V. 573. P. 353–355.
Patchev V.K., Hassan A.H., Holsboer D.F., Almeida O.F. // Neuropsychopharmacology. 1996. V. 15. P. 533–540.
Patchev V.K., Shoaib M., Holsboer F., Almeida O.F. // Neuroscience. 1994. V. 62. P. 265–271.
Guo A.L., Petraglia F., Criscuolo M., Ficarra G., Nappi R.E., Palumbo M.A., Trentini G.P., Purdy R.H., Genazzani A.R. // Gynecol. Endocrinol. 1995. V. 9. P. 1–7.
Sarkar J., Wakefield S., Mackenzie G., Moss S.J., Maguire, J. // J. Neurosci. 2011. V. 31. P. 18198–18210.
Nelson M., Pinna G. // Neuropharmacology. 2011. V. 60. P. 1154–1159.
Almeida F.B., Nin M.S., Barros H.M.T. // Neurobiol. Stress. 2020. V. 12:100218.
Locci A., Pinna G. // Br. J. Pharmacol. 2017. V. 174. P. 3226–3241.
Pinna G. // Front. Behav. Neurosci. 2019. V. 13. P. 114.
Heydari B., Le Mellédo J.M. // Psychol. Med. 2002. V. 32. P. 929–933.
Mukerji S.S., Misra V., Lorenz D.R., Chettimada S., Keller K., Letendre S., Ellis R.J., Morgello S., Parker R.A., Gabuzda D. // J. Infect. Dis. 2020. Mar 10:jiaa104.
Обут Т.А., Сарыг С.К., Эрдыниева Т.А., Обут Е.Т. Интегративная роль дегидроэпиандростерон-сульфата в межэндокринной регуляции. Новосибирск: Омега Принт, 2010. 122 с.
Rasmusson A.M., King M.W., Valovski I., Gregor K., Scioli-Salter E., Pineles S.L., Hamouda M., Nillni Y.I., Anderson G.M., Pinna G. // Psychoneuroendocrinology. 2019. V. 102. P. 95–104.
Uzunova V., Sheline Y., Davis J.M., Rasmusson A., Uzunov D.P., Costa E., Guidotti A // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 3239–3244.
Schüle C., Romeo E., Uzunov D.P., Eser D., di Michele F., Baghai T.C., Pasini A., Schwarz M., Kempter H., Rupprecht R. // Mol. Psychiatry. 2006. V. 11. P. 261–272.
Romeo E., Ströhle A., Spalletta G., di Michele F., Hermann B., Holsboer F., Pasini A., Rupprecht R. // Am. J. Psychiatry. 1998. V. 155. P. 910–913.
Cruz D.A., Glantz L.A., McGaughey K.D., Parke G., Shampine L.J., Kilts J.D., Naylor J.C., Marx C.E., Williamson D.E. // Chronic Stress (Thousand Oaks). 2019. V. 3: 2470547019838570.
Almeida F.B., Barros H.M.T., Pinna G. // Int. J. Mol. Sci. 2021. V. 22. P. 1758.
Osborne D.M., Edinger K., Frye C.A. // Age (Dordr). 2009. V. 31. P. 119–126.
Frye C.A., Edinger K.L., Lephart E.D., Walf A.A. // Front. Aging Neurosci. 2010. V. 2. P. 15.
Maninger N., Wolkowitz O.M., Reus V.I., Epel E.S., Mellon S.H. // Front. Neuroendocrinol. 2009. V. 30. P. 65–91.
Peixoto C., Grande A.J., Mallmann M.B., Nardi A.E., Cardoso A., Veras A.B. // CNS Neurol. Disord. Drug Targets. 2018. V. 17. P. 706–711.
Peixoto C., José Grande A., Gomes Carrilho C., Nardi A.E., Cardoso A., Barciela Veras A. // J. Neurosci. Res. 2020. V. 98. P. 2510–2528.
Peltier M.R., Verplaetse T.L., Mineur Y.S., Gueorguieva R., Petrakis I., Cosgrove K.P., Picciotto M.R., McKee S.A. // Neuropharmacology. 2021. V. 187:108499.
Schweizer-Schubert S., Gordon J.L., Eisenlohr-Moul T.A., Meltzer-Brody S., Schmalenberger K.M., Slopien R., Zietlow A.L., Ehlert U., Ditzen B. // Front. Med. (Lausanne). 2021. V. 7:479646.
Epperson C.N., Steiner M., Hartlage S.A., Eriksson E., Schmidt P.J., Jones I., Yonkers K.A. // Am. J. Psychiatry. 2012. V. 169. P. 465–475.
Жуков Д.А. Биологичекие основы поведения. Гуморальные механизмы. С.-Пб, Издательство Р. Асланова “Юридический центр Пресс”, 2004. 453 с. ISBN 5-94201-325-X
Smith S.S., Ruderman Y., Frye C., Homanics G., Yuan M. // Psychopharmacology (Berl). 2006. V. 186. P. 323–333.
Li Y., Pehrson A.L., Budac D.P., Sánchez C., Gulinello M. // Behav. Brain Res. 2012. V. 234. P. 238–247.
Schneider T., Popik P. // Curr. Protoc. Neurosci. 2009. Chapter 9:Unit 9.31.
Zhukov D.A., Arutunan N.A., Vinogradova E.P. // Integrative Physiology. 2020. V. 1. P. 155–159.
Griffiths J.L., Lovick T.A. // Neuroscience. 2005. V. 136. P. 457–466.
Lovick T.A. // Exp. Physiol. 2006. V. 91. P. 655–660.
Bäckström T., Haage D., Löfgren M., Johansson I.M., Strömberg J., Nyberg S., Andréen L., Ossewaarde L., van Wingen G.A., Turkmen S., Bengtsson S.K.// Neuroscience. 2011. V. 191. P. 46–54.
Dichtel L.E., Lawson E.A., Schorr M., Meenaghan E., Paskal M.L., Eddy K.T., Pinna G., Nelson M., Rasmusson A.M., Klibanski A., Miller K.K. // Neuropsychopharmacology. 2018. V. 43. P. 1436–1444.
Hantsoo L., Epperson C.N. // Curr. Psychiatry Rep. 2015. V. 17. P. 87.
Zorumski C.F., Paul S.M., Covey D.F., Mennerick S. // Neurobiol. Stress. 2019. V. 11:100196.
Nappi R.E., Petraglia F., Luisi S., Polatti F., Farina C., Genazzani A.R. // Obstet. Gynecol. 2001. V. 97. P. 77–80.
Kanes S., Colquhoun H., Gunduz-Bruce H., Raines S., Arnold R., Schacterle A., Doherty J., Epperson C.N., Deligiannidis K.M., Riesenberg R., Hoffmann E., Rubinow D., Jonas J., Paul S., Meltzer-Brody S. // Lancet. 2017. V. 390. P. 480–489.
Meltzer-Brody S., Colquhoun H., Kanes S. // Lancet. 2018. V. 392. P. 1058–1070.
Faden J., Citrome L. // Ther. Adv. Psychopharmacol. 2020. V. 10:2045125320968658.
National Library of Medicine, Bethesda, MD, USA, 2018, http://clinicaltrials. gov/show/NCT03000530.
Gunduz-Bruce H., Silber C., Paul S.M., Kanes S.J. // N. Engl. J. Med. 2019. P. 381. P. 903–911.
Aguilar-Aguilar E. // Nutr. Hosp. 2021. V. 37. P. 52–56. Spanish.
Klatzkin R.R., Morrow A.L., Light K.C., Pedersen C.A., Girdler S.S. // Psychoneuroendocrinology. 2006. V. 31. P. 1208–1219.
Crowley S.K., Girdler S.S. // Psychopharmacology (Berl). 2014. V. 231. P. 3619–3634.
Pineles S.L., Nillni Y.I., Pinna G, Webb A., Arditte Hall K.A., Fonda J.R., Irvine J., King M.W., Hauger R.L., Resick P.A., Orr S.P., Rasmusson A.M. // Neurobiol. Stress. 2020. V. 13:100225.
Pinna G.// Front. Endocrinol. (Lausanne). 2020. V. 11. P.236. Erratum in: Front. Endocrinol. (Lausanne). 2020. V. 11. P. 507.
Hester J., Ventetuolo C., Lahm T. // Compr. Physiol. 2019. V. 10. P. 125–170.
Berridge M.J. // Pharmacol. Rev. 2017. V. 69. P. 80–92.
Дополнительные материалы отсутствуют.


