Нейрохимия, 2022, T. 39, № 1, стр. 70-79
Фармакологическая модуляция эндогенной нейропротекции после экспериментальной пренатальной гипоксии
И. Ф. Беленичев 1, Е. Г. Алиева 1, А. М. Камышный 2, Н. В. Бухтиярова 1, В. П. Рыженко 1, Н. О. Горчакова 3
1 Запорожский государственный медицинский университет
Запорожье, Украина
2 Тернопольский государственный медицинский университет
Тернополь, Украина
3 Национальный медицинский университет им. А.А. Богомольца
Киев, Украина
Поступила в редакцию 30.06.2021
После доработки 31.08.2021
Принята к публикации 02.09.2021
- EDN: PYOSOS
- DOI: 10.31857/S1027813322010046
Аннотация
Пренатальная гипоксия (ПГ) вызывает патологические изменения в головном мозге и может привести к необратимым долгосрочным нарушениям его развития и возникновению психоневрологических патологий у детей. Фармакологическая коррекция постгипоксических нарушений ЦНС является приоритетной проблемой современной медицины. Целью настоящего исследования явилось изучение нейропротективного действия ангиолина, тиотриазолина, тамоксифена, глуторедоксина, цереброкурина, антагониста IL-1b (РАИЛ), мексидола и L-аргинина в сравнении с референс-препаратом пирацетамом по их влиянию на экспрессию факторов эндогенной нейропротекции для дальнейшего обоснования применения их в лечении пренатального поражения ЦНС в модели хронической гемической ПГ. Методами ПЦР в реальном времени и иммуноферментного анализа были изучены экспрессия мРНК HSP70, HIF-1, c-fos и содержание HSP70 в цитоплазматической и митохондриальной фракциях головного мозга крысят на 60е сут жизни, перенесших ПГ. Установлено, что хроническая ПГ приводит к угнетению транскрипционных процессов в нейронах и подавлению синтеза HIF1a, HSP70 и c-fos. Изучаемые препараты способны модулировать HSP70-опосредованные механизмы эндогенной нейропротекции. Наиболее активными среди модуляторов HSP70 в условиях хронической ПГ являются цереброкурин (150 мкл/кг) и ангиолин (50 мг/кг), которые превосходят другие исследуемые препараты по уровню повышения экспрессии мРНК HSP70, мРНК HIF-1α и концентрации белка HSP70 в головном мозге экспериментальных животных и могут рассматриваться в качестве перспективных нейропротективных средств в комплексной терапии после ПГ.
ВВЕДЕНИЕ
Гипоксические повреждения головного мозга занимают ведущее место в структуре перинатальной патологии нервной системы у новорожденных детей, и, несмотря на интенсивность исследований, актуальность данной проблемы не снижается, так как патогенез и этиология остаются во многом неясны, а лечение требует разработки новых лекарственных препаратов [1]. Пренатальная гипоксия (ПГ) и асфиксия являются основными причинами перинатальной смертности, составляя от 20 до 50% в ее структуре [2]. Развивающийся мозг новорожденного чрезвычайно чувствителен к воздействию гипоксии, которая не только вызывает очаговые повреждения мозговой ткани, но и тормозит ангиогенез, нарушает клеточную дифференцировку [3]. Новорожденные, перенесшие ПГ, отличаются различными клинико-метаболическими, иммунологическими, гормональными расстройствами адаптации к внеутробной жизни, высокой частотой инфекционных заболеваний, психоневрологических нарушений и существенных отклонений развития в последующие годы жизни [2, 4]. Существенный прорыв в изучении молекулярных механизмов функционирования мозга в условиях нормы и патологии осуществлен лишь в последний годы, благодаря успехам молекулярной биологии, нейрохимии и фундаментальной фармакологии [5]. Гипоксическое повреждение ЦНС плода происходит вследствие снижения парциального давления кислорода за счет ухудшения маточного кровообращения, плацентарной недостаточности и при заболеваниях плода [5, 6]. Различают механизмы нейродеструкции в период острой ПГ – трансмиттерный аутокоидоз, глутамат-кальциевый каскад, нарушение нитроксидергической системы, энергодефицит, а также в постгипоксический период, который значительно пролонгирован во времени – оксидативный стресс, вторичная митохондриальная дисфункция, нейроапоптоз, нейровоспаление, дефицит нейротрофических и цитопротективных факторов [2, 5, 7]. Эволюцией предусмотрены компенсаторно-приспособительные механизмы системы мать–плацента–плод, повышающие устойчивость ЦНС плода – активация компенсаторных энергетических шунтов, экспрессия факторов эндогенной цитопротекции, генов ответственных за синтез антиоксидатных ферментов, а также факторов регуляции гемоциркуляции [4]. Работами первых десятилетий XXI в. показана роль белков теплового шока (HSP) и фактора индуцированного гипоксией HIF-1 в реализации механизмов эндогенной нейропротекции при гипоксическом поражении мозга [7–10]. В настоящее время с целью нейропротекции после ПГ применяются ноотропы, антигипоксанты, вазоактивные средства [11–19]. Однако их действие не удовлетворяет требованиям клиники. В этой связи, а также основываясь на многочисленных работах сотрудников кафедры фармакологии и медицинской рецептуры Запорожского государственного медицинского университета (ЗГМУ), перспективным направлением нейропротекции после ПГ можно обозначить применение средств, активирующих HSP70 – зависимые механизмы эндогенной нейропротекции. В этом отношении интерес представляют такие лекарственные препараты, как ангиолин, тиотриазолин, тамоксифен, глуторедоксин, цереброкурин, РАИЛ, которые показали свою способность в регуляции экспрессии HSP70 в условиях моделирования ишемии головного мозга, миокарда, хронической алкоголизации [7, 11–16]. Также интересным представилось оценить HSP70 –механизм нейропротективного действия и таких препаратов, как L-аргинин, мексидол и пирацетам, обладающих различными механизмами цитопротективного и противоишемического действия [17–19].
Цель исследования – оценить влияние ангиолина, тиотриазолина, тамоксифена, глуторедоксина, цереброкурина, РАИЛ, мексидола, L-аргинина и референсного препарата пирацетама на экспрессию факторов эндогенной нейропротекци и экспериментально обосновать перспективность дальнейшего изучение средств – модуляторов этой системы в качестве компонентов комплексного лечения пренатального гипоксического поражения ЦНС.
МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика лабораторных животных и экспериментальной модели ПГ. Опыты проведены на 50 аутбредных белых нелинейных самках и 10 самцах крыс, массой 220–240 г. в возрасте 4.5 мес., полученных из питомника ГУ “Институт фармакологии и токсикологии АМН Украины”. Крысы содержались в стандартных условиях вивария: температура – 20–25°С, относительная влажность – 50–55%, естественное освещение, рацион, рекомендуемый для этого вида лабораторных животных, питьевой режим “ad libitum”. Экспериментальную часть исследования выполняли в строгом соответствии с национальными “Совместными этическими принципами экспериментов на животных” (Украина, 2001), согласованными с положением Совета 2010/63EU Европейского парламента и Совета от 22 сентября 2010 г. по защите животных, используемых в научных целях, (Council Directive 2010/63EU of the European Parlament and of the Councilof 22 September 2010 on the protection of animals used for scientific purposes). В работе использовали модель хронической гемической нитрит-индуцированной ПГ [20, 21]. Для фиксированной беременности виргинным самкам подсаживали половозрелых самцов из расчета два самца на четыре самки. Отсчет срока беременности крыс осуществляли с момента обнаружения сперматозоидов во влагалищном мазке (1-й день беременности). Моделирование гемической гипоксии осуществляли в пренатальном периоде развития путем введения внутрибрюшинно беременным самкам крыс раствора нитрита натрия ежедневно с 16-го по 21-й день беременности в дозе 50 мг/кг (доза, вызывающая гипоксию средней тяжести) [20]. Для контроля беременным самкам вводили физиологический раствор в том же режиме. Потомство было разделено на группы: I – здоровые животные, полученные от самок с нормальной физиологической беременностью, которым вводили физиологический раствор; II- контрольная группа крысят, после моделирования ПГ, которым ежедневно вводили физиологический раствор; III–XI группы потомства крыс после моделирования ПГ, которым ежедневно с 1-го по 30 день жизни вводили лекарственные препараты.
Обоснование выбора лекарственных препаратов и их характеристики. Нами были выбраны лекарственные препараты с экспериментально доказанной способностью модулировать экспрессию HSP70:
1. Тиотриазолин (морофолиний 3-метил-1,2,4-триазолил-5-тиоуксусной кислоты) (2.5% раствор для инъекций, “Артериум”, Украина), метаболитотропный кардиопротектор и антиоксидант. Имеются данные, что препарат увеличивает экспрессию HSP70 в миокарде при ишемии, хронической сердечной недостаточности и алкогольном поражении сердца [11].
2. Тамоксифен (таблетки, Финляндия, на их основе экстемпорально приготовлен интраназальный гель (1 мг/1 мл) на кафедре технологи лекарственных средств ЗГМУ) в низких дозах – агонист β эстрогеновых рецепторов (β-ER). Способен повышать концентрацию HSP70 в митохондриях и цитозоле головного мозга и миокарда при острой ишемии за счет регуляции механизмов, в которые вовлечены активные формы кислорода и восстановленный глутатион (АФК/GSH-зависимые механизмы) [12].
3. Ангиолин ([(S)-2,6–диаминогексановой кислоты 3-метил-1,2,4-триазолил-5-тиоацетат) (субстанция, НПО “Фарматрон”, Украина), противоишемическое, эндотелиопротективное средство. Повышает экспрессию HSP70 в митохондриях и цитозоле головного мозга и миокарда при острой и хронической ишемии, алкогольной болезни. Также в ответ на ишемию нормализует экспрессию гена раннего реагирования (c-fos) и васкулоэндотелиального фактора роста (VEGF) [13].
4. Глуторедоксин (Сигма–Олдридж, США). Полученные ранее данные свидетельствуют, что глуторедоксин влияет на GSH-зависимые механизмы экспрессии HSP70 в митохондриях и цитозоле головного мозга при острой церебральной ишемии [14].
5. Цереброкурин (раствор для инъекций, НПО “НИР”, Украина). Цереброкурин содержит нейропептиды, белки S-100, рилин, фактор роста нервов (NGF) (не менее 2 мг/мл) и аминокислоты. Проявляет выраженное нейропротективное действие, повышает пластичность нейронов, стимулирует экспрессию транскрипционных факторов, а также защитных белков, в том числе HSP [15].
Также в качестве перспективных средств нейропротекции изучались:
6. РАИЛ – селективный антагонист IL-1b (субстанция предоставлена Федеральным государственным унитарным предприятием “Государственный научно-исследовательский институт особо чистых биологических препаратов” (Россия, Санкт-Петербург, ЛСР-007452/1-0300710). Субстанция получена биотехнологически из E. coli TG1(pTAC-hlL-1ra), в своей структуре содержит 153 фрагментов аминокислот. Молекулярная масса 17, 906 кДа. Интраназальный РАИЛ-гель (5 мг/1 мл) разработан на кафедре технологии лекарственных средств ЗГМУ). РАИЛ прерывает IL-b – зависимые каскадные механизмы ишемической нейродеструкции [16]. Имеются данные, что РАИЛ нормализует глутатион (GSH)-зависимые механизмы экспрессии HSP70 в митохондриях и цитозоле головного мозга при острой ишемии [22].
7. L-аргинин (42% раствор для инъекций во флаконе, Тивортин, Юрия-фарм, Украина) – прекурсор NO, снижает нарушения в нитроксидергической системе при ишемии, проявляет эндотелиотропное, антиоксидатное действие [17].
8. Мексидол (2-этил-6-метил-3-гидроксипирида сукцинат, раствор для инъекций, 50 мг/мл, НПК “Фармасофт”, “Эллара”, Россия. Антиоксидант с нейропротективными свойствами. Тормозит механизмы ишемической нейродеструкции, в которых неросредственное участие принимают активные формы кислорода (АФК – зависимые механизмы) [18].
9. В качестве референс-препарата был отобран пирацетам (200 мг/мл, АТ “Фармак”, Украина). Пирацетам – ноотропное средство с выраженным противоишемическим действием [19]. Выбор пирацетама в качестве референсного препарата обусловлен тем, что доклиническими исследованиями достаточно полно изучен молекулярно-биохимический механизм ноотропного, нейропротективного и противоишемического действия данного лекарственного средства, имеется доказательная база его клинической эффективности [2, 7]. Пирацетам включен в протоколы ведения больных с острыми нарушениями мозгового кровообращения, черепно-мозговыми травмами, а также с фетоплацентарной недостаточностью и пренатальной энцефалопатией Украины, Российской Федерации, США и Евросоюза в качестве базового средства нейропротекции [7, 19].
Препараты вводили по следующей схеме – пирацетам 500 мг/кг, в/б, ангиолин 50 мг/кг, в/б, тиотриазолин 50 мг/кг, в/б, мексидол – 100 мг/кг, в/б, L‑аргинин 200 мг/кг, в/б, глуторедоксин 200 мкг/кг, в/б, тамоксифен 0.1 мг/кг, интаназально, РАИЛ 1 мг/кг, интаназально, цереброкурин – 150 мкл/кг, в/б. При подборе дозировки использовались инструкции к препаратам и результаты наших предыдущих исследований [7, 11, 13, 22].
Крыс выводили из эксперимента на 60 сут жизни под тиопенталовым наркозом (40 мг/кг). Для исследований брали кровь из брюшной артерии и мозг. С головного мозга быстро удаляли кровь, отделяли от мозговой оболочки и исследуемые кусочки помещали в жидкий азот. Затем измельчали в жидком азоте до порошкообразного состояния и гомогенизировали в 10-кратном объеме среды при 2°С, содержащий (в ммоль): сахарозы – 250, трис-HCl-буфера – 20, ЭДТА – 1 (рН 7.4). При температуре (+4°С) методом дифференциального центрифугирования на рефрижераторной центрифуге Sigma 3-30k (Германия) выделяли митохондриальную фракцию. Головной мозг экспериментальных животных помещали на сутки в фиксатор Буэна и после стандартной гистологической проводки ткань заключали в парапласт. Для проведения ПЦР на ротационном микротоме изготавливали срезы V–VI слоя сенсомоторной коры толщиной 5 микрон. Способность позитивно модулировать механизмы эндогенной нейропротекции у исследуемых лекарственных средств оценивалась по экспрессии и концентрации HSP70, а также по экспрессии HIF-1 и c-fos. Одним из нейропротективных эффектов HSP70 является пролонгирование “времени жизни” HIF-1, который в условиях гипоксии способен активировать и регулировать компенсаторные цитозольно-митохондриальные шунты (в частности, малат-аспартатный) [7]. Фактор транскрипции c-fos (иногда в литературе его называют геном раннего реагирования) быстро и временно активируется в ответ на воздействия самого широкого спектра, в том числе и на гипоксию, и способен, в зависимости от выраженности экспрессии, участвовать в процессах от апоптоза до нейропротекции, запуская транскриппцию HSP70 [42].
ПЦР в реальном времени. Экспрессию мРНК HSP70, HIF-1, c-fos определяли методом полимеразной цепной реакции в реальном времени. Ткани депарафинировали путем инкубации в двух следующих друг за другом ванн ксилолов и 100% этанола. После депарафинирования и центрифугирования, осадок высушивали на воздухе для удаления остатков этанола. Выделение тотальной РНК из ткани крыс проводили с использованием набора “Trizol RNA Prep 100” (“Изоген”, Россия), который содержит следующие реагенты: Trizol reagent и ExtraGene Е. РНК выделяли в соответствии с протоколом набора. Для обратной транскрипции (синтез до ДНК) использовали “Набор реагентов для проведения обратной транскрипции (ОТ-1)” (“Синтол”, Россия). Для определения уровня экспрессии исследуемых генов использовали амплификатор CFX96 ™ Real-Time PCR Detection Systems (“Bio-Rad Laboratories, Inc.”, США) и набор реактивов для проведения ПЦР-РВ в присутствии SYBR Green R-402 (“Синтол”, Россия). Специфические пары праймеров (5'–3') для анализа исследуемых и референс-генов были подобраны с помощью программного обеспечения Primer Blast (www.ncbi.nlm.nih.gov/tools/primer-blast) и изготовлены фирмой ThermoScientific, США. Регистрация интенсивности флуоресценции происходила автоматически в конце стадии элонгации каждого цикла по каналу автоматически SybrGreen. В качестве референс-гена для определения относительного значения изменения уровня экспрессии исследуемых генов был использован ген actin, beta (Actb).
Иммуноферментный анализ. Принцип метода основан на твердофазной энзим-связанной иммуносорбции по принципу “сэндвича”. Уровень белка теплового шока HSP70 определяли в цитоплазматической и митохондриальной фракциях головного мозга иммуноферментным методом, используя набор AMP’D® HSP70 high sensitivity ELISA kit, Enzo (Швеция). Концентрацию HSP70 выражали в нг/мл.
Статистические методы. Статистическая обработка данных научных исследований проводилась с использованием пакета программ “Statistica® for Windows 6.0” (StatSoft Inc., № AXXR712D833214FAN5), а также “SPSS 16.0”, “Microsoft Office Excel 2010”. Перед применением статистических критериев проводилась проверка гипотезы о нормальном законе распределения случайных величин (по критерию Shapiro–Wilk и Колмогорова–Смирнова). В условиях нормального распределения достоверность межгрупповых различий устанавливалась с использованием параметрического t-критерия Стьюдента. В случае, когда данные не соответствовали законам нормального распределения, сравнительный анализ проводили с помощью непараметрического U-критерия Манна–Уитни. Для сравнения независимых переменных в более чем двух выборках применяли дисперсионный анализ (ANOVA) при нормальном распределении или критерий Kruskal–Wallis для распределения, отличного от нормального. Для анализа закономерностей связи между отдельными показателями проведен корреляционный анализ с использованием коэффициента корреляции Пирсона или Спирмена. Для всех видов анализа статистически значимыми считали различия р < 0.05 (95%).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
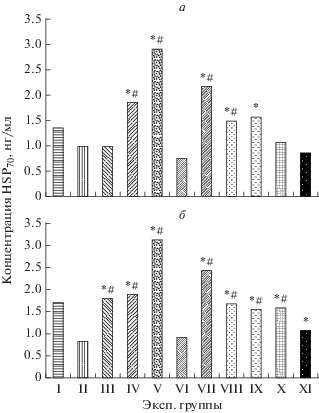
Анализируя данные, представленные на рис. 1, характеризующие экспрессию HIF-1α, мРНК HSP70 и мРНК c-fos в сенсомоторной коре головного мозга крысят на 60 сутки жизни, перенесших ПГ, было установлено, что экспрессия мРНК HIF-1α в группе не леченых крыс (контроль) была на 67% ниже по сравнению с интактной группой. Также было зарегистрировано снижение экспрессии мРНК HSP70 на 59% и мРНК c-fos на 72%. Методом иммуноферментного анализа было установлено снижение концентрации HSP70 на 26% в митохондриях и почти в 2 раза в цитозоле головного мозга крысят после перенесенной ПГ по сравнению со здоровыми животными аналогичного возраста (рис. 2). Выявленные факты свидетельствуют об угнетении транскрипционных процессов в нейронах и подавлении HSP70- зависимых механизмов эндогенной нейропротекции.
Рис. 1.
Характер экспрессии мРНК HIF-1α (а), мРНК HSP70 (б) и мРНК c-fos (в) в сенсомоторной коре головного мозга крыс, перенесших пренатальную гипоксию, после постнатальной 30-суточной фармакологической коррекции на 60 день жизни (М ± m). Экспериментальные группы: I – здоровые животные (интакт), n = 10; II – животные, перенесшие ПГ (контроль), n = 10; III – ПГ + L-аргинин (200 мг/кг), n = = 10; IV – ПГ + тамоксифен (0.1 мг/кг), n = 10; V – ПГ + + цереброкурин (150 мкл/кг), n = 10; VI – ПГ + пирацетам (500 мг/кг), n = 10; VII – ПГ + ангиолин (50 мг/кг), n = 10; VIII – ПГ + РАИЛ (1 мг/кг), n = 10; IX – ПГ + глуторедоксин (200 мкг/кг), n = 10; X – ПГ + + тиотриазолин (50 мг/кг), n = 10; XI – ПГ + мексидол (100 мг/кг), n = 10. Примечание: * достоверные различия с контрольной группой (ПГ), р < 0, # достоверные различия с контрольной группой пирацетама р < 0.05.
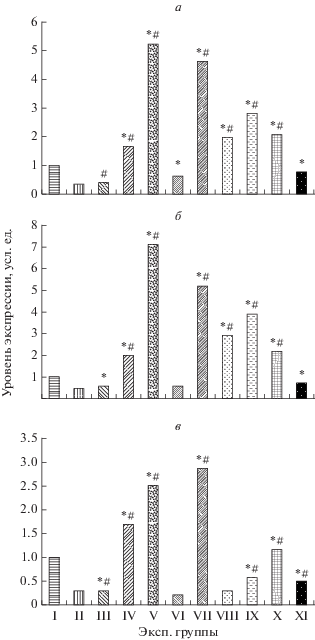
Рис. 2.
Количественные показатели содержания HSP70 в митохондриальной (а) и цитозольной (б) фракциях гомогената головного мозга крыс, перенесших пренатальную гипоксию, после постнатальной 30-суточной фармакологической коррекции на 60 день жизни (М ± m). Экспериментальные группы: I – здоровые животные (интакт), n = 10; II – животные, перенесшие ПГ (контроль), n = 10; III – ПГ + L-аргинин (200 мг/кг), n = 10; IV – ПГ + тамоксифен (0.1 мг/кг), n = 10; V – ПГ + цереброкурин (150 мкл/кг), n = 10; VI – ПГ + пирацетам (500 мг/кг), n = 10; VII – ПГ + ангиолин (50 мг/кг), n = 10; VIII – ПГ + РАИЛ (1 мг/кг), n = 10; IX – ПГ + глуторедоксин (200 мкг/кг), n = 10; X – ПГ + тиотриазолин (50 мг/кг), n = 10; XI – ПГ + мексидол (100 мг/кг), n = 10. Примечание: * достоверные различия с контрольной группой (ПГ), р < 0, # достоверные различия с контрольной группой пирацетама р < 0.05.
Курсовое 30-суточное лечение отобранными лекарственными препаратами оказывало различное по выраженности действия влияние на экспрессию мРНК HIF-1α, мРНК HSP70 и мРНК c-fos, а также на концентрацию HSP70 в головном мозге крысят, перенесших ПГ.
Исследования экспрессии мРНК HIF-1α показало, что во всех группах, кроме животных, получавших L-аргинин, уровень синтеза белка HIF-1α выше контрольных значений (тамоксифен в 4.9 раз, цереброкурин – в 15.8 раз, пирацетам – на 82%, ангиолин – в 13.9 раз, РАИЛ – в 6 раз, глуторедоксин – в 8.5 раз, тиотриазолин – в 6.2 раза, мексидол – в 2.3 раза). Показатели экспресии мРНК HIF-1α у животных после введения цереброкурина и ангиолина являются максимальными и достоверно (p < 0.05) превышают показатели всех экспериментальных групп, а уровень экспрессии мРНК HIF-1α у животных, получавших L-аргинин, не отличаются от показателей контроля.
Изменения в уровне экспрессии мРНК HSP70 после применения лекарственных препаратов в целом соответствует показателям мРНК HIF-1α. Большинство препаратов вызывает существенное увеличение этого показателя (тамоксифен в 4.8 раз, цереброкурин – в 17.4 раза, ангиолин – в 12.7 раз, РАИЛ – в 7 раз, глуторедоксин – в 9.5 раз, тиотриазолин – в 5.2 раза). Применение L-аргинина, мексидола и пирацетама демонстрирует незначительное (в сравнении с другими препаратами) повышение уровня экспрессии мРНК HSP70 (на 39, 37.7, и 66% соответственно), а применение цереброкурина и ангиолина, как и в исследовании экспрессии мРНК HIF-1α, характеризуется максимальными значениями среди всех исследуемых препаратов (рис. 1а).
Применение исследуемых лекарственных препаратов приводит к увеличению показателей уровня экспрессии мРНК c-fos в сенсомоторной коре головного мозга крыс в большинстве экспериментальных групп (тамоксифен – в 6 раз, цереброкурин – в 9 раз, ангиолин – в 10 раз, глуторедоксин – в 2 раза, тиотриазолин – в 4 раза, мексидол – на 75%). Применение L-аргинина и РАИЛ не вызывало достоверных изменений уровня экспрессии мРНК c-fos, а курсовое введение пирацетама привело к снижению данного показателя на 25%.
Показатели концентрации HSP70 в цитозольной фракции гомогената головного мозга крыс экспериментальных групп в целом коррелируют со значениями уровня экспрессии мРНК этого белка. Так, введение ангиолина и цереброкурина приводит к увеличению концентрации HSP70 в цитозоле в 3 и 3.8 раза соответственно, а применение пирацетама и мексидола демонстрируют минимальные значения. Показатели остальных препаратов достоверно выше контрольной группы в 1.9–2.3 раза (рис. 2б).
Характер изменения концентрации HSP70 в митохондриальной фракции в группах животных после ПГ, получавших лечение исследуемыми препаратами, демонстрирует разнонаправленность их воздействия. Так, показатели концентрации HSP70 в митохондриях нейронов головного мозга животных, получавших L-аргинин и тиотриазолин не отличаются от показателей не леченных животных, а в группах после лечения пирацетамом и мексидолом незначительно снижаются (на 24% и 14% соответственно). Курсовое введение тамоксифена увеличило концентрацию митохондриального HSP70 на 85%, РАИЛ – на 48% и глуторедоксона – на 57% (рис. 2а). Как и по другим исследуемым показателям, максимальные значения концентрации HSP70 в митохондриальной фракции демонстрируют препараты цереброкурин и ангиолин (в 2.4 и в 2.2 раза выше контрольных значений).
Можно предположить, что в механизме развития нейродеструктивных нарушений и последующего когнитивного дефицита у крыс после ПГ существенная роль принадлежит подавлению экспрессии гена раннего реагирования c-fos, что связано с его транскрипционной ролью в синтезе регуляторных белков, участвующих в механизмах эндогенной нейропротекции, ангиогенеза, консолидации памяти [5, 7]. Данное предположение подтверждается и опытами других исследователей, в которых показано, что в инициации механизмов эндогенной нейропротекции определенную роль играют факторы транскрипции (c-fos и c-jun), которые запускают экспрессию генов белков теплового шока (HSP70 и HSP72), а также фактора, индуцируемого гипоксией (HIF-1) [23, 24]. Продукты c-fos генов играют решающую роль в контроле над клеточным циклом, развитием, ростом и клеточной дифференцировкой, а также определяют судьбу дифференцированных нейронов, участвуют в передаче информации от клетки к клетке. При срыве адаптационных возможностей организма, резкого увеличения АФК и дефицита восстановленных тиолов, происходит инактивация факторов транскрипции с последующим подавлением экспрессии генов c-fos [23]. Известно, что подавление трансляции мРНК c-fos в структурах мозга нарушает кратковременную память на различных моделях обучения у разных видов животных [24]. Таким образом, выше представленные экспериментальные исследования позволяют сделать предположение, что ген c-fos является тем самым “мостиком”, через который индивидуальный опыт животного вступает во взаимодействие со всем генетическим аппаратом [25, 26]. Однако, и усиление экспрессии гена c-fos не выполняет физиологическую функцию. В случае, когда экспрессия гена усиливается более чем в 20 раз, c-fos уже играет отрицательную роль. Гиперэкспрессия гена c-fos, как было отмечено в СА1 гиппокампе крысят на 1–14 сут жизни после перенесенной ПГ, приводит к значительному повышению содержания в клетках белка c-fos, который непосредственно участвует в процессе фрагментации ДНК и инициировании процессов апоптической гибели клетки [5, 27]. Исходя из вышеизложенного, можно сделать вывод, что активация гена c-fos происходит при любых воздействиях на клетку. Характер экспрессии гена будет определять дальнейшую судьбу клетки: либо в ней будут активироваться трансляционные, транскрипционные процессы, синтез пластических материалов, либо она апоптически погибнет.
Индуцируемые гипоксией транскрипционные факторы (Hypoxia-inducible factor, HIFs) являются одним из приспособительных механизмов, активированных во время гипоксии/ишемии. Гипоксия стабилизирует HIF-1 субъединицу, которая связывается с HIF-1α субъединицей и индуцирует транскрипцию генов-мишеней, регулирующих кислородный гомеостаз. Некоторые из этих генов, ассоциированных с регулированием HIF-1, включают эритропоэтин, играющий важную роль в выживании клеток, фактор роста эндотелия сосудов, который активирует эндотелиальные клетки и способствует капиллярному прорастанию [5, 28, 29], и транспортер глюкозы-1 (Glut-1), который влияет на клеточный метаболизм глюкозы [7]. HIF играет решающую роль в стимулировании ангиогенеза и метаболической адаптации в процессе развития головного мозга. Экспрессия гена HIF-1 зависит не только от гипоксии, но и других регулирующих факторов, в том числе генетически обусловленных, и поэтому не всегда может быть адекватной гипоксическому воздействию. В этом случае, а также когда гипоксия/ишемия действует длительно и чрезмерно, может развернуться каскад транскрипционных и эпигенетических реакций и опосредованных ими структурно-метаболических сдвигов, которые могут знаменовать собой перепрограммирование с высокой готовностью к перинатальному поражению ЦНС [8].
Исследованиями последнего десятилетия показана способность белков теплового шока (HSP70) проявлять защитное действие при ишемических поражениях мозга и сердца [7, 30]. Нейропротекторное действие HSP70 обнаружено в условиях оксидативного и нитрозирующего стрессов, глутаматной эксайтотоксичности, при депривации глюкозы и кислорода, а также на различных моделях ишемии головного мозга [11, 14, 31]. Повышение HSP70 в тканях мозга свидетельствует об активации механизмов эндогенной нейропротекции, а его дефицит о преобладании механизмов нейродегенерации. Кроме того, в последнее время появились данные о роли HSP70 в стабилизации HIF-1 – белка, который в условиях ишемии отвечает за экспрессию генов, продукты которых участвуют в процессах пролиферации. апоптоза, стабилизации белковых молекул в условиях оксидативного стресса, инициации фолдинг окислительно модифицированных функционально активных макромолекул [5, 7, 32]. Принимая во внимание данные о способности HSP70 усиливать жизнеспособность нейронов в условиях гипоксии и факт однонаправленного изменения содержания в тканях головного мозга HSP и HIF-белков, можно предположить, что HSP70 участвует в регуляции сигнальных путей ответа клетки на гипоксический стресс на уровне регуляции стабильности HIF-белка [7], что подтверждалось проведенными нами исследованиями [5, 7, 16, 22]. Полученные результаты не противоречат данным других исследователей, которыми было показано регулирующее влияние HSP70 на процессы митохондриальной дисфункции, оксидативного стресса, экспрессию HIF-белков в клетках головного мозга при ишемии и гипоксии [6, 9, 27].
Пирацетам, который играет особую роль по влиянию на обменные процессы и кровообращение мозга плода, что обуславливает возможность его использования с целью лечения последствий ПГ в ЦНС. Препарат стимулирует окислительно-восстановительные реакции, усиливает утилизацию глюкозы, улучшает регионарный кровоток в ишемизированных участках мозга. Пирацетам повышает энергетический потенциал организма за счет ускорения оборота АТФ. Улучшение энергетических процессов под его влиянием повышает устойчивость к гипоксии [19, 33]. Однако, пирацетам имеет ряд побочных эффектов: у детей до года на фоне гипоксии в ЦНС он может спровоцировать судорожную реакцию и усилить лактат-ацидоз [2]. Известные механизмы противоишемического действия пирацетама не раскрывают в полной мере его влияние на изучаемые звенья механизма эндогенной нейропротекции. L-аргинин, являясь прекурсором NO, проявляет эндотелиопротективные, вазодилятирующие, антиоксидатные свойства, которые обеспечивают ему некоторую эффективность при угрозе невынашивания, задержке роста плода и фетоплацентарной недостаточности [2]. Однако, как демонстрируют наши исследования, восстановление продукции NO не влияет на экспрессию HSP70, хотя и имеются исследования о NO – регуляции HSP70 [7, 34]. Возможно, это связано с быстрым превращением NO в пероксинитрит при ишемии и потерей его физиологических функций [35].
Определенный успех в лечении последствий ПГ внесло применение антиоксидантов нейропротекторов – мексидола и тиотриазолина. Мексидол тормозит окислительную модификацию белков, нуклеиновых кислот и фосфолипидов, являясь скавенджером кислородных радикалов и радикалов жирных кислот, сохраняет физико-химические константы фосфолипидного бислоя мембраны [18, 36]. Мексидол проявляет цереброваскулярное действие за счет снижения окислительного повреждения рецепторов ГАМК-рецепторов сосудов головного мозга [36]. Мексидол позитивно влияет на энергетический обмен новорожденных после ПГ и ускоряет восстановление двигательных функций [37]. Однако, свойства “прямого” антиоксиданта не обеспечивают мексидолу полноценного влияния на HSP70- зависимые механизмы эндогенной нейропротекции. Тиотриазолин уменьшает образование АФК в митохондриях, сохраняя окислительную продукцию энергии. Тиотриазолин, снижая гиперпродукцию NO и АФК, предупреждает окислительную модификацию белковых структур рецепторов, ионных каналов, ферментов, факторов транскрипции (регулирует SH/SS-механизмы экспрессии при ишемии, ядерный транскрипционный фактор-каппа В (NF-kВ)) и восстанавливает экспрессию редокс-чувствительных генов, которые необходимы для защиты клеток от токсических эффектов оксидативного стресса, в том числе и HSP70 [7, 11, 38]. Использование тиотриазолина у первородящих старше 30 лет с угрозой прерывания беременности обеспечивает существенное уменьшение частоты осложнений беременности и родов, улучшает состояние (по шкале Апгар) и адаптацию новорожденных [2].
Выявленные нами выраженные свойства цереброкурина активировать синтез HSP и HIF-белков, объясняется, по нашему мнению, во-первых, их способностью модулировать в условиях гипоксии ответ генома, активируя при этом глобальные факторы транскрипции, запускающие синтез HSP [39]. Во-вторых, в ряде работ показана способность нейропептидов напрямую связываться с HSP-белками и в таком виде презентировать их дендритным клеткам [5, 7]. Кроме того, цереброкурин, как и ряд других нейропептидных препаратов, обладает выраженной антиоксидантной активностью, что обусловлено способностью нейропептидов позитивно воздействовать на экспрессию генов, кодирующих синтез одних из основных ферментов антиоксидантной системы – каталазы и супероксиддисмутазы [15]. Данное свойство исследуемых препаратов, позволяет угнетать окислительную деструкцию самого HSP70-белка в условиях интенсификации процессов свободнорадикального окисления, что пролонгирует его протекторное действие.
Выраженное действие на HSP70-механизмы эндогенной нейропротекции выявлено в данном исследовании у ангиолина. Ангиолин проявляет значительное противоишемическое, нейропротективное, кардиопротективное, эндотелиопротективное действие, которые обеспечивается его следующими механизмами. Во-первых, за счет антиоксидатного механизма (скавенджер АФК и NO) ангиолин оказывает позитивное действие на экспрессию генов, кодирующих синтез супероксиддисмутазы, глутатионпероксидазы и глутатионредуктазы [7, 13], осуществляет регуляцию АФК/GSH-зависимых механизмов экспрессии HSP70, способствует повышению биодоступности NO [7, 40]. Во-вторых, ангиолин в условиях ишемии способен активировать компенсаторные цитозольно-митохондриальные щунты энергии. И, в-третьих, ангиолин, за счет входящего в его состав остатка L-лизина, повышает аффинитет ГАМК рецепторов и снижает эксайтотоксичность [41].
Нейропротективная активность селективного модулятора эстрогеновых рецепторов – тамоксифена обусловлена, по нашему мнению, его активацией β-эстрогеновых рецепторов головного мозга и последующим отсоединением от последних HSP70. Механизм данного взаимодействия объясняется способностью HSP70 образовывать комплексы с эстрогеновыми рецепторами, не связанными с эстрогенами, для поддержания их в неактивном состоянии [7, 40, 42]. При взаимодействии же эстрогенового рецептора со стероидным лигандом, происходят конформационные изменения белка-рецептора и высвобождение из комплекса белка HSP, вхождение его внутрь клетки и митохондрии для реализации нейропротективного действия. Также, некоторыми исследователями была выдвинута гипотеза о способности селективных модуляторов эстрогеновых рецепторов (SERM) усиливать экспрессию HSP за счет стимулирующего влияния на белковый фактор транскрипции – фактор теплового шока (FHS) [43, 44]. Кроме того, тамоксифен способен ограничивать развитие оксидативного и нитрозильного стрессов на фоне повышения глутатиона, восстанавливая тем самым, тиол-дисульфидное равновесие в нервных клетках [42].
Нейропротективный эффект применения РАИЛ обусловлен его способностью прерывать IL-1b- зависимую экспрессию iNOS и последующее инициирование NO-обусловленных механизмов нейродеструкции. РАИЛ оказывает позитивное действие и на показатели тиол-дисульфидной системы и HSP70. Возможно, РАИЛ через повышение уровня HSP70 на фоне активации редокс-чувствительных факторов транскрипции АР-1, NF-kB, NF-1, приводит к повышению экспрессии генов глутатионпероксидазы, глутатионредуктазы и глутатионтрансферазы, а также генов синтеза ферментов, которые обеспечивают стабильность внутриклеточной концентрации глутатиона восстановленного (γ-глутамилтрансферазы, γ-глутамилцистеинсинтетазы) за счет его синтеза de novo [16].
ВЫВОДЫ
1. Хроническая ПГ приводит к угнетению транскрипционных процессов в нейронах и подавлению синтеза HIF1a, HSP70 и c-fos, что свидетельствует о нарушении механизмов эндогенной нейропротекции.
2. Введение лекарственных препаратов (пирацетам 500 мг/кг, в/б, ангиолин 50 мг/кг, в/б, тиотриазолин 50 мг/кг, в/б, мексидол – 100 мг/кг, в/б, L-аргинин 200 мг/кг, в/б, глуторедоксин 200 мкг/кг, в/б, тамоксифен 0,1 мг/кг, интаназально, АРИЛ 1 мг/кг, интаназально, цереброкурин – 150 мкл/кг, в/б) с 1 по 30 сут жизни крысам после пренатального воздействия хронической гипоксии, оказывает в разной степени выраженности влияние на экспрессию мРНК HIF-1α, мРНК HSP70 и мРНК c-fos, а также на концентрацию HSP70 в головном мозге экспериментальных животных, что свидетельствует о способности изучаемых препаратов модулировать HSP70-опосредованные механизмы эндогенной нейропротекции.
3. Наиболее активными по способности воздействия на HSP70 – зависимые механизмы эндогенной нейропротекции среди изучаемых средств в условиях моделирования хронической ПГ являются цереброкурин (150 мг/кг) и ангиолин (50 мг/кг), которые превосходят другие исследуемые препараты по уровню повышения экспрессии мРНК HSP70, мРНК HIF-1α и концентрации белка HSP70.
4. Полученные результаты являются экспериментальным обоснованием для дальнейшего изучения исследуемых препаратов, особенно ангиолина и цереброкурина, в качестве перспективных нейропротективных средств в комплексной терапии поражений ЦНС после хронической ПГ у новорожденных.
Список литературы
Семина В.И., Степанова Ю.А. // Медицинская визуализация. 2015. № 2. С. 95–105.
Резниченко Ю.Г., Беленiчев I.Ф., Риженко О.І., Горчакова Н.О., Резниченко Н.Ю. // Перинатальні ураження нервової системи. Запоріжжя: Просвіта, 2020. 364 с.
Каркашадзе Г.А., Савостьянов К.В., Макарова С.Г., Намазова-Баранова Л.С., Маслова O.И., Яцык Г.В. // Вопросы современной педиатрии. 2016. Т. 15. № 5. С. 440–451.
Афанасьева И.А., Кириченко М.А., Юзва А.А., Хайтович Н.В. // Міжнародний журн. педіатрії, акушерства та гінекології. 2017. Т. 11. № 1. С. 24–28
Бєленічев І.Ф., Алієва О.Г. // Фармакологія та лікарська токсикологія, 2019. Т. 13. № 4. С. 235–248.
Соколова Н.А., Граф А.В., Маслова М.В., Маклакова А.С., Хиразова Е.Э. // Стресс на ранних стадиях онтогенеза: пептидергическая коррекция. М.: Товарищество научных изданий КМК, 2016. 255 с.
Беленичев И.Ф., Черний В.И., Бухтиярова Н.В., Горчакова Н.А. // Нейропротекция и нейропластичность. Киев: Логос, 2015. 512 с.
Tang L.Q., Ringstedt T., Pequignot J., Lagercrantz H. // Brain Res. 2000. V. 852(1). P. 84–91.
Lee W.B., Kwon S.H., Kim H.M. // Clin. Exp. Pediatr. 2000. V. 43(3). P. 386–394.
Ветровой О.В., Нимирицкий П.П., Тюлькова Е.И., Рыбникова Е.А.// Нейрохимия. 2020. Т. 37. № 3 С. 228–232.
Беленичев И.Ф., Визир В.А., Мамчур В.И., Курята А.В. // Запорожский медицинский журн. 2019. Т. 21. № 1(112). С. 119–128.
Богуш Т.А., Полежаев Б.Б., Дудко Е.А., Богуш Е.А., Кирсанов В.Ю., Полоцкий Б.Е., Тюляндин С.А., Давыдов М.И. // Антибиотики и химиотерапия. 2016. Т. 61. № 3–4. С. 41–49.
Чекман І.С., Казакова О.О., Мазур І.А., Нагорна О.О., Бєленічев І.Ф., Горчакова Н.О., Бухтіярова Н.В., Сирова Г.О., Довгань Р.С., Загородний М.І. // Допов. Нац. акад. наук Укр. 2017. № 8. С. 86–93.
Беленичев И.Ф., Литвиненко Е.С. // Фармакологія та лікарська токсикологія. 2017. Т. 55. № 4–5. С. 20–26.
Моргунцова С.А. // Запорожский медицинский журн. 2014. Т. 86. № 5. С. 36–40.
Belenichev I.F., Burlaka B.S., Bukhtiyarova N.V., Aliyeva E.G., Suprun E.V., Ishchenko A.M., Simbirtsev A.S. // Neurochemical J. 2021. № 1(15). P. 30–36.
Свиридова Н.К., Жгільова Н.О. // Східно-Європейський неврологічний журн. 2017. Т. 13. № 1. С. 4–8.
Чуканова Е.И., Чуканова А.С. // Журн. неврологии и психиатрии им. С.С. Корсакова. 2019. Т. 119. № 9. С. 39–45.
Востриков В.В. // Обзоры по клинической фармакологии и лекарственной терапии. 2017. Т. 15. №1. С. 14–25.
Черкасова Д.У., Магомедгаджиева Д.Н., Рабаданова А.И. // Известия Самарского научного центра Российской академии наук. 2009. Т. 11. № 1(5). С. 934–937.
Заднипряный И.В., Сатаева Т.П. // Сб. мат. межд. науч. конф. АГМУ. Астрахань, 2017. С. 66–67.
Горбачева С.В., Беленичев И.Ф., Кучеренко Л.И. // Фармакологія та лікарська токсикологія. 2016. Т. 47. № 1. С. 24–30.
Tang L.Q., Ringstedt T., Pequignot J., Lagercrantz H. // Brain Res. 2000. V. 852(1). P. 84–91.
Sun Hak Kwon, Heng Mi Kim // Clin Exp. Pediatr. 2000. V. 43(3). P. 386–394.
Абрамов А.В., Шаменко В.А. Колесник Ю.М. // Вісник української медичної стоматологічної академії. 2017. Т. 17. № 4(60). С. 5–8.
Кузнецов С.Л., Афанасьев М.А. // Биомедицина. 2013. № 1. С. 109–116.
Millar L.J., Shi L., Hoerder-Suabedissen A. // Frontiers in cellular neuroscience. 2017. V. 11. P. 1–36.
Nalivaeva N.N., Turner A.J., Zhuravin I.A. // Front. Neurosci. 2018. V. 12. P. 1–21.
Smith T.F., Schmidt-Kastner R., McGeary J.E., Kaczorowski J.A., Knopik V.S. // Behav. Genet. 2016. V. 46. P. 467–477.
Rosenzweig R., Nillegoda N.B., Mayer M.P., Bukau B. // Nature Reviews Molecular Cell Biology. 2019. V. 20(11). P. 665–680.
Radons J. // Cell Stress and Chaperones. 2016. V. 21. № 3. P. 379–404.
Belenichev I.F., Gorbacheva S.V., Bukhtiyarova N.V., Levich S.V. // Biological Markers and Guided Therapy. 2016. V. 3. P. 107 – 114.
Belenichev I.F., Sokolik E.P., Bukhtiyarova N.V., Levich S.V. // Bulletin of Clinical Psychopharmacology. 2016. V. 26(1). P. 11–18.
Беленичев И.Ф., Билла Ю.В. // Вісник проблем біології і медицини. 2016. Т. 131(1). № 3. С. 60–65.
Belenichev I.F., Voitenko D.S., Bukhtiayrova N.V. // International J. Neurorehabilitation. 2019. V. 6. № 2. P. 312–316.
Chekman I.S., Yakovleva I.Yu., Belenichev I.F., Gorchakova N.A., Bukhtiyarova N.V. // Molecular Pharmacology. 2013. V. 2. P. 1–6.
Gnezdilova A.V., Ganshina T.S., Mirzoian R.S. // Eksp. Klin. Farmakol. 2010. V. 73(10). P. 11–13.
Belenichev I.F., Bukhtiayarova N.V., Mazur I.A. // Neurochemical J. 2013. V. 7. № 4. P. 296–303.
Беленичев И.Ф., Павлов С.В. // Нейронауки: теоретические и клинические аспекты. 2010. Т. 6. № 1. С. 12–17.
Belenichev I.F., Mazur I.A., Kucherenko L.I., Nagornaya E.A., Gorbacheva S.V., Bidnenko A.S. // Neurochemical J. 2016. V. 10. № 2. P. 131–136.
Belenichev I.F., Pavlov S.V., Bukhtiayarova N.V., Samura I.B., Egorov A.N., Semenov D.M. // Biological Markers and Guided Therapy. 2017. V. 4. № 1. P. 105–111.
Беленичев И.Ф., Фероз Шах, Чекман И.С., Нагорная Е.А., Горбачева С.В., Горчакова Н.А., Бухтиярова Н.В., Резниченко Ю.Г. // Тиол-дисульфидная система: роль в эндогенной цито- и органопротекции, пути фармакологической модуляции. Киев: ТОВ “Видавництво “Юстон””, 2020. 232 с.
Belenichev I., Odnokoz O., Pavlov S., Belenicheva O., Polyakova E. // Neurochemical J. 2012. V. 6. № 3. P. 202–212.
Belenichev S.F., Pavlov S.V. // Neurochemical J. 2014. V. 8. № 1. P. 28–32.
Дополнительные материалы отсутствуют.


