Нейрохимия, 2022, T. 39, № 1, стр. 59-69
Морфологические изменения ГАМКергических структур головного мозга крысы в ходе постнатального развития
В. А. Разенкова 1, Д. Э. Коржевский 1
1 ФГБНУ “Институт экспериментальной медицины”
Санкт-Петербург, Россия
Поступила в редакцию 07.04.2021
После доработки 27.04.2021
Принята к публикации 14.05.2021
- EDN: EZJMQC
- DOI: 10.31857/S1027813322010101
Аннотация
Целью настоящего исследования было изучение ГАМКергических нейронов головного мозга и синаптических терминалей в раннем постнатальном онтогенезе и при старении. В качестве материала были использованы срезы головного мозга крыс породы Вистар на разных сроках постнатального развития (от конца первой недели и до 24 месяцев). ГАМКергические структуры выявляли с помощью иммуногистохимической реакции на фермент синтеза ГАМК – глутаматдекарбоксилазу изоформы 67 (GAD67). Были охарактеризованы морфологические изменения, происходящие в ГАМКергической системе в ходе постнатального онтогенеза. В частности, было показано, что GAD67-иммунопозитивные cинаптические окончания, у 7-дневных животных преимущественно локализованы в I слое коры. Подтверждено предположение о том, что клетки Кахаля-Ретциуса не являются ГАМКергическими. ГАМКергические нейроны были обнаружены в субвентрикулярной зоне конечного мозга на ранних сроках постнатального онтогенеза и у старых животных. Установлено, что эпителиоциты сосудистого сплетения головного мозга к концу первого месяца развития содержат GAD67 и, поэтому, могут служить источником внесинаптической ГАМК.
ГАМКергические структуры головного мозга представлены преимущественно тормозными интернейронами и их синаптическими терминалями. Эти нейроны представляют собой гетерогенную совокупность клеток, которые избирательно модулируют активность нейронных цепей центральной нервной системы [1, 2]. Считается, что эти клетки образуются из предшественников в эмбриональном субпаллиуме, в области ганглиозного возвышения. ГАМКергические нейроны развиваются под регуляцией типичных для субпаллиума транскрипционных факторов (семейство Dlx, Ascl1, Gsx1 и Gsx2), однако на их разнообразие влияют дополнительные транскрипционные факторы, которые ограничивают дифференцировку предшественников только в определенные типы интернейронов [3–7]. Несмотря на то, что ганглиозное возвышение считается основным источником ГАМКергических клеток, ряд авторов предполагает возможность наличия клеток-предшественников в субвентрикулярной зоне боковых желудочков мозга в постнатальном онтогенезе [2, 8–10].
В период постнатального развития происходит окончательное формирование элементов тормозной системы. Процессы миграции, происходящие в эмбриональном развитии, сменяются процессами дифференцировки и созревания. В конце первой недели после рождения начинают формироваться функциональные синаптические связи, а созревание ГАМКергических интернейронов происходит в первый месяц постнатального онтогенеза [11–13].
Известно, что ГАМКергическая система головного мозга участвует в структурной и функциональной организации процессов ЦНС в ходе развития [1, 14, 15]. На ранних этапах развития до этапов формирования синапсов, ГАМК высвобождается внесинаптически. Внесинаптическое высвобождение ГАМК создает хемотаксис, необходимый для правильной миграции фенотипически различных популяций предшественников нейронов в процессе кортикогенеза, а частичная или полная блокировка высвобождения ГАМК приводит к порокам развития кровеносных сосудов головного мозга и патологически влияет на миграцию и позиционирование интернейронов коры [16, 17].
Несмотря на то, что существует большое количество информации о становлении ГАМКергической системы, данные о роли ГАМК в развитии противоречивы. В частности, это относится к регуляции процесса синаптогенеза, происходящего в первый месяц постанатального развития. Было показано, что в мозге молодых животных, в отсутствие глутамата, ГАМК может действовать в качестве возбуждающего нейротрансмиттера. Активация ГАМКА рецепторов и потенциал-зависимых кальциевых каналов приводит к спонтанным деполяризациям нейронов, что необходимо для активность-зависимого образования синапсов [18–20]. Однако, другие авторы оспаривают эти предположения, обращая внимание на то, что указанные данные получены на переживающих срезах мозга, в которых присутствуют поврежденные клетки, что может приводить к ошибочным результатам [21, 22]. Их наблюдения ставят под сомнение предыдущие выводы о роли ГАМК в процессе синаптогенеза.
Таким образом, несмотря на то, что ГАМКергическая система оказывает существенное влияние на обеспечение нормального функционирования процессов и реализации функций ЦНС как в процессе развития, так и в зрелом возрасте, особенности формирования ГАМКергических интернейронов и их связей в период раннего постнатального развития, а также в процессе естественного старения остаются дискуссионными. Поэтому, целью данного исследования было изучение ГАМКергических нейронов и синаптических терминалей в раннем постнатальном онтогенезе и при старении.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводили на парафиновых срезах головного мозга крыс-самцов породы Вистар на разных сроках постнатального развития: 7 (P7), 30 (P30) постнатальные сутки, половозрелые (5-6 месяцев) и старые (23–24 мес.) животные (n = 5 для каждого срока). При содержании и умерщвлении животных соблюдали основные принципы Европейской Конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 1986 г.) и “Правила проведения работ с использованием экспериментальных животных” (приказ № 755 от 12.08.1977 г. МЗ СССР). Исследование одобрено локальным этическим комитетом ФГБНУ ИЭМ (заключение № 1/20 от 27.02.2020). Материал фиксировали в цинк-этанол-формальдегиде [23] и заливали в парафин по общепринятой методике. Изготавливали фронтальные срезы толщиной 5 мкм и наклеивали их на предметные стекла “Superfrost Ultra Plus” (Menzel Gläser, Германия). После депарафинирования и регидратации препаратов проводили тепловое демаскирование антигена в модифицированном цитратном буфере (S1700, Agilent, США) в течение 24 мин. Ингибирование эндогенной пероксидазы осуществляли путем обработки срезов 3%-ным водным раствором перекиси водорода в течение 10 мин.
Для выявления ГАМКергических структур головного мозга использовали поликлональное кроличье антитело к ферменту синтеза ГАМК – глутаматдекарбоксилазе изоформы 67 (GAD67) в разведении 1 : 300 (E10260, Spring Bioscience, США). Инкубацию в первичном антителе проводили в течение трех суток при температуре 27.5°С. В качестве вторичных реагентов использовали Goat anti-rabbit HRP Conjugate из набора Mouse and Rabbit Specific HRP/DAB IHC Detection Kit (ab236466, Abcam, Великобритания). Для световой микроскопии при выявлении продукта реакции использовали хромоген 3'3-диаминобензидин из набора DAB+ (Agilent, США). Часть срезов подкрашивали квасцовым гематоксилином. Для конфокальной лазерной микроскопии после инкубации во вторичном антителе (30 минут при температуре 27.5°С) на срезы наносили козье антитело против пероксидазы хрена, конъюгированное с флуорохромом Cy3 (Jackson ImmunoResearch, США) [24]. Непосредственно в раствор антитела добавляли флуоресцентный ядерный краситель SYTOX Green в концентрации 0.5 мкмоль (Invitrogen, США) и инкубировали срезы 30 мин при температуре 27.5°С. Для постановки положительного контроля антител использовали препараты мозжечка крысы, для нейронов которых хорошо известна локализация GAD67 [25]. При постановке отрицательного контроля на один из срезов обрабатываемой серии препаратов вместо раствора первичных антител наносили раствор для разведения антител Antibody Diluent (Abcam, Великобритания). Полученные препараты анализировали с помощью светового микроскопа Leica DM750 (Leica, Германия) и сканирующего конфокального микроскопа Zeiss LSM 800, оснащенного системой Airyscan (Carl Zeiss AG, Германия). Использовали объективы Plan-Apochromat 20×/0.8 M27 и Plan-Apochromat 63×/1.40 Oil DICM27 (масляная иммерсия). Для возбуждения флуоресценции Cy3 и SYTOX Green использовали лазеры с длиной волны 561 и 488 нм соответственно. Обработку полученных изображений проводили с помощью программ ZEN-2012 (Carl Zeiss AG, Германия) и ImageJ (Wayne Rasband (NIH), США). Для анализа возрастной динамики количества ГАМКергических интернейронов проводили подсчет клеток по четырем полям зрения размером 325 × 244 мкм для каждого случая. После этого количество GAD67-положительных клеток делили на общее число клеток для вычисления процентного соотношения. Среднюю интенсивность флуоресценции красного канала на каждом изображении оценивали по методике, описанной Шиханом и соавторами [26]. Среднюю интенсивность флуоресценции представляли в виде условных единиц яркости пикселей для 8-битных изображений (от 0 до 255). Статистическую обработку проводили в программе GraphPad Prism 8 (GraphPad Software, США). Данные представляли в виде среднего значения ± ошибки средней. На основании проверки на соответствие нормальному распределению с помощью критерия Шапиро–Уилка, для сравнения данных применяли односторонний дисперсионный анализ Краскела–Уоллиса. Последующее сравнение групп осуществляли с помощью post-hoc-критерия Данна. Различия считали достоверными при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
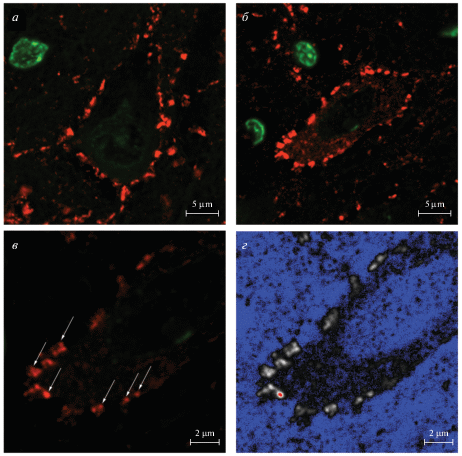
Предварительная часть исследования заключалась в проверке возможности визуализации синапсов при использовании иммуногистохимической реакции на GAD67 на препаратах головного мозга половозрелых крыс при использовании конфокального микроскопа Zeiss LSM 800. При использовании объектива Plan-Apochromat 63×/1.40 Oil DICM27 с диаметром конфокальной диафрагмы (pinhole), равного одному диску Эйри (1 AU), оказалось возможным получить изображения, на которых отчетливо видны как тела GAD67-положительных нейронов, так и ГАМКергические синаптические терминали (рис. 1а, б). Уменьшение диаметра диафрагмы примерно до половины диска Эйри (0.56 AU) позволило повысить аксиальную и латеральную разрешающие способности конфокального микроскопа и дифференцированно выявить ГАМКергические пресинапсы (рис. 1в). Для проверки пригодности полученного изображения для дальнейшего анализа использовали профиль Range Indicator, который преобразует исходное изображение так, что пиксели с минимальным значением яркости (0) окрашены в синий цвет, а с максимальным (255) – в красный (рис. 1г). При определенных настройках режима сканирования конфокального микроскопа возможно получение изображений, на которых некоторые объекты будут иметь значения яркости 255 (т.е., будут переэкспонированы), что можно использовать для конкретных целей. В настоящей работе подобную настройку сканирования применяли для получения изображений с четкой визуализацией не только синаптических терминалей ГАМКергических клеток, но и тел самих интернейронов (см. рис. 1б). Необходимость такой настройки прибора связана с тем, что цитоплазма интернейронов характеризуется более слабыми значениями сигнала GAD67 по сравнению с пресинапсами.
Рис. 1.
Синаптические терминали на телах нейронов в головном мозге половозрелых крыс. Иммуногистохимическая окраска на GAD67 (красный) с подкраской ядер SytoxGreen (зеленый). а – пирамидный нейрон III слоя коры; б – корковый ГАМКергический интернейрон; в – корковый ГАМКергический интернейрон, большое увеличение; г – корковый ГАМКергический интернейрон, большое увеличение, профиль Range Indicator. Стрелки указывают на ГАМКергические синаптические терминали.
В ходе основного иммуногистохимического исследования было выявлено, что на 7-е сутки постнатального развития характерно интенсивное окрашивание вентральной области мозга и I слоя неокортекса (рис. 2а). Интенсивная окраска I слоя коры обусловлена скоплением большого количества ГАМКергических терминалей. При этом тела ГАМКергических интернейронов располагаются в нижележащих слоях (V–VI). Было показано, что для I слоя цингулярной области коры характерно присутствие не только синаптических терминалей, но и тел клеток с выраженной цитоплазматической реакцией GAD67. Фермент распределен равномерно по цитоплазме перикариона нейронов (но не выявляется в ядре), отростки клеток не выявляются или прослеживаются только на небольшом расстоянии от тела клетки. В подкорковых структурах усиленная реакция наблюдается в обонятельном бугорке, гипоталамусе и globus pallidus. Для септальной зоны головного мозга характерно неравномерное окрашивание латерального септального ядра. В субвентрикулярной зоне выявляются клетки с отчетливой цитоплазматической реакцией на GAD67 (рис. 3а).
Рис. 2.
Распределение ГАМКергических структур в головном мозге на разных сроках постнатального онтогенеза. Иммуногистохимическая окраска на GAD67. а – 7 сут постнатального развития; б – 30 сут постнатального развития; в – взрослое животное; г – старое животное.
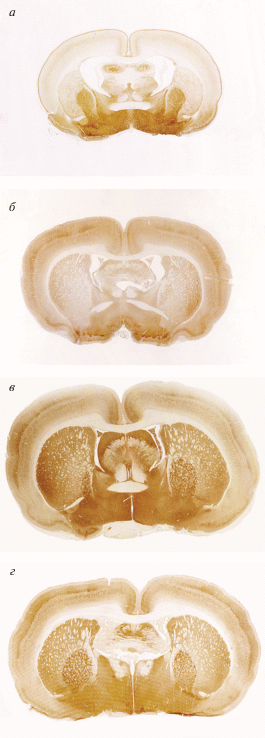
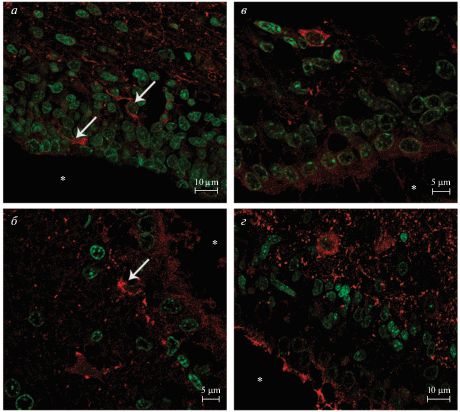
Рис. 3.
ГАМКергические нейроны субвентрикулярной зоны. Иммуногистохимическая окраска на GAD67 (красный) с подкраской ядер SytoxGreen (зеленый). а – 7 сут постнатального развития; б – старое животное; в – 30 сут постнатального развития; г – взрослое животное. Стрелка указывает на ГАМКергические нейроны в субвентрикулярной зоне, звездочка – полость желудочка.
Несмотря на наличие GAD67-положительных терминалей аксонов, выявляемых во всех структурах мозга к концу первой недели постнатального развития, на этом сроке не наблюдаются сформированные ГАМКергические аксосоматические пресинапсы на интернейронах.
На 30-е сутки постнатального развития проявляется четкая слоистость коры, обусловленная интенсивным окрашиванием синаптических окончаний ГАМКергических интернейронов, сконцентрированных на телах и отростках пирамидных клеток III и V слоя (рис. 2б). Для инсулярной зоны коры характерна слабая окраска при сохранении ламинарности распределения GAD67. Скопления ГАМКергических терминалей в I слое коры, характерного для 7-х постнатальных суток, на этом сроке не наблюдается. Тела GAD67-положительных нейронов располагаются во всех слоях коры. На телах интернейронов появляются синаптические окончания. В отличие от P7, у животных P30 как в caudate-putamen, так и в globus pallidus наблюдается окрашивание средней интенсивности. Для этого срока также характерно наибольшее процентное содержание ГАМКергических интернейронов как в коре, так и в подкорковых структурах (табл. 1). GAD67-положительные структуры в субвентрикулярной зоне на этом сроке не выявляются (рис. 3в). Интересно, что у одномесячных животных появляется реакция на GAD67 в сосудистом сплетении (рис. 4б). Фермент содержится в апикальной части эпителиальных клеток. Средняя интенсивность флуоресценции невелика и составляет 68.71 ± 1.58 условных единиц яркости.
Таблица 1.
Процентное содержание GAD67-положительных клеток в кортексе и в подкорковых структурах головного мозга на разных сроках (средняя ± ошибка средней (число значений, использовавшихся для подсчета среднего)). P-value: * – <0.01
| Зона | P7 | P30 | Половозрелые | Старые |
|---|---|---|---|---|
| Кора | 6.96 ± 0.3 (20) | 15.76 ± 0.89* (20) | 7.21 ± 0.58 (20) | 7.96 ± 0.49 (20) |
| Стриатум | 4.38 ± 0.13 (20) | 6.25 ± 0.31* (20) | 4.12 ± 0.57 (20) | 3.72 ± 0.27 (20) |
Рис. 4.
GAD67 в сосудистом сплетении. Иммуногистохимическая окраска на GAD67 (красный) с подкраской ядер SytoxGreen (зеленый). а – 7 сут постнатального развития, отсутствие реакции; б – 30 сут постнатального развития; в – взрослое животное, интенсивная реакция; г – старое животное. Стрелка указывает на скопление фермента в апикальной части эпителиальных клеток, звездочка – полость желудочка.
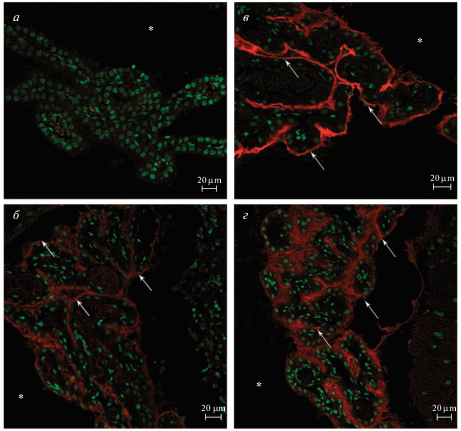
У половозрелых животных (5–6 мес.), подобно 30-дневным, усиленная реакция наблюдается в III и V слоях коры. В нейропиле I и IV слоев коры ГАМКергичсекие терминали расположены с меньшей плотностью. Высокой интенсивностью окрашивания отличается цингулярная и сенсорная зоны коры, остальные области коры (за исключением инсулярной) характеризуются средней интенсивностью. Тела ГАМКергических нейронов имеют разнообразную морфологию и располагаются во всех слоях коры. Однако, присутствие тел нейронов в I слое коры наблюдали только в определенных областях: в основном в цингулярной коре и вторичной двигательной коре. Благодаря неодинаковой интенсивности иммуногистохимической реакции возможно различение globus pallidus и caudate-putamen на анатомическом уровне (рис. 2в). В подкорковых структурах можно также выявить две популяции ГАМКергических интернейронов: клетки с сильно выраженной реакцией на GAD67 и клетки с умеренной реакцией на GAD67. В субвентрикулярной зоне отсутствуют клетки с положительной иммуногистохимической реакцией на GAD67. В этом возрасте также наблюдается скопление фермента в апикальной части эпителиальных клеток (рис. 4в), при этом средняя интенсивность флуоресценции наивысшая среди исследуемых сроков (183.4 ± 3.05 условных единиц яркости).
У старых крыс (23–24 мес.), также как у P30 и взрослых животных, распределение фермента позволяет четко выделить слои коры (рис. 2г). Сохраняется различная интенсивность окрашивания областей коры, характерная для более ранних сроков (P30 и взрослые животные), а именно: высокоинтенсивная окраска в цингулярной и сенсорной областях, окраска средней интенсивности двигательной и пириформной областей, слабая окраска инсулярной зоны коры. Было отмечено, что в I слое определенных областей коры головного мозга, а именно в цингулярной, двигательной и сенсорной, выявляются тела ГАМКергических нейронов. Сохраняется различная интенсивность в окрашивании caudate-putamen и globus pallidus (см. рис. 2). У старых животных, как и у 7-дневных, можно заметить ГАМКергические клетки в субвентрикулярной зоне (рис. 3б). На этом сроке средняя интенсивность флуоресценции GAD67 в сосудистом сплетении понижается до 53.01 ± 1.16 условных единиц яркости. Различия по данному параметру были статистически значимыми для всех исследуемых сроков (р < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Предварительное исследование показало возможность выявления тел ГАМКергических нейронов и аксонных терминалей на срезах головного мозга крыс с использованием методов конфокальной лазерной сканирующей микроскопии. Несмотря на то, что синаптические терминали в связи с их малым размером традиционно изучают с применением методов электронной микроскопии, их наблюдение в головном мозге возможно и на световом уровне при использовании антител к белкам, избирательно локализованным в районе синаптических контактов. Наиболее легко визуализируемы крупные синапсы, например, терминали моховидных волокон гиппокампа и мозжечка [27]. Выявление более мелких структур реализуемо благодаря тому, что высокая концентрация антигена в малом объеме позволяет получить сигнал с высокой интенсивностью флуоресценции, который может регистрироваться конфокальным микроскопом как дискретная структура, если расположение этих структур не ближе, чем разрешающая способность микроскопа. В работах по изучении морфологии синапсов, выполненных с использованием электронной микроскопии [28–30], можно обнаружить, что ГАМКергические синаптические терминали имеют размеры примерно от 0.3 мкм до 2 мкм. Поскольку латеральная разрешающая способность конфокального микроскопа Zeiss LSM 800 для объектива Plan-Apochromat 63×/1.40 Oil DICM27 и лазера длиной волны 561 нм (которую использовали для возбуждения спектра флуоресценции Cy3) составляет около 0.16 мкм, техническая возможность для выявления синапсов существует. Настоящее исследование подтверждает возможность выявления дискретных GAD67-иммунопозитивных структур, которые являются аксосоматическими синапсами (см. рис. 1).
В ходе развития ГАМКергические интернейроны претерпевают различные молекулярные, структурные и функциональные изменения, которые оказывают влияние на состояние и функционирование ЦНС. ГАМКергические клетки головного мозга формируются в субпаллиуме и заселяют кору головного мозга в ходе тангенциальной миграции в процессе эмбриогенеза [2, 31]. Эти клетки располагаются во всех слоях коры и различаются не только морфологически, но и по своим биохимическим, электрофизиологическим свойствам и формируемым межклеточным контактам [32, 33]. Такое разнообразие необходимо для четкого модулирования активности как основных эфферентов коры – пирамидных нейронов, так и других клеток. Высокое разнообразие морфологических, молекулярных и физиологических характеристик ГАМКергических клеток привело к разработке сложной номенклатуры тормозных нейронов коры головного мозга [34–36].
В первом слое коры у 7-дневных крыс во всех областях коры, кроме цингулярной и пириформной, наблюдали большое количество ГАМКергических структур. Первый слой коры головного мозга – единственный слой, который не содержит возбуждающих клеток. Известно, что в первый слой свои аксоны проецируют ГАМКергические клетки Мартинотти, устанавливающие синаптические связи с дендритами пирамидных клеток. Было выявлено, что большинство тормозных синапсов в течение первой недели постнатального развития создается клетками Мартинотти именно на апикальных дендритах пирамидных клеток [37], отростки которых достигают I слоя коры. В коре развивающегося мозга в I слое расположены также рилин-продуцирующие клетки Кахаля–Ретциуса, которые регулируют миграцию кортикальных нейронов во время эмбриональной и ранней постнатальной стадий развития [38]. Поскольку клетки Кахаля–Ретциуса экспрессируют ГАМКA рецепторы как во время эмбрионального, так и во время постнатального развития, а соматостатин-содержащие клетки Мартинотти дифференцируются достаточно рано, было высказано предположение, что наблюдаемые в первом слое ГАМКергические терминали принимают участие в формировании колонок головного мозга за счет регуляции работы клеток Кахаля–Ретциуса [39–41]. Кроме того, поскольку во взрослом мозге рилин-содержащие клетки относятся к ГАМКергическим интернейронам, было высказано предположение о том, что клетки Кахаля–Ретциуса крыс претерпевают фенотипическую трансформацию в интернейроны неокортекса [42, 43]. Исследования, проводимые на мышах, однако, показали, что эти клетки погибают путем апоптоза в ходе первых двух недель постнатального развития [44, 45]. Поскольку у 7-дневных животных не было обнаружено ни одной GAD67-положительной клетки в I слое разных отделов неокортекса, наши данные свидетельствуют о том, что клетки Кахаля–Ретциуса крыс, как минимум на момент окончания первой недели постнатального развития не являются ГАМКергическими.
Считается, что в первом слое коры взрослого мозга располагаются два типа ГАМКергических интернейронов: нейроглиаформные и однопучковые клетки (single-bouquet cells). Однопучковые клетки регулируют работу интернейронов II/III слоев коры, формируя на них однонаправленные аксональные синаптические терминали [46]. Нейроглиаформные клетки примечательны тем, что оказывают свое тормозное влияние не только путем синаптической передачи, но и путем внесинаптической экскреции ГАМК [47]. Примечательно, что GAD67-положительные клетки в первом слое коры в ходе исследования чаще всего наблюдали в цингулярной зоне на всех сроках развития. Это соответствует представлениям о сложной структуре этой области коры [48, 49]. Особенности клеточного состава первого слоя в различных зонах коры половозрелых животных могут быть связаны с функциональной специализацией структур первого слоя коры.
Несмотря на наши данные о том, что первые ГАМКергические синапсы можно наблюдать в коре на ранних сроках, сформированные синаптические терминали на интернейронах в настоящей работе наблюдали к концу первого месяца постнатального развития. У мышей, первые синапсы начинают формироваться на 5–8 постнатальные сутки, а пик синаптогенеза приходится на 10-е сутки [37]. У крыс активное созревание ГАМКергических синапсов также происходит к концу первой постнатальной недели. Показано, что частота спонтанных постсинаптических токов от ГАМКергических клеток приобретает статистически достоверные ненулевые значения только к Р7, а отношение частот сигналов глутамат/ГАМК превышало единицу до 11-х суток постнатального развития, что говорит о более раннем развитии глутаматергической проводимости по сравнению с ГАМКергической [50]. Предположительно, это связано с формированием таламокортикальных связей, которые формируются после первой недели развития [51]. Таким образом, развитие ГАМКергической иннервации обусловлено необходимостью обработки сенсорной информации. С помощью поведенческих тестов было выявлено, что на второй неделе жизни детеныши крыс действительно начинают исследовать окружающую среду [50]. Поэтому кажется логичным, что к середине второй недели постнатального развития, после полного развития моторных и сенсорных функций, происходит усиление синаптогенеза, который продолжается в течение длительного периода до 30-х суток.
На 30-е сутки постнатального развития также регистрировали самое высокое содержание ГАМКергических интернейронов среди всех возрастов как в коре, так и в подкорковых структурах. В недавних исследованиях распределения рецепторов ГАМК было выявлено увеличение плотности ГАМКB рецепторов от P30 до P90 [52]. Поскольку происходит увеличение плотности постсинапсов, можно было бы ожидать увеличение числа пресинапсов вследствие либо появления новых связей между нейронами, либо увеличения количества самих ГАМКергических нейронов. Это позволяет предположить участие ГАМКергических нейронов в поздних стадиях развития головного мозга.
При постановке иммуногистохимической реакции на GAD67 наблюдали окрашивание слабой интенсивности в области инсулярной коры у крыс всех возрастов. Ключевыми нейротрансмиттерами этой области коры считаются ГАМК и дофамин. ГАМКергические интернейроны инсулярной коры получают сигналы от аксонов дофаминергических нейронов вентральной области покрышки [53]. Поскольку исследования показали, что дофаминергическая стимуляция может влиять на уровни синтеза мРНК GAD67 [54], можно предположить, что низкое содержание фермента в инсулярной коре может быть связано с дофаминовым контролем.
Низкое содержание GAD67 также могло бы быть связано с преобладанием далекопроецирующих интернейронов над интернейронами, образующими связи внутри области инсулярной коры. Поскольку GAD67, в отличие от других ферментативных маркеров нейронов: тирозингидроксилазы и холинацетилтрансферазы [55], не распределен равномерно по цитоплазме клетки, интенсивность окрашивания кажется меньшей, чем в других зонах коры. Однако на сегодняшний день информации об интернейронном составе этой области и их связях недостаточно, чтобы сделать вывод о снижении интенсивности окрашивания GAD67 в связи с преобладанием далекопроецирующих нейронов в инсулярной области коры.
Как было показано, наибольшей интенсивностью окрашивания характеризуются вентральные структуры мозга. К 30-м постнатальным суткам резкое различие в интенсивности окрашивания начинает снижаться. Тем не менее, в подкорковых структурах у половозрелых животных caudate-putamen проявляет меньшую интенсивность окрашивания, чем globus pallidus, что сохраняется и при старении. Эти наблюдения согласуются с данными о субпаллиальном происхождении большей части ГАМКергических интернейронов головного мозга [2]. К такому же выводу пришли Да́вила и соавторы, которые наблюдали похожее соотношение интенсивностей окрашивания кальбиндин-положительных клеток в дорсальной и вентральной части комплекса ограды. Они также отметили кальбиндин-положительные нейроны с интенсивным и слабым окрашиванием и предположили, что интенсивность окрашивания на кальбиндин может быть связана с фенотипом ГАМКергических нейронов [56].
На ранних сроках в субвентрикулярной зоне наблюдали GAD67-положительные клетки. Поскольку предполагается, что субвентрикулярная зона служит дополнительным источником клеток-предшественники ГАМКергических нейронов [8], можно ожидать присутствие этих клеток не только на постнатальных, но и на эмбриональных стадиях развития мозга. Действительно, в экспериментах на мышах показано, что ГАМКположительные клетки можно наблюдать в субвентрикулярной зоне в позднем пренатальном (E14-E19) и раннем постнатальном онтогенезе (P0-P8) [15]. ГАМКергические клетки также наблюдали в вентрикулярной зоне в эмбриогенезе (E14-E20) у крыс породы Вистар [57]. GAD67-положительные клетки в субвентрикулярной зоне на более поздних сроках не наблюдаются, однако присутствуют у старых животных. По всей видимости, это связано с дифференцировкой клеток нейрогенной зоны в ответ на нейродегенеративные процессы, происходящие при старении в условиях торможения миграции.
В нашем исследовании впервые было обращено внимание на онтогенетическую динамику иммунореакивности GAD67 в эпителиоцитах сосудистого сплетения. Ранее, в сосудистом сплетении мозга эмбрионов мышей была отмечена иммуногистохимическая реакция на другой фермент синтеза ГАМК, GAD65 [58]. В противоположность этому, GAD67 на данном этапе развития не был обнаружен. Хотя в отдельных публикациях также можно наблюдать, что апикальная часть эпителиоцитов сосудистого сплетения мозга взрослых животных содержит GAD67 [59], авторы не акцентируют на этом внимания, поскольку эта область не является их зоной интереса. Из этого можно сделать вывод, что факт наличия GAD67 в этой зоне не является артефактом иммуногистохимического окрашивания. Об этом также свидетельствует то, что в препаратах отрицательного контроля никакой иммунной активности как со стороны сосудистого сплетения, так и со стороны остальных структур, не было отмечено.
Поэтому возникает вопрос, могут ли клетки сосудистого сплетения вырабатывать внесинаптическую ГАМК. Поскольку локализация фермента приближена к апикальной поверхности, а также известно, что ГАМК содержится в цереброспинальной жидкости (ЦСЖ), можно предположить, что выработка ГАМК в сосудистом сплетении производится для дальнейшего транспорта аминокислоты в ЦСЖ. Существует мнение, что ГАМК поступает в ЦСЖ из крови [60]. Однако известно, что такой продукт сыворотки крови как транстиретин (преальбумин) попадает в ЦСЖ не из крови, но синтезируется в эпителиоцитах сосудистого сплетения [61]. Кроме того, было выявлено, что уровень транспорта ГАМК в ЦСЖ снижается у половозрелых крыс по сравнению с молодыми животными [60]. Это может косвенно указывать на то, что синтез ГАМК в апикальной части эпителиоцитов сосудистого сплетения с помощью GAD67 действительно происходит и усиливается с возрастом. Снижение интенсивности флуоресценции при старении говорит об уменьшении количества фермента у старых животных.
ВЫВОДЫ
Проведенное исследование характеризует морфологические изменения, происходящие в ГАМКергической системе в ходе постнатального онтогенеза. 1) Преимущественная локализация ГАМКергических синаптических структур, наблюдаемая в I слое коры 7-дневных животных, может быть связана с обеспечением процесса миграции нейронов. 2) Предполагаемые ГАМКергические клетки Кахаля–Ретциуса у крыс не выявляются с помощью иммуногистохимической реакции на GAD67, следовательно, они не являются ГАМКергическими. 3) Наличие GAD67-положительных клеток в субвентрикулярной зоне мозга на ранних сроках постнатального онтогенеза и у старых животных указывает на наличие клеток-предшественников ГАМКергических нейронов и их дифференцировку в пределах данной области мозга. Их локальное появление при старении может быть связано с замедлением процесса миграции. 4) Эпителиоциты сосудистого сплетения головного мозга к концу первого месяца развития могут являться источником внесинаптической ГАМК, поступающей в цереброспинальную жидкость.
Список литературы
Kubota Y. // Curr. Opin. Neurobiol. 2014. V. 26. P. 7–14.
Lim L., Mi D., Llorca A., Marín O. // Neuron. 2018. V. 100. № 2. P. 294–313.
Wang B., Long J.E., Flandin P., Pla R., Waclaw R.R., Campbell K., Rubenstein J.L.R. // J. Comp. Neurol. 2013. V. 521. № 7. P. 1561–1584.
Long J.E., Cobos I., Potter G.B., Rubenstein J.L.R. // Cereb. Cortex. 2009. V. 28. P. 3797–3815.
Wang Y., Neubauer F.B., Lüscher H.R., Thurley K. // Eur. J. Neurosci. 2010. V. 31. № 9. P. 1582–1594.
Sandberg M., Flandin P., Silberberg S., Su-Feher L., Price J.D., Hu J.S., Kim C., Visel A., Nord A.S., Rubenstein J.L.R. // Neuron. 2016. V. 91. № 5. P. 1260–1275.
Liu Z., Zhang Z., Lindtner S., Li Z., Xu Z., Wei S., Liang Q., Wen Y., Tao G., You Y., Chen B., Wang Y., Rubenstein J.L., Yang Z. // Cereb. Cortex. 2019. V. 29. № 6. P. 2653–2667.
Shmakova A.A., Balatskiy A.V., Kulebyakina M.A., Schaub T., Karagyaur M.N., Kulebyakin K.Y., Rysenkova K.D., Tarabykin V.S., Tkachuk V.A., Semina E.V. // Russ. J. Dev. Biol. 2021. V. 52. № 1. P. 53–63.
Al-Jaberi N., Lindsay S., Sarma S., Bayatti N., Clowry G.J. // Cereb. Cortex. 2015. V. 25. № 3. P. 631–645.
Radonjić N.V., Ayoub A.E., Memi F., Yu X., Maroof A., Jakovcevski I., Anderson S.A., Rakic P., Zecevic N. // Cell Rep. 2014. V. 9. № 6. P. 2139–2151.
Okaty B.W., Miller M.N., Sugino K., Hempel C.M., Nelson S.B. // J. Neurosci. 2009. V. 29. № 21. P. 7040–7052.
Rice F.L., Gomez C., Barstow C., Burnet A., Sands P. // J. Comp. Neurol. 1985. V. 236. № 4. P. 477–495.
Vincent S.L., Pabreza L., Benes F.M. // J. Comp. Neurol. 1995. V. 355. № 1. P. 81–92.
Foster A.C., Kemp J.A. // Curr. Opin. Pharmacol. 2006. V. 6. P. 7–17.
Le Magueresse C., Monyer H. // Neuron. 2013. V. 77. № 3. P. 388–405.
Behar T.N., Schaffner A.E., Scott C.A., O’Connell C., Barker J.L. // J. Neurosci. 1998. V. 18. № 16. P. 6378–6387.
Li S., Kumar P., Joshee S., Kirschstein T., Subburaju S., Khalili J.S., Kloepper J., Du C., Elkhal A., Szabó G., Jain R.K., Köhling R., Vasudevan A. // Cell Res. 2018. V. 28. № 2. P. 221–248.
Oh W.C., Lutzu S., Castillo P.E., Kwon H.B. // Science. 2016. V. 353. № 6303. P. 1037–1040.
Wang D.D., Kriegstein A.R. // J. Physiol. 2009. V. 587. № 9. P. 1873–1879.
Ben-Ari Y. // Epileptic Disord. 2006. V. 8. № 2. P. 91–102.
Bregestovski P., Bernard C. // Front. Pharmacol. 2012. V. 3. № 65. 5 p.
Zilberter M. // J. Neurosci. 2016. V. 36. № 40. P. 10242–10244.
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V., Grigorev I.P. // Eur. J. Histochem. 2015. V. 59. № 3. P. 5–9.
Gusel’nikova V.V., Korzhevskii D.E. // Neurosci. Behav. Physiol. 2018. V. 48. № 2. P. 153–156.
Greif K.F., Erlander M.G., Tillakaratne N.J.K., Tobin A.J. // Neurochem. Res. 1991. V. 16. № 3. P. 235–242.
Shihan M.H., Novo S.G., Le Marchand S.J., Wang Y., Duncan M.K. // Biochem. Biophys. Reports. 2021. V. 25. P. 100916.
Колос Е.А., Григорьев И.П., Коржевский Д.Э. // Морфология 2015. Т. 147. № 1. С. 78–82.
Nakamoto K.T., Mellott J.G., Killius J., Storey-Workley M.E., Sowick C.S., Schofield B.R. // Front. Neuroanat. 2014. V. 8. № 108. P. 1–13.
Cesa R., Morando L., Strata P. // Proc. Natl. Acad. Sci. USA. 2008. V. 105. № 48. P. 18988–18993.
Peters A. // J. Neurocytol. 2002. V. 31. № 3–5 Spec. Iss. P. 183–193.
Lodato S., Arlotta P. // Annu. Rev. Cell Dev. Biol. 2015. V. 31. P. 699–720.
Feldmeyer D., Qi G., Emmenegger V., Staiger J.F. // Neuroscience. 2018. V. 368. P. 132–151.
Tremblay R., Lee S., Rudy B. // Neuron. 2016. V. 91. № 2. P. 260–292.
Ascoli G.A., Alonso-Nanclares L., Anderson S.A., Barrionuevo G., Benavides-Piccione R., Burkhalter A., Buzsáki G., Cauli B., DeFelipe J., Fairén A., Feldmeyer D., Fishell G., Fregnac Y., Freund T.F., Gardner D., Gardner E.P., Goldberg J.H., Helmstaedter M., Hestrin S., Karube F., Kisvárday Z.F., Lambolez B., Lewis D.A., Marin O., Markram H., M$\tilde {u}$oz A., Packer A., Petersen C.C.H., Rockland K.S., Rossier J., Rudy B., Somogyi P., Staiger J.F., Tamas G., Thomson A.M., Toledo-Rodriguez M., Wang Y., West D.C., Yuste R. // Nat. Rev. Neurosci. 2008. V. 9. № 7. P. 557–568.
Defelipe J., López-Cruz P.L., Benavides-Piccione R., Bielza C., Larrañaga P., Anderson S., Burkhalter A., Cauli B., Fairén A., Feldmeyer D., Fishell G., Fitzpatrick D., Freund T.F., González-Burgos G., Hestrin S., Hill S., Hof P.R., Huang J., Jones E.G., Kawaguchi Y., Kisvárday Z., Kubota Y., Lewis D.A., Marín O., Markram H., McBain C.J., Meyer H.S., Monyer H., Nelson S.B., Rockland K., Rossier J., Rubenstein J.L.R., Rudy B., Scanziani M., Shepherd G.M., Sherwood C.C., Staiger J.F., Tamás G., Thomson A., Weng Y., Yuste R., Ascoli G.A. // Nat. Rev. Neurosci. 2013. V. 14. № 3. P. 202–216.
Mihaljević B., Benavides-Piccione R., Bielza C., Larrañaga P., DeFelipe J. // Sci. data. 2019. V. 6. № 1. P. 221.
Favuzzi E., Deogracias R., Marques-Smith A., Maeso P., Jezequel J., Exposito-Alonso D., Balia M., Kroon T., Hinojosa A.J., Maraver E.F., Rico B. // Science. 2019. V. 363. № 6425. P. 413–417.
Kohno T., Honda T., Kubo K.I., Nakano Y., Tsuchiya A., Murakami T., Banno H., Nakajima K., Hattori M. // J. Neurosci. 2015. V. 35. № 11. P. 4776–4787.
Cheng Q., Yeh P.W.L., Yeh H.H. // Eur. J. Neurosci. 2006. V. 24. № 8. P. 2145–2151.
Gonchar Y., Wang Q., Burkhalter A.H. // Front. Neuroanat. 2008. V. 1. P. 3.
Wang Y., Toledo-Rodriguez M., Gupta A., Wu C., Silberberg G., Luo J., Markram H. // J. Physiol. 2004. V. 561. № 1. P. 65–90.
Imamoto K., Karasawa N., Isomura G., Nagatsu I. // Neurosci. Res. 1994. V. 20. № 1. P. 101–105.
Sarnat H.B., Flores-Sarnat L. // Semin. Pediatr. Neurol. 2002. V. 9. № 4. P. 302–308.
Chowdhury T.G., Jimenez J.C., Bomar J.M., Cruz-Martin A., Cantle J.P., Portera-Cailliau C. // Front. Neuroanat. 2010. V. 4. № 10. 8 p.
Derer P., Derer M. // Neuroscience. 1990. V. 36. № 3. P. 839–856.
Jiang X., Wang G., Lee A.J., Stornetta R.L., Zhu J.J. // Nat. Neurosci. 2013. V. 16. P. 210–218.
Oláh S., Füle M., Komlósi G., Varga C., Báldi R., Barzó P., Tamás G. // Nature. 2009. V. 461. № 7268. P. 1278–1281.
Fedosikhina L.A. // Neurosci. Behav. Physiol. 1986. V. 16. № 4. P. 340–345.
Григорьев И.П., Алексеева О.С., Кирик О.В., Суфиева Д.А., Коржевский Д.Э. // Морфология. 2018. Т. 154. № 5. С. 7–12.
Naskar S., Narducci R., Balzani E., Cwetsch A.W., Tucci V., Cancedda L. // Nat. Commun. 2019. V. 10. № 1. P. 1–12.
Molnár Z., Blakemore C. // Trends. Neurosci. 1995. V. 18. № 9. P. 389–397.
Behuet S., Cremer J.N., Cremer M., Palomero-Gallagher N., Zilles K., Amunts K. // Front. Neuroanat. 2019. V. 13. № 100. 14 p.
Ohara P.T., Granato A., Moallem T.M., Wang B.R., Tillet Y., Jasmin L. // J. Neurocytol. 2003. V. 32. № 2. P. 131–141.
Rétaux S., Trovero F., Besson M.-J. // Eur. J. Neurosci. 1994. V. 6. № 12. P. 1782–1791.
Kolos E.A., Korzhevskii D.A. // Neurochem. J. 2016. V. 10. № 1. P. 47–52.
Dávila J.C., Real M.Á., Olmos L., Legaz I., Medina L., Guirado S. // J. Comp. Neurol. 2005. V. 481. № 1. P. 42–57.
Cobas A., Fairén A., Alvarez-Bolado G., Sánchez M.P. // Neuroscience. 1991. V. 40. № 2. P. 375–397.
Tochitani S., Kondo S. // PLoS One. 2013. V. 8. № 2. 7 p.
Andrews W.D., Barber M., Nemitz M., Memi F., Parnavelas J.G. // Brain Struct. Funct. 2017. V. 222. № 5. P. 2217–2233.
Al-Sarraf H. // Dev. Brain Res. 2002. V. 139. № 2. P. 121–129.
Vieira M., Saraiva M.J. // Biomol. Concepts. 2014. V. 5. № 1. P. 45–54.
Дополнительные материалы отсутствуют.


