Неорганические материалы, 2019, T. 55, № 10, стр. 1087-1091
Влияние давления кислорода на термодинамическую стабильность Nd0.85Ba0.15MnO3
О. М. Федорова 1, *, Л. Б. Ведмидь 1, 2, В. М. Димитров 1
1 Институт металлургии УрО Российской академии наук
620016 Екатеринбург, ул. Амундсена, 101, Россия
2 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
* E-mail: fom55@mail.ru
Поступила в редакцию 16.12.2018
После доработки 04.04.2019
Принята к публикации 16.04.2019
Аннотация
Представлены результаты исследования структуры соединения Nd0.85Ba0.15MnO3 и его стабильности в условиях пониженного парциального давления кислорода. Определены структурные характеристики Nd0.85Ba0.15MnO3 методом рентгенофазового анализа. Статическим методом с использованием вакуумной циркуляционной установки установлена последовательность фазовых превращений в системе Nd–Ba–Mn–O при понижении давления кислорода от атмосферного до –21 атм.
ВВЕДЕНИЕ
Манганиты редкоземельных элементов Ln1 ‒ xAxMnO3 (Ln = редкоземельный элемент; A = = Ca, Sr, Ba) привлекают внимание исследователей своими интересными физическими свойствами – эффектом колоссального магнитосопротивления [1], магнитокалорическим эффектом [2]. Замещение трехвалентного редкоземельного элемента на двухвалентный щелочноземельный элемент приводит к возникновению переменной степени окисления марганца, ответственной за фазовые изменения и появление уникальных свойств рассматриваемых манганитов. Еще один способ достижения переменной валентности ионов марганца – изменение кислородной нестехиометрии образцов. Манганиты, допированные Ba, представляют интерес благодаря значительной разнице между величинами ионных радиусов лантаноида и бария. Различие между ионными радиусами лантаноида и щелочноземельного металла благоприятствует формированию ян-теллеровского искажения в этих манганитах [3].
Несомненный интерес представляет область исследования сложных оксидов в широких интервалах температур и давлений кислорода в равновесии с фазами других составов, построение диаграмм состояния. Детально исследовался лишь разрез LaMnO3 ±d–BaMnO3 –d, твердые растворы La1 –xBaxMnO3 ±d при 1100°С на воздухе образуются в интервале 0 < х ≤ 0.3 [4, 5]. Содержание бария может быть увеличено при использовании восстановительных условий (понижение давления кислорода вкупе с увеличением температуры) вплоть до х = 0.5, но при этом наблюдается эффект упорядочения с образованием фазы двойного перовскита LaBaMn2O6 – δ [6]. Упорядочению подвергаются А-катионы: La и Ва, которые располагаются в чередующихся слоях, удваивая таким образом элементарную ячейку вдоль оси с, а также и вакансии кислорода, концентрирующиеся в плоскости La–O, формируя при этом более сложные сверхструктуры [7]. Систематическое изучение фазовых равновесий при переменном давлении кислорода допированных манганитов РЗЭ не проводилось [8].
Задачей настоящего исследования явилось изучение интервалов термодинамической стабильности соединения Nd0.85Ba0.15MnO3 в широком диапазоне температур и давлений кислорода.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез соединения Nd0.85Ba0.15MnO3 был осуществлен по керамической технологии из оксидов Nd2O3, BaCO3, Mn2O3 при температуре 1250°C в течение 70 ч на воздухе с последующим охлаждением с печью.
Последовательность фазовых равновесий при удалении из Nd0.85Ba0.15MnO3 фиксированных порций кислорода изучена статическим методом с использованием вакуумной циркуляционной установки [9]. Использованная экспериментальная установка обеспечивала точность поддержания температуры ±3 К, определения парциального давления кислорода – lg(${{p}_{{{{{\text{O}}}_{{\text{2}}}}}}}$ Па–1) ± 0.1, количества кислорода, удаляемого из исходного образца, (m) – ±1.0 ат. %. Рентгенофазовый анализ исходных образцов и продуктов их диссоциации проводился на дифрактометре XRD-7000 (Shimadzu) в CuKα-излучении в диапазоне углов 20°–70° по 2θ с шагом 0.03° и выдержкой в точке 2 с. Уточнение кристаллической структуры образцов проведено методом Ритвельда с использованием программного комплекса GSAS [10].
Изучение термических свойств Nd0.85Ba0.15MnO3 выполнено на приборе синхронного термического анализа STA 449 F3 (NETZSCH) в атмосферах с различным давлением кислорода при нагреве от комнатной температуры до 765°C со скоростью 10°С/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
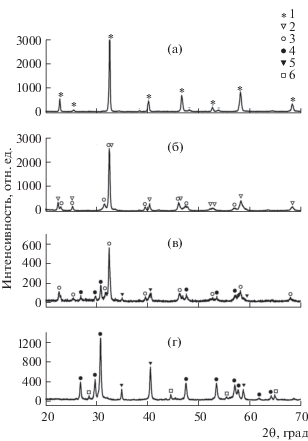
Полученный однофазный образец Nd0.85Ba0.15MnO3 имеет орторомбическую структуру (пр. гр. Pmna), параметры элементарной ячейки: а = 5.4850(2), b = 7.7439(5), c = 5.5256(4) Å, V = 234.75(9) Å3 (рис. 1a). Соотношение параметров а < $\frac{b}{{\sqrt 2 }}$ < c свидетельствует о том, что это орбитально упорядоченная О'-фаза [11].
Рис. 1.
Дифрактограммы образцов: а – исходного Nd0.85Ba0.15MnO3, б – на первом этапе, в – на втором этапе, г – на третьем этапе разложения исходного образца: 1 – Nd0.85Ba0.15MnO3, 2 – Nd0.7Ba0.3MnO3, 3 – NdMnO3, 4 – Nd2O3, 5 – MnO, 6 – BaO.
Обработка полученного образца при пониженном давлении кислорода приводит к следующей последовательности фазовых превращений. Сначала происходит изменение кислородной нестехиометрии образца Nd0.85Ba0.15MnO3. Эта фаза стабильна в интервале температур от комнатной до 834°C и давлении кислорода от атмосферного до –14 атм. При температуре 834°C и давлении кислорода –14 атм происходит разложение сложного оксида на два других сложных оксида по уравнению
(1)
$2{\text{N}}{{{\text{d}}}_{{{\text{0}}{\text{.85}}}}}{\text{B}}{{{\text{a}}}_{{{\text{0}}{\text{.15}}}}}{\text{Mn}}{{{\text{O}}}_{{\text{3}}}}\, = \,{\text{N}}{{{\text{d}}}_{{{\text{0}}{\text{.7}}}}}{\text{B}}{{{\text{a}}}_{{{\text{0}}{\text{.3}}}}}{\text{Mn}}{{{\text{O}}}_{3}}\, + \,{\text{NdMn}}{{{\text{O}}}_{3}}.$Таким образом, наблюдается обогащение одной фазы барием с образованием более устойчивого в этих условиях твердого раствора Nd0.7Ba0.3MnO3 и недопированного манганита неодима. Рентгенограмма фаз, находящихся в равновесии на данной стадии, представлена на рис. 1б.
Дальнейшее понижение температуры (t = 765°С) и давления кислорода (–17 атм) приводит к диссоциации сложного оксида NdMnO3 с выделением оксидов неодима и марганца по уравнению
(2)
$\begin{gathered} {\text{2N}}{{{\text{d}}}_{{{\text{0}}{\text{.85}}}}}{\text{B}}{{{\text{a}}}_{{{\text{0}}{\text{.15}}}}}{\text{Mn}}{{{\text{O}}}_{{\text{3}}}} = {\text{N}}{{{\text{d}}}_{{{\text{0}}{\text{.7}}}}}{\text{B}}{{{\text{a}}}_{{{\text{0}}{\text{.3}}}}}{\text{Mn}}{{{\text{O}}}_{{\text{3}}}} + \\ + \,\,0.5{\text{N}}{{{\text{d}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{3}}}} + {\text{MnO}} + 0.25{{{\text{О}}}_{2}}. \\ \end{gathered} $Рентгенограмма продуктов данной реакции представлена на рис. 1в.
При выдержке в течение 96 ч при фиксированной температуре t = 765°С и давлении кислорода –21 атм происходит полное восстановление исходного соединения Nd0.85Ba0.15MnO3 до простых оксидов (рис. 1г) по уравнению
(3)
$\begin{gathered} 2{\text{N}}{{{\text{d}}}_{{{\text{0}}{\text{.85}}}}}{\text{B}}{{{\text{a}}}_{{{\text{0}}{\text{.15}}}}}{\text{Mn}}{{{\text{O}}}_{{\text{3}}}} = 0.85{\text{N}}{{{\text{d}}}_{{\text{2}}}}{{{\text{О}}}_{{\text{3}}}} + {\text{ }}0.3{\text{BaO}}\,{\text{ + }} \\ + \,\,2{\text{MnO}} + 0.575{{{\text{О}}}_{2}}. \\ \end{gathered} $В результате полного восстановления Nd0.85Ba0.15MnO3 до простых оксидов определена абсолютная кислородная нестехиометрия исходного соединения. Ее определение проведено в вакуумной циркуляционной установке гравиметрическим методом при понижении давления кислорода путем введения небольших, точно отмеренных порций водорода. Расчет кислородной нестехиометрии выполнен по формуле
(4)
$\delta = \frac{M}{{15.9994}} - \frac{{m{{M}_{{{\text{восст}}}}}}}{{{{m}_{{{\text{восст}}}}} \times 15.9994}},$где М – молекулярная масса исследуемой фазы, Мвосст – суммарная молекулярная масса твердых продуктов реакции восстановления с учетом стехиометрических коэффициентов, 15.9994 – атомная масса кислорода, mвосст – масса твердых продуктов реакции восстановления при экспериментальной температуре, m – масса навески. При этом на основании данных [12] сделано допущение об отсутствии значимой кислородной нестехиометрии продуктов диссоциации (MnO, ВаO и Nd2O3) в условиях нашего эксперимента. Согласно расчету, кислородная нестехиометрия соединения Nd0.85Ba0.15MnO3 + δ составила +0.03, т.е. формулу этого соединения можно записать как Nd0.85Ba0.15MnO3.03.
При изучении термических свойств Nd0.85Ba0.15MnO3.03 методом совмещенного термоанализа (ТГ, ДСК) на приборе STA 449 F3 (рис. 2) установлено, что при линейном нагреве до температуры 765°С с понижением давления кислорода в используемой газовой атмосфере кислородная нестехиометрия образцов уменьшается (данные приведены в табл. 1). При этом в диапазоне давлений от атмосферного до –5 атм не происходит видимого изменения фазового состава образцов, что подтверждается данными РФА. Присутствие экзотермических пиков в диапазоне температур 240–270°С (для всех трех образцов) свидетельствует о начале процесса изменения кислородной стехиометрии и частичном снятии ян-теллеровского искажения.
Рис. 2.
Кривые ТГ и ДСК образцов Nd0.85Ba0.15MnO3 при нагреве в газовой атмосфере с пониженным давлением кислорода: 1 (1), –3.5 (2), –5 атм (3).
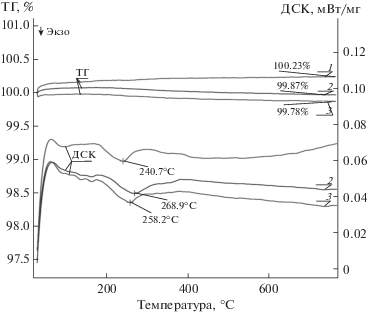
Таблица 1.
Интервалы стабильности при воздействии давления кислорода на Nd0.85Ba0.15MnO3.03, кислородная нестехиометрия (δ) и характеристики образующихся фаз
| Фаза | Давление кислорода, атм | C, % | Параметры ячейки, Å | δ | ||
|---|---|---|---|---|---|---|
| а | b | c | ||||
| Nd0.85Ba0.15MnO3 | 1 | 100 | 5.4828(3) | 7.7588(6) | 5.5018(9) | 0.04 |
| Nd0.85Ba0.15MnO3 | –3.5 | 100 | 5.4789(2) | 7.7574(7) | 5.5122(4) | 0.03 |
| Nd0.85Ba0.15MnO3 | –5 | 100 | 5.4798(2) | 7.7549(5) | 5.5133(4) | 0.02 |
| Nd0.85Ba0.15MnO3 | от–5 до –14 | 100 | 5.4817(2) | 7.7561(5) | 5.5167(4) | –0.01 |
| Nd0.7Ba0.3MnO3 | от –14 до –21 | 69.4 | 5.5048(2) | 7.7676(5) | 5.6233(2) | –0.03 |
| NdMnO3 | от –17 до –21 | 30.6 | 5.5249(2) | 7.7579(6) | 5.6887(3) | 0 |
Протекание первого этапа разложения допированного барием манганита неодима, заключающегося в образовании двух сложных оксидов марганца, один из которых обогащен барием, а второй обеднен, довольно необычно, поэтому мы провели структурные исследования получившихся фаз методом Ритвельда с использованием программного комплекса GSAS. В качестве стартовых были выбраны координаты атомов, приведенные в работе [13] для Nd0.7Ba0.3MnO3 и в работе [14] для NdMnO3. Дифрактограмма уточненного профиля (рис. 3) демонстрирует хорошее соответствие полученных экспериментальных данных с расчетными (параметр соответствия χ2 = 2.67). Параметры элементарных ячеек образовавшихся фаз приведены в табл. 1.
ЗАКЛЮЧЕНИЕ
В ходе проведенного исследования установлено, что в атмосфере пониженного давления кислорода сложный оксид Nd0.85Ba0.15MnO3.03 претерпевает фазовые превращения. Разложение данного оксида до простых протекает в три этапа: на первом происходит образование двух сложных оксидов, один из которых обогащен ионами бария, а во втором эти ионы отсутствуют. На втором этапе происходит диссоциация двойного оксида NdMnO3 на простые оксиды Nd2O3 и MnO, на третьем – полное разложение Nd0.85Ba0.15MnO3 + 0.03 на простые оксиды Nd2O3, ВаО и MnO. Определены температуры и значения парциального давления кислорода на каждом этапе.
Список литературы
Dagotto E., Hotto T., Moreo A. Colossal Magnetoresistante Materials: the Key Role of Phase Separation // Phys. Rep. 2001. V. 344. P. 1–153.
IslamA M.S., KhanC B.F.A., HakimD M.A., MinhE D.L., ChauE N. Structure, Magneticand Magnetocaloric Properties of La0.7(Ca1– x Bax)0.3MnO3 Perovskite Manganites // J. Sci. Res. Phys. Math. Sci. 2015. V. 2. № 1. P. 1–30.
Kamegashira N., Miyazaki Y. Nonstoichiometry and Phase Transition in NdMnO3 // Mat. Res. Bull. 1984. V. 19. P. 1201–1206.
Cherepanov V.A., Filonova E.A., Voronin V.I., Berger I.F. Phase Equilibria in the LaCoO3–LaMnO3–BaCoOz–BaMnO3 System // J. Solid State Chem. 2000. V. 153. № 2. P. 205–211.
Radaelli P.G., Marezio M., Hwang H.Y., Cheong S.W. Structural Phase Diagram of Perovskite A0.7${\text{A}}_{{0.{\text{3}}}}^{'}$MnO3 (A = La, Pr; A' = Ca, Sr, Ba): A New Imma Allotype // J. Solid State Chem. 1996. V. 122. № 2. P. 444–447.
Millange F., Caignaert V., Domenges B., Raveau B., Suard E. Order–Disorder Phenomena in New LaBaMn2O6 –x CMR Perovskites. Crystal and Magnetic Structure // Chem. Mater. 1998. V. 10. P. 1974–1983.
Caignaert V., Millange F., Domenges B., Raveau B. A New Ordered Oxygen-Deficient Manganite Perovskite: LaBaMn2O5.5. Crystal and Magnetic Structure // Chem. Mater. 1999. V. 11. P. 930–938.
Черепанов В.А., Гаврилова Л.Я., Волкова Н.Е., Урусова А.С., Аксенова Т.В., Киселев Е.А. Фазовые равновесия и термодинамические свойства оксидов в системах на основе редкоземельных, щелочноземельных и 3d-переходных (Mn, Fe, Co) металлов. Краткий обзор // Chim. Techno Acta. 2015. № 4. С. 289–305.
Yankin A.M., Balakirev V.F., Vedmid’ L.B., Fedorova O.M. A Static Method for Studying Heterogeneous Equilibria // Russ. J. Phys. Chem. 2003. V. 77. № 11. P. 1899–1902.
Larson A.C., Von Dreel R.B. General Structure Analysis System (GSAS). LANSCE, MS-H805. Los Alamos: Los Alamos National Laboratory, 1986. № 87545.
Kasper N.V., Troyanchuk I.O. Study of Jahn-Teller Phase Transitions in Nonstoichiometric RMnO3 +x Orthomanganites (R = La, Nd. Sm, Eu) // J. Phys. Chem. Solids. 1996. V. 57. № 11. P. 1601–1607.
Янкин А.М., Балакирев В.Ф., Федорова О.М., Голиков Ю.В. Манганиты редкоземельных и щелочно-земельных элементов. Физико-химический анализ. Екатеринбург: УрО РАН, 2009. 290 с.
Kundu A.K., Selkh M.M., Ramesha K., Rao C.N.R. Novel Effect of Size Disorder on the Electronic and Magnetic Properties of Rare Earth Manganeses of the Type La0.7 –xLnxBa0.3MnO3 (Ln = Pr, Nd, Gd or Dy) with Large Average Radius of the A-Site Cations // J. Phys. Condens. Matter. 2005. V. 17. P. 4171–4180.
Dabrovski B., Kolesnik S., Baszczuk A., Chmaissem O., Maxwell T., Mais J. Structural, Transport and Magnetic Properties of RMnO3 Perovskites (R = La, Pr, Nd, Sm, 153Eu, Dy) // J. Solid State Chem. 2005. V. 178. P. 629–637.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы