Неорганические материалы, 2019, T. 55, № 11, стр. 1219-1223
Синтез муллита из раствора в расплаве
В. А. Маслов 1, В. В. Воронов 1, Л. Д. Исхакова 2, Е. Г. Яроцкая 1, П. П. Федоров 1, *
1 Институт общей физики им. А.М. Прохорова Российской академии наук
119991 Москва, ул. Вавилова, 38, Россия
2 Научный центр волоконной оптики Российской академии наук
119991 Москва, ул. Вавилова, 38, Россия
* E-mail: ppfedorov@yandex.ru
Поступила в редакцию 15.02.2019
После доработки 16.04.2019
Принята к публикации 20.04.2019
Аннотация
Исследовано фазообразование муллита при перекристаллизации из раствора-расплава высокоглиноземистой керамики. Использование флюсов, содержащих щелочные металлы, приводит к кристаллизации соответствующих алюмосиликатов. Положительный результат получен при использовании в качестве растворителя расплава PbO–V2O5, причем муллит растворяется в нем инконгруэнтно.
ВВЕДЕНИЕ
Муллит – аналог редкого природного минерала, высокотемпературная фаза переменного состава, образующаяся в системе из оксидов алюминия и кремния [1–7]. Химическая формула муллита может быть записана как Al[AlxSi2 –xO5.5 – 0.5x], где x = 0.17–0.59. В ромбической структуре муллита имеет место чередование связанных вершинами тетраэдров SiO4 и AlO4, а также присутствуют колонки из октаэдров AlO6, связанных ребрами.
Муллит – единственный алюмосиликат, устойчивый при высоких температурах, и важнейший технический материал. Муллит входит в состав огнеупорной и кислотостойкой керамики, используется в качестве покрытий и катализаторов. Нитевидные и игольчатые кристаллы муллита используются в различных композиционных материалах с участием стекол, фарфора, керамики, полимеров, а также металлокерамики.
Фазовая диаграмма системы Al2O3–SiO2 изучалась многократно [8, 9]. Фаза муллита имеет ширину около 3 мол. %, причем ее равновесный состав смещается при понижении температуры в область меньших содержаний алюминия. Температурная область термодинамической устойчивости фазы муллита 1890–932°С. Низкотемпературная упорядоченная фаза – силлиманит Al2SiO5 – при 1200°С разлагается на высокотемпературный муллит и SiO2. Характер плавления муллита был предметом многочисленных дискуссий. Можно констатировать, что при нормальном давлении он является промежуточным между конгруэнтным и инконгруэнтным и соответствует окрестности точки бифуркации фазовой диаграммы [10]. Практическая устойчивость муллитовой фазы выходит далеко за границы термодинамической устойчивости. Распад муллита чрезвычайно заторможен, и эта фаза практически устойчива при температурах ниже эвтектоидного равновесия (932°С).
При синтезе муллита большое значение имеют минерализаторы, которые обеспечивают появление жидкой фазы и оказывают значительное влияние на вязкость и структуру расплава, а также, соответственно, и на характеристики конечного продукта. Влияние минерализаторов на степень муллитизации в стехиометрических составах SiO2–AlO3 увеличивается в ряду: TiO2–NaCl–CaCO3–MnO2–LiCl–MgCO3–LiF. Добавка LiF при 1400°С приводит к синтезу 100% муллита. Габитус кристаллов муллита зависит от введенного в шихту минерализатора.
В основном получают керамику, поликристаллы, нитевидные кристаллы муллита. Выращивание объемных монокристаллов муллита из расплава затруднено высокой температурой плавления, высокой вязкостью и низкой теплопроводностью расплава [11]. Имеются единичные сообщения о синтезе муллита методами Вернейля [12], Чохральского [5] и холодного тигля (индукционный нагрев) [13].
Монокристаллы муллита, легированные d-элементами (Cr, V, Mn и др.), представляют интерес в качестве материалов фотоники, поэтому исследование возможности кристаллизации муллита при низких температурах с использованием раствор-расплавного метода представляется весьма актуальной проблемой.
Целью настоящей работы является исследования фазообразования при взаимодействии муллита с различными расплавами, используемыми в качестве флюсов при раствор-расплавной кристаллизации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных компонентов, перекристаллизуемых в условиях градиента температуры, использовались стандартная муллитокремнеземистая (МКР) керамика (содержание Al2O3 около 60 мол. %) производства ООО Огнеупоры (г. Домодедово) и профилированный сапфир, полученный методом Степанова (г. Обнинск). В качестве растворителей использовали оксидные составы, применяемые при кристаллизации алюмосиликатов [14], а именно: LiVO3, K2Mo2O7, K2W2O7, PbO–V2O5 (реактивы V2O5 квалификации “ос. ч.”, PbO “х. ч.”, MoO3 и WO3 “ч. д. а.”, K2CO3 “х. ч.” и Li2CO3 “ч. д. а.”).
Исследование растворимости керамики МКР и Al2O3 в растворах-расплавах проводилось в платиновом тигле объемом 50 мл. Керамика и сапфир вырезались в виде брусочков или стержней длиной 20–25 мм, которые могли опускаться в расплав высотой 10–12 мм и извлекаться в процессе растворения. Тигли с исходными реагентами помещали в изотермические условия – в печь сопротивления, регулируемую с точностью 0.1°С, и выдерживали при температуре 970°С в течение 10–18 ч, после чего расплав сливался, а продукты кристаллизации отмывались в 25%-ной азотной кислоте (флюсы PbO–V2O5, LiVO3) или воде (флюсы K2Mo2O7, K2W2O7).
На рис. 1 приведена схема двухзонной печи сопротивления, которая была использована для изучения растворимости керамики МКР в растворах-расплавах и может быть применена для перекристаллизации муллита в условиях градиента температуры.
Рис. 1.
Схема установки для перекристаллизации: 1 – нагреватели из фехраля диаметром 6 мм, 2 – термопары марки ТПP, 3 – стакан платиновый с крышкой диаметром 120 мм, наполненный флюсом, 4 – сетка платиновая с ячейками, 5 – исходная шихта, 6 – теплоотвод платиновый.
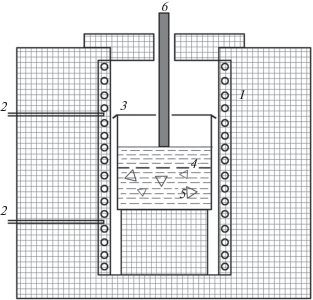
Использованная методика аналогична той, которая применялась для получения монокристаллов изумруда раствор-расплавным методом [15].
Рентгенофазовый анализ проводился на дифрактометре BrukerD8 Advanced, излучение CuKα. Рентгенограммы интерпретировали с использованием базы данных JCPDS.
Микрофотографии получали на сканирующем электронном микроскопе JSM-5910LV, JEOL, ускоряющее напряжение 20 кВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
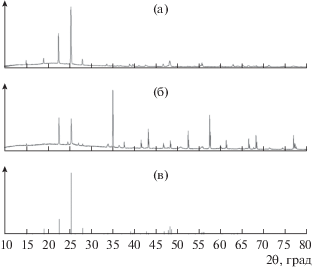
По данным РФА, фазовый состав керамики МКР – смесь муллита и сапфира (рис. 2). При растворении муллитовой керамики в выбранных растворах-расплавах поверхность растворяемых образцов в той части, что погружена в расплав, и особенно в приповерхностной области уже через 2–3 ч покрывается корочкой из кремнеземистых фаз (табл. 1). Образующаяся корочка блокирует поверхность и тормозит процесс растворения. Образующаяся на растворяемой керамике корочка из кристаллических фаз представляет собой смесь тридимита и кристобалита. Примечательно, что в первую очередь образуются не альфа-кварц, а тридимит и кристобалит (рис. 3). Заметим, что использованная температура кристаллизации соответствует термодинамической устойчивости тридимита, а кристобалит является метастабильной фазой [16]. Во всех щелочных растворах-расплавах растворяемая керамика покрывается корочкой, представляющей собой смесь щелочных алюмосиликатов – сподумена и альбита (полевого шпата) (рис. 4). Таким образом, установлено, что стандартная керамика МКР растворяется во всех исследуемых растворах-расплавах инконгруэнтно и для получения алюмосиликата необходимо обогащение растворов-расплавов оксидом алюминия. Подобное инконгруэнтное растворение наблюдается у многих сложных по составу алюмосиликатов, в частности у изумруда [15]. Для кристаллизации подобных алюмосиликатов необходимо использование составов флюсов, обогащенных алюминием.
Рис. 2.
Рентгенограммы: а – керамика МКР, б – муллит (образец 7), в – муллит (карточка JCPDS № 74-4144), г – корунд Al2O3 (карточка JCPDS № 46-1212).
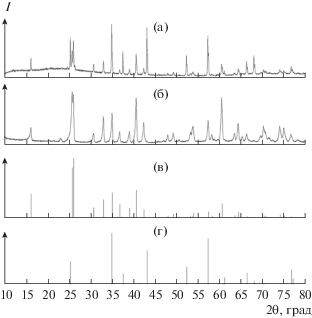
Таблица 1.
Результаты РФА
| Образец | Растворитель | Загрузка | Фазовый состав |
|---|---|---|---|
| 1 | PbO–V2O5 | МКР | SiO2 (тридимит, кристобалит) |
| 2 | K2MоO7 | МКР | KAlSi3O8 + ? |
| 3 | LiVO3 | МКР | LiAlSi3O8 |
| 4 | LiVO3 | МКР | LiAlSi3O8 + Al2O3 |
| 5 | K2WO7 | МКР | KAlSi3O8 + ? |
| 6 | PbO–V2O5 | МКР + Al2O3 | SiO2 (тридимит, кристобалит) |
| 7 | PbO–V2O5 | МКР + Al2O3 | Муллит |
Рис. 3.
Рентгенограммы: а – образец 6, б – тридимит SiO2 (карточка JCPDS № 42-1401), в – кристобалит SiO2 (карточка JCPDS № 39-1425).
Следующая серия экспериментов проводилась с использованием монокристаллического сапфира, который вводился в исследуемые растворы-расплавы одновременно с керамикой МКР. Объем сапфира составлял 20–30% от объема керамики. Установлено, что растворение сапфира во всех растворах-расплавах происходит конгруэнтно, без образования побочных кристаллических фаз. Уже через 8–10 ч при 970°С стержни из сапфира начинали покрываться гладкими гранями, происходила перекристаллизация сапфира. Перекристаллизованный в ванадатных растворах-расплавах сапфир имеет слегка розоватый оттенок, в молибдатном и вольфраматном – бесцветный. Растворимость монокристаллического сапфира при 18-часовой выдержке при 970°С составляет 0.6, 1.9, 1.4, 1.5 мас. % для растворителей PbO–V2O5, LiVO3, K2Mo2O7, K2W2O7 соответственно.
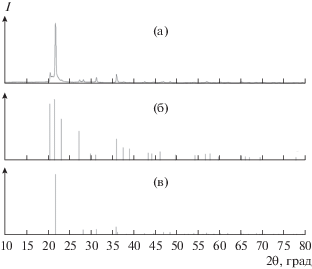
При совместном с сапфиром растворении керамики МКР побочные кристаллические фазы практически отсутствуют. Единичные бесцветные кристаллики видны на керамике, растворяемой в молибдатном и вольфраматном растворах-расплавах. Все керамические образцы были раскристаллизованы и пропитаны расплавом, поэтому определить количество растворенного материала было невозможно. Данные проведенных экспериментов по перекристаллизации приведены в табл. 1, рентгенограммы выявленных фаз представлены на рис. 2–4, микрофотографии – на рис. 5.
Рис. 5.
Микрофотографии образующихся фаз: a – кристобалит + тридимит, блестящие участки – платина (образец 6, Z – контраст), б – платина (образец 7), в – муллит (образец 7).

Таким образом, можно констатировать, что при наличии щелочных катионов в расплаве в зоне кристаллизации происходит формирование многочисленных алюмосиликатов лития и калия, что должно существенно сужать область образования муллита, если таковую удастся найти. При использовании растворителя PbO–V2O5 формирование фазы муллита представляется более реальной задачей исходя из большей раскристаллизованности керамических образцов. Судя по величине растворимости оксида алюминия в свинцово-ванадатном флюсе, состав флюса для конгруэнтного растворения стандартной керамики МКР представляет собой PbV2O6 ⋅ 0.012Al2O3.
В экспериментах по растворимости МКР вместе с сапфиром на приповерхностной части керамических образцов и на стенке платинового тигля в более холодной его части обнаружены микрокристаллы муллита, имеющие игольчатый габитус (рис. 5в), характерный для этой фазы [3].
Необходимо отметить также, что флюс PbO–V2O5 эффективно растворяет платину, которая кристаллизуется в холодной зоне (рис. 3б). Изогнутый габитус микрокристаллов платины свидетельствует о том, что при температуре кристаллизации монокристаллы Pt отличаются высокой пластичностью. Встречаются и гексагональные пластинчатые кристаллики платины среди кристаллизуемых фаз. Весь процесс кристаллизации можно интерпретировать как химическую транспортную реакцию, протекающую в растворе-расплаве.
Несмотря на инконгруэнтный характер растворимости МКР и низкую растворимость оксидов алюминия и кремния в свинцово-ванадатном флюсе (менее 2 мас. %), успешная кристаллизация муллита возможна в условиях перекристаллизации при наличии градиента температуры, как это применялось при выращивании кристаллов изумруда модифицированным методом Чохральского из раствора в расплаве PbO–V2O5 [15]. В качестве перекристаллизуемого вещества желательно использовать керамику муллитового состава.
ЗАКЛЮЧЕНИЕ
Растворитель PbO–V2O5 перспективен для дальнейших экспериментов с целью разработки методики получения муллита путем перекристаллизации высокоглиноземистой керамики раствор-расплавным методом. В связи с низкой растворимостью и инконгруэнтным характером растворения для получения муллита в условиях градиента температуры необходим избыток глинозема в зоне кристаллизации.
Список литературы
Грошева В.М., Карпинос Д.М., Панасевич И.М. Синтетический муллит и материалы на его основе. Киев: Техника, 1971. 375 с.
Aksay I.A., Dabbs D.M., Sarikaya M. Mullite for Structural, Electronic, and Optical Applications // J. Am. Ceram. Soc. 1991. V. 74. P. 2345–2357.
Яроцкая Е.Г., Полянский Е.В., Яроцкий В.Г., Голенко В.П. Муллит // Синтез минералов. Александров: ВНИИСИМС, 2000. Т. 2. С. 142–178.
Scneider H., Komarneri S. Mullite. Weinheim: WILEY-VCH, 2005. 487 p.
Scneider H., Fischer R.X., Screuer J. Mullite: Crystal Structure and Related Properties // J. Am. Ceram. Soc. 2015. V. 98. P. 2948–2967.
Яроцкая Е.Г., Федоров П.П. Муллит и его изоморфные замещения // Конденсированные среды и межфазные границы. 2018. Т. 20. № 4. С. 537–544.
Dong X., Liu J., Li X. et al. Electrospum Mullite Nanofibres from Diphasicmullute sol // J. Am. Ceram. Soc. 2018. V. 101. P. 3425–3433.
Lambotte G., Chartrand P. Thermodynamic Evaluation and Optimization of the Al2O3–SiO2–AlF3–SiF4 Reciprocal System Using the Modified Quasichemical Model //J. Am. Ceram. Soc. 2011. V. 94. P. 4000–4008.
Igami Y., Ohi S., Miyake A. Sillimanite-Mullite Transformation Observed in Synchrotron X-ray Diffraction Experiments // J. Am. Ceram. Soc. 2017. V. 100. P. 4928–4937.
Федоров П.П. Трансформации фазовых T-х диаграмм конденсированного состояния бинарных систем. II. Равновесие фаз с дополнительно наложенными условиями // Журн. физ. химии. 1999. Т. 73. № 9. С. 1551–1556.
Kriven W.N. Solid Solution Range and Microstructures of Melt-Grown Mullite // J. Am. Ceram. Soc. 1983. V. 66. № 9. P. 649–654.
Вильке К.-Т. Выращивание кристаллов. Л.: Недра, 1977. 600 с.
Кузьминов Ю.С., Ломонова Е.Е., Осико В.В. Тугоплавкие материалы из холодного тигля. М.: Наука, 2004. 372 с.
Тимофеева В.А. Рост кристаллов из растворов-расплавов. М.: Наука, 1978. 268 c.
Maslov V.A. Emerald Crystal Growth from Fluxes by Czochralsky Technique. The Eleventh International Conference on Crystal Growth (ICCG-11). The Hague (The Netherland). June 18–23 1995, Abstract O303.06.
Эйтель В. Физическая химия силикатов. М.: Иностр. лит., 1962. 1056 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы