Неорганические материалы, 2019, T. 55, № 11, стр. 1230-1234
Синтез и исследование люминесцентных свойств люминофора Li3Ba2Y3(MoO4)8:Tb3+ со слоистой шеелитоподобной структурой
Н. М. Кожевникова 1, *, С. Ю. Батуева 1
1 Байкальский институт природопользования СО Российской академии наук
670047 Улан-Удэ, ул. Сахьяновой, 6, Россия
* E-mail: nicas@binm.ru
Поступила в редакцию 19.09.2018
После доработки 04.04.2019
Принята к публикации 08.04.2019
Аннотация
Синтезирован люминофор Li3Ba2Y3(MoO4)8:Tb3+, который кристаллизуется в шеелитоподобной структуре (пр.гр. С2/с), изучены его люминесцентные свойства. Полученный материал исследован методами рентгенографии, дифференциального термического анализа, ИК-спектроскопии.
ВВЕДЕНИЕ
Перспективы развития светотехники, оптоэлектроники, лазерных технологий в значительной степени определяются физико-химической базой направленного поиска и создания новых материалов с необходимыми спектрально-люминесцентными свойствами. Интерес к изучению сложных молибдатов и вольфраматов не ослабевает в течение двух десятилетий, что обусловлено уникальными спектрально-люминесцентными, сегнетоэлектрическими свойствами, каталитической активностью, высокой ионной проводимостью, термической и химической устойчивостью фаз [1–6].
Цель настоящей работы – синтез люминофора на основе тройного молибдата Li3Ba2Y3(MoO4)8:Tb3+ со слоистой шеелитоподобной структурой и изучение его люминесцентных свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходными компонентами для изучения фазообразования в системе Li2MoO4–BaMoO4–Y2(MoO4)3 служили предварительно синтезированные твердофазным способом Li2MoO4, BaMoO4 и Y2(MoO4)3 из Li2CO3, BaO, Y2O3 и MoO3 в интервале температур 400–650°С с многократными промежуточными перетираниями через каждые 20–30 ч. Время прокаливания при каждой температуре составляло 100–120 ч. После обжига образцы медленно охлаждали вместе с печью. Неравновесные образцы отжигали дополнительно, равновесие считали достигнутым, если фазовый состав образцов оставался неизменным при двух последовательных отжигах. Продукты синтеза идентифицировали методами рентгенофазового анализа (РФА) на дифрактометре D8 Advance фирмы Bruker (CuKα-излучение). Расчет рентгенограмм проводили с использованием программ “Рентген”. Колебательные спектры поликристаллических образцов Li3Ba2R3(MoO4)8 зарегистрированы на спектрометре Bruker FT-IR и спектрометре Specord М-80 с использованием для возбуждения лазера с излучением в ближней ИК‑области 1.06 мкм. Геометрия рассеяния – на отражение, разрешение 3–5 см–1. Образцы готовили в виде суспензии в вазелиновом масле на полиэтиленовой подложке и таблеток с KBr. Изотопозамещенные по литию (6Li) образцы готовили с использованием в качестве исходного реагента Li2CO3 с содержанием основного изотопа 90.5%.
Дифференциальный термический анализ (ДТА) проводили на дериватографе ОД-103 фирмы МОМ, скорость подъема температуры 10°С/мин, навеска 0.3–0.4 г.
Для введения различных концентраций ионов активатора оксид иттрия эквимолярно заменялся на оксид тербия в Li3Ba2Y3(MoO4)8. Таким способом были получены образцы люминофора с концентрациями 1–3 мол. % Tb4O7.
Спектры возбуждения и люминесценции Li3Ba2Y3(MoO4)8:Tb3+ при УФ-возбуждении (λвозб = = 300 нм) получены на спектрофлуориметре СМ 2203 (Solar, Беларусь), источник излучения – ксеноновая дуговая лампа высокого давления ДКсШ 150-1М. Погрешность измерения составляла ±2 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Взаимодействие в системе Li2MoO4–BaMoO4–Y2(MoO4)3 изучено в области 400–900°С. В ограняющей двойной системе Li2MoO4–Y2(MoO4)3 установлено образование молибдатов состава 1 : 1, 7 : 3, построенных на шеелитовой основе [2, 3]. Двойные молибдаты LiY(MoO4)2 имеют неупорядоченную тетрагональную структуру шеелита (пр. гр. I41/а). Для Li7R3(MoO4)8 (пр. гр. PĪ) характерна слоистая структура, построенная из слоев М‑восьмивершинников (М = 0.75R + 0.25Li), соединяющихся по общим ребрам и имеющих общие вершины с обрамляющими их МоО4-тетраэдрами.
В системе BaMoO4–Y2(MoO4)3 синтезирован молибдат BaY2(MoO4)4 с широкой областью гомогенности, принадлежащий к триклинной сингонии (пр. гр. PĪ) [3], в которой образуются с незначительными видоизменениями сотоподобные слои. Атомы Мо имеют тетраэдрическую координацию, атомы Y располагаются в центре восьмивершинников, атомы Ва имеют координацию 10 и располагаются между слоями, образованными полиэдрами Mo и R [3, 5, 6].
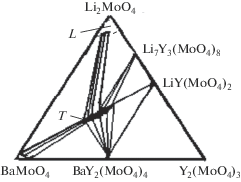
Исследование системы Li2MoO4–BaMoO4–Y2(MoO4)3 проведено в две стадии. Первоначально изучали фазовый состав точек пересечения разрезов, исходящих из средних и двойных молибдатов, образующихся в ограняющих двойных системах Li2MoO4–Y2(MoO4)3 и BaMoO4–Y2(МоО4)3, система Li2MoO4–BaMoO4 является эвтектической. На второй стадии изучали выявленные квазибинарные разрезы, что позволило провести триангуляцию системы (рис. 1).
Наиболее подробно (через 1–2 мол. %) изучено взаимодействие по разрезу BaMoO4–LiY(MoO4)2, где установлено образование тройного молибдата Li3Ba2Y3(MoO4)8 при 650–700°С. Для достижения равновесия необходимо прокаливать реакционные смеси в течение 120–140 ч с промежуточной гомогенизацией.
В системе Li2MoO4–BaMoO4–Y2(MoO4)3 фазовые равновесия при 700°С характеризуются следующими квазибинарными разрезами: Li2MoO4–Li3Ba2Y3(MoO4)8, Li7Y3(MoO4)8–Li3Ba2Y3(MoO4)8, BaMoO4–Li3Ba2Y3(MoO4)8, Li3Ba2Y3(MoO4)8–LiR(MoO4)2, Li3Ba2Y3(MoO4)8–BaY2(MoO4)4 и BaY2(MoO4)4–LiY(MoO4)2. Методами РФА установлено, что в тройном молибдате Li3Ba2Y3(MoO4)8 растворяется 18 мол. % BaMoO4, растворимость тройного молибдата в BaY2(MoO4)4 не превышает 5 мол. %. Растворимость LiY(MoO4)2 в Li3Ba2Y3(MoO4)8 составляет 12 мол. %, в LiY(MoO4)2 растворяется не более 10 мол. % Li3Ba2Y3(MoO4)8.
Рентгенограмма Li3Ba2Y3(MoO4)8 (рис. 2) индицирована в моноклинной сингонии с использованием параметров элементарной ячейки монокристалла Li3Ba2Gd3(MoO4)8. Структура Li3Ba2Gd3(MoO4)8 расшифрована методом тяжелого атома с использованием трехмерной функции Патерсона и последующими расчетами карт электронной плотности ρ(хуz) и ρ(хуz) для локализации более легких атомов O и Li. Уточнение структуры в анизотропном приближении с одновременным уточнением фактора заполнения позиций гадолиния привело к R = 0.044. Был рассчитан локальный баланс валентных усилий с учетом заполнения позиций. Полученные данные хорошо согласуются со стехиометрическим составом соединения Li3Ba2Gd3(MoO4)8, качество баланса валентности Do составляет 2.10% [3,5]. Плавится Li3Ba2Y3(MoO4)8 инконгурэнтно при 960°С, не претерпевая полиморфных превращений.
Таблица 1.
Частоты колебаний в длинноволновой области ИК-спектров поглощения (см–1)
| 6Li3Ba2Y3(MoO4)8 | 7Li2NaBa2Y3(MoO4)8 | Li3Ba2Y3(MoO4)8:Tb3+ | Отнесение |
|---|---|---|---|
| 456 | 454 | 453 | δ(МоО4) |
| 418 | 416 | 417 | δ(МоО4) |
| 384 | 384 | 384 | δ(МоО4) |
| 352 | 350 | 344 | TLi + TNa |
| 325 | 319 | 319 | TLi |
| 307 | 297 | 290 | TLi + TNa |
| 290 | 286 | – | TLi |
| – | 265 | 265 | TMo + TBa |
| 263 | 258 | 258 | TLi |
| 232 | 227 | 231 | TLi |
| – | – | 216 | TNa |
| – | – | 204 | TNa |
| 186 | 186 | – | TMo + TBa |
| 164 | – | 164 | R |
| 156 | 156 | 156 | R |
| 90 | 92 | 90 | TBa |
Молибдат Li3Ba2Y3(MoO4)8 принадлежит к структурному типу моноклинно искаженного шеелита, пр.гр. С2/с, Z = 2. Соединение изоструктурно двойному молибдату BaGd2(MoO4)4 [2, 3, 6], в структуре реализуются сотоподобные слои из Y-восьмивершинников, к обеим сторонам слоя присоединяются Мо-тетраэдры через общие кислородные вершины. Атомы лития в структуре Li3Ba2Y3(MoO4)8 занимают различные кристаллографические позиции, треть атомов лития статистически располагается по позициям редкоземельного элемента с к. ч. = 8. Оставшиеся 2/3 атомов лития локализованы в частной позиции на оси второго порядка с октаэдрической координацией по кислороду. При этом происходит упорядоченное или частично упорядоченное заселение этих позиций, которое не приводит к новой сверхструктуре, хотя и возникает новая структура. Кристаллохимическую формулу соединения можно записать в виде: Li2(Ba0.85Y0.15)2(Y0.675Ba0.075Li0.25)4(MoO4)8 [5]. Параметры элементарной ячейки Li3Ba2Y3(MoO4)8 равны: а = 5.189(1), b = 12.694(2), c = 19.109(2) Å, β = 91.57(2)°, V/Z = 629.1 Å3.
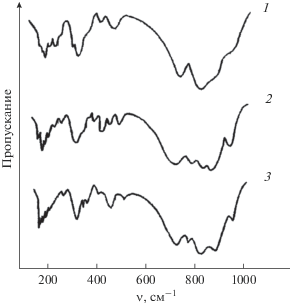
ИК-спектры Li3Ba2Gd3(MoO4)8, Li3Ba2Y3(MoO4)8 и люминофора Li3Ba2Y3(MoO4)8:Tb3+ представлены на рис. 3. Измеренные значения колебательных частот длинноволновой области ИК-спектров Li3Ba2Y3(MoO4)8, приведены в табл. 1. Согласно результатам теоретико-группового анализа колебаний кристалла Li3Ba2Y3(MoO4)8, из общего числа 144 мод, соответствующих полному колебательному представлению, только 24 нормальных колебания отвечают движениям атомов трех катионных подрешеток и описываются следующими неприводимыми представлениями:
– для катионов лития, расположенных на осях второго порядка (в октаэдрах)
– катионов бария и иттрия на осях второго порядка (позиция М1)
– катионов лития, бария и иттрия в общих позициях (позиция М2 в восьмивершинниках)
Эти колебания активны в ИК-спектрах поглощения или КР с соблюдением правила альтернативного запрета и должны иметь частоты ниже 500 см–1. Кроме того, в этой же области спектра должны наблюдаться 44 полосы, относящиеся к деформационным, либрационным и трансляционным колебаниям MoO4-групп [7].
Зарегистрированные спектры Li3Ba2Y3(MoO4)8 в своей высокочастотной (950–650 см–1) части не имеют заметных различий. Полосы поглощения этой области спектра, относящиеся к валентным колебаниям MoO4-групп, плохо разрешены. Это является следствием реализации описанного способа размещения в кристалле катионов по кристаллографическим позициям и связанной с этим статистикой в искажении тетраэдрических анионных группировок [2].
В области деформационных колебаний МоО4-групп и колебаний катионных подрешеток (ниже 500 см–1) в спектре Li3Ba2Y3(MoO4)8 зарегистрировано до 14 полос поглощения. Последнее намного меньше ожидаемого числа колебаний. Такие различия между результатами теоретико-группового анализа и экспериментально зарегистрированным числом колебаний обусловлены, по-видимому, незначительным расщеплением по фактор-группе внутренних (деформационных) и внешних колебаний МоО4-групп. В то же время спектры рассматриваемого соединения в данной области очень близки к спектрам двойного молибдата BaGd2(MoO4)4. Это свидетельствует о том, что колебания катионных подрешеток близки между собой и с деформационными колебаниями тетраэдров MoO4.
Частоты внешних колебаний MoO4-групп и колебаний подрешеток тяжелых катионов имеют примерно те же значения, что и в случае BaGd2(MoO4)4.
К либрационным колебаниям MoO4-групп отнесены полосы с частотами 164 и 156 см–1, к колебаниям атомов подрешетки бария – 90 см–1. Трансляционные колебания молибдена перемешаны с колебаниями атомов подрешетки гадолиния и имеют частоты 265 и 186 см–1.
Помимо этого, в длинноволновой области спектров исследованных соединений зарегистрированы две дополнительные полосы: 307–297 и 263–258 см–1, демонстрирующие изотопический эффект. Отнесение полос колебаний атомов подрешеток щелочных элементов проведено по сдвигу полос при изотопозамещении по литию или при замене лития на натрий. Наиболее сильные сдвиги зафиксированы для двух групп полос поглощения: 325–319, 307–297, 290–286 см–1 и 263–258, 232–227 см–1.
Первая группа полос отнесена к колебаниям катионов лития в октаэдрических позициях, а вторая – в восьмивершинниках. Именно среди этих групп и лежат две дополнительные по сравнению с BaGd2(MoO4)4 полосы спектра, что хорошо согласуется с известными литературными данными по ИК-спектрам LiLn2(MoO4)2 [2, 7].
Отнесение полос колебаний атомов лития проведена при замещении лития на натрий. При изоморфном замещении в ячейке одного атома Li на Na в ИК-спектрах появляются две новые полосы поглощения при 216 и 204 см–1. Эти значения частот соответствуют колебаниям катионов натрия в восьмивершинниках. Однако наряду с этим сохраняются полосы 263–258 и 232–227 см–1 в тех же позициях. В то же время снижается интенсивность полосы 352–350–344 см–1 и увеличивается интегральная интенсивность формирующейся группы полос в области 350–320 см–1, что подтверждает распределение катионов лития и натрия по двум различным кристаллографическим позициям.
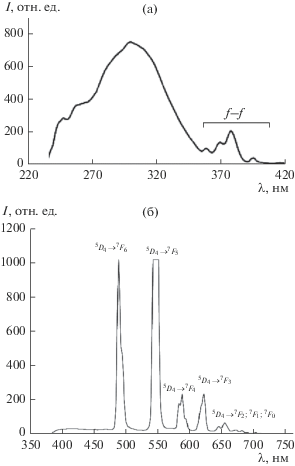
Исследование спектрально-люминесцентных свойств показало, что при возбуждении полосы с λ = 300 нм в спектре люминесценции ионов Tb3+ в Li3Ba2Y3(MoO4)8:Tb3+ (рис. 4) фиксируются полосы, соответствующие оптическим переходам ионов тербия: при 490 нм переход 5D4 → 7F6, при 548 нм переход 5D4 → 7F5, при 590 нм переход 5D4 → → 7F4, при 624 нм переход 5D4 → 7F3, а также полосы в области 650–690 нм – переходы 5D4 → 7F2, 7F1, 7F0 [8–11]. Наиболее интенсивная полоса люминесценции вызывается переходом 5D4 → 7F5 и расположена в зеленой области спектра, что обеспечивает основной вклад в зеленую люминесценцию этого иона.
Для оценки эффективности преобразования возбуждающего излучения в фотолюминесценцию (ФЛ) использовали рассчитанные отношения IФЛ/Iвозб, где IФЛ – интенсивность полосы ФЛ в максимуме на 548 нм, Iвозб – интенсивность полосы возбуждающего излучения в максимуме, получено значение 1.33.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований изучены фазовые равновесия в cубсолидусной области системы Li2MoO4–ВаMoO4–Y2(MoO4)3, проведена триангуляция системы при 700°С. Установлено образование тройного молибдата Li3Ba2Y3(MoO4)8 на разрезе BaMoO4–LiY(MoO4)2, принадлежащего к структурному типу моноклинно искаженного шеелита, пр.гр. С2/с, Z = 2. Определены его кристаллографические характеристики и термическая устойчивость.
На основе тройного молибдата, легированного ионами Tb3+ (2.5 мол. % Tb4O7), получен люминофор Li3Ba2Y3(MoO4)8:Tb3+. Идентифицирован спектр люминесценции ионов Tb3+ в матрице Li3Ba2Y3(MoO4)8 при 293 К. Показано, что все линии в видимой области спектра обусловлены переходами 5D4 → 7Fj. Наиболее интенсивная линия соответствует переходу 5D4 → 7F5 в области 548 нм. Полученные люминесцентные характеристики указывают на возможность его использования в качестве зеленого люминофора.
Список литературы
Каминский А.А. Спектроскопия кристаллов. М.: Наука, 1975. 255 с.
Кожевникова Н.М., Мохосоев М.В. Тройные молибдаты. Улан-Удэ: Изд-во Бурятского госуниверситета, 2000. 298 с.
Кожевникова Н.М., Копылова О.А. Синтез и исследование тройных молибдатов Li3Ba2R3(MoO4)8 (R = La–Lu, Y) методами рентгенографии и ИК-спектроскопии // Журн. неорган. химии. 2011. Т. 56. № 6. С. 991–994.
Kozhevnikova N.M., Korsun V.P., Mursakhanova I.I., Mokhosoev M.V. Luminescence Materials Based on RE Molybdates // J. Rare Earths. 1991. V. 2. P. 845–849.
Клевцова Р.Ф., Васильев А.Д., Глинская Л.А. и др. Кристаллоструктурное исследование тройных молибдатов состава Li3Ba2R3(MoO4)8 (R = Gd, Tu) // Журн. структур. химии. 1992. Т. 33. № 3. С. 126–130.
Трунов В.К., Ефремов В.А., Великодный Ю.А. Кристаллохимия и свойства двойных молибдатов и вольфраматов. Л.: Наука, 1986. 173 с.
Петров К.И., Полозникова М.Э., Шарипов Х.Т., Фомичёв В.В. Колебательные спектры молибдатов и вольфраматов. Ташкент: ФАН, 1990. 135 с.
Маляревич Г.К., Гапоненко Н.В., Мудрый А.В. и др. Фотолюминесценция ионов Tb3+ в ксерогелях алюмоиттриевых гранатов // Физика и техника полупроводников. 2009. Т. 43. Вып. 2. С. 170–173.
Цыретарова С.Ю., Кожевникова Н.М., Еремина Н.С. Люминофоры красного и зеленого свечения на основе оксидной стеклокерамики, активированной ионами Eu3+ и Tb3+ // Материалы междунар. науч. конф. “Полифункциональные химические материалы и технологии”. 2015. Т. 2. С. 264–267.
Anthuvan J.P., Shameem Banu I.B. Synthesis and Luminescent Properties of Tb3+ Activated Li3Ba2Gd3 – x(MoO4)8 Based Efficient Green Emitting Phosphors // J. Appl. Sci. Eng. 2016. V. 19. № 4. P. 409–412.
Xinyu Li, Chunxin Liang, Shaojie Guo. Photoluminescence and Afterglow Behavior of Tb3+ Activated Li2SrSiO4 Phosphor // J. Lumin. 2017. V. 188. P. 199–203.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы