Неорганические материалы, 2019, T. 55, № 11, стр. 1190-1196
Получение наноструктурированного оксида олова(IV) и нанесенных платиновых электрокатализаторов на его основе
В. А. Волочаев 1, *, И. Н. Новомлинский 1, Ю. В. Давыдович 1, Е. А. Могучих 1, С. В. Беленов 1, В. Е. Гутерман 1
1 Южный федеральный университет
344058 Ростов-на-Дону, ул. Зорге, 7, Россия
* E-mail: v.a.volotchaev@mail.ru
Поступила в редакцию 03.07.2018
После доработки 01.03.2019
Принята к публикации 06.06.2019
Аннотация
Синтезирован диоксид олова с высокой площадью удельной поверхности (122 м2/г), на его основе получены и исследованы нанесенные платиновые материалы. Показано, что композиции Pt/SnO2 + C могут быть использованы в качестве катализатора в реакции электровосстановления кислорода. Стабильность такого катализатора, содержащего 50% углерода и 15 мас. % Pt, оказалась существенно выше, чем у коммерческого Pt/C с 20%-ным содержанием Pt.
ВВЕДЕНИЕ
Создание экологически чистых химических источников энергии, таких как топливные элементы, занимает важное место среди современных направлений научных исследований [1–4]. Эффективными электрокатализаторами (ЭК) для низкотемпературных топливных элементов (ТЭ) являются наноструктурные композиционные материалы, содержащие наночастицы (НЧ) на основе платины, нанесенные на нано- или микрочастицы углеродного носителя [5–10]. Одной из ключевых проблем ТЭ с полимерной мембраной является ограниченный срок их службы, обусловленный в первую очередь деградацией мембраны и каталитического слоя [11–16]. Поэтому важным является выбор оптимального носителя для НЧ платины [17]. Использование некоторых типов углеродных носителей, более устойчивых к окислению, чем пиролитические углеродные сажи, например углеродных нанотрубок, позволяет увеличить срок службы мембранно-электродных блоков [18, 19] и, следовательно, повысить эффективность. Однако сама природа материала-носителя, способного окисляться, при этом не меняется.
В последнее время большое внимание уделяется неуглеродным носителям для катализаторов, устойчивым к деградации. Применение различных методов синтеза неорганических материалов [20, 21] позволяет существенно расширить спектр объектов, пригодных для использования, а также стимулирует поиск новых подходов к модификации уже известных материалов.
Перспективным носителем для Pt-содержащих ЭК по ряду параметров (устойчивость, доступность, простота синтеза и др.) является диоксид олова. Разработка относительно простых методов синтеза носителя SnO2 и платиновых ЭК на его основе для ТЭ с полимерной мембраной весьма актуальна. Так, в работе [22], посвященной изучению влияния pH среды и продолжительности синтеза (при температуре 190°С) на размер НЧ SnO2, авторы указывают на возможность получения кристаллитов размером от одного до десятков нанометров, хотя и не определяют площадь по методу БЭТ. Весьма интересны результаты работ [23, 24], посвященных электрохимическому методу синтеза материалов Pt/SnOх–С и Pt/MOx–C. К сожалению, несмотря на возможность контроля размера кристаллитов SnO2 и относительную простоту метода, в [23] отмечены проблемы с контролем химического состава SnO2, а в [24] характеристики носителя описаны весьма кратко. В работе [25] приведены результаты исследования ЭК сложного состава, содержащего Pt, SnO2 и углерод. Авторы [25] декларируют возможность синтеза композита Pt/SnO2 + C c кубическими НЧ платины без использования органических добавок в качестве стабилизаторов. При этом, в работе [25] уделяется основное внимание мерам по увеличению доли граней (100) у НЧ Pt и не содержится подробного описания условий синтеза SnO2.
Интересны результаты работы [26], в которой получены нанесенные на SnO2 платиновые ЭК, обладающие повышенной, по сравнению с коммерческими Pt/C-материалами, стабильностью. Результаты исследований [27, 28] также представляют несомненный интерес, указывая на возможность дальнейшего улучшения функциональных характеристик полученных Pt/(Sn, Sb)Ox-материалов. При этом в [26–28] синтез SnO2 из SnCl4 проведен с использованием достаточно сложной золь–гель-технологии. В работе [29] изучены материалы Sb–SnO2 и Ru–SnO2 и ЭК на их основе, а в [30] исследовано влияние примеси ионов Ag+ на рост платиновых НЧ на поверхности SnO2 и установлена прямая зависимость: доля ограненных НЧ Pt увеличивается с ростом концентрации Ag+.
В [31] композиты Pt–Ag/SnO2–C изучены в качестве ЭК окисления метанола, что весьма интересно с точки зрения повышения каталитической активности Pt за счет присутствия SnO2. В то же время, очевидно, что введение других металлов в Pt/SnO2 создает дополнительные возможности для загрязнения полимерных компонентов мембранно-электродного блока их катионами.
В целом результаты исследований поведения ЭК Pt/SnO2 демонстрируют положительное влияние НЧ SnO2 на электрохимические характеристики и стабильность материалов по сравнению с Pt/C. В то же время проблема создания относительно простых, хорошо воспроизводимых и масштабируемых методов синтеза как самих носителей, так и свободных от примесей Pt/SnO2-катализаторов, способных обеспечить стабильные функциональные характеристики, не решена. Важной задачей остается повышение масс-активности таких катализаторов. В случае использования композитов Pt/SnO2 c углеродом не определен их оптимальный состав, а также не установлено наличие или отсутствие негативного влияния углеродной добавки на стабильность ЭК. Учитывая необходимость формирования пористого каталитического слоя, необходимо продолжить поиск оптимальных составов композиций Pt/(SnO2 + C), способных обеспечить сочетание эффективного электронного переноса, контакта НЧ Pt с иономером и молекулами реагентов при работе ЭК.
Цель настоящей работы состояла в получении высокодисперсного SnO2 с размером частиц нанометрового диапазона и, следовательно, хорошо развитой (не менее 100 м2/г) поверхностью, а также в получении на его основе стабильного ЭК Pt/SnO2 реакции электровосстановления кислорода. С учетом низкой электронной проводимости диоксида олова важной задачей исследования представлялось изучение электрохимического поведения композиционных ЭК на основе смесей Pt/SnO2 с дисперсным углеродом, оценка их каталитической активности и стабильности в сравнении с катализаторами Pt/SnO2 и Pt/C.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза носителя использовали двухводный хлорид двухвалентного олова (SnCl2 · 2H2O), мелкокристаллическую мочевину (NH2CONH2), насыщенный раствор аммиака (NH4OH, 35 мас. %) и концентрированный водный раствор пероксида водорода (Н2О2, 30 мас. %) квалификации “ч.”. При синтезе образца 1 (SnO2) к 10%-ному раствору SnCl2 при перемешивании добавляли избыток раствора NH3 (доводя pH среды до 12), затем – десятикратный избыток раствора H2O2, продолжая перемешивание в течение часа при температуре 60°С. Для получения образца 2 в круглодонной колбе с обратным холодильником смешивали водный раствор SnCl2 (10%-ный) и 10-кратный избыток мочевины (в условиях нейтральной среды), а затем суспензию нагревали при 90°С на воздухе на водяной бане при постоянном перемешивании (15 ч). Осадок многократно промывали и отделяли центрифугированием (10 000 об./мин, 5 мин). Выход продукта (SnO2) в обоих случаях составил 98–100%. Pt-содержащие материалы получали химическим восстановлением Pt(IV) в суспензии SnO2. Для приготовления суспензии использовали полученные на предыдущем этапе образцы 1 или 2, которые диспергировали в смеси воды и этиленгликоля, добавляли необходимый объем водного раствора хлорплатиновой кислоты (H2PtCl6 · 6H2O, Aurat, Россия), после чего водным раствором аммиака (35 мас. %) доводили pH до 10. Далее при интенсивном перемешивании к суспензии добавляли 4-кратный избыток раствора боргидрида натрия (NaBH4), затем отделяли твердую фазу центрифугированием. Многократную (8–10 раз) промывку полученных образцов проводили бидистиллированной водой и этиловым спиртом. Продукт сушили над P2O5 до достижения постоянной массы. Полученные Pt-содержащие материалы далее маркированы как образцы 1Pt и 2Pt. Композиты Pt/SnO2 + C получали посредством добавления сажи марки Vulcan XC72 к Pt/SnO2 в процессе приготовления “электрохимических чернил” – суспензии катализатора, наносимой на электрод [32].
Рентгенограммы регистрировали на автоматическом дифрактометре ARL X’TRA с использованием CuKα-излучения (λср = 1.5418 Å). Расчет среднего размера кристаллитов Dav проводили согласно методике, ранее описанной в [33]. Определение удельной площади поверхности и распределения пор по размерам выполняли с помощью анализатора удельной поверхности и пористости ASAP 2020 (MicromeriticsCorp., США). Обработку данных проводили по методу БЭТ [34].
Исследования методом просвечивающей электронной микроскопии (ПЭМ) проводили в просвечивающем растровом аналитическом электронном микроскопе FEI Tecnai G2 F20 S-TWIN TMP с приставкой EDAX.
Величину площади электрохимически активной поверхности (S), активность и стабильность ЭК измеряли в стандартной трехэлектродной ячейке с помощью потенциостата-гальваностата Pine AFCBP1 (Pine Research Instrumentation, USA). Методика нанесения слоя катализатора на электрод и техника проведения электрохимических измерений аналогичны описанным ранее [32].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
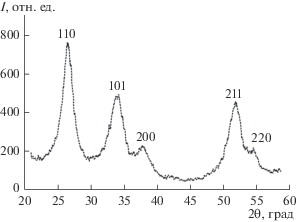
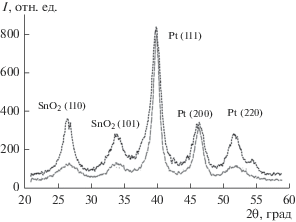
При получении SnO2 из SnCl2 в качестве осадителя использовали аммиак и карбамид. В первом случае в качестве окислителя использовали H2O2, во втором – кислород воздуха. На дифрактограммах полученных материалов присутствуют отражения, характерные для структуры рутила. Рефлексов примесных фаз не обнаружено (рис. 1 и табл. 1). Уширение отражений обусловлено малым размером кристаллитов (Dav). Были получены два материала, сходные по химическому составу (SnO2), но различающиеся по среднему диаметру кристаллитов (табл. 1).
Таблица 1.
Некоторые структурные характеристики синтезированных SnO2-материалов
| Образец | 1 | 2 |
|---|---|---|
| Пр. гр. | P42/mnm | P42/mnm |
| Число идентифицируемых рефлексов | 9 | 5 |
| a, Å | 4.757(2) | 4.736(9) |
| c, Å | 3.182(3) | 3.169(4) |
| Ширина пика на середине высоты (FWHM), град | 2.2 | 4.4 |
| Средний размер кристаллитов Dav, нм | 3.9 ± 0.1 | 2.8 ± 0.1 |
Нанесение НЧ Pt на поверхность частиц SnO2 проводили по методике, способной обеспечить воспроизводимые результаты по размерному распределению НЧ и единообразию их формы.
Учитывая низкую электронную проводимость SnO2, стратегия получения платиновых ЭК состояла в добавлении к Pt/SnO2 углеродной сажи Vulcan XC72 в количестве, которое обеспечивало бы электронную проводимость композита в целом и подвод/отвод электронов к/от НЧ Pt в частности. Образцы ЭК, полученные добавлением от 5 до 50 мас. % сажи к образцам 1Pt и 2Pt, далее обозначены как 1PtC и 2PtC (табл. 2).
Таблица 2.
Некоторые характеристики материалов Pt/SnO2 и Pt/SnO2 + С
| Образец | 1Pt | 1PtС50 | 2Pt | 2PtC5 | 2PtC15 | 2PtC25 | 2PtC33 | 2PtС50 | JM20 |
|---|---|---|---|---|---|---|---|---|---|
| Носитель | SnO2, 1 | SnO2, 1 | SnO2, 2 | SnO2, 2 | SnO2, 2 | SnO2, 2 | SnO2, 2 | SnO2, 2 | Vulcan-72 |
| Pt в Pt/SnO2, мас. % | 30 | 15 | 30 | 28.5 | 25.5 | 22.5 | 20.1 | 15 | 20 |
| C в Pt/SnO2 + C, мас. % | – | 50 | – | 5 | 15 | 25 | 33 | 50 | 80 |
| Dav(Pt), нм | 5.1 ± 0.2 | 5.1 ± 0.2 | 7.3 ± 0.3 | 7.3 ± 0.3 | 7.3 ± 0.3 | 7.3 ± 0.3 | 7.3 ± 0.3 | 7.3 ± 0.3 | 2.0 ± 0.1 |
| S, м2/г Pt | 7 ± 0.7 | 30 ± 3 | 17 ± 2 | 24 ± 3 | 34 ± 5 | 42 ± 5 | 47 ± 6 | 47 ± 6 | 94 ± 7 |
| Стабильность, % | – | 95 | – | – | – | – | – | 90 | 37 |
Измерение S в Pt/SnO2-материалах, а также в композитах Pt/SnO2 + C с разным содержанием углерода показало, что повышение содержания сажи в ЭК Pt/SnO2 + C на основе образца 2Pt примерно до 33% сопровождается ростом S (табл. 2). При дальнейшем повышении содержания углерода в композите значения S стабилизируются (табл. 2). По-видимому, содержание углерода ≥33% соответствует “превращению” всех НЧ Pt в электроактивные.
С учетом полученных результатов измерение S было выполнено и для ЭК 1PtC50, содержащего 50% углерода (табл. 2). Значение S в этом случае оказалось меньше – 30 м2/г Pt. Такой результат может быть обусловлен меньшей доступностью каталитических центров из-за особенностей морфологии частиц образца 1 в качестве носителя. Отметим, что площадь “рабочей” поверхности Pt в каждом углеродсодержащем композите значительно превысила S Pt в исходных материалах Pt/SnO2 (табл. 2).
Исходные носители (SnO2) имеют высокую удельную площадь поверхности. Так, площадь образца 2 составляет 122 м2/г (БЭТ), средняя суммарная площадь пор – 35.5 м2/г при среднем диаметре пор 4.1 нм. Согласно результатам ПЭМ, композит 1PtC50 включает отдельные НЧ SnO2 размером 4 нм, а также их агломераты и хорошо окристаллизованные НЧ Pt размером около 5 нм (рис. 3). К сожалению, из-за слабых различий контраста НЧ Pt и SnO2 на полученных изображениях построение гистограмм размерного распределения НЧ Pt и SnO2 затруднено. Элементное картирование ЭК 1PtС50 (рис. 4) показало, что Pt равномерно распределена по поверхности зерен SnO2.
Меньшее значение S у образца 1Pt50, содержащего кристаллиты Pt меньшего по сравнению с 2Pt50 размера (табл. 2), может быть обусловлено как наличием в носителе пор, близких по размеру к НЧ Pt (что приводит к размещению части НЧ металла в порах), так и более высокой степенью агломерации НЧ платины в 1Pt по сравнению с 2Pt.
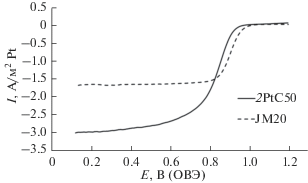
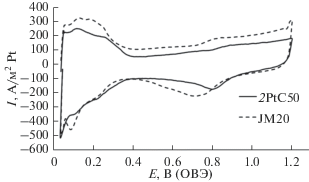
На рис. 5 проведено сравнение циклических вольтамперограмм образца 2PtC50 и коммерческого образца. Вольтамперограммы реакции восстановления кислорода (РВК) ЭК 2PtC50 имеют вид, характерный для нанесенных платиновых ЭК (рис. 6). Значение потенциала полуволны в РВК при скорости вращения 1600 об./мин составило 0.88 В, а рассчитанное по уравнению Коутетского–Левича число электронов, участвующих в акте восстановления молекулы О2, – 3.9. Это подтверждает реализацию 4-электронного механизма электровосстановления кислорода на композитном ЭК. Активность ЭК при потенциале 0.85 В составляет 1.73 А/м2Pt, что несколько ниже, чем у коммерческого Pt/C-аналога.
Рис. 5.
Циклические вольтамперограммы образцов 2PtC50 и коммерческого ЭК Pt/C JM20 (ОВЭ – обратимый водородный электрод).
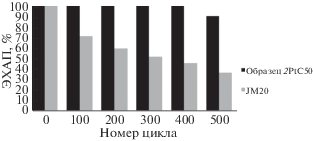
Оценка стабильности (рис. 7) ЭК 2PtC50 была проведена в сравнении с коммерческим ЭК Pt/C (JM20). Оказалось, что ЭК Pt/C подвергся катастрофической деградации: за 500 циклов его S изменилась от 93 до 11 м2/г Pt. В то же время композиционный ЭК 2PtC50 продемонстрировал падение S около 10% от начального значения.
ЗАКЛЮЧЕНИЕ
Оптимизация условий синтеза наноструктурированного SnO2 из раствора SnCl2 позволила получить материал в виде НЧ со средним размером кристаллитов около 3–4 нм с высокой удельной площадью поверхности (122 м2/г SnO2). Структура нанокристаллитов SnO2 подтверждена прямыми наблюдениями (ПЭМ), данными электронной дифракции и результатами ренгенографических исследований. Размеры кристаллитов хорошо соответствуют размеру НЧ, определенному ПЭМ.
Методом химического восстановления получены ЭК Pt/SnO2 с массовой долей Pt 30% и диаметром кристаллитов около 5 и 7 нм. Добавление дисперсного углеродного материала Vulcan-XC72 приводит к повышению электронной проводимости композита, при этом максимальная S платины, достигающая 47 м2/г Pt для ЭК 2PtC50, наблюдается при содержании в композиции более 33% углерода.
Массовая активность ЭК Pt/SnO2 + C в РВК несколько уступает таковой для коммерческого ЭК Pt/C, содержащего НЧ Pt значительно меньшего размера. Стабильность ЭК Pt/SnO2 + C в “жестких” условиях стресс-теста значительно превышает стабильность Pt/C. Это подтверждает перспективность применения композитов Pt/SnO2 + C в качестве ЭК для водородо-воздушных ТЭ с полимерной мембраной. Снижение размера НЧ Pt и оптимизация содержания углерода в подобной композиции могут привести к повышению функциональных характеристик ЭК.
Список литературы
Kuzov A.V., Tarasevic M.R., Bogdanovskaya V.A. Catalysts of Ethanol Anodic Oxidation for Ethanol-Air Fuel Cell with a Proton-Conducting Polymer Electrolyte // Russ. J. Electrochem. 2010. V. 46. № 4. P. 422–430.
Sharaf O.Z., Orhan M.F. An Overview of Fuel Cell Technology: Fundamentals and Applications // Renew. Sustain. Energy Rev. 2014. V. 32. P. 810–853.
Ярославцев А.Б., Добровольский Ю.А., Шаглаева Н.С., Фролова Л.А., Герасимова Е.В., Сангинов Е.А. Наноструктурированные материалы для низкотемпературных топливных элементов // Успехи химии. 2012. Т. 81. С. 191–220.
Antolini E. Structural Parameters of Supported Fuel Cell Catalysts: The Effect of Particle Size, Inter-Particle Distance and Metal Loading on Catalytic Activity and Fuel Cell Performance // Appl. Catal. B. 2016. V. 181. P. 298–313.
Antolini E. Carbon Supports for Low-Temperature Fuel Cell Catalysts // Appl. Catal. B. 2009. V. 88. № 1–2. P. 1–24.
Stamenkovic V.R., Fowler B., Mun B.S., Wang G.F., Ross P.N., Lucas C.A., Markovic N.M. Improved Oxygen Reduction Activity on Pt3Ni(111) via Increased Surface Site Availability // Science. 2007. V. 315. № 5811. P. 493–497.
Stamenkovic V.R., Mun B.S., Arenz M., Mayrhofer K.J.J., Lucas C.A., Wang G.F., Ross P.N., Markovic N.M. Trends in Electrocatalysis on Extended and Nanoscale Pt-Bimetallic Alloy Surfaces // Nat. Mater. 2007. V. 6. № 3. P. 241–247.
Stamenkovic V., Mun B.S., Mayrhofer K.J.J., Ross P.N., Markovic N.M., Rossmeisl J., Greeley J., Norskov J.K. Changing the Activity of Electrocatalysts for Oxygen Reduction by Tuning the Surface Electronic Structure // Angew. Chem. Int. Ed. 2006. V. 45. № 18. P. 2897–2901.
Oezaslan M., Hasche F., Strasser P. Pt-Based Core-Shell Catalyst Architectures for Oxygen Fuel Cell Electrodes // J. Phys. Chem. Lett. 2013. V. 4. № 19. P. 3273–3291.
Chen A., Holt-Hindle P. Platinum-Based Nanostructured Materials: Synthesis, Properties, and Applications // Chem. Rev. 2010. V. 110. № 6. P. 3767–3804.
Ferreir P.J., la O G.J., Shao-Horn Y., Morgan D., Makharia R., Kocha S., Gasteiger H.A. Instability of Pt/C Electrocatalysts in Proton Exchange Membrane Fuel Cells – A Mechanistic Investigation // J. Electrochem. Soc. 2005. V. 152. № 11. P. A2256–A2271.
Borup R., Meyers J., Pivovar B., Kim Y.S., Mukundan R., Garland N., Myers D., Wilson M., Garzon F., Wood D., Zelenay P., More K., Stroh K., Zawodzinski T., Boncella J., McGrath J.E., Inaba M., Miyatake, K., Hori M., Ota K., Ogumi Z., Miyata S., Nishikata A., Siroma Z., Uchimoto Y., Yasuda K., Kimijima K.I., Iwashita N. Scientific Aspects of Polymer Electrolyte Fuel Cell Durability and Degradation // Chem. Rev. 2007. V. 107. № 10. P. 3904–3951.
Shao Y.Y., Yin G.P., Gao Y.Z. Understanding and Approaches for the Durability Issues of Pt-Based Catalysts for PEM Fuel Cell // J. Power Sources. 2007. V. 171. № 2. P. 558–566.
Hodnik N., Dehm G., Mayrhofer K.J.J. Importance and Challenges of Electrochemical in Situ Liquid Cell Electron Microscopy for Energy Conversion Research // Acc. Chem. Res. 2016. V. 49. № 9. P. 2015–2022.
Kuzov A.V., Tarasevich M.R., Bogdanovskaya V.A., Modestov A.D., Tripachev O.V., Korchagin O.V. Degradation Processes in Hydrogen-Air Fuel Cell as a Function of the Operating Conditions and Composition of Membrane-Electrode Assemblies // Russ. J. Electrochem. 2016. V. 52. № 7. P. 705–715.
Venkatesan S.V., Dutta M., Kjeang E. Mesoscopic Degradation Effects of Voltage Cycled Cathode Catalyst Layers in Polymer Electrolyte Fuel Cells // Electrochem. Commun. 2016. V. 72. P. 15–18.
Sharma S., Pollet B.G. Support Materials for PEMFC and DMFC Electrocatalysts – A Review // J. Power Sources. 2012. V. 208. P. 96–119.
Bogdanovskaya V.A., Kol’tsova E.M., Tarasevich M.R., Radina M.V., Zhutaeva G.V., Kuzov A.V., Gavrilova N.N. Highly Active and Stable Catalysts Based on Nanotubes and Modified Platinum for Fuel Cells // Russ. J. Electrochem. 2016. V. 52. № 8. P. 723–734.
Wang L., Chen J., Rudolph V., Zhu Z. Nanotubules-Supported Ru Nanoparticles for Preferential CO Oxidation in H2-rich Stream // Adv. Powder Technol. 2012. V. 23. № 4. P. 465–471.
Balakhonov S.V., Vatsadze S.Z., Churagulov B.R. Effect of Supercritical Drying Parameters on the Electrochemical Properties of Vanadium Oxide-Based Aerogels // Inorg. Mater. 2017. V. 53. № 2. P. 181–184.
Ogi T., Nandiyanto A.B.D., Okuyama K. Nanostructuring Strategies in Functional Fine-Particle Synthesis Towards Resource and Energy Saving Applications // Adv. Powder Technol. 2014. V. 25. № 1. P. 3–17.
Jiang L., Sun G., Zhou Z., Sun S., Wang Q., Yan S., Li H., Tian J., Guo J., Zhou B., Xin Q. Size-Controllable Synthesis of monodispersed SnO2 Nanoparticles and Application in Electrocatalysts // J. Phys. Chem. B. 2005. V. 109. № 18. P. 8774–8778.
Kuriganova A.B., Smirnova N.V. Pt/SnOx-C Composite Material for Electrocatalysis // Mendeleev Commun. 2014. V. 24. № 6. P. 351–352.
Kuriganova A.B., Leontyeva D.V., Ivanov S., Bund A., Smirnova N.V. Electrochemical Dispersion Technique for Preparation of Hybrid MOx–C Supports and Pt/MOx–C Electrocatalysts for Low-Temperature Fuel Cells // J. Appl. Electrochem. 2016. V. 46. № 12. P. 1245–1260.
Antoniassi R.M., Silva J.C.M., Oliveira N.A., Spinacé E.V. Synthesis of Pt + SnO2/C Electrocatalysts Containing Pt Nanoparticles with Preferential (100) Orientation for Direct Ethanol Fuel Cell // Appl. Catal. B. 2017. V. 218. P. 91–100.
Zhang P., Huang S.-Y., Popov B. N. Mesoporous Tin Oxide as an Oxidation-Resistant Catalyst Support for Proton Exchange Membrane Fuel Cells // J. Electrochem. Soc. 2010. V. 157. № 8. P. B1163–B1172.
Frolova L.A., Dobrovolsky Yu.A. Platinum Electrocatalysts Based on Oxide Supports for Hydrogen and Methanol Fuel Cells // Russ. Chemi. Bull. Int. Ed. 2011. V. 60. № 6. P. 1101–1111.
Frolova L., Lyskov N., Dobrovolsky Yu. Nanostructured Pt/SnO2–SbOx–RuO2 Electrocatalysts for Direct Alcohol Fuel Cells // Solid State Ionics. 2012. V. 225. P. 92–98.
Elezović N.R., Babić B.M., Radmilović V.R., Krstajić N.V. Synthesis and Characterization of Pt Catalysts on SnO2 Based Supports for Oxygen Reduction Reaction // J. Electrochem. Soc. 2013. V. 160. № 10. P. F1151–F1158.
Gutsche C., Knipper M., Plaggenborg T., Parisi J., Kolny-Olesiak J. Synthesis of Facetted Pt Nanoparticles on SnO2 as an Oxygen Reduction Catalyst // CrystEngComm. 2017. V. 19. № 26. P. 3666–3673.
Ruiz-Camacho B., Medina-Ramírez A., Fuentes-Ramírez R., Gómez C. M. Simple Synthesis of Pt–Ag/SnO2–C for Use as a Catalyst of Methanol Oxidation in Alkaline Media // J. Solid State Electrochem. 2017. V. 21. № 8. P. 2449–2456.
Alekseenko A., Ashihina E., Shpanko S., Volochaev V., Safronenko O., Guterman V. Application of CO Atmosphere in the Liquid Phase Synthesis as a Universal Way to Control the Microstructure and Electrochemical Performance of Pt/C Electrocatalysts // Appl. Catal. B. 2018. V. 226. P. 608–615.
Kirakosyan S.A., Alekseenko A.A., Guterman V.E., Volochaev V.A., Tabachkova N.Y. Effect of CO Atmosphere on Morphology and Electrochemically Active Surface Area in the Synthesis of Pt/C and PtAg/C Electrocatalysts // Nanotechnol. Russ. 2016. V. 11. № 5. P. 287–296.
Brunauer S., Emmett P. H., Teller E. Adsorption of Gases in Multimolecular Layers // J. Am. Chem. Soc. 1938. V. 60. № 2. P. 309–319.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы