Неорганические материалы, 2019, T. 55, № 2, стр. 123-132
Морфология и термическая устойчивость тонких пленок Cu1.8Se, полученных химическим осаждением
Е. А. Федорова 1, Л. Н. Маскаева 1, 2, *, В. Ф. Марков 1, 2, В. И. Воронин 3, В. Г. Бамбуров 4
1 Уральский федеральный университет им. первого Президента России Б.Н. Ельцина
620002 Екатеринбург, ул. Мира, 19, Россия
2 Уральский институт ГПС МЧС России
620062 Екатеринбург, ул. Мира, 22, Россия
3 Институт физики металлов им. М.Н. Михеева УрО Российской академии наук
620108 Екатеринбург, ул. С. Ковалевской, 18, Россия
4 Институт твердого тела УрО Российской академии наук
620990 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: mln@ural.ru
Поступила в редакцию 16.02.2018
Аннотация
Исследованы морфология и термическая устойчивость тонких пленок Cu1.8Se, полученных при 333 K путем гидрохимического осаждения с использованием селеносульфата натрия. Методами рентгеновской дифракции и сканирующей электронной микроскопии изучены их кристаллическая структура и фазовый состав. Показано изменение фазового состава пленки селенида меди (I) после термообработки в интервале температур 453–563 K, а также морфологии и размеров структурных элементов синтезированных пленок.
ВВЕДЕНИЕ
Известно большое количество работ, посвященных получению тонких пленок селенида меди (I) химическим осаждением из водных растворов с использованием широкого круга лигандов [1–16], причем в качестве халькогенизатора в основном применялся селеносульфат натрия. Определенный интерес с точки зрения использования селенида меди (I) в качестве прекурсорных слоев для получения соединений халькопиритной и кестеритной структур представляет оценка их термической устойчивости.
В работе [17] показано, что образцы Cu2Se после термообработки до 550°C, изначально состоящие из α- и β-фаз, содержали только одну высокотемпературную фазу β-Cu2Se. Переход α-фазы Cu2Se в β-Cu2Se начинался уже при 140°C, а изменение фазового состава слоев после их охлаждения связывалось с отсутствием в них нестехиометрической кубической фазы Cu1.83Se. В работе также утверждается, что химически осажденные порошки Cu1.84Se начинают интенсивно окисляться выше 250°C с резким снижением в них содержания селена. Однако, согласно [18], при отжиге Cu2Se его структура заметно изменяется уже при 200°C. Анализ литературы позволил заключить, что сведения о фазовом составе и термической устойчивости пленок и порошков Cu2Se, полученных гидрохимическим осаждением, ограничены и крайне противоречивы.
Целью настоящей работы являлось проведение комплексных исследований структуры, морфологии и термической устойчивости химически осажденных пленок селенида меди (I).
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Термодинамическая оценка граничных условий гидрохимического осаждения твердой фазы селенида меди (I) с использованием селеносульфата натрия выполнена по методике, предложенной в [19] и успешно апробированной при получении пленок сульфидов олова, цинка, меди (I) [14–16], а также селенидов индия и галлия [20, 21]. Проведенные расчеты значительно упрощают определение концентрационных областей образования и диапазона pH осаждения селенида металла.
Для обеспечения восстановительной среды в процессе химического осаждения селенида меди (I) при использовании в составе реакционной смеси соли двухвалентной меди в реактор вводили солянокислый гидроксиламин NH2OH ⋅ HCl (${{\varphi }_{{{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{H}}}^{ + }}} \mathord{\left/ {\vphantom {{{\text{N}}{{{\text{H}}}_{{\text{3}}}}{\text{O}}{{{\text{H}}}^{ + }}} {{{{\text{N}}}_{{\text{2}}}}}}} \right. \kern-0em} {{{{\text{N}}}_{{\text{2}}}}}}}}} = - {\text{1}}{\text{.87 В }}$ [22]). Поэтому реакцию получения селенида меди (I) можно записать в следующем виде:
(1)
$\begin{gathered} {\text{2C}}{{{\text{u}}}^{ + }} + {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{SeS}}{{{\text{O}}}_{3}} + 2{\text{O}}{{{\text{H}}}^{ - }} = \\ = {\text{C}}{{{\text{u}}}_{{\text{2}}}}{\text{Se}} + {\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{S}}{{{\text{O}}}_{4}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Для определения минимально необходимой концентрации соли металла, обеспечивающей образование твердой фазы селенида меди (I), использовали выражение
(2)
$\begin{gathered} {\text{p}}{{C}_{{\text{н }}}} = \frac{{\text{1}}}{2}{\text{p}}\Pi {{{\rm P}}_{{{\text{С }}{{{\text{u}}}_{{\text{2}}}}{\text{Se}}}}} - {\text{p}}{{\alpha }_{{{\text{C}}{{{\text{u}}}^{ + }}}}} - \\ - \,\,\frac{1}{2}\left( {{\text{p}}k_{{{{{\text{H}}}_{{\text{2}}}}{\text{Se}}}}^{{{\text{1,2}}}} + \frac{1}{2}{\text{p}}{{K}_{{{\text{N}}{{{\text{a}}}_{{\text{2}}}}{\text{SeS}}{{{\text{O}}}_{{\text{3}}}}}}} - {\text{pH}} + \frac{1}{2}{\text{p}}{{{\left[ {{\text{SeSO}}_{3}^{{2 - }}} \right]}}_{{\text{н }}}}} \right. - \\ \,\,\left. { - \frac{{\text{1}}}{{\text{2}}}{\text{p}}{{\beta }_{{{\text{Se}}}}}} \right) - \frac{{0.86\sigma {{V}_{{\text{м }}}}}}{{RT{{r}_{{{\text{к р }}}}}}}, \\ \end{gathered} $Кроме селенида меди, в объеме реакционной смеси возможно осаждение гидроксида меди (I), для определения условий образования которого использовали уравнение [19]
(3)
${\text{p}}{{C}_{i}} = {\text{p}}\Pi {{{\rm P}}_{{{\text{M(OH}}{{{\text{)}}}_{n}}}}} - {\text{p}}{{\alpha }_{{{{{\text{M}}}^{{n + }}}}}} - n{\text{p}}{{K}_{w}} + n{\text{p}}{{{\text{H}}}_{i}},$Поскольку вероятность присутствия как одно-, так и двухвалентной меди в реакционной смеси достаточно велика, несмотря на то что солянокислый гидраксиламин довольно сильный восстановитель, при проведении анализа ионных равновесий в реакционных системах CuCl2–L–Na2SeSO3 (где L – цитрат-ионы ${{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}_{7}^{{3 - }},$ аммиак NH3, солянокислый гидроксиламин NH2OH ⋅ HCl и смесь NH3 + + NH2OH ⋅ HCl) использовали все известные комплексные формы меди и их показатели констант нестойкости. В аммиачной реакционной смеси Cu (II) образует следующие комплексы: Cu(NH3)2+ (pk1 = 3.99), ${\text{Cu}}\left( {{\text{N}}{{{\text{H}}}_{3}}} \right)_{2}^{{2 + }}$ (pk2 = 7.33), ${\text{Cu}}\left( {{\text{N}}{{{\text{H}}}_{3}}} \right)_{3}^{{2 + }}$ (pk3 = 10.06), ${\text{Cu}}\left( {{\text{N}}{{{\text{H}}}_{3}}} \right)_{4}^{{2 + }}$ (pk4 = 12.03), ${\text{Cu}}\left( {{\text{N}}{{{\text{H}}}_{3}}} \right)_{5}^{{2 + }}$ (pk5 = 11.43), ${\text{Cu}}\left( {{\text{N}}{{{\text{H}}}_{3}}} \right)_{6}^{{2 + }}$ (pk6 = 8.9) [23], а одновалентная медь – Cu(NH3)+ (pk1 = 5.93), ${\text{Cu}}\left( {{\text{N}}{{{\text{H}}}_{3}}} \right)_{2}^{ + }$ (pk2 = 10.86). В цитратной системе присутствуют комплексы ${\text{Cu}}{{\left( {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}_{7}^{{3 - }}} \right)}^{--}}$ (pk1 = 5.90), ${\text{Cu}}\left( {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}_{7}^{{3 - }}} \right)_{2}^{{4 - }}$ (pk2 = 16.35), ${\text{Cu}}\left( {{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{O}}_{7}^{{3 - }}} \right)_{3}^{{7 - }}$ (pk3 = = 18.77) [24], а в гидроксиламинной с двухвалентной медью – Cu(NH2OH)2+ (pk1 = 2.2), ${\text{Cu}}\left( {{\text{N}}{{{\text{H}}}_{{\text{2}}}}{\text{OH}}} \right)_{2}^{{2 + }}$ (pk2 = 4.1) и c одновалентной медью – Cu(NH2OH)+ (pk3 = 10.8) [23]. Кроме того, при расчете ионного состава раствора учитывали все известные гидроксокомплексы двухвалентной меди – Cu(OH)+ (pk1 = 6.0), Cu(OH)2 (pk2 = 10.7), ${\text{Cu}}\left( {{\text{OH}}} \right)_{3}^{ - }$ (pk3 = 14.2), ${\text{Cu}}\left( {{\text{OH}}} \right)_{4}^{{ - 2}}$ (pk4 = 16.4) [23] и одновалентной меди – Cu(OH) (pk = 6.0) [23].
Проведенная оценка возможного осаждения селенидов и гидроксидов меди (I, II) во всех четырех системах при [CuCl2] = 0.2 моль/л, [Na2SeSO3] = = 0.1 моль/л и температуре 298 K в трехмерных координатах “показатель начальной концентрации соли металла (рСн)–концентрация вводимого лиганда [L]–pH раствора” приведена на рис. 1.
Рис. 1.
Зависимости граничных условий образования CuSe, Cu2Se, Cu(OH)2 и CuOH от pH среды и концентрации лиганда в системе CuCl2–L–Na2SeSO3, где L – NH3 (а), Cit3– (б), NH3 + NH2OH · HCl при [NH2OH · HCl] = 0.2 моль/л (в), NH2OH · HCl (г); расчеты проведены при [CuCl2] = 0.2 моль/л, [Na2SeSO3] = 0.1 моль/л, Т = 298 K.
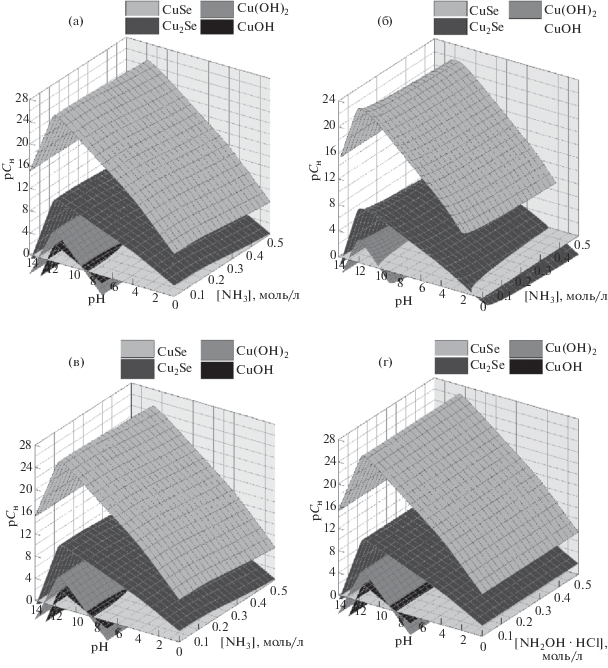
Концентрационные области, заключенные между поверхностями на рис. 1, отвечающие образованию CuSe и Cu2Se (верхние плоскости), соответствуют прогнозируемому образованию одной твердой фазы селенида меди (II) – CuSe. В условиях, ограниченных плоскостями, характеризующими формирование Cu2Se и примесных кислородсодержащих фаз Cu(OH)2 и CuOH (нижние плоскости), возможно одновременное образование селенидов одно- и двухвалентной меди. В области pH и концентраций лиганда, ограниченной поверхностью, принадлежащей гидроксидам меди, происходит совместное осаждение селенидов CuSe и Cu2Se и гидроксидных фаз Cu(OH)2 и CuOH.
Сравнивая положения концентрационных поверхностей, отвечающих началу образования гидроксидов CuOH и Cu(OH)2 в аммиачной (рис. 1а), аммиачно-гидроксиламинной (рис. 1в) и гидроксиламинной (рис. 1г) системах, можно отметить, что CuOH может образоваться во всем диапазоне концентраций лигандов при pH ≈ 8–12. Область возможного формирования гидроксида Cu(OH)2 смещается в сторону больших значений pH (9.0–13.5). Заметим, что в двух первых системах с ростом концентрации комплексообразующих агентов незначительно уменьшается вероятность формирования рассматриваемых примесных гидроксидных фаз.
Иная ситуация наблюдается в цитратной системе (рис. 1б), в которой можно увидеть образование только одной примесной фазы – Cu(OH)2, в то время как гидроксид меди (I) в данных условиях вообще не образуется. Отметим, что в рассматриваемой системе значение показателя pCн, отвечающее превращению соли металла в селенид, уменьшается в 3 раза по сравнению с другими системами. Кроме того, несколько сужается диапазон pH – до 2–14, в нем возможно образование селенидных фаз CuSe и Cu2Se.
Прогнозируемые расчетами области осаждения селенидов одно- и двухвалентной меди в системах CuCl2–NH3–Na2SeSO3 (рис. 1а) и CuCl2–NH3 + NH2OH ⋅ HCl–Na2SeSO3 (рис. 1в) не отличаются друг от друга. Это обусловлено превалирующим содержанием достаточно прочных аммиачных комплексов меди ${\text{Cu}}\left( {{\text{N}}{{{\text{H}}}_{3}}} \right)_{3}^{{2 + }},$ ${\text{Cu}}\left( {{\text{N}}{{{\text{H}}}_{3}}} \right)_{4}^{{2 + }},$ ${\text{Cu}}\left( {{\text{N}}{{{\text{H}}}_{3}}} \right)_{5}^{{2 + }}$ в обеих системах.
Таким образом, проведенные расчеты граничных условий образования Cu2Se и CuSe в четырех рассматриваемых системах показали, что их осаждение возможно практически во всем диапазоне pH.
Отметим, что использование пленок селенида меди в качестве прекурсорных слоев при формировании многокомпонентных соединений со структурой халькопирита (CuGaSe2, CuInSe2, CuInGaSe2) и кестерита (Cu2SnSe4, Cu2ZnSnSe4) предполагает нахождение меди в одновалентном состоянии. Поэтому при выборе рецептуры и условий синтеза пленок необходимо руководствоваться созданием восстановительной среды в реакционной смеси; возможностью получения слоев селенида меди (I) без примеси гидроксидных фаз (реализуется в относительно кислой среде), простотой состава реакционной смеси, а также ее экологической безопасностью.
Поскольку водные растворы аммиака неустойчивы уже при комнатных условиях, аммиачные системы были исключены из рассмотрения.
В цитратной системе образование прочных комплексов меди Cu(OH)Cit2– (kн = 4.50 × 10–17 [24]), Cu(OH)2$\left( {Cit} \right)_{2}^{{6 - }}$ (kн = 1.7 × 10–19 [24]) возможно только в щелочной среде, в то время как в кислой области преобладает относительно слабый комплексный ион CuCit– (kн = 1.26 × 10–6 [24]), который не способен справиться с задачей управления процессом осаждения фазы селенида меди (I) на поверхность подложки. Поэтому наиболее перспективной, отвечающей критериям выбора рецептурного состава, обеспечивающей восстановление меди до одновалентного состояния и проведение процесса в относительно кислой среде является гидроксил-амминная реакционная система CuCl2–NH2OH ⋅ HCl–Na2SeSO3. Предварительно проведенные эксперименты позволили установить рабочее значение pH реакционной среды, равное 3.3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пленки селенида меди (I) Cu2 − xSe получали на предварительно обезжиренных ситалловых подложках путем осаждения из водных растворов 0.2 М хлорида меди CuCl2 и 0.04 М селеносульфата натрия Na2SeSO3 в присутствии 0.02 М солянокислого гидроксиламина NH2OH ⋅ HCl (pH 3.3) при температуре 333 K. Продолжительность синтеза варьировалась от 5 до 120 мин.
Оценку толщины полученных пленок проводили с помощью микроинтерферометра Линника МИИ-4М.
Тонкопленочные слои селенида меди (I) термообрабатывали на воздухе в квазизамкнутом объеме, т.е. в условиях ограниченного поступления кислорода воздуха, в электрических печах марок SNOL 8.2/1000 и СНЗ 4,3.5,8.3,5/12 в температурном диапазоне 453–563 K. Методика термообработки пленок заключалась в их нагреве до заданной температуры, выключении печи с последующим ее медленным остыванием вместе с образцами. Исходя из температурной инерции печи средний темп ее нагрева составлял около 8–12 K/мин, а средний темп остывания – 1.2–1.3 K/мин в первые 6 ч после отключения со снижением его до 0.6 K/мин в дальнейшем.
Структурную аттестацию полученных тонкопленочных слоев после отжига проводили методом рентгеновской дифракции в CuKα1,2-излучении в интервале углов 2θ от 15° до 100° с шагом 0.05° и временем экспозиции в каждой точке 7 с. Для съемки использовали метод скользящего луча. Поверхность пленки располагали к рентгеновскому лучу под углом 3°.
Морфологию исследуемых образцов селенида меди (I) изучали с использованием растрового электронного микроскопа MIRA3LMV при ускоряющем напряжении 10 кВ. Исследование элементного состава проводили с использованием микроскопа JEOL JSM-5900 LV с приставкой для энергодисперсионного анализа (EDS IncaEnergy 250).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что устойчивое формирование твердой фазы возможно лишь при образовании зародышей критического размера, причем от количества зародышевых центров зависят скорость осаждения, толщина и морфология осаждаемых пленок, а следовательно, и их функциональные свойства. Поэтому представляло интерес исследование эволюции морфологии пленок Cu2 – xSe на стадии зарождения.
На рис. 2 приведены электронные микрофотографии, иллюстрирующие изменение морфологии пленок Cu2 – xSe. Через 5 мин от начала процесса химического осаждения пленки на поверхности подложки появляются фибриллярные образования протяженностью 160–310 и шириной 125–330 нм (рис. 2а, 2г). Можно заметить также вторичное зародышеобразование, когда на фибриллярных структурах закрепляются глобулы размером 20–30 нм (рис. 2).
Рис. 2.
Электронные микрофотографии пленок Cu2–xSe, осажденных при 333 K из реакционной смеси, содержащей [CuCl2] = 0.2 моль/л, [NH2OH ⋅ HCl] = 0.2 моль/л, [Na2SeSO3] = 0.04 моль/л при продолжительности синтеза, мин: 5 (а, г), 10 (б, д), 20 (в, е).

Через 10 мин от начала процесса подложка практически полностью покрывается слоем селенида меди, состоящим из кристаллитов с выраженным кубическим габитусом и средним размером видимого ребра 150–170 нм (рис. 2б, 2д). Через 20 мин на поверхности подложки формируется пленка из кристаллитов полиэдрической структуры за счет частичного вхождения одного структурного элемента в другой (рис. 2в, 2е). Видно, что размеры кристаллитов в процессе осаждения увеличиваются до ~270 нм.
На рис. 3 показана кинетика роста и изменение морфологии пленки селенида меди Cu2 – xSe в процессе химического осаждения при 333 K. Видно, что в первые 20 мин синтеза наблюдается интенсивное увеличение толщины слоя до ~150 нм со средней скоростью около 0.14 нм/с (рис. 3а). Увеличение продолжительности осаждения пленки до 120 мин сопровождается увеличением ее толщины до 390–450 нм и снижением средней скорости роста до 0.05 нм/с. Однако дальнейшее увеличение продолжительности осаждения не приводит к заметному изменению толщины слоя.
Рис. 3.
Зависимость толщины (а) и морфологии пленки селенида меди (I), гидрохимически осажденной при 333 K, от продолжительности синтеза, мин: 60 (б), 90 (в) и 120 (г); состав реакционной смеси, моль/л: [CuCl2] = 0.2, [NH2OH ⋅ ⋅ HCl] = 0.2, [Na2SeSO3] = 0.04, pH 3.3.
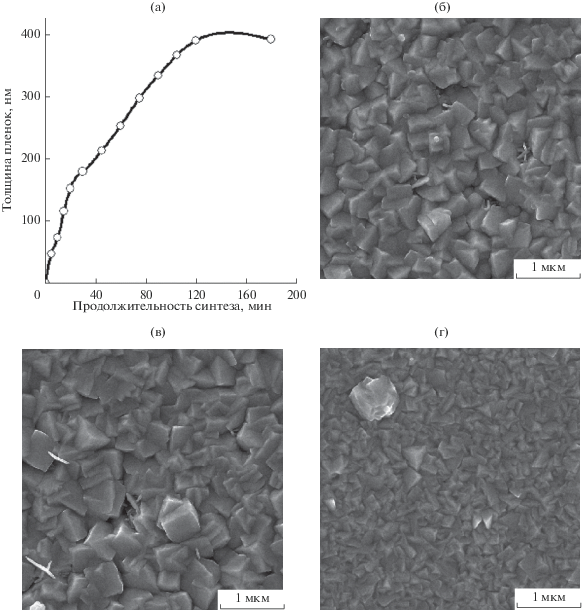
Была проведена оценка влияния продолжительности осаждения на морфологию пленки Cu2 – xSe в период активного роста (60–120 мин). Так, с увеличением продолжительности осаждения пленки существенно изменяется ее структура и размеры кристаллитов (рис. 3б–3г). После 60-минутного осаждения (рис. 3б) размеры кристаллитов, формирующих пленку, находятся в диапазоне от 150 до 450 нм, при этом наблюдается вторичное зародышеобразование в виде небольших шарообразных частиц (~80 нм), закрепившихся на гранях кристаллитов.
Осаждение пленки в интервале от 60 до 90 мин сопровождается укрупнением кристаллитов и формированием между ними пластинчатых образований толщиной ~30–40 и длиной 200–300 нм. Обычно такая кристаллизация обеспечивает образование достаточно плотной упаковки (рис. 3в). Стоит отметить, что по истечении 90 мин от начала процесса осаждения увеличение толщины слоя происходит за счет адсорбции кристаллитов из объема раствора, а не за счет формирования новых.
После двухчасового синтеза (рис. 3г) пленка состоит из плотно расположенных более мелких кристаллитов, на которых видны единичные частицы полиэдрической формы со средним размером ~390 нм. Если сравнивать микроэлектронные изображения, представленные на рис. 3б–3г, то можно увидеть, что к 120-й мин синтеза образуется однородный плотно упакованный слой Cu2 – xSe, что, по-видимому, свидетельствует о завершении процесса его роста.
Таким образом, для дальнейших исследований были взяты пленки Cu2 – xSe, полученные в течение 120 мин из реакционной ванны (pH 3.3), содержащей [CuCl2] = 0.2 моль/л, [NH2OH ⋅ HCl] = = 0.2 моль/л, [Na2SeSO3] = 0.04 моль/л. Приведенные условия обеспечивают гранулометрическую однородность кристаллитов, формирующих пленку селенида меди (I), толщина которой может достигать 400 ± 25 нм.
Результаты элементного анализа слоев свидетельствуют о том, что пленка Cu2–xSe состоит преимущественно из меди и селена, среднее содержание которых по девяти измерениям составило 58.98 ± 1.78 и 32.76 ± 0.99 ат. % соответственно. Содержание кислорода при этом находится в пределах 8.25 ± 0.25 ат. %. Полученные результаты демонстрируют определенную нестехиометрию синтезированных пленок, при которой отношение содержания металла к халькогену составляет около 1.8. Таким образом, гидрохимическим осаждением с использованием селеносульфата натрия в присутствии гидроксиламина осаждаются слои селенида меди (I) с формульным составом Cu1.8Se. Присутствие в пленках кислорода может быть частично связано с оксидной природой ситалловой подложки.
На рентгенограмме пленки, приведенной на рис. 4, идентифицированы дифракционные отражения 111, 200, 220 и 311, соответствующие кубической фазе (${\text{п р }}{\text{.}}\,{\text{г р }}{\text{. }}Fm\bar {3}m$) Cu2 – xSe (берцелианит) [5, 11, 25–27]. Также присутствуют дифракционные отражения ситалловой подложки, наличие которых обусловлено небольшой толщиной пленок (~390 нм).
Рис. 4.
Рентгенограмма свежеосажденной пленки Cu1.8Se, полученной гидрохимическим осаждением при 333 K из реакционной смеси CuCl2 + NH2OH ⋅ ⋅ HCl + Na2SeSO3.
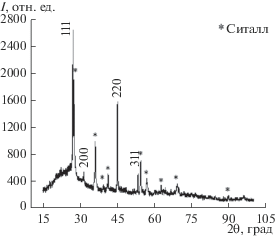
Период кристаллической решетки для анализируемого образца селенида меди (I) определяли с использованием программы WinPLOTR, входящей в состав программного обеспечения Fullprof. Период решетки составил 5.706 ± 0.002 Å, причем приведенное значение хорошо согласуется с данными работ, в которых исследовался селенид меди Cu1.8Se [10]. Стоит отметить, что наибольшей интенсивностью отличаются рефлексы, соответствующие 2θ ≈ 27°, т.е. рост кристаллитов происходит преимущественно за счет грани {111} кубической структуры (рис. 2), что весьма типично для тонкопленочного селенида Cu2 – xSe [4, 9–11].
Относительно кристаллической структуры β‑фазы селенида меди в публикациях наблюдаются противоречивые сведения. У различных авторов описаны тетрагональная, моноклинная, псевдо-орторомбическая, триклинная фазы [28]. В работе [29] отмечено, что нанокристаллы и нанопластины Cu1.8Se в зависимости от содержания селеносульфата натрия, гидрата гидразина и нитрата меди в растворе при температурах синтеза до 373 K имеют различные значения постоянной кристаллической решетки: a = 5.674(1), 5.737(1) и 5.738(1) Å. В работе [30] на рентгенограммах пленки селенида меди (I), осажденной селеносульфатом натрия при 353 K из аммиачного комплекса меди, обнаружили кубическую фазу с периодом кристаллической решетки, равным 0.584(2) нм. В работе [17] методом механохимического синтеза и компактирования с помощью горячего прессования получены смешанные объемные образцы с основной фазой α-Cu2Se, в которой с увеличением продолжительности синтеза в интервале 5–10 ч увеличивается доля кубической β-фазы с параметром решетки a = 0.5763 нм, соответствующим составу Cu1.8Se. На дифрактограммах образцов, синтезированных авторами [28] методом твердотельного синтеза при 773 K, присутствуют рефлексы низкотемпературной орторомбической фазы Cu2Se и кубической фазы берцелианита Cu1.8Se (пр. гр. Fm3m). К сожалению, авторы не приводят значения параметра кристаллической решетки синтезированных образцов. Приведенные сведения позволяют сделать вывод о том, что структура и параметры кристаллической ячейки селенида Cu1.8Se в случае химического осаждения в значительной степени зависят от состава реакционной ванны.
Рентгенограммы и электронные микрофотографии исследуемых пленок, термообработанных при 453 (а), 493 (б), 528 (в), 563 K (г), приведены на рис. 5. Видно, что на рентгенограммах слоев, нагретых до 453, 493 и 528 K, присутствуют интенсивные линии 111, 220, соответствующие ориентации кристаллитов в направлении грани {111}, и слабые рефлексы 200, 311, 400, 331 и 422. Период кристаллической решетки a, уточненный с использованием программы WinPLOTR, увеличивается от 5.706 ± 0.002 Å для свежеосажденного слоя состава Cu1.8Se до 5.728 ± 0.002 Å для образца, термообработанного при 453 K, и до 5.741 ± 0.002 Å для пленки, нагретой при 493 K. Аналогичное увеличение постоянной элементарной ячейки кубического кристалла Cu1.8Se с 5.734 до 5.773 Å с повышением температуры от 299 до 573 K наблюдали и авторы [31]. Значение постоянной кристаллической решетки 5.728 ± 0.002 Å пленки селенида меди (I), нагретой до 453 K, близко к параметру элементарной ячейки природного минерала берцелианита Cu2 – xSe а = 5.731 Å [32].
Рис. 5.
Рентгенограммы (а–г) и электронные микрофотографии (д–з) пленок Cu1.8Se, термообработанных при 453 (а, д), 493 (б, е), 528 (в, ж), 563 K (г, з).
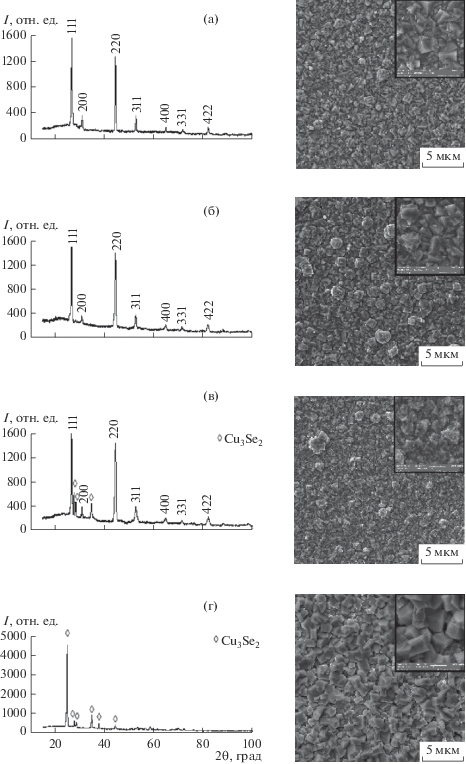
Электронные микрофотографии пленок, представленные на рис. 5, показали, что термическая обработка слоев селенида меди (I) в интервале температур от 453 до 563 K сопровождается изменением их морфологии. При повышении температуры отжига происходит увеличение размеров кристаллитов, формирующих пленку. Так, если слой свежеосажденного селенида меди (I) (рис. 3г) состоит из полиэдрических кристаллитов со средним размером ~250 нм, то нагрев до 493 K (рис. 5б) приводит к их укрупнению до ~745 нм, а также росту отдельных частиц, в результате чего поверхность пленки становится более шероховатой. Повышение температуры отжига до 528 K (рис. 5в) практически не влияет на морфологию поверхности пленки и размер формирующих ее частиц (~750 нм), однако на гранях полиэдрических кристаллитов основного селенида Cu1.8Se заметны сферические глобулы новой фазы, размеры которых составляют 150 ± 40 нм, а формульный состав близок к Cu3Se2. Микрофотография термообработанной при 563 K пленки (рис. 5г) показывает, что обнаруженные в предыдущем случае частицы, предположительно тетрагональной фазы умангита, трансформировались в четко ограненные однородные кристаллиты размером ~315 нм, что косвенно подтверждает гомогенизацию нагретого до этой температуры селенидного слоя.
Результаты элементного анализа термообработанных в интервале 453–493 K пленок селенида меди (I) показали, что, как и в случае свежеосажденных тонкопленочных слоев (рис. 3г), основными элементами являются медь (59.24 ± 2 ат. %) и селен (32.91 ± 5 ат. %), наряду с ними обнаружено незначительное количество кислорода (7.85 ± ± 3 ат. %). Как уже отмечалось, присутствие кислорода обусловлено в основном оксидной природой ситалловой подложки.
Таким образом, нагрев пленок Cu1.8Se в квазизамкнутом объеме воздуха в температурном диапазоне от 453 до 563 K не оказывает существенного влияния на их элементный состав, однако при термообработке выше 493 K наблюдается постепенный фазовый переход кубической фазы берцелианита в тетрагональную умангита.
ЗАКЛЮЧЕНИЕ
Анализом ионных равновесий в системе CuCl2–L–Na2SeSO3 (где L – NH3, Cit3–, NH3 + NH2OH ⋅ ⋅ HCl, NH2OH ⋅ HCl) определены перспективные для реализации процесса химического осаждения селенида меди (I) условия, обеспечивающие отсутствие примесной фазы гидроксида металла. Показано, что использование солянокислого гидроксиламина обеспечивает создание восстановительной среды с переводом двухвалентной меди в одновалентное состояние при формировании твердой фазы селенида металла.
Исследована эволюция морфологии тонкопленочного слоя Cu1.8Se в процессе гидрохимического осаждения селеносульфатом натрия при 333 K во временном интервале 5–120 мин. Показано, что в течение первых 10 мин ситалловая подложка практически полностью покрывается слоем селенида меди (I), состоящим из кристаллитов с выраженным кубическим габитусом и имеющим состав Cu1.8Se. С увеличением продолжительности процесса осаждения средний размер кристаллитов увеличивается от 150–170 до 400 нм. К 120-й мин синтеза пленка селенида меди (I) представляет собой однородный слой из плотно упакованных кристаллитов.
Верхняя температурная граница устойчивости гидрохимически осажденных пленок Cu1.8Se в квазизамкнутой воздушной среде составляет около 493 K. При более высоких температурах отжига происходит постепенный фазовый переход кубической фазы берцелианита в тетрагональную умангита.
Список литературы
Клочко Н.П., Хрипунов Г.С., Волкова Н.Д. Копач В.Р., Момотенко А.В., Любов В.Н. Структура и свойства электроосажденных пленок и пленочных композиций для прекурсоров халькопиритных и кестеритных солнечных элементов // ФТП. 2014. Т. 48. Вып. 4. С. 539–548. doi https://doi.org/10.1134/S1063782614040150
Gosavi S.R., Deshpande N.G., Gudage Y.G., Sharma R. Physical, Optical and Electrical Properties of Copper Selenide (CuSe) Thin Films Deposited by Solution Growth Technique at Room Temperature // J. Alloys Compd. 2008. V. 448. P. 344–348. doi https://doi.org/10.1016/j.jallcom.2007.03.068
Hankare P.P., Khomane A.S., Chate P.A., Rathod K.C., Garadkar K.M. Preparation of Copper Selenide Thin Films by Simple Chemical Route at Low Temperature and Their Characterization // J. Alloys Compd. 2009. V. 469. P. 478–482. doi https://doi.org/10.1016/j.jallcom.2008.02.062
Bari R.H., Ganesan V., Potadar S., Patil L.A. Structural, Optical and Electrical Properties of Chemically Deposited Copper Selenide Films // Bull. Mater. Sci. 2009. V. 32. P. 37–42. doi https://doi.org/10.1007/s12034-009-0006-z
Khomane A.S. Synthesis and Characterization of Chemically Deposited Cu2–xSe Thin Films // Arch. Appl. Sci. Res. 2012. V. 4. P. 1857–1863. http://scholarsresearchlibrary.com/archive.html.
Durdu B.G., Alver U., Kucukonder A. Investigation on Zinc Selenide and Copper Selenide Thin Films Produced by Chemical Bath Deposition // Acta Phys. Pol., A. 2013. V. 124. P. 41–45. doi https://doi.org/10.12693/APhysPolA.124.41
Sandoval-Paz M.G., Rodrнguez C.A., Porcile-Saavedra P.F., Trejo-Cruz C. Study of the Crystallographic Phase Change on Copper (I) Selenide Thin Films Prepared Through Chemical Bath Deposition by Varying the pH of the Solution // J. Solid State Chem. 2016. V. 239. P. 106–112. doi https://doi.org/10.1016/j.jssc.2016.04.026
Mane R.S., Kajve S.P., Lokhande C.D., Han S.-H. Studies on p-type Copper (I) Selenide Crystalline Thin Films for Hetero-Junction Solar Cells // Vacuum. 2006. V. 80. P. 631–635. doi https://doi.org/10.1016/j.vacuum.2005.08.021
Bhuse V.M., Hankare, Garadkar K.M., Khomane A.S. A Simple, Convenient, Low Temperature Route to Grow Polycrystalline Copper Selenide Thin Films // Mater. Chem. Phys. 2003. V. 80. P. 82–88. doi https://doi.org/10.1016/S0254-0584(02)00306-1
Al-Mamun Firoz S.H., Islam A.B.M.O. Detection of Crystal Structure of Chemically-Deposited Copper Selenide Thin Films // Ind. J. Phys. A. 2004. V. 78. P. 377−379.
Dhanam M., Manoj P.K., Prabhu R.R. High-Temperature Conductivity in Chemical Bath Deposited Copper Selenide Thin Films // J. Cryst. Growth. 2005. V. 280. P. 425–435. doi https://doi.org/10.1016/j.jcrysgro.2005.01.111
Pai R.R., John T.T., Lakshmi M. Observation of Phase Transitions in Chemical Bath Deposited Copper Selenide Thin Films Through Conductivity Studies // Thin Solid Films. 2005. V. 473. P. 208–212. https://org/ doi https://doi.org/10.1016/j.tsf.2004.04.020.
Danu Bernice Yram. Investigating the Optical Band Gap and Crystal Structure of Copper Sulphide and Copper Selenide Thin Films Deposited by Chemical Bath Deposition. 2015. 83 p.
Маскаева Л.Н., Туленин С.С., Тимина А.А., Шемякина А.И., Марков В.Ф. Оценка условий образования и синтез тонких пленок сульфида олова(II) из растворов с использованием тиомочевины и тиоацетамида // Бутлер. сообщения. 2016. Т. 45. № 3. С. 72–79. jbc-01/16-45-3-72
Маскаева Л.Н., Шемякина А.И., Марков В.Ф., Сарыева Р.Х. Прогнозирование условий химического осаждения и микроструктура нанокристаллических пленок сульфида цинка // ЖПХ. 2015. Т. 88. № 9. С. 115–125. doi https://doi.org/10.1134/S1070427215090062
Маскаева Л.Н., Глухова И.А., Марков В.Ф., Туленин С.С., Воронин В.И. Наноструктурные пленки сульфида меди (I): синтез, состав, морфология и структура // ЖПХ. 2016. Т. 89. № 12. С. 1525–1533. doi https://doi.org/10.1134/S107042721612003X
Иванов А.А., Сорокин А.И., Панченко В.П., Тарасова И.В., Табачкова Н.Ю., Бублик В.Т., Акчурин Р.Х. Структура соединения Сu2Se, полученного различными методами // ФТП. 2017. Т. 51. № 7. С. 904–907. doi https://doi.org/10.21883/FTP.2017.07.44638.24
Маскаева Л.Н., Марков В.Ф., Федорова Е.А., Берг И.А., Самигуллина Р.Ф., Воронин В.И. Структура и термическая устойчивость прекурсорных наноструктурированных порошков сульфида и селенида меди (I) // ЖПХ. 2017. Т. 90. № 10. С. 1287–1294. doi https://doi.org/10.1134/S1070427217100032
Марков В.Ф., Маскаева Л.Н., Иванов П.Н. Гидрохимическое осаждение пленок сульфидов металлов: моделирование и эксперимент. Екатеринбург: УрО РАН, 2006. 218 с.
Туленин С.С., Маскаева Л.Н., Марков В.Ф., Кузнецов М.В. Условия осаждения, состав и структура химически осажденных пленок In2Se3 // ЖНХ. 2016. Т. 61. № 4. С. 488–495. doi https://doi.org/10.7868/S0044457X1604022X
Федорова Е.А., Маскаева Л.Н., Марков В.Ф., Мокроусова О.А. Термодинамическая оценка условий образования Ga2Se3 гидрохимическим осаждением // Бутлер. сообщения. 2015. Т. 42. № 6. С. 33–40. jbc-01/15-42-6-33
Кварацхелия Р.К. Электрохимия гидроксиламина. Тбилиси: Мецниереба, 1981. 108 с.
Лурье Ю.Ю. Справочник по аналитической химии. 6-е изд., перераб. и доп. М.: Химия, 1989. 448 с.
Martell A.E., Hancock R.D. Metal Complexes in Aqueous Solutions. New York: Plenum Press, 1996. 264 p.
Moysiadou A., Koutsikou R., Bouroushian M. Pulse Electrodeposition of Copper Selenides from Acidic Aqueous Baths // Mater. Lett. 2015. V. 139. P. 112–115. doi https://doi.org/10.1016/j.matlet.2014.10.036
Cho A., Ahn S., Yun J.H., Gwak J., Ahn S.K., Shin K., Yoo J., Song H., Yoon K. The Growth of Cu2−xSe Thin Films Using Nanoparticles // Thin Solid Films. 2013. V. 546. P. 299–307. doi https://doi.org/10.1016/j.tsf.2013.02.037
Kristl M., Kristl J. Sonochemical Process for the Preparation of Nanosized Copper Selenides with Different Phases // Chalcogenide Lett. 2014. V. 11. P. 59–66.
Balapanov M.Kh., Ishembetov R.Kh., Kuterbekov K.A., Yakshibaev R.A. Thermoelectric and Thermal Properties of Superionic AgxCu2 − xSe (x = 0.01, 0.02, 0.03, 0.04, 0.25) Compounds // Lett. Mater. 2016. V. 6(4). P. 360–365. doi https://doi.org/10.22226/2410-3535-2016-4-360-365
Jin Y., Han M.-K., Kim S.-J. Na-Doping Effects on Thermoelectric Properties of Cu2−xSe Nanoplates // Appl. Sci. 2018. V. 8. № 12. P. 1–10. doi https://doi.org/10.3390/app8010012
Марков В.Ф., Туленин С.С., Маскаева Л.Н., Кузнецов М.В. Термодинамический анализ условий образования и химическое осаждение твердых растворов замещения в системе Cu2Se−In2Se3 // Бутлер. сообщения. 2011. Т. 26. № 12. С. 29–36. jbc-01/11-26-12-29
Асадов Ю.Г., Алыев Ю.И., Бабаев А.Г. Полиморфные превращения в Cu2Se, Ag2Se, AgCuSe и роль частичного катион-катионного и анион-анионного замещения в стабилизации их модификаций // Физика элементарных частиц и атомного ядра. 2015. Т. 46. № 3. С. 812–850.
Earley J.W. Description and Synthesis of the Selenide Minerals // Am. Mineral. 1950. V. 35. P. 337–364.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


