Неорганические материалы, 2019, T. 55, № 3, стр. 283-289
Синтез высокодисперсного α-LiAlO2 при термической обработке механически активированной смеси гиббсита и карбоната лития
В. П. Исупов 1, *, И. А. Бородулина 1, Р. Н. Ниязова 1, 2, Н. В. Еремина 1
1 Институт химии твердого тела и механохимии СO Российской академии наук
630128 Новосибирск, ул. Кутателадзе, 18, Россия
2 Новосибирский государственный технический университет
630073 Новосибирск, пр. К. Маркса, 20, Россия
* E-mail: isupov@solid.nsc.ru
Поступила в редакцию 12.05.2018
После доработки 15.10.2018
Принята к публикации 04.10.2018
Аннотация
Определены условия синтеза высокодисперсного однофазного α-LiAlO2, образующегося при термической обработке механически активированной смеси гиббсита и карбоната лития на воздухе. Показано, что для синтеза α-LiAlO2 на этапе механической активации смеси реагентов не должно происходить аморфизации гиббсита, а процесс термической обработки на воздухе должен осуществляться в интервале 650–700°С.
ВВЕДЕНИЕ
Высокодисперсные моноалюминаты лития (α-LiAlO2, γ-LiAlO2) представляют интерес в качестве материалов матричного электролита карбонатрасплавленных топливных элементов [1]. Для такого применения этих соединений необходимы высокие чистотa (≥98%) и удельная поверхность материала (≥10 м2/г). В настоящее время для этих целей используется высокотемпературный моноалюминат лития γ-LiAlO2 [2]. Однако недавно было показано, что при длительном (20 тыс. ч) выдерживании γ-LiAlO2 в расплаве карбонатной эвтектики Li2CO3 + Na2CO3 происходит фазовый переход γ-LiAlO2 в его низкотемпературную форму α-LiAlO2 [3]. Такая трансформация может нарушать работу матричного элемента, поэтому возникает вопрос о целесообразности использования высокодисперсного α-LiAlO2 вместо γ-LiAlO2 в качестве материала матричного электролита карбонатрасплавленных топливных элементов [3, 4].
Существует несколько способов синтеза высокодисперсного α-LiAlO2. Среди них наибольший интерес представляет керамический метод, основанный на термической обработке шихты, содержащей соединения алюминия (оксиды, гидроксиды) и карбонат лития, при температурах ниже 700°С – температуры фазового перехода α → γ [5]. Так, в первых работах по синтезу α-LiAlO2 смесь корунда и карбоната лития нагревали на воздухе при 600°С в течение 200 ч с промежуточными перетираниями спеков [5, 6]. Образующийся при таком методе синтеза α-LiAlO2 имеет низкую удельную поверхность и требует дополнительного длительного измельчения в шаровой мельнице. Позднее в качестве соединений алюминия был использован гамма-оксид алюминия, взаимодействие которого с карбонатом лития осуществляли в присутствии эвтектической смеси карбоната лития и калия при температуре 600°С в течение 24 ч [7, 8]. Для удаления эвтектики, остающейся после синтеза, использовали смесь уксусной кислоты и уксусного ангидрида с последующей промывкой твердой фазы этанолом. Несмотря на уменьшение времени термической обработки, необходимой для синтеза целевого продукта, необходимость очистки α-LiAlO2 от щелочных карбонатов усложняет процесс синтеза целевого продукта.
Для синтеза высокодисперсного α-LiAlO2 в качестве соединений алюминия перспективно применение тригидроксида алюминия в форме гиббсита. Так, в [9] показано, что взаимодействие крупнодисперсного гиббсита с карбонатом лития при температуре 650°С в течение 2 ч на воздухе приводит к образованию альфа-алюмината алюмината с примесью непрореагировавшего карбоната лития. Увеличение температуры до 700°С позволяет получать моноалюминат лития без примеси карбоната лития, однако в твердой фазе наряду с α-LiAlO2 появляется примесь γ-LiAlO2, содержание которой возрастает по мере увеличения температуры термической обработки. Для увеличения скорости взаимодействия между карбонатом лития и гиббситом и синтеза однофазного α-LiAlO2 в [10] была использована предварительная гомогенизация исходной смеси в водной среде с последующей сушкой материала при 110°С в течение одного дня. Высушенную смесь прокаливали на воздухе в течение 24 ч при температурах от 600 до 800°С. Образующиеся при 600 и 700°С продукты содержали однофазный α-LiAlO2 с удельной поверхностью, варьирующейся от 9 до 11 м2/г. Недостатками предложенного подхода являются необходимость предварительной гомогенизации смеси исходных реагентов в водной пульпе, наличие дополнительной операции сушки пульпы и последующей длительной термической обработки.
Другой путь интенсификации взаимодействия между гиббситом и карбонатом лития связан с предварительной механической активацией (МА) смеси этих реагентов в мельницах-активаторах планетарного типа с последующей термической обработкой продуктов активации на воздухе [9, 11]. Так, активация смеси гиббсита и карбоната лития в мельнице-активаторе планетарного типа АГО-2 при центробежном ускорении 40 g в течение нескольких минут приводит к существенному увеличению удельной поверхности реагентов, накоплению дефектов в кристаллической структуре этих соединений, их перемешиванию на микронном уровне, а также изменению структуры [11]. При последующей термической обработке МА-смеси на воздухе в течение 4 ч при температуре 700°С образуется смесь, состоящая из γ-LiAlO2 и α-LiAlO2, с удельной поверхностью более 10 м2/г. Содержание γ-LiAlO2 в смеси прямо пропорционально содержанию рентгеноаморфного гидроксида алюминия, образующегося на стадии МА [12]. При одноминутной активации содержание рентгеноаморфной фазы гидроксида алюминия составляет 16%, α-LiAlO2 – 80%, γ-LiAlO2 – 20% [11]. Полученные данные указывают на то, что МА смеси гиббсита и карбоната лития в планетарном активаторе, не приводящая к существенному образованию рентгеноаморфного гидроксида алюминия, с последующей термической обработкой на воздухе при температуре ниже фазового перехода α-LiAlO2 → → γ-LiAlO2 может быть использована для синтеза высокодисперсного α-LiAlO2.
Целью настоящей работы явилось определение условий МА (времени процесса и величины центробежного ускорения) смеси гиббсита и карбоната лития в планетарном активаторе АГО-2 и последующей термической обработки на воздухе, необходимых для получения однофазного α-LiAlO2 с характеристиками, удовлетворяющими требованиям к материалам матричного электролита карбонатрасплавленных топливных элементов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для работы был использован Al(OH)3 в форме гиббсита (“ч. д. а.”) и Li2CO3 (“х. ч.”) с удельной поверхностью 0.2 и 1 м2/г соответственно. МA смеси осуществляли на воздухе в лабораторной планетарной центробежной мельнице АГО-2 в стальных барабанах объемом 100 мл при ускорении 10, 20 и 40 g (частота вращения ротора 420, 590 и 830 об./мин) и интервале времен от 1 до 5 мин. Для активации использовали стальные шары диаметром 5 мм, отношение массы вещества к массе шаровой загрузки составляло 1 : 20.
Для фазового анализа МА-образцов и продуктов их термической обработки применяли дифрактометр D8 Advance (CuKα-излучение). Съемку осуществляли в диапазоне углов 2θ = 10°–70° с шагом 0.02° и временем накопления 35 с. Для высокотемпературных исследований РФА in situ использовали камеру HTK 1200N (Anton Paar, Австрия) с корундовой кюветой. Нагрев камеры проводили на воздухе от комнатной температуры до 100°С, скорость нагрева 12°C/мин. При достижении температуры нагрев прекращали и проводили регистрацию рентгенограммы, далее температуру снова подымали до 200°С с последующей записью рентгенограммы и т.д. Для оценки содержания рентгеноаморфного гидроксида алюминия (А, %) в активированной смеси использовали формулу А (%) = 100(Io – Iτ)/Io, где Io – интегральная интенсивность выбранного рефлекса гиббсита в смеси до активации, Iτ – интегральная интенсивность этого рефлекса после активации смеси в течение τ минут. Для описания изменения фазового состава МА-смеси в процессе нагрева измеряли интегральную интенсивность рефлексов гиббсита 112, карбоната лития 110, а также образующихся при взаимодействии продуктов: бемита 020, α-LiAlO2 003 и γ-LiAlO2 101. Так как наиболее интенсивные рефлексы γ-Al2O3 и χ-Al2O3, образующихся при разложении гидроксида алюминия, перекрываются с рефлексами α-LiAlO2 и карбоната лития, их интегральную интенсивность не измеряли.
Термическую обработку МА-смеси проводили на воздухе в муфельной печи SNOL со скоростью нагрева 10°C/мин, после достижения необходимой температуры смесь выдерживали в течение необходимого времени. Количественный состав алюминатов лития определяли путем моделирования профиля рентгенограммы методом Ритвельда в программе Topas 4.2 (Bruker AXS, Германия). Удельную поверхность измеряли путем десорбции аргона с использованием стандартного образца удельной поверхности.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ
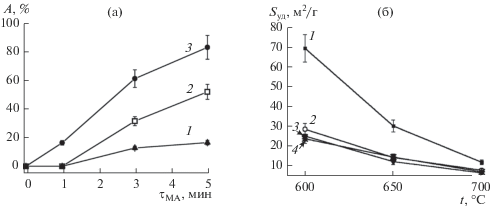
Влияние времени и центробежного ускорения при МА смеси гиббсита и карбоната лития на аморфизацию гидроксида алюминия. Как уже указывалось выше, имеющиеся литературные данные позволяют предполагать, что для синтеза высокодисперсного α-LiAlO2 без значимой (единицы процентов) примеси γ-LiAlO2 необходимо, чтобы на этапе МА смеси гиббсита и карбоната лития в планетарном активаторе не происходило существенного образования рентгеноаморфного гидроксида алюминия. Поэтому на первом этапе работы было исследовано влияние величины центробежного ускорения и времени активации смеси гиббсита и карбоната лития на содержание в продуктах активации рентгеноморфного гидроксида алюминия (рис. 1). Как видно из рис. 1а, снижение величины центробежного ускорения с 40 до 10 g при фиксированном времени МА позволяет существенно (в разы) уменьшить содержание рентгеноаморфного гидроксида алюминия. Поэтому в дальнейших экспериментах были использованы образцы, полученные при величине центробежного ускорения 10 g в течение 1, 3 и 5 мин, с удельной поверхностью 2.7, 5.7 и 7.6 м2/г соответственно. Средний размер частиц смеси, рассчитанный по формуле D = 6/ρSуд, где ρ – средняя плотность смеси (2.3 г/см3), а Sуд – удельная поверхность, составляет 1.0, 0.46 и 0.34 мкм соответственно.
Рис. 1.
Зависимости содержания рентгеноаморфного гидроксида алюминия (А, %) от времени МА и величины центробежного ускорения: 1 – 10 g, 2 – 20 g, 3 – 40 g (а) и удельной поверхности продуктов термической обработки исходной (1) и МА в течение 1 (2), 3 (3), 5 мин (4) смеси гидроксида алюминия и карбоната лития от температуры процесса (время термической обработки – 4 ч) (б).
Влияние условий термической обработки МА-смеси гиббсита и карбоната лития на образование α-LiAlO2. При термической обработкe неактивированной смеси выше 200°С происходит разложение гиббсита с образованием χ-Al2O3 и бемита (рис. 2, 3). Бемит в интервале от 400 до 600°С разлагается с образованием γ-Al2O3. При температуре выше 600°С карбонат лития взаимодействует с χ-Al2O3 и γ-Al2O3 с образованием α-LiAlO2. Наряду с рефлексами α-LiAlO2 при температуре 800°С начинают появляться рефлексы γ-LiAlO2. При охлаждении образца до комнатной температуры в твердой фазе наряду с рефлексами α-LiAlO2 и γ-LiAlO2 наблюдаются слабые рефлексы карбоната лития, что свидетельствует о незавершенности реакции.
Рис. 2.
Результаты РФА in situ исходной смеси гидроксида алюминия и карбоната лития на воздухе: H – Al(OH)3, C – Li2CO3, B – AlO(OH), χ – χ-Al2O3, G – γ-Al2O3, α – α-LiAlO2, γ – γ-LiAlO2.
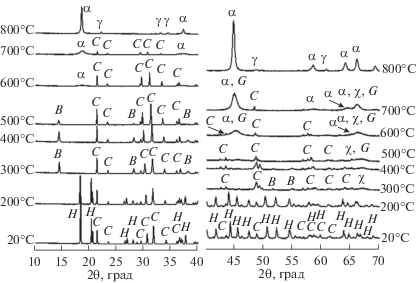
Рис. 3.
Зависимости интегральной интенсивности рефлексов фаз, образующихся при термической обработке смеси карбоната лития и гиббсита, от температуры термической обработки.
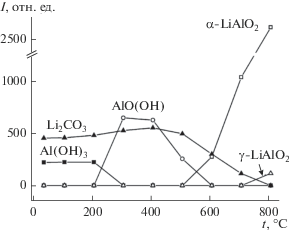
Для смеси, активированной в течение 1 мин, нагревание до 300°С также приводит к образованию бемита и χ-Al2O3 (рис. 4, 5). Количество бемита, образующегося при разложении гидроксида алюминия в МА-смеси, меньше по сравнению с неактивированной смесью. Разложение бемита также начинает происходить в интервале от 400 до 500°С (рис. 5) и сопровождается образованием γ-Al2O3. Интенсивность рефлексов карбоната лития начинает уменьшаться в температурном интервале от 500 до 600°С, при 700°С рефлексы карбоната лития практически полностью исчезают и регистрируются только рефлексы α-LiAlO2 (рис. 5). Нагревание до 800°C приводит к появлению слабых рефлексов гамма-моноалюмината лития. При снижении температуры образца до комнатной на рентгенограмме наблюдаются преимущественно рефлексы α-LiAlO2, а также γ-LiAlO2 небольшой интенсивности, рефлексы карбоната лития отсутствуют.
Рис. 4.
Результаты РФА in situ смеси гидроксида алюминия и карбоната лития, МА в течение 1 мин, на воздухе: H – Al(OH)3, C – Li2CO3, B – AlO(OH), χ – χ-Al2O3, G – γ-Al2O3, α – α-LiAlO2, γ – γ-LiAlO2.

Рис. 5.
Зависимости интегральной интенсивности рефлексов фаз, образующихся при термической обработке МА-смеси карбоната лития и гиббсита, от температуры термической обработки (τМА = 1 мин).
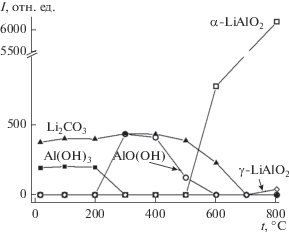
Картины фазовых превращений при термической обработке смесей, активированных в течение 3 и 5 мин, качественно аналогичны картине при τМА = 1 мин. Наблюдается дальнейшее уменьшение содержания бемита, образующегося при разложении гидроксида алюминия, увеличение интенсивности рефлексов α-LiAlO2, образующегося при 600°С, и увеличение интенсивности рефлексов γ-LiAlO2, образующихся при нагревании до 800°С.
Таким образом, данные РФА in situ свидетельствуют о том, что оптимальные температуры, необходимые для образования α-LiAlO2 как из неактивированной, так и из активированной смеси, лежат в интервале от 600 до 700°С. Нагрев до температур ниже этого интервала приводит к неполному взаимодействию между исходными реагентами, нагрев до более высоких температур приводит к появлению примеси высокотемпературного γ-LiAlO2.
Следующим этапом работы явилось исследования влияния условий термической обработки на фазовый состав и удельную поверхность α-LiAlO2. Исследование было выполнено на образцах, полученных при прокаливании исходной и МА в течение 1, 3 и 5 мин смеси гиббсита и карбоната лития при температурах 600, 650 и 700°С в течение 4 ч (рис. 6). Термическая обработка неактивированной смеси во всем исследованном температурном интервале приводит к образованию α-LiAlO2, содержащего примесь непрореагировавшего карбоната лития (рис. 6а). Предварительная МА смеси в течение 1 мин увеличивает скорость взаимодействия между реагентами и позволяет получить при 650–700°С практически однофазный α-LiAlO2 (рис. 6б). Увеличение времени активации до 3 и 5 мин приводит к появлению в продуктах взаимодействия наряду с α-LiAlO2 примеси γ-LiAlO2, количество которого возрастает при увеличении температуры термической обработки и времени МА (рис. 6в, 6г, табл. 1). Содержание примесной фазы γ-LiAlO2 в α-LiAlO2 практически линейно коррелирует с содержанием рентгеноаморфного гидроксида алюминия (табл. 1). Для того чтобы содержание примесной фазы γ-LiAlO2 в α-LiAlO2 не превышало единиц %, необходимо, чтобы содержание рентгеноаморфного гидроксида в МА-смеси находилось на таком же уровне.
Рис. 6.
Рентгенограммы продуктов, образующихся при термической обработке исходной (а) и МА в течении 1 (б), 3 (в), 5 мин (г) смесей гидроксида алюминия и карбоната лития (время термической обработки 4 ч).
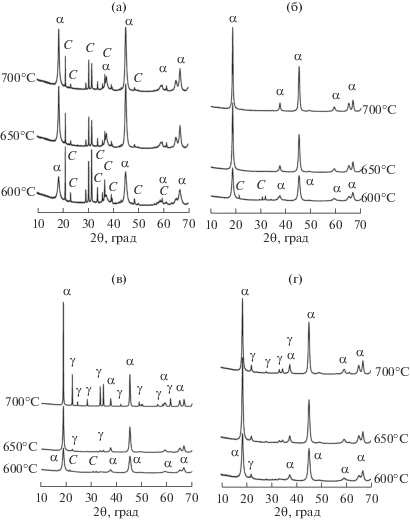
Таблица 1.
Зависимость фазового состава продуктов, образующихся при термической обработке смесей гидроксида алюминия и карбоната лития на воздухе при 700°С в течение 4 ч, от времени МА
| τМА, мин | А, % | Содержание, мас. % | ||
|---|---|---|---|---|
| Li2CO3 | α-LiAlO2 | γ-LiAlO2 | ||
| 0 | 0 | 1.7 | 98.3 | – |
| 1 | 1.5 | – | 99.0 | 1.0 |
| 3 | 11 | – | 94.0 | 6.0 |
| 5 | 16 | – | 88.3 | 11.7 |
Удельная поверхность алюмината лития зависит от времени активации смеси реагентов, а также от температуры ее термической обработки (рис. 1б). Наиболее высокая удельная поверхность наблюдается для продуктов, образующихся при термической обработки исходной смеси гиббсита и карбоната лития при 600°С. При увеличении температуры обработки удельная поверхность уменьшается (кривая 1 на рис. 1б). Такая же зависимость удельной поверхности α-LiAlO2 от температуры наблюдается при термической обработке МА-образцов (кривые 2–4 на рис. 1б). При одной и той же температуре термической обработки удельная поверхность снижается при увеличении времени МА смеси. Удельная поверхность однофазного α-LiAlO2, синтезированного при τМА = 1 мин и температуре термической обработке, варьирующейся от 650 до 700°С, лежит в интервале от 10 до 15 м2/г, что отвечает требованиям, предъявляемым к материалам матричного электролита карбонатрасплавленного топливного элемента.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно литературным данным, образование α-LiAlO2 при термической обработке смеси гиббсита и карбоната лития происходит при температуре выше 600°С за счет взаимодействия карбоната лития с кристаллическими γ-Al2O3 и χ-Al2O3, образующимися по реакциям [11, 13]:
(1)
${\text{Al}}{{\left( {{\text{OH}}} \right)}_{{3{\text{к р }}}}}\xrightarrow{{t > 200^\circ {\text{C}}}}{\text{AlOO}}{{{\text{H}}}_{{{\text{к р }}}}} + {{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \uparrow ,$(2)
${\text{Al}}{{\left( {{\text{OH}}} \right)}_{{3{\text{к р }}}}}\xrightarrow{{t > 250^\circ {\text{C}}}}\chi {\text{ - A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}} + 1.5{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \uparrow ,$(3)
${\text{AlOO}}{{{\text{H}}}_{{3{\text{к р }}}}}\xrightarrow{{t > 450^\circ {\text{C}}}}\gamma {\text{ - A}}{{{\text{l}}}_{2}}{{{\text{O}}}_{3}} + 1.5{{{\text{H}}}_{2}}{\text{O}}{\kern 1pt} \uparrow {\text{.}}$Кристаллические оксиды χ-Al2O3 и γ-Al2O3 образуют псевдоморфозу по сферолитовидным сросткам кристаллов исходного гиббсита, размер которых для крупнокристаллического материала лежит преимущественно в интервале от 60 до 150 мкм. Ввиду больших размеров образующихся частиц оксида алюминия скорость их взаимодействия с карбонатом лития в условиях эксперимента (600–700°С, 4 ч) не приводит к полному взаимодействию реагентов. Продукты взаимодействия содержат как α-LiAlO2, так и непрореагировавшие карбонат лития и оксиды алюминия. Кратковременная активация смеси реагентов при центробежном ускорении 10 g в течение 1 мин приводит к уменьшению среднего размера частиц гиббсита и карбоната лития примерно на порядок при практическом отсутствии аморфизации гиббсита. Существенное уменьшение размера частиц гиббсита и образующихся кристаллических оксидов алюминия приводит к увеличению скорости взаимодействия между оксидами и карбонатом лития с образованием практически однофазного высокодисперсного α-LiAlO2 без существенной примеси карбоната лития. Увеличение времени МА смеси до 3 и 5 мин приводит к дальнейшему уменьшению размера частиц гиббсита, а также к появлению примеси рентгеноаморфного гидроксида алюминия.
Термическая обработка активированной смеси приводит не только к дальнейшему увеличению скорости взаимодействия между кристаллическим оксидами и карбонатом лития, но и к разложению рентгеноаморфного гидроксида алюминия и появлению, наряду с кристаллическими оксидами алюминия, примеси рентгеноаморфного π-Al2O3, взаимодействие которого с карбонатом лития является причиной образования примеси γ-LiAlO2 в α-LiAlO2 [11, 14 ] . Эта точка зрения подтверждается наличием линейной корреляции между содержанием γ-LiAlO2 в α-LiAlO2 и количеством рентгеноаморфного гидроксида алюминия после МА, отмеченной выше. При температурах термической обработки выше 700°С образование примеси γ-LiAlO2 может происходить также за счет фазового перехода α-LiAlO2 в γ-LiAlO2.
ЗАКЛЮЧЕНИЕ
Механическая активация смеси гиббсита и карбоната лития в планетарном активаторе АГО-2 в течение 1–3 мин при центробежном ускорении 10 g с последующей термической обработкой МА-смеси при 650–700°С в течение нескольких часов позволяет получать высокодисперсный α-LiAlO2 с характеристиками, приемлемыми для использования этого вещества в матричном электролите карбонатрасплавленных топливных элементов. Полученные данные свидетельствуют о том, что для получения α-LiAlO2 с низким содержанием примеси γ-LiAlO2 необходимо, чтобы на этапе МА смеси реагентов не происходило существенной (не более 1–2%) аморфизации гидроксида алюминия.
Список литературы
Molten Carbonate Fuell Cells // Fuel Cell Handbook. 7-th Ed. Morgantown, 2004.
Электронный ресурс: https://www.fuelcellenergy.com/products/.
Choi H.J., Lee J.J., Hyun S.H., Lim H.C. Phase and Microstructural Stability of Electrolyte Matrix Materials for Molten Carbonate Fuel Cells // Fuel Cells. 2010. V. 10. № 4. P. 613–618.
Choi H.J., Lee J.J., Hyun S.H., Lim H.C. Fabrication and Performance Evaluation of Electrolyte-combined α-LiAlO2 Matrices for Molten Carbonate Fuel Cells // Int. J. Hydrogen Energy. 2011. V. 36. P. 11048–11055.
Семенов Н.Н., Меркулов А.Г., Фомин А.Г. О низкотемпературной модификации алюмината лития // II Всесоюз. совещ. по редким щелочным элементам. Новосибирск: Наука, 1967. С. 100–109.
Lehmann H.A., Hesselbarth H. Über eine neue Modifikation des LiA1O2 // Z. Annorg. Allg. Chem. 1961. № 313. P. 117–124.
Kinoshita K., Sim J.W., Ackerman J.P. Preparation and Characterization of Lithium Aluminate // Mater. Res. Bull. 1978. № 13. P. 445–455.
Kinoshita K., Sim J.W., Kusera G.H. Synthesis of Fine Particle Size Lithium Aluminate for Application un Molten Carbonate Fuel Cels // Mater. Res. Bull. 1979. V. 14. P. 1357–1368.
Харламова О.А., Митрофанова Р.П., Исупов В.П. Синтез ультрадисперсного γ-LiAlO2 с помощью механической активации и отжига // Неорган. материалы. 2007. Т. 43. № 6. С. 732–737.
Choi H.J., Lee J.J., Hyun S.H., Lim H.C. Cost-effective Synthesis of α-LiAlO2 Powders for Molten Carbonate Fuel Cell Matrices // Fuel Cells. 2009. № 5. P. 605–612.
Исупов В.П., Трухина Я.Е., Еремина Н.В., Булина Н.В., Бородулина И.А. Механохимический синтез высокодисперсного γ-LiAlO2 // Неорган. материалы. 2016. Т. 52. № 11. С. 1262–1270.
Исупов В.П., Еремина Н.В., Бородулина И.А., Герасимов К.Б., Булина Н.В. Механохимический синтез высокодисперсных наноструктурированных моноалюминатов лития // VI Всерос. Конф. по наноматериалам с элементами научной школы для молодежи. М.: ИМЕТ РАН, 2016. С. 26–27.
Gao J., Shi S., Xiao R., Li H. Synthesis and Ionic Transport Mechanisms of α-LiAlO2 // Solid State Ionics. 2016. V. 286. P. 122–134.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


