Неорганические материалы, 2019, T. 55, № 4, стр. 367-373
Синтез нанопорошка диоксида титана окислительным гидролизом нитрида титана
Т. В. Резчикова 1, И. Л. Балихин 1, В. И. Берестенко 1, И. А. Домашнев 1, Е. Н. Кабачков 1, 2, *, Е. Н. Куркин 1, В. Н. Троицкий 1
1 Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, пр. Академика Семенова, 1, Россия
2 Научный центр Российской академии наук в Черноголовке
142432 Московская обл, Черноголовка, ул. Лесная, 9, Россия
* E-mail: en.kabachkov@gmail.com
Поступила в редакцию 17.04.2018
После доработки 17.10.2018
Принята к публикации 09.10.2018
Аннотация
Представлена новая методика синтеза TiO2 окислительным гидролизом порошка TiN. Исследовано влияние факторов, определяющих скорость растворения TiN (температура, концентрация, вид окислителя), на фазовый состав и дисперсность получаемых порошков TiO2, а также оценена фотокаталитическая активность полученных образцов в сравнении с коммерческими фотокатализаторами.
ВВЕДЕНИЕ
Большая группа существующих способов получения порошкообразного диоксида титана основывается на гидролизе растворов его неорганических солей (в основном, сульфата или хлорида) с образованием на промежуточной стадии гидратированных форм TiO2 и их последующей высокотемпературной обработкой для удаления воды и получения кристаллического продукта [1–10]. Гидролизные технологии широко применяются для промышленного производства порошков рутила и анатаза с удельной поверхностью до нескольких десятков квадратных метров на грамм. Такие порошки широко используются в лакокрасочной, полимерной, бумажной, фармацевтической, парфюмерной и других отраслях промышленности. Получение порошков с более развитой поверхностью, например для фотокатализа, требует применения специальных мер по предотвращению укрупнения частиц во время синтеза и формированию кристаллической структуры получаемого оксида непосредственно из раствора без дополнительной высокотемпературной обработки осадка, приводящей к спеканию частиц. Примером может служить гидролиз сульфата титанила в гидротермальных условиях с одновременным воздействием на раствор микроволнового излучения [1]. Образование нанокристаллов TiO2 анатазной модификации наблюдается при гидролизе кислых растворов, содержащих ионы Ti3+, полученных растворением TiH2 или металлического титана в соляной или серной кислоте [2].
В работе [3] при исследовании гальванического процесса нанесения композиционных хромовых покрытий из электролитов, содержащих взвесь нанопорошка TiN, было отмечено образование в электролите кристаллических частиц TiO2 вследствие постепенного окисления нитрида, входящего в состав электролита совместно с хромовым ангидридом, при этом размер оксидных частиц был на порядок меньше размера частиц исходного TiN. Поскольку образование закристаллизованных наночастиц TiO2 происходило непосредственно из раствора при сравнительно невысоких температурах, представляется целесообразным более детально изучить возможности синтеза TiO2 по описанной химической схеме с целью управляемого получения порошка с необходимыми для фотокатализа свойствами. Отличительной чертой такого синтеза является использование в качестве исходного сырья труднорастворимого в обычных условиях TiN, который, медленно растворяясь под воздействием окислителя, обеспечивает пролонгированное поступление в раствор ионов титана и одновременную кристаллизацию TiO2 вследствие гидролиза. Нитрид титана обладает высокой химической стойкостью по отношению к кислотам, включая H2SO4, в которой слабо растворяется даже при длительном кипячении [4], поэтому добавление окислителя является необходимым условием для ускорения процесса.
В настоящей работе исследовано влияние факторов, определяющих скорость растворения TiN (температура, концентрация, вид окислителя), на фазовый состав и дисперсность получаемых порошков TiO2, а также оценена фотокаталитическая активность полученных образцов. Такой метод позволяет получать TiO2 в одну стадию в водной среде при низких температурах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В экспериментах в основном использовались два вида порошка TiN – с удельной поверхностью 20 и 6 м2/г. Порошки были получены самостоятельно: первый – водородным восстановлением паров TiCl4 в потоке азотной плазмы микроволнового разряда [5], второй – термическим разложением порошка TiH2 в электродуговой плазме Ar при токе азота в качестве газа-носителя [11]. Для сравнения был испытан также промышленный крупнокристаллический порошок TiN с размером частиц 50 мкм марки Black производства ООО “СВС Системы” (г. Томск, Россия). В качестве окислителя были опробованы CrO3 и HNO3. Порошок Al2O3 был получен на собственной плазмохимической установке по методике [12].
Реакционная смесь, содержащая водный раствор H2SO4, порошок TiN и окислитель, подвергалась длительному нагреванию при заданной температуре в стеклянном реакторе при постоянном перемешивании. Периодически из реакционной смеси отбирались пробы, которые разделялись фильтрацией на жидкость и твердый осадок. В фильтрате методами химического анализа определяли содержание ионов титана и хрома по ГОСТ 31870-2012 [13], а также аммония по ГОСТ 33045-2014 [14]. Осадок после высушивания анализировался на содержание азота, фазовый состав и дисперсность. При визуальном наблюдении за реакционной смесью отмечается постепенный переход цвета суспензии от черного к белому по мере превращения исходного порошка TiN в оксид.
В случае использования CrO3 в качестве окислителя реакционная смесь готовилась добавлением к 1 л дистиллированной воды 1 мл 98%-ной H2SO4, 8 г порошка TiN и 8 г CrO3. Температура нагрева составляла 55, 85 и 100°С. Как показали эксперименты, растворение TiN сопровождается уменьшением содержания азота в твердой фазе и одновременным появлением в растворе ионов Ti4+, при этом скорость растворения TiN напрямую зависит от дисперсности используемого порошка.
Изотермы адсорбции/десорбции азота и удельную поверхность образцов измеряли методом БЭТ при температуре жидкого азота (77 K) c помощью анализатора Quantachrome Quadrasorb SI. Спектры рентгеновской дифракции регистрировались с помощью дифрактометра DRON ADP-2-02 (CuKα-излучение, λ = 0.154056 нм). Для исследования структуры и состава поверхности использовались электронный просвечивающий микроскоп марки JEOL JEM 2100, сканирующий электронный микроскоп Supra 25 Carl Zeiss и электронный спектрометр для химического анализа SPECS Phoibos 150 MCD. Для взвешивания реактивов и образцов использовали электронные весы Асculab марки ALC-80d4.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
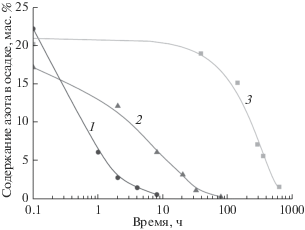
На рис. 1 показана зависимость содержания азота в осадке от времени термообработки реакционной смеси при температуре 55°С для трех видов исходного порошка TiN с различной дисперсностью. Видно, что скорость растворения порошка TiN тем выше, чем меньше размер его частиц и больше удельная поверхность. Порошки TiN с большей дисперсностью использовать для получения TiO2 предпочтительнее, поскольку это значительно сокращает продолжительность синтеза.
Рис. 1.
Зависимости содержания азота в осадке от времени нагрева: 1 – TiN с Sуд 20 м2/г; 2 – TiN с Sуд 6 м2/г; 3 – крупнокристаллический TiN.
Исследование фазового состава осадка на промежуточных стадиях синтеза показывает, что он состоит из смеси TiN и TiO2 анатазной и (или) рутильной модификаций, а по завершении процесса в твердой фазе присутствует лишь TiO2.
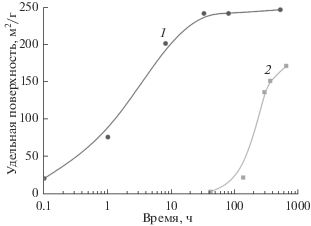
Значительная ширина рентгеновских рефлексов образующегося TiO2 по сравнению с шириной линий исходного TiN говорит о существенно меньшем размере частиц TiO2. Измерение удельной поверхности образцов осадка, отобранных на различных стадиях синтеза, подтверждает его резкое измельчение по мере перехода TiN в TiO2 (рис. 2): если исходная поверхность TiN составляет 20 м2/г, то образующийся TiO2 имеет удельную поверхность до 250 м2/г.
Рис. 2.
Изменение удельной поверхности осадка в процессе синтеза: 1 – исходный TiN с Sуд 20 м2/г; 2 – крупнокристаллический TiN.
Электронно-микроскопическое исследование полученного порошка TiO2 показывает, что он состоит в основном из частиц размером 100–200 нм, каждая из которых образована более мелкими кристаллитами размером примерно 5 нм (рис. 3). Для сферических частиц TiO2 такого размера расчетная величина удельной поверхности должна составлять около 300 м2/г. Экспериментальная величина составила около 250 м2/г, что довольно близко к расчетному значению.
Наряду с изменениями, происходящими в процессе синтеза в твердом осадке, изучалось изменение состава жидкой фазы. На рис. 4 показана зависимость содержания ионов Ti4+ в растворе от времени нагрева реакционной смеси. Видно, что по мере растворения порошка нитрида титана на начальном этапе происходит накопление в растворе ионов Ti4+, являющихся продуктом окисления нитрида. Концентрация Ti4+ проходит через максимум и падает при дальнейшем нагреве до значений, близких к нулю. Положение максимумов на кривых примерно коррелирует с завершением растворения нитрида титана и формированием в осадке высокодисперсного TiO2.
Рис. 4.
Зависимости концентрации ионов Ti4+ в растворе от времени нагрева реакционной смеси: 1 – крупнокристаллический TiN, температура 55°С; 2, 3, 4 – TiN с Sуд 20 м2/г, температура 55, 75, 85°С соответственно.
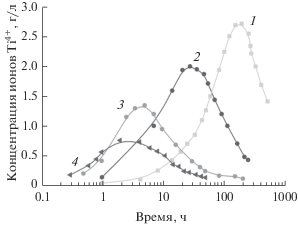
Скорость растворения нитрида титана и нарастания содержания титана в растворе зависит от дисперсности исходного порошка (кривые 1, 2) и температуры в реакторе (кривые 2–4). С уменьшением размера частиц TiN и повышением температуры процесс значительно ускоряется.
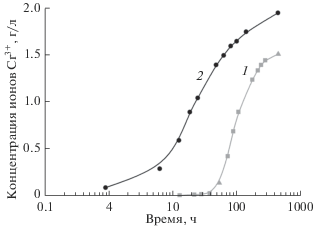
Одновременно с появлением ионов титана в растворе обнаруживаются ионы Cr3+, являющиеся продуктом восстановления окислителя Cr6+. Их концентрация возрастает по мере растворения TiN (рис. 5) и пропорциональна его количеству в реакционной смеси.
Рис. 5.
Зависимости концентрации ионов Cr3+ в растворе от времени нагрева реакционной смеси: 1 – крупнокристаллический TiN; 2 – TiN с Sуд 20 м2/г.
Наблюдаемые химические превращения в реагирующей смеси можно описать двумя одновременно протекающими реакциями: растворением нитрида под действием окислителя с образованием в растворе соединения Ti4+ (реакция (1)) и его гидролизом, приводящим к образованию кристаллического TiO2 (реакция (2)).
(1)
$\begin{gathered} {\text{TiN}} + {1 \mathord{\left/ {\vphantom {1 6}} \right. \kern-0em} 6}{\text{C}}{{{\text{r}}}_{2}}{\text{O}}_{7}^{{2 - }} + {{19} \mathord{\left/ {\vphantom {{19} 3}} \right. \kern-0em} 3}{{{\text{H}}}^{ + }}\quad \to {\text{T}}{{{\text{i}}}^{{4 + }}} + \\ + \,\,{\text{NH}}_{4}^{ + } + {1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}{\text{C}}{{{\text{r}}}^{{3 + }}} + {7 \mathord{\left/ {\vphantom {7 6}} \right. \kern-0em} 6}{{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(2)
${\text{T}}{{{\text{i}}}^{{4 + }}} + 2{{{\text{H}}}_{{\text{2}}}}{\text{O}}\quad\quad \to \quad{\text{Ti}}{{{\text{O}}}_{2}} + 4{{{\text{H}}}^{ + }}.$Конкуренция двух указанных реакций определяет экстремальный вид зависимостей концентрации ионов титана в растворе от времени нагрева (рис. 4). Через некоторое время, зависящее от температуры раствора и дисперсности исходного порошка нитрида титана, процесс завершается полным переходом TiN в диоксид с установлением постоянной концентрации Cr3+ в растворе, которая зависит от количества изначально введенного в реакционную смесь TiN.
Помимо интенсификации процесса растворения TiN повышение температуры приводит к увеличению дисперсности получаемого TiO2 и возрастанию относительной доли анатаза в получаемом продукте. При температурах синтеза 55, 75, 85°С образующийся TiO2 представляет собой смесь анатаза и рутила, причем доля последнего снижается с повышением температуры синтеза. Порошок, полученный из TiN с Sуд 20 м2/г при температуре 100°С, содержит только анатаз и обладает максимальной удельной поверхностью (табл. 1).
Таблица 1.
Зависимость удельной поверхности и фазового состава диоксида титана от температуры синтеза
| Температура синтеза, °С | 55 | 85 | 100 |
| Удельная поверхность, м2/г | 250 | 320 | 340 |
| Фазовый состав | анатаз + рутил | анатаз + рутил | анатаз |
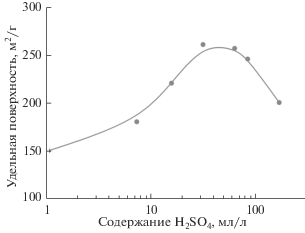
С целью оценки возможности увеличения производительности процесса были выполнены эксперименты с большей загрузкой реактора по исходному сырью. Концентрация TiN была увеличена до 50 г/л, количество окислителя (CrO3) было пропорционально увеличено и составило 50 г/л. Температура процесса во всех случаях составляла 100°С, поскольку это обеспечивало получение модификации анатаза с максимально развитой поверхностью за минимальное время. Количество H2SO4, необходимое для полного протекания синтеза, и ее влияние на свойства получаемых порошков было изучено экспериментально. На рис. 6 представлена зависимость дисперсности синтезируемого продукта от количества H2SO4 в реакционной смеси. Время нагрева составляло 10 ч. Из графика видно, что удельная поверхность порошков, получаемых при содержании TiN 50 г/л, во всех случаях ниже, чем порошков, получаемых при 8 г/л TiN, что, вероятно, связано с кристаллизацией из раствора с повышенным содержанием растворенного титана более крупных частиц TiO2 и большей их агломерацией. На кривой присутствует явно выраженный максимум при концентрации H2SO4 30–50 мг/л, последующее снижение удельной поверхности может быть связано с повышением растворимости диоксида титана при увеличении концентрации серной кислоты.
Рис. 6.
Зависимость удельной поверхности осадка от содержания серной кислоты при концентрации нитрида титана 50 г/л.
Образующийся осадок TiO2 при температуре 100°С и концентрации H2SO4 30–50 мг/л является анатазом. Отмечено, что при концентрации H2SO4 1 мл/л в осадке присутствует значительное количество TiN, в то время как в ранее выполненных экспериментах с исходным содержанием TiN 8 г/л такая концентрация H2SO4 позволяла полностью перевести нитрид в раствор. Добиться полного растворения нитрида титана увеличением времени синтеза без добавления серной кислоты невозможно. Это говорит о том, что растворение нитрида под действием окислителя происходит через образование растворимых сульфатных соединений Ti4+.
Использование CrO3 в процессе получения TiO2 имеет определенные недостатки, связанные в первую очередь с возможностью загрязнения хромом получаемого продукта и токсичностью соединений шестивалентного хрома. Поэтому была исследована возможность использования другого окислителя, не содержащего ионов тяжелых металлов, в частности, были выполнены эксперименты с HNO3. Использовалась реакционная смесь, содержащая на один литр воды 50 г TiN с удельной поверхностью 20 м2/г, 70 мл 68%-ной HNO3, от 10 до 80 мл 98%-ной H2SO4. Смесь нагревали при 100°С в течении 2 ч.
Следует отметить, что под воздействием HNO3 полное растворение TiN и выпадение оксидного осадка происходит значительно быстрее. Процесс полностью завершается за 2 ч. Зависимость удельной поверхности полученного продукта от содержания H2SO4 в реакционной смеси, так же как в случае использования CrO3, носит экстремальный характер, проходя через максимум при содержании H2SO4 около 40 мл/л (рис. 7). В экспериментах с HNO3 обращают на себя внимание меньшие по сравнению с использованием CrO3 значения удельной поверхности получаемого TiO2. Максимальная удельная поверхность продукта достигает лишь 160 м2/г. Причиной наблюдаемого снижения дисперсности кристаллизующегося TiO2, очевидно, является более высокая концентрация титана в растворе, возникающая вследствие значительного ускорения растворения нитрида титана при окислении HNO3 по сравнению с CrO3. Аналогичное уменьшение дисперсности продукта наблюдалось в экспериментах с CrO3 при увеличении концентрации TiN в реакционной смеси.
Рис. 7.
Зависимость удельной поверхности продукта от содержания H2SO4 в экспериментах с HNO3: А – анатаз, Р – рутил.
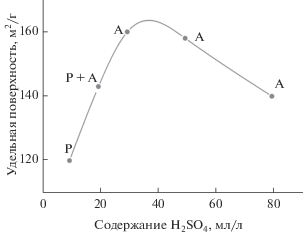
Другим важным отличием процесса с HNO3 является возможность получения порошка TiO2, полностью состоящего из рутильной модификации. Если при окислении нитрида с помощью CrO3 образование рутила в смеси с анатазом наблюдалось только при температурах менее 85°С, а при температуре 100°С продукт всегда представлял собой 100% анатаз, то при использовании HNO3 можно получать образцы с высоким содержанием рутила даже при 100°. Склонность к образованию рутила наблюдается при низком содержании H2SO4 в реакционной смеси вплоть до получения практически “чистого” рутила при содержании H2SO4 10 мл/л (рис. 7).
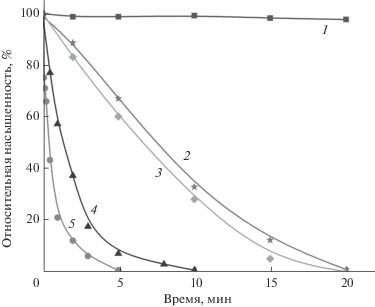
Поскольку порошки анатаза с высокой удельной поверхностью могут представлять практический интерес как фотокатализаторы окисления органических загрязнений в воздухе и воде, была проведена сравнительная оценка фотокаталитической активности образцов полученного TiO2. Испытаниям подвергались два образца: 100%-ный анатаз с удельной поверхностью 160 м2/г, приготовленный окислением нитрида титана HNO3, и 100%-ный анатаз с удельной поверхностью 320 м2/г, приготовленный окислением TiN триоксидом хрома. В качестве образцов сравнения использовались коммерческие фотокатализаторы: Degussa P25, представляющий собой смесь анатаза и рутила с удельной поверхностью 50 м2/г, и Hombifine N – анатаз с удельной поверхностью 340 м2/г, а также плазмохимический порошок Al2O3, заведомо не обладающий фотокаталитической активностью. Для испытаний был применен модифицированный экспресс-метод на основе итальянского стандарта UNI 11259 для тестирования фотокаталитических материалов, известный как “родаминовый тест” [6]. О фотокаталитической активности образцов судили по скорости обесцвечивания порошка, окрашенного красителем родамин Б, на предметном стекле микроскопа под действием излучения ультрафиолетовой лампы с длиной волны 365 нм. Результаты испытаний приведены на рис. 8.
ЗАКЛЮЧЕНИЕ
Деградация красителя на поверхности образцов TiO2, синтезированных из TiN, происходит с различной скоростью, которая зависит от способа получения порошка. Если образец с удельной поверхностью 120 м2/г, полученный окислением нитрида с помощью азотной кислоты при темпертуре 100°С и концентрации TiN 50 г/л, лишь немного превосходит порошок Degussa P25, то образец с удельной поверхностью 320 м2/г, полученный окислением нитрида с помощью CrO3 при темпертуре 100°С и концентрации нитрида титана 8 г/л, является рекордсменом в нашем исследовании, обгоняя по активности лучший коммерческий фотокатализатор Hombifine N. Несущественные изменения насыщенности в контрольных экспериментах с Al2O3 убедительно доказывают фотокаталитическую природу окисления красителя на поверхности исследуемых образцов TiO2.
Список литературы
Зверева И.А., Чурагулов Б.Р., Иванов В.К., Баранчиков А.Е., Шапорев А.С., Миссюль А.Б. Способ получения фотокатализатора на основе нанокристаллического диоксида титана: Патент РФ № 2408428, опубл. 10.01.2011, Бюл. № 1.
Волков В.Л., Захарова Г.С. Способ получения наноразмерных частиц диоксида титана: Патент РФ № 2349549, опубл. 20.03.2009, Бюл. № 8.
Резчикова Т.В., Куркин Е.Н., Троицкий В.Н. Получение хромовых и медных электролитических покрытий из композиционного электролита с добавками ультрадисперсных порошков TiN и Al2O3 // Физика и химия обработки материалов. 2005. № 5. С. 51–58.
Самсонов Г.В. Нитриды. Киев: Наукова думка, 1969. С. 144–145.
Балихин И.Л., Берестенко В.И., Домашнев И.А., Куркин Е.Н., Троицкий В.Н. Установка и способ получения нанодисперсных порошков в плазме СВЧ разряда: Патент РФ № 2252817, опубл. 27.05.2005, Бюл. № 15.
UNI 11259:2008. Determination of the Photocatalytic Activity of Hydraulicbinders – Rodammina Test Method. UNI Ente Nazionale Italiano di Unificazione, 2008.
Soto-Vázquez L., Cotto M., Ducongé J., Morant C., Márquez F. Synthesis and Photocatalytic Activity of TiO2 Nanowires in the Degradation of p-Aminobenzoic Acid: A Comparative Study with a Commercial Catalyst // J. Environmental Management. 2016. V. 167. P. 23–28.
Soto-Vázquez L. M., Rodríguez T., Márquez F. Catalytic Photodegradation of p-Aminobenzoic Acid on TiO2 Nanowires with High Surface Area. 2014.
Le Thanh Son, Ngo Quoc Buu, Nguyen Viet Dung, Nguyen Hoai Chau, Dao Trong Hien, Tran Xuan Tin, Kabachkov E.N., Balikhin I.L. Photocatalytic Equipment with Nitrogen-Doped Titanium Dioxide for Air Cleaning and Disinfecting // Adv. Nat. Sci.: Nanosci. Nanotechnol. 2014. V. 5. № 1. P. 015–017.
Kabachkov E.N., Kurkin E.N., Nadtochenko V.A., Terent’ev A.A. Fourier Transform Infrared Spectroscopic Study of the Photocatalytic Degradation of Cancerous Cells on Titanium Dioxide // High Energy Chem. 2010. V. 44. № 5. P. 426–430.
Troitskii V.N., Rakhmatullina A.Z., Berestenko V.I., Gurov S.V. Initial Sintering Temperature of Ultrafine Powders // Sov. Powder Metall. Met. Ceram. 1983. V. 22. № 1. P. 12–14.
Gurov S.V., Troitskii V.N., Berestenko V.I., Kurkin E.N. Thermal-Decomposition of Ammonium Alum // J. Appl. Chem. USSR. 1987. V. 60. № 8. P. 1582–1586.
ГОСТ 31870-2012 Вода питьевая. Определение содержания элементов методами атомной спектрометрии (с Поправками). М.: Стандартинформ, 2013.
ГОСТ 33045-2014 Вода. Методы определения азотсодержащих веществ (с Поправкой) М.: Стандартинформ, 2013.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы