Неорганические материалы, 2019, T. 55, № 5, стр. 486-495
Гидридно-кальциевый синтез порошков сплавов на основе системы Ti–Ni–Hf
А. В. Касимцев 1, 2, С. С. Володько 1, 2, *, С. Н. Юдин 1, 2, Т. А. Свиридова 3, В. В. Чеверикин 3
1 ООО “Метсинтез”
300041 Тула, пр. Красноармейский, 25, Россия
2 Тульский государственный университет
300041 Тула, пр. Ленина, 84, Россия
3 Национальный исследовательский технологический университет “МИСиС”
119049 Москва, Ленинский пр., 4, Россия
* E-mail: metsintez@tula.net
Поступила в редакцию 17.10.2018
После доработки 15.11.2018
Принята к публикации 23.11.2018
Аннотация
Показана принципиальная возможность получения порошков сплавов на основе интерметаллидов систем Ti–Ni–Hf и Ti–Ni–Hf–Zr гидридно-кальциевым методом. Приведены физико-химические и технологические свойства полученных порошков Ti40Ni50Hf10, Ti28Ni50Hf22, Ti28Ni50Hf12Zr10. На основе экспериментальных данных установлено, что в основном синтез идет с образованием промежуточных фаз, присущих бинарным диаграммам состояния компонентов сплава. По данным фазового анализа, синтезированные порошки преимущественно состоят из B19'-мартенсита, количество которого существенно зависит от температуры синтеза. Наибольшей гомогенностью при одних и тех же технологических параметрах обладает сплав с наименьшей концентрацией легирующего элемента Hf.
ВВЕДЕНИЕ
Известно, что из большого числа материалов, проявляющих эффект памяти формы, сплавы на основе соединения TiNi обладают наивысшим комплексом функциональных и механических свойств [1–3]. Благодаря этому TiNi находит все более широкое применение в медицине и промышленности. Однако различные конструкторские решения, особенно в аэрокосмической области, требуют использования сплавов памяти формы (СПФ) при температурах, значительно превышающих максимально возможные для бинарного никелида титана (100–120°С) [4, 5].
Анализ литературы показывает, что добавки в качестве третьего элемента Hf, Zr, Pd, Pt и Au позволяют повысить температуры фазовых превращений бинарного TiNi [5–7]. Однако такие элементы, как Pt, Pd и Au, являются слишком дорогостоящими для широкого применения, поэтому большее внимание уделено системам Ti–Ni–Hf/Zr, в основном, благодаря их относительно низкой стоимости. Существенное увеличение температур мартенситных превращений происходит при концентрации Hf и Zr более 8–10 ат. % [5–8], а для того, чтобы получить температуры обратных мартенситных превращений в районе 200–300°С, необходимо ввести около 20 и более ат. % легирующего элемента, что, например, для сплава Ti30Ni50Hf20 означает содержание гафния около 45 мас. %.
Такое высокое содержание тугоплавкого и тяжелого элемента (tпл = 2231°С, ρ = 13.31 г/см3) создает существенные трудности в получении гомогенных по химическому и фазовому составу заготовок методами вакуумно-дуговой и вакуумно-индукционной плавок, которые очень активно применяются для получения тройных сплавов систем Ti–Ni–Hf/Zr. Проблема получения гомогенных слитков СПФ ярко выражена для бинарных сплавов TiNi [9]. Для трех- и четырехкомпонентных сплавов все осложняет разность температур плавления и плотностей элементов Ni, Ti, Zr и Hf. Ликвация при кристаллизации слитка приводит к образованию вторичных Ti2Ni, Ni3Ti, Ni4Ti3, легированных гафнием и цирконием, фаз, что является причиной изменения химического состава матрицы, ухудшения механических свойств и снижения способности к обработке давлением [10, 11].
Из возможных методов производства заготовок больших размеров можно выделить технологию порошковой металлургии, основанную на гидридно-кальциевом синтезе [12]. Суть метода заключается во взаимодействии расплава кальция (tпл = 842°С) с оксидами металлов, в ходе которого оксиды восстанавливаются до чистых металлов и взаимодействуют между собой через жидкую фазу (расплав кальция) с образованием соединения требуемого стехиометрического состава в соответствии с соотношением компонентов в исходной шихте.
Гидридно-кальциевый синтез порошков сплавов и последующая их консолидация позволяют получать бинарные сплавы на основе TiNi с высокой степенью гомогенности и высоким комплексом механических свойств в компактном состоянии [12–15].
На данный момент процесс синтеза интерметаллида (Ti,Hf)Ni гидридно-кальциевым методом не изучен. Предыдущие исследования показали, что синтез бинарного TiNi идет достаточно активно при температурах более 1150°С [12].
Стоит предположить, что кинетика образования интерметаллида (Ti,Hf)Ni может существенно отличаться от наблюдаемой для TiNi. Это связано как с увеличением количества компонентов сплава, так и, очевидно, с низкой растворимостью гафния в расплаве кальция. Данных о растворимости Hf в жидком кальции в литературе не обнаружено. Из анализа бинарных диаграмм состояния Сa–М, где М – тугоплавкий металл, однозначно можно сказать, что ни один из переходных металлов IV–V подгрупп Таблицы Менделеева с температурой плавления более 1600°С не обладает заметной растворимостью в расплаве кальция [16].
Таким образом, цель данного исследования заключаeтся в установлении возможности синтеза гидридно-кальциевым методом сплавов на основе TiNi, легированных Hf и Zr, а также в разработке механизма гидридно-кальциевого синтеза интерметаллида (Ti,Hf)Ni, что позволит оценить его кинетику сплавообразования при наличии малорастворимых в расплаве кальция Ti и Hf.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами исследования послужили экспериментальные партии порошков трех модельных сплавов Ti40Ni50Hf10, Ti28Ni50Hf22, Ti28Ni50Hf12Zr10. Шихту рассчитывали на следующий состав сплавов (мас. %): Ti–44.2Ni–26.9Hf, Ti–35.8Ni–47.9Hf и Ti–40Ni–29.2Hf–12.4Zr. Исследуемые порошковые сплавы были получены по технологии гидридно-кальциевого синтеза. Методика процесса состоит из следующих технологических этапов: 1) прокаливание и смешивание исходных компонентов шихты, 2) загрузка шихты в контейнер из нержавеющей стали, 3) создание предварительного вакуума в контейнере (глубина вакуума 10–1–10–2 мм рт. ст.) с последующим напуском аргона, 4) установка контейнера в печь, 5) нагрев контейнера с шихтой до температуры синтеза с последующей изотермической выдержкой, 6) обработка продуктов реакции водой и кислотой для удаления оксида кальция с последующей сушкой готового порошка.
В качестве исходных компонентов использовали диоксид титана марки РК (TiO2 ≥ 99 мас. %), диоксид гафния марки ГФО-1 (HfO2 ≥ 99.3 мас. %) и порошок электролитического никеля марки ПНЭ-1 (Ni ≥ 99.5 мас. %), а также гидрид кальция (CaH2 ≥ 93 мас. %, CaO ≤ 5.5 мас. %).
Фазовый состав образцов исследовали на автоматизированном дифрактометре ДРОН-3 с использованием монохроматического CuKα-излучения. Обработку спектров проводили с использованием пакета программ [17].
Микрорентгеноспектральный анализ проводили на электронном сканирующем микроскопе TESCAN VEGA LMH с приставкой для проведения анализа Oxford Instruments Advanced AZtec Energy, включая INCA Energy 350)/X-max 50 – систему рентгеновского энергодисперсионного микроанализа с безазотным детектором X-max 50 Standard (кремний-дрейфовый детектирующий элемент активной площадью 50 мм2, разрешение на линии MnKα – 127 эВ).
Химический состав полученных порошков определяли методом атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой и методом рентгенофлуоресцентной спектроскопии. Атомно-эмиссионный анализ выполнялся на спектрометре ICAP б300 Тhеrmо Electron Соrроrаtiоn с индуктивно связанной плазмой. Рентгенофлуоресцентная спектроскопия осуществлялась на спектрометре ARL OPTIM’X.
Методом горячей экстракции в несущем газе (методом сжигания) определяли общие (интегральные) содержания газообразующих примесей в порошках и компактных образцах. Измерения проводили на оборудовании фирмы Leco (США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование процесса гидридно-кальциевого синтеза. Схематично процесс гидридно-кальциевого синтеза исследуемых сплавов можно представить следующей реакцией, протекающей при температурах ниже их температур плавления:
(1)
$\begin{gathered} {\text{Ti}}{{{\text{O}}}_{2}} + {\text{Hf}}{{{\text{O}}}_{2}} + {\text{Ni}} + {\text{Ca}}{{{\text{H}}}_{{2\quad}}} \to \\ \to {\text{T}}{{{\text{i}}}_{x}}{\text{H}}{{{\text{f}}}_{y}}{\text{N}}{{{\text{i}}}_{z}} + {\text{CaO}} + {{{\text{H}}}_{{\text{2}}}} \uparrow , \\ \end{gathered} $В действительности процесс синтеза сплава (Ti,Hf)Ni имеет сложный характер и проходит через множество промежуточных реакций, таких как диссоциация CaH2 на Ca и H, восстановление оксидов металлов кальцием и образование эвтектик, твердых растворов, интерметаллидов и др. [12].
Исследование процессов, происходящих при гидридно-кальциевом синтезе, проводилось на сплаве Ti28Ni50Hf22. Для определения оптимальных технологических параметров необходимо разработать феноменологическую модель синтеза интерметаллида (Ti,Hf)Ni гидридно-кальциевым методом и установить механизм сплавообразования. Для решения данной задачи был поставлен ряд экспериментов, технологические параметры которых представлены в табл. 1.
Таблица 1.
Технологические параметры синтеза интерметаллида (Ti,Hf)Ni
| Температура восстановления, °С | Время изотермической выдержки, ч |
|---|---|
| 900 | 0.5, 1, 3, 8 |
| 1000 | 0.5, 1, 3, 8 |
| 1200 | 0.25, 0.5, 1, 4, 8 |
Результаты экспериментов, проведенных по указанным технологическим режимам (табл. 1), приведены в табл. 2 и на рис. 1. На рис. 1а, 1б и 1в показаны состав основных фаз и кинетика изменения их количества в ходе изотермической выдержки при температурах 900, 1000 и 1200°С соответственно.
Таблица 2.
Фазовый состав порошков после различной изотермической выдержки при температурах 900 и 1000°С
| Фаза | C, об. % (±5%) | Периоды, нм | Фаза | C, об. % (±5%) | Периоды, нм |
|---|---|---|---|---|---|
| 900°С | 1000°С | ||||
| 0.5 ч | |||||
| (Hf,Ti)H | 30 | a = 0.4690 | (Hf,Ti)H | 15 | а = 0.4685 |
| Ni | 40 | a = 0.3521 | Hf2Ni | 5 | – |
| HfO2 | 25 | – | α-Ti | 25 | а = 0.2944 с = 0.4702 |
| Ni | 20 | – | |||
| TiH2 | 5 | – | HfNi | 10 | а = 0.3217 b = 0.9797 c = 0.4094 |
| HfO2 | 10 | – | |||
| α-Hf | 15 | a = 0.3195 c = 0.5054 |
|||
| 1 ч | |||||
| (Hf,Ti)H | 25 | a = 0.4691 | (Hf,Ti)H | 25 | a = 0.4686 |
| Ni | 20 | a = 0.3523 | Ni | 15 | a = 0.3531 |
| HfO2 | 20 | – | HfO2 | 10 | – |
| TiH2 | 30 | a = 0.4444 | TiH2 | 25 | a = 0.4421 |
| Ni3Ti | 5 | – | α-Ti | 10 | a = 0.2957 c = 0.4640 |
| HfNi | 5 | – | |||
| Ni3Ti | 10 | a = 0.5113 c = 0.8335 |
|||
| 3 ч | |||||
| Hf2Ni | 5 | a = 0.6407 c = 0.5262 |
(Hf,Ti)H | 15 | – |
| α-Ti | 35 | a = 0.2941 c = 0.4702 |
Hf2Ni | 5 | – |
| Ni | 10 | – | |||
| HfNi | 15 | a = 0.3212 b = 0.9800 c = 0.4095 |
α-Ti | 30 | a = 0.2936 c = 0.4712 |
| HfO2 | 15 | – | HfO2 | 10 | – |
| HfH2 | 10 | a = 0.4903 c = 0.4284 |
Ni3Ti | 5 | a = 0.5119 c = 0.8250 |
| α-Hf | 10 | a = 0.3197 c = 0.5052 |
TiNi | 10 | – |
| HfNi | 20 | a = 0.3211 b = 0.9778 c = 0.4095 |
|||
| (Ti,Hf)Ni | 5 | а = 0.3030 | |||
| 8 ч | |||||
| (Hf,Ti)H | 30 | a = 0.4678 | (Hf,Ti)H | 10 | – |
| Ni | 10 | a = 0.3529 | Hf2Ni | 5 | – |
| HfO2 | 5 | – | HfNi | 15 | a = 0.3208 b = 0.9702 c = 0.4110 |
| TiH2 | 20 | a = 0.4422 | Hf7Ni10 | 20 | a = 0.9153 b = 0.9020 c = 1.2388 |
| α-Ti | 15 | a = 0.2952 c = 0.4740 |
TiNi | 40 | a = 0.2933 b = 0.4102 c = 0.4669 β = 83.4° |
| HfNi | 10 | – | (Ti,Hf)Ni | 10 | a = 0.3057 |
| Ni3Ti | 10 | a = 0.5109 b = 0.8326 |
|||
Рис. 1.
Влияние времени восстановления на количество образующихся фаз в ходе изотермической выдержки при 900 (а), 1000 (б), 1200°С (в) (V – объемная доля фаз, τ – время изотермической выдержки).
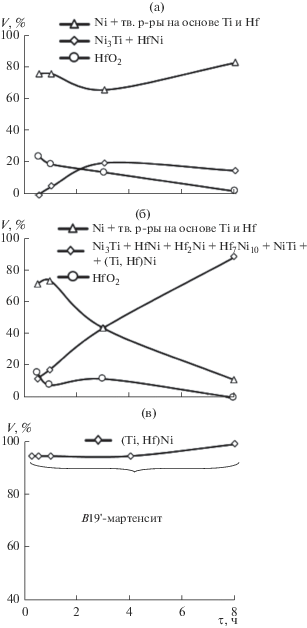
По данным фазового анализа и результатам сканирующей электронной микроскопии (СЭМ), при температуре синтеза 900°С и времени изотермической выдержки 0.5 ч образуется твердый раствор на основе титана и гафния (Hf,Ti)H, в котором, вероятно, растворен водород. В большом количестве присутствует чиcтый Ni, а также небольшая доля Ti в виде гидрида TiH2 и невосстановленный HfO2. Ввиду более высокого сродства гафния к кислороду [18] по сравнению с титаном ($\Delta {{G}_{{{\text{Ti}}{{{\text{O}}}_{2}}}}}$ = = –455 кДж/г-ат О, $\Delta {{G}_{{{\text{Hf}}{{{\text{O}}}_{2}}}}}$ = –525 кДж/г-ат О) для его восстановления требуются более длительные времена выдержки или более высокая температура, чем это необходимо для TiO2, который не был обнаружен в продуктах реакций на всех стадиях синтеза. Водород, который образовался при диссоциации гидрида кальция во время нагрева шихты, не удаляется полностью из атмосферы контейнера, и при охлаждении происходит образование водородсодержащих фаз ввиду большого сродства переходных металлов Ti и Hf к водороду. Как правило, после вакуумного спекания порошков уровень водорода в гидридно-кальциевых сплавах находится на уровне тысячных долей процента, что показано в работах [13, 14].
После выдержки 1 ч количество HfO2 уменьшается, по-прежнему присутствует твердый раствор на основе титана и гафния. Начинает образовываться первый интерметаллид Ni3Ti. После 3 ч изотермической выдержки при температуре 900°С в структуре порошка присутствуют α-Ti и α-Hf с гексагональными решетками, параметры которых очень близки к стандартным значениям, представленным в табл. 3. Образуются интерметаллиды Hf2Ni и HfNi, параметры решеток которых (табл. 2) сходятся с данными, представленными в работе [19].
Таблица 3.
Фазовый состав порошковых сплавов
| Сплав | Фаза | Объемная доля, % | Периоды, нм |
|---|---|---|---|
| Ti40Ni50Hf10 | B19' | 95 | a = 0.3027 b = 0.4076 c = 0.4832 β = 100.512° |
| Ti2Ni | 5 | a = 1.146 | |
| Ti28Ni50Hf22 | B19' | 100 | a = 0.3084 b = 0.4068 c = 0.4921 β = 103.792° |
| Ti28Ni50Hf12Zr10 | B2 | 5 | a = 0.3051 |
| B19' | 95 | a = 0.3061 b = 0.4078 c = 0.4882 β = 103.372° |
После 8 ч выдержки при 900°С по результатам фазового анализа не обнаружено присутствие (Ti,Hf)Ni, но образуются более простые двойные фазы HfNi и Ni3Ti. Количество HfO2 существенно уменьшилось по сравнению с первоначальными стадиями синтеза. В порошке сплава все еще присутствуют Ti в виде гидрида, твердый раствор на основе Ti и Hf, чистый Ni и α-Ti. По данным СЭМ, в синтезированном порошке после 8 ч изотермической выдержки при 900°С присутствуют включения Hf, Ni и Ti, в которых растворены другие элементы. Вероятно, при столь низких температурах синтеза растворимость и диффузионная подвижность элементов сплава в расплаве кальция недостаточны для образования тройного интерметаллида (Ti,Hf)Ni.
Как видно из рис. 1а, кривая, соответствующая общей доле интерметаллидов в порошке, выходит на постоянный уровень уже после 3 ч изотермической выдержки при 900°С, что соответствует ~20 об. % от общей доли фаз, содержащихся в структуре порошка. На протяжении всей изотермической выдержки количество HfO2 снижается и растет общая доля восстановленных металлов (рис. 1а), которые находятся в структуре порошка в виде твердых растворов и чистых компонентов.
При температуре синтеза 1000°С объемная доля образующихся при синтезе интерметаллических соединений практически линейно зависит от времени выдержки (рис. 1б). Однако даже при длительных выдержках (8 ч) образуется лишь ~10 об. % фазы (Ti,Hf)Ni с кубической решеткой типа В2 с параметром а = 0.3057 нм. Результаты СЭМ и фазового анализа показали, что при временах выдержки 0.5 и 1 ч наблюдается такая же ситуация, как и при 900°С. Сначала образуются восстановленные металлы и промежуточные фазы. Образование фаз типа HfNi, Hf2Ni идет активнее за счет увеличения растворимости элементов и повышения их диффузионной подвижности в расплаве кальция, что также отражается на подъеме кривой, соответствующей доле интерметаллидов (рис. 1б). При продолжительности выдержки 3 ч и температуре 1000°С образуются фазы TiNi и (Ti,Hf)Ni с кубической решеткой, параметры которой представлены в табл. 2. После 8 ч изотермической выдержки количество фазы TiNi значительно увеличивается и немного подрастает количество (Ti,Hf)Ni. Очевидно, что образование фазы TiNi предшествует образованию фаз (Ti,Hf)Ni. Ввиду низкой растворимости Hf в расплаве кальция образование фазы (Ti,Hf)Ni идет медленно.
Ситуация кардинально меняется при температуре изотермической выдержки 1200°C. Судя по результатам фазового анализа, ~95 об. % фазы (Ti,Hf)Ni с решеткой В19' (а = 0.3070, b = 0.4074, c = 0.4924 нм, β = 104.14°) стехиометрического состава Ti28Ni50Hf22 и ~5 об. % фазы Hf2Ni3Ti образуются уже в течение 15 мин изотермической выдержки. После 8 ч изотермической выдержки количество (Ti,Hf)Ni достигает 100 об. % (рис. 1в).
Анализ полученных данных показывает, что важнейшими факторами гидридно-кальциевого процесса являются температура реакции восстановления и время изотермической выдержки. Температурная зависимость количества фазы (Ti,Hf)Ni при выдержкe 8 ч представлена на рис. 2. Данные свидетельствуют, что рост температуры синтеза значительно интенсифицирует процесс образования фазы (Ti,Hf)Ni. Столь быстрое образование сплава Ti28Ni50Hf22 при температуре синтеза 1200°С, которая на ~60–70°С [19] ниже его tпл, можно объяснить только наличием расплава кальция, через который идет синтез соединения в результате диффузионного взаимодействия никеля с тугоплавкими Ti и Hf. Эти данные согласуются с предыдущими исследованиями и подтверждают определяющую роль жидкой фазы в синтезе интерметаллидов в ходе гидридно-кальциевого процесса.
Рис. 2.
Влияние температуры синтеза на количество фазы (Ti,Hf)Ni в процессе 8 ч изотермической выдержки.

Кроме этого, процессы синтеза интенсифицируются благодаря высокой растворимости Ni в жидком Ca (при 1200°С – 81.3 мас. %) и его активной диффузии к восстановленным частицам титана и гафния. Диффундируя через расплав кальция, никель образует интерметаллические соединения различного состава c гафнием и титаном. Также можно отметить, что образование фаз типа (Ti,Hf)Ni идет через промежуточное образование TiNi с последующим растворением Hf в этой фазе.
Изотермическая выдержка помимо гомогенизации состава сплава влияет и на полноту процесса восстановления, что можно оценить по содержанию кислорода в готовых порошках сплавов. Из рис. 3 видно, что процесс восстановления оксидов при синтезе сплава Ti28Ni50Hf22 происходит достаточно активно и с увеличением времени изотермической выдержки при температуре 1200°С уровень кислорода в готовых порошках снижается.
Рис. 3.
Зависимость содержания кислорода в синтезированном порошке сплава Ti28Ni50Hf22 от времени изотермической выдержки при 1200°С.

Таким образом, на основании полученных экспериментальных данных и с учетом предыдущих исследований в области закономерностей сплавообразования бинарного TiNi [12] можно представить процесс гидридно-кальциевого синтеза тройного интерметаллида (Ti,Hf)Ni в виде следующих последовательных стадий при нагреве исходной смеси TiO2 + HfO2 + Ni + CaH2:
1) диссоциация CaH2 на Ca и H2;
2) плавление Ca и начало процесса восстановления TiO2 и HfO2 до чистых металлов;
3) образование промежуточных интерметаллических соединений типа Hf2Ni, HfNi, Ni3Ti, подобных эквиатомным соединениям в бинарных системах Ti–Ni и Hf–Ni, благодаря диффузионному взаимодействию атомов металлов через расплав кальция;
4) синтез фазы TiNi и дальнейшее ее взаимодействие с HfNi с образованием требуемого интерметаллида (Ti,Hf)Ni вследствие процессов гомогенизации, протекающих во время изотермической выдержки.
Представленная модель адекватно описывает процессы, происходящие в ходе синтеза интерметаллидов системы Ti–Ni–Hf и может применяться в дальнейшем для разработки технологии получения сплавов многокомпонентных систем.
Можно предположить, что синтез сплава Ti40Ni50Hf10 будет проходить по аналогичной схеме. Для сплава с добавкой Zr в качестве четвертого компонента процесс синтеза фазы (Ti,Zr,Hf)Ni, вероятно, будет усложнен за счет образования большего количества промежуточных соединений в ходе взаимодействия двух или трех компонентов сплава.
Физико-химические и технологические свойства синтезированных порошков. Экспериментальные партии порошков сплавов были получены по следующему режиму: температура синтеза 1200°С, время изотермической выдержки 8 ч.
Фазовый и химический составы порошков представлены в табл. 3 и 4 соответственно. Химический состав полученных сплавов практически полностью отвечает модельным составам. Структура синтезированных порошков в основном представлена фазой B19' (табл. 3). Сплав Ti–44.2Ni–26.9Hf содержит около 5% примесной фазы Ti2Ni. В четырехкомпонентном сплаве Ti–40Ni–29.2Hf–12.4Zr обнаружено некоторое количество остаточного В2-аустенита.
Таблица 4.
Химический состав исследуемых порошковых сплавов
| Модельный сплав | C, ат. % (мас. %) | Примеси, мас. % | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Ni | Ti | Hf | Zr | O | N | C | H | Ca | |
| Ti40Ni50Hf10 (Ti–44.2Ni–26.9Hf)* |
50.0 (44.6) |
40.8 (29.7) |
9.2 (25.0) |
– | 0.101 | 0.035 | 0.039 | 0.33 | 0.13 |
| Ti28Ni50Hf22 (Ti–35.8Ni–47.9Hf)* |
49.9 (35.5) |
28.4 (16.5) |
21.7 (46.8) |
– | 0.093 | 0.036 | 0.040 | 0.30 | 0.09 |
| Ti28Ni50Hf12Zr10 (Ti–40Ni–29.2Hf–12.4Zr)* |
49.9 (40.0) |
28.9 (18.9) |
11.5 (28.8) |
9.7 (12.1) |
0.100 | 0.053 | 0.031 | 0.5 | 0.10 |
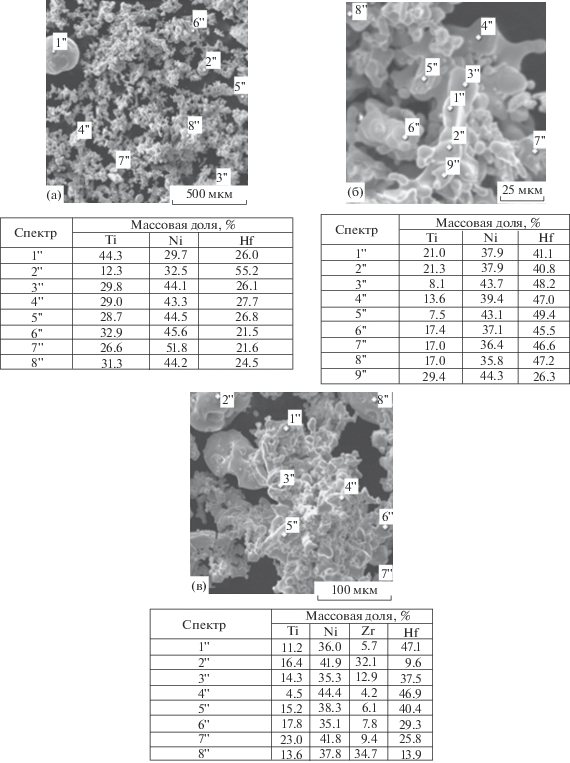
Данные микрорентгеноспектрального анализа показывают, что сплав Ti–44.2Ni–26.9Hf обладает наилучшей гомогенностью по основным элементам в сравнении с остальными порошковыми сплавами (рис. 4а). Разброс концентраций Ti и Ni в порошке сплава Ti–35.8Ni–47.9Hf (рис. 4б), возможно, связан с образованием промежуточных соединений, присущих бинарным диаграммам состояния Ti–Ni и Ni–Hf, в решетках которых растворен сопутствующий элемент. Четырехкомпонентный сплав Ti–40Ni–29.2Hf–12.4Zr содержит ряд твердых растворов (рис. 4в). В порошках обнаружены области, обогащенные Zr или Hf, а также области, в которых концентрация основных элементов приближается к той, которая закладывалась шихтой. Мы предполагаем, что такое неравномерное распределение элементов в сплавах Ti–35.8Ni–47.9Hf и Ti–40Ni–29.2Hf–12.4Zr связано с неполным протеканием процессов гомогенизации. По нашему мнению, для того чтобы привести сплав в равновесное состояние, необходимо увеличивать время изотермической выдержки.
Рис. 4.
Микрорентгеноспектральный анализ поверхностей частиц порошка исследуемых сплавов: а – Ti40Ni50Hf10, б – Ti28Ni50Hf22, в – Ti28Ni50Hf12Zr10.
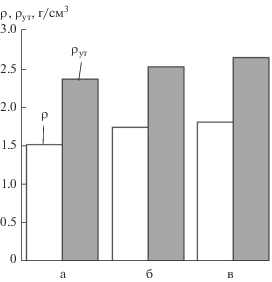
Гранулометрический состав порошков определяли методом ситового анализа согласно ГОСТ 27562 на ситовом анализаторе Вибротехник А20, результаты представлены на рис. 5. Насыпную плотность и плотность утряски определяли в соответствии с ГОСТ 19440 и ГОСТ 25279 соответственно, результаты представлены на рис. 6.
Рис. 5.
Результаты ситового анализа порошков, синтезированных при 1200°С, 8 ч: а – Ti40Ni50Hf10, б – Ti28Ni50Hf22, в – Ti28Ni50Hf12Zr10 (M – массовая доля, D – размер ячеек сита).
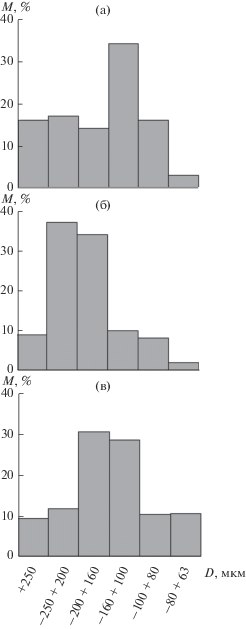
Рис. 6.
Насыпная плотность (ρ) и плотность утряски (ρут) синтезированных порошков сплавов: а – Ti40Ni50Hf10, б – Ti28Ni50Hf22, в – Ti28Ni50Hf12Zr10.
Текучесть порошков определяли по ГОСТ 20889 как время истечения порошка (с) массой 50 г через калиброванное отверстие диаметром 2.5 мм. Испытания показали, что порошки всех исследуемых сплавов не текут.
ЗАКЛЮЧЕНИЕ
Установлена принципиальная возможность синтеза интерметаллида (Ti,Hf)Ni с гомогенным фазовым составом в условиях гидридно-кальциевого процесса.
Предложен механизм гидридно-кальциевого синтеза интерметаллида (Ti,Hf)Ni, состоящий из следующих основных стадий: 1) диссоциация CaH2 на Ca и H2 и восстановление TiO2 и HfO2 до чистых металлов; 2) образование промежуточных интерметаллических соединений, подобных эквиатомным соединениям в бинарных системах Ti–Ni и Hf–Ni, благодаря диффузионному взаимодействию через расплав кальция; 3) синтез фазы TiNi и дальнейшее ее взаимодействие с фазами типа HfNi с образованием требуемого интерметаллида (Ti,Hf)Ni.
Показано, что рост температуры синтеза значительно интенсифицирует процесс образования фазы (Ti,Hf)Ni. Полученные экспериментальные результаты позволяют установить оптимальные параметры синтеза интерметаллида (Ti,Hf)Ni: температура восстановления не менее 1200°С, изотермическая выдержка при температуре восстановления не менее 8 ч.
Изучен комплекс физико-химических и технологических свойств гидридно-кальциевых порошковых сплавов TiNiHf и TiNiHfZr. Установлено, что структура синтезируемых порошковых сплавов в основном представлена B19'-мартенситом. Наблюдается небольшое количество примесной фазы типа Ti2Ni.
Список литературы
Лихачев В.А., Кузьмин С.Л., Каменцева З.П. Эффект памяти формы. Л.: ЛГУ, 1987. 218 с.
Ооцука К., Симидзу К., Судзуки Ю. и др. Сплавы с эффектом памяти формы. М.: Металлургия, 1990. 224 с.
Хачин В.Н., Пушин В.Г., Кондратьев В.В. Никелид титана: Структура и свойства. М.: Наука, 1992. 160 с.
Song G., Ma N., Li H.-N. Applications of Shape Memory Alloys in Civil Structures // Eng. Structures. 2006. V. 28. P. 1266–1274.
Firstov G.S., Humbeeck J., Koval Y. High Temperature Shape Memory Alloys Problems and Prospects // Intell. Mater. Syst. Struct. 2006. P. 1041–1047.
Karaca H.E., Acar E., Tobe H., Saghaian S.M. TiNiHf-Based Shape Memory Alloys // Mater. Sci. Technol. 2014. P. 1530–1544.
Ma J., Karaman I., Noebe R.D. High Temperature Shape Memory Alloys // Int. Mater. Rev. 2010. P. 257–315.
Tong Y., Chen F., Tian B., Li L., Zheng Y. Microstructure and martensitic transformation of Ti49Ni51 – xHfx High Temperature Shape Memory Alloys // Mater. Lett. 2009. V. 63. P. 1869–1871.
Коллеров М.Ю., Александров А.В., Гусев Д.Е. Влияние шихтового материала и метода выплавки на структуру и эффект запоминания формы слитков сплавов на основе никелида титана / Технология легких сплавов. 2012. № 2. С. 87–93.
Kim J.H., Park C.H., Kim S.W., Hong J.K., Oh C.-S., Jeon Y.M., Kim K.M., Yeom J.T. Effects of Microstructure and Deformation Conditions on the Hot Formability of Ni–Ti–Hf Shape Memory Alloys // J. Nanoscience Nanotechnology. 2014. V. 14. P. 9548–9533.
Prasad R.V.S., Park C.H., Kim S.-W., Hong J.K., Yeom J.-T. Microstructure and Phase Transformation Behavior of a New High Temperature TiNiHf–Ta Shape Memory Alloy with Excellent Formability // J. Alloys Compd. 2017. V. 697. P. 55–61.
Касимцев А.В., Левинский Ю.В. Гидридно-кальциевые порошки металлов, интерметаллидов, тугоплавких соединений и композиционных материалов. М.: Изд-во МИТХТ, 2012. 248 с.
Касимцев А.В., Маркова Г.В., Шуйцев А.В., Левинский Ю.В., Свиридова Т.А., Алпатов А.В. Изменение структуры при консолидации гидридно-кальциевых порошков интерметаллида TiNi // Металлург. 2014. № 11. С. 108–114.
Касимцев А.В., Маркова Г.В., Шуйцев А.В., Левинский Ю.В., Свиридова Т.А., Алпатов А.В. Порошковый гидридно-кальциевый интерметаллид TiNi // Изв. вузов. Порошковая металлургия и функциональные покрытия. 2014. № 3. С. 31–37.
Касимцев А.В., Маркова Г.В., Шуйцев А.В., Свиридова Т.А., Володько С.С. Изменение структуры и свойств порошкового гидридно-кальциевого никелида титана при ротационной ковке // Технология легких сплавов. 2016. № 3. С. 44–52.
Диаграммы состояния двойных металлических систем: Справочник: В 3 т.: Т. 1 / Под. общ. ред. Лякишева Н.П. М.: Машиностроение, 1996. 992 с.
Шелехов Е.В., Свиридова Т.А. Программы для рентгеновского анализа поликристаллов // МиТОМ. 2000. № 8. С. 16–19.
Верятин У.Д., Маширев В.П., Рябцев Н.Г. и др. Термодинамические свойства неорганических веществ / Под общ. ред. Зефирова А.П. М.: Атомиздат, 1965. 461 с.
Gupta K.P. The Hf–Ni–Ti (Hafnium–Nickel–Titanium) System // J. Phase Equilibria. 2001. V. 22. № 1. P. 69–72.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


