Неорганические материалы, 2019, T. 55, № 8, стр. 851-858
Влияние источника углерода на электрохимические свойства композитов Li4Ti5O12/С, полученных твердофазным методом
И. А. Стенина 1, *, А. Н. Соболев 1, 2, А. А. Кузьмина 3, Т. Л. Кулова 3, А. Б. Ярославцев 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
3 Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский пр., 31 корп. 4, Россия
* E-mail: stenina@igic.ras.ru
Поступила в редакцию 10.01.2019
После доработки 12.02.2019
Принята к публикации 20.02.2019
Аннотация
Твердофазным методом получены композиционные анодные материалы Li4Ti5O12/C, для которых литий- или титансодержащий реагенты (лактат, ацетат, ацетилацетонат лития, оксиацетилацетонат титана), используемые для синтеза титаната лития, одновременно являлись и источником углерода. В качестве последнего также выступали различные поверхностно-активные вещества: Pluronic123 (P123) и цетилтриметиламмоний бромид (CTAB). Полученные композиты охарактеризованы с помощью РФА, СЭМ, КР-спектроскопии, проведено их электрохимическое исследование. Наилучшие электрохимические характеристики получены для материалов, при синтезе которых использовался P123. Так, разрядная емкость Li4Ti5O12/C, полученного на основе TiO2/P123 и лактата лития, составляет 119 и 44 мА ч/г при плотностях тока 200 и 3200 мА/г. При использовании ацетилацетонатов лития и титана получаются материалы с высоким содержанием углерода и большей деградацией при циклировании при высоких плотностях тока.
ВВЕДЕНИЕ
В современном мире литий-ионные аккумуляторы распространены повсеместно. В качестве анодного материала в них чаще всего используется графит. Однако он обладает достаточно весомыми недостатками, такими как высокие вероятность возгорания и степень деградации при продолжительном циклировании. Одним из перспективных материалов, способных заменить графит, является титанат лития Li4Ti5O12 (LTO), в первую очередь за счет своей безопасности, минимальной деградации при циклировании, а также благодаря практически постоянному рабочему потенциалу ~1.5 В и относительно высокой теоретической емкости (175 мА ч/г) [1–3]. Основными недостатками LTO являются высокий для анодного электрода потенциал, недостаточно высокие величины электронной и литиевой проводимости, что снижает его практическую значимость [4]. Известны различные методы улучшения электрохимических характеристик электродных материалов, среди которых следует выделить получение наноразмерных частиц [5–7], гетровалентное допирование [8–12] и нанесение высокопроводящих покрытий, в первую очередь углеродных [13–15 ], что способствует росту электронной проводимости и улучшению электрического контакта между частицами. Кроме того, введение углеродного материала или его прекурсора на стадии формирования частиц электродного материала (метод in situ) позволяет ограничить их рост. В результате могут быть получены материалы с меньшим размером частиц, характеризующиеся высокой проводимостью. При этом представляется весьма перспективным способ получения углеродного покрытия без использования дополнительного, “внешнего”, источника углерода – в его качестве выступают реагенты для синтеза электродного материала, чаще всего органические соли.
Наиболее распространенными методами синтеза титаната лития являются золь–гель [16, 17], гидротермальный [18, 19] и твердофазный методы [13, 20–22]. Основными преимуществами последнего метода являются, в первую очередь, низкая стоимость, сравнительная легкость проведения реакций (высокотемпературный отжиг часто требуется на заключительном этапе и при использовании других методов), возможность допирования материала различными элементами, в т.ч. и такими, которые практически нерастворимы в условиях проведения гидротермальной или золь–гель-реакции. В отличие от различных разновидностей золь–гель-метода (метод Печини, цитратный метод и пр.) при твердофазном синтезе композитов с углеродом источником последнего могут служить только непосредственно используемые в реакции соединения лития и титана, в частности, органические соли лития [22] или ацетилацетонат титана [23]. Это обстоятельство позволяет корректно оценить влияние различных источников углерода на качество получаемого углеродного покрытия и соответственно электрохимические свойства композитов.
Основным исходным титансодержащим реагентом в случае твердофазного метода синтеза Li4Ti5O12 является диоксид титана. При этом для интенсификации протекания реакции проводят многочасовое измельчение в шаровой мельнице содержащей его смеси, что значительно усложняет и удорожает процесс синтеза. В то же время использование мелкодисперсного TiO2 часто позволяет достичь хороших результатов и без предварительного интенсивного помола [24]. Наиболее часто такой диоксид титана получают в присутствии поверхностно-активных веществ (ПАВ): цетилтриметиламмоний бромида (CTAB) [25] и Pluronic123 (P123) [26], которые сгорают в результате последующего высокотемпературного отжига на воздухе. В то же время за счет образования мицелл в ходе синтеза в присутствии сурфактантов при их пиролизе можно ожидать получения равномерного углеродного покрытия. Однако на настоящий момент данные об использовании этих соединений в качестве источника углеродного покрытия в литературе отсутствуют.
Целью работы является твердофазный синтез композиционных материалов Li4Ti5O12/C, для которых литий- или титансодержащий реагенты, а также ПАВ, используемые при получении оксида титана, одновременно являются и источниками углерода, и исследование электрохимических характеристик полученных материалов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оксид титана получали осаждением изопропоксида титана (97%, Аldrich) в присутствии следующих ПАВ: Pluronic123 (P123, средняя молекулярная масса 5800, Aldrich), цетилтриметиламмоний бромида (CTAB, >96%, Fluka). Предварительно СТАВ растворяли в 32%-ном водном растворе этилового спирта (EtOH). Для полного растворения P123 в 6%-ной HCl смесь перемешивали при 50°С в течение 3 ч. Затем к полученным растворам по каплям прибавляли изопропоксид титана. Смеси оставляли при интенсивном перемешивании при 25°С на 3 ч и при 50°С на 24 ч в случае использования СТАВ и Р123 соответственно. Полученные осадки центрифугировали, промывали водой до нейтральной реакции и сушили на воздухе при комнатной температуре. Так как в ряде случаев Pluronic123 и цетилтриметиламмоний бромид выступали также в качестве источника углерода, для получения материалов с разным его содержанием варьировали степень отмывки оксида титана от ПАВ, используя для этих целей этиловый спирт. Кроме того, некоторые из полученных образцов прокаливали при 550°С на воздухе в течение 5 ч для удаления органического компонента.
Для синтеза композитов Li4Ti5O12/C оксид титана смешивали в стехиометрическом соотношении со следующими солями лития: карбонатом (99% Fluka), ацетатом (LiAc, ≥97% Aldrich), лактатом (LiLact, 95% Aldrich), ацетилацетонатом лития (Liacac, 97% Aldrich). Для получения Li4Ti5O12/C также использовали стехиометрическую смесь оксиацетилацетоната титана (TiO(acac)2, 90% Aldrich) и карбоната лития. Каждую смесь перетирали в агатовой ступке и отжигали в токе аргона при температуре 800°С в течение 5 ч. Далее по тексту в обозначении материалов приведены используемое ПАВ (способ отмывки, температура прокаливания оксида титана) и источник лития, например, LTO/CTAB(H2O, 550°С)-LiLact.
В качестве образцов сравнения использовали титанат лития, как синтезированный твердофазным методом из оксида титана и карбоната лития с последующим отжигом на воздухе, так и полученный золь–гель-методом по методике [17].
Рентгенофазовый анализ образцов проводили с помощью дифрактометра Rigaku D/MAX 2200 (излучение CuKα). Для обработки рентгенограмм использовали пакет программ Rigaku Application Data Processing. Размер частиц оценивали на основании уширения линий рентгенограмм (области когерентного рассеяния (ОКР)) по формуле Дебая–Шеррера. В качестве стандарта использовали LaB6.
Анализ микроструктуры полученных образцов осуществляли с использованием сканирующего электронного микроскопа Carl Zeiss NVision 40.
Содержание воды и углерода в полученных оксиде титана и композитах соответственно определяли методом термогравиметрического анализа на термовесах Netzsch TG 209, сопряженных с масс-спектрометром Aeolos QMS 403C для анализа состава газовой фазы, в платиновых тиглях на воздухе в интервале температур 25–800°С со скоростью нагрева 10°С/мин, масса навески 20–30 мг.
Строение получаемого углеродного покрытия исследовали с помощью спектроскопии комбинационного рассеяния (КР) на приборе DXRxi Raman Imaging Microscope (Thermo Fisher Scientific) с возбуждением линией лазера 532 нм, мощность излучения 0.2–0.6 мВт.
Для приготовления электродной пасты смешивали 88% полученного композита Li4Ti5O12/C в качестве активного материала, 10% сажи (Timcal) и 2% поливинилиден фторида (Aldrich), предварительно растворенного в N-метилпирролидиноне (Aldrich). Полученную электродную массу слоем 10–15 мг/см2 наносили на сетку из нержавеющей стали, используемую в качестве токоотвода, затем прессовали под давлением 0.1 ГПа и сушили при 120°С в вакууме в течение 8 ч.
Исследование электрохимических характеристик проводили в трехэлектродных герметичных электрохимических ячейках с литиевым вспомогательным электродом и литиевым электродом сравнения, используя в качестве сепаратора нетканый полипропилен (НПО “Уфим”). Электрохимические ячейки собирали в перчаточном боксе в атмосфере сухого аргона. В качестве электролита использовали 1М LiPF6 в смеси этиленкарбоната, диэтилкарбоната и диметилкарбоната (1 : 1 : 1) (Aldrich). Электрохимическое циклирование ячеек проводили в интервале потенциалов от 1 до 3 В с помощью зарядно-разрядного стенда ЗРУ 50 мА-10 В (ООО “НТЦ Бустер”). Тестирование проводили в гальваностатическом режиме при плотностях тока 20–3200 мА/г.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно данным рентгенофазового анализа, для всех синтезированных материалов Li4Ti5O12/C полученные углеродные покрытия рентгеноаморфны. При этом на рентгенограммах почти всех материалов присутствуют только рефлексы титаната лития Li4Ti5O12 (PDF-2, карточка № 72-0426). Исключение составляют образцы, полученные с использованием оксиацетилацетоната титана и ацетилацетоната лития, LTO/CTAB(EtOH)-LiАс и LTO/CTAB(EtOH)-Li2СО3, для которых наблюдается образование значительного количества примесной фазы оксида титана (рутила). Наиболее вероятно, что высокая толщина углеродного покрытия, образующегося вокруг частиц оксида титана при разложении TiО(acac)2, препятствует эффективной диффузии лития для формирования однофазного титаната лития и остается часть непрореагировавшeго TiО2. Аналогичный эффект наблюдается и в случае Liacac. Отмывка оксида титана от СТАВ с помощью этилового спирта может приводить к его дeгидратации, интенсификации процессов оляции и оксоляции и, соответственно, уменьшению реакционной способности. Действительно, содержание воды в полученном таким образом оксиде титана оказалось наименьшим из всех полученных образцов, а по составу полученные образцы были близки к TiO2. Уточненные значения параметра кубической решетки титаната лития для полученных композиционных материалов Li4Ti5O12/С составляют 8.3590-8.3601 Å.
Полуширина линий рентгенограммы титаната лития, полученного твердофазным методом путем отжига при 800°С на воздухе (образец сравнения), оказалась сопоставимой с таковой для стандарта. Таким образом, исходя из условий применимости формулы Дебая–Шеррера, можно заключить, что размер частиц Li4Ti5O12 в этом случае превышает 1 мкм. Использование ПАВ и/или органических соединений лития или титана при синтезе титаната лития приводит к уменьшению ОКР Li4Ti5O12 в среднем до 70–90 нм. При этом в случае использования ацетилацетоната лития и оксиацетилацетоната титана размер ОКР уменьшается до 35 и 20 нм соответственно, что обусловлено образованием объемного углеродного покрытия, препятствующего дальнейшему росту частиц. Полученные результаты согласуются с данными термогравиметрического анализа, согласно которым эти образцы характеризуются наибольшим содержанием углерода (табл. 1).
Таблица 1.
Содержание углерода (w), значения I(sp2)/I(sp3) и удельной разрядной емкости Q при разных плотностях тока для образцов Li4Ti5O12/C
| Источник Ti | Источник Li | w, % | I(sp2)/I(sp3) | Q, мА ч/г | |||
|---|---|---|---|---|---|---|---|
| 20 мА/г | 800 мА/г | 1600 мА/г | 3200 мА/г | ||||
| TiO2/CTAB(EtOH, 25°С) | Li2CO3 | 0.4 | 0.31 | 82 | 31 | 22 | 12 |
| LiAc | 0.8 | 0.36 | 87 | 36 | 30 | 21 | |
| LiLact | 1.0 | 0.97 | 97 | 41 | 32 | 22 | |
| TiO2/CTAB(H2O, 25°С) | Li2CO3 | 0.8 | 1.04 | 130 | 49 | 33 | 32 |
| LiAc | 1.3 | 1.10 | 89 | 38 | 31 | 26 | |
| TiO2/P123 | Li2CO3 | 0.9 | 1.13 | 137 | 84 | 67 | 44 |
| LiAc | 1.2 | 1.20 | 142 | 85 | 58 | 41 | |
| LiLact | 2.8 | 1.23 | 144 | 80 | 53 | 44 | |
| Liacac | 6.8 | 0.89 | 125 | 87 | 67 | 50 | |
| TiO(acac)2 | Li2CO3 | 19.0 | 0.99 | 112 | 44 | 26 | 9 |
| TiO2/CTAB(H2O, 550°С) | LiAc | 1.0 | 1.25 | 105 | 60 | 49 | 28 |
| LiLact | 1.4 | 1.12 | 118 | 52 | 40 | 36 | |
| Liacac | 7.7 | 0.97 | 107 | 42 | 33 | 25 | |
| Li4Ti5O12 (золь–гель-метод, отжиг на воздухе при 800°С) | 140 | 47 | 35 | 27 | |||
| Li4Ti5O12 (твердофазный метод, отжиг на воздухе при 800°С) | 90 | 50 | 30 | 15 | |||
По данным сканирующей электронной микроскопии полученные образцы Li4Ti5O12/С представляют собой поликристаллическую массу с размером частиц до 300–400 нм (рис. 1). Несовпадение наблюдаемых размеров частиц с рассчитанными на основании уширения линий рентгенограмм в первую очередь обусловлено тем, что на микрофотографиях представлены не отдельные частицы, а их сростки. При этом образцы, полученные с использованием оксида титана, осажденного в присутствии СТАВ, оказались более спеченными (рис. 1a). На микрофотографиях образцов, при синтезе которых в качестве исходного реагента использовался ацетилацетонат лития или оксиацетилацетонат титана, представлены как одиночные довольно крупные ограненные частицы, так и сростки более мелких, причем количество последних преобладает (рис. 1г).
Рис. 1.
СЭМ-изображения образцов LTO/CTAB(EtOH)-LiLact (а), LTO/P123-LiLact (б), LTO/P123-Li2CO3 (в), LTO/P123-Liacac (г).

Спектры КР композитов LTO/C в области 900–2000 см–1 дают информацию о состоянии углеродного покрытия. Их можно разложить на 4 компоненты (рис. 2). Интенсивные линии с максимумами при ~1600 и ~1350 см–1 относятся соответственно к G- и D-полосам графита (sp2-гибридизация углерода) [27–30]. Наряду с ними можно выделить еще 2 широких полосы в областях ~1250 и 1520 см–1 (рис. 2), соответствующих углеродным фрагментам, различающимся по строению. Так, полосу при 1520 см–1 относят к колебаниям углерода в состоянии sp3-гибридизации [29]. По отношению сумм площадей пиков углерода в sp2- и sp3-гибридизации (I(sp2) и I(sp3) соответственно) можно судить о степени графитизации и доле проводящего углерода.
Рис. 2.
КР-спектры в области 1000–1800 см–1 для LTO/Р123-LiAc (1), LTO/P123-Li2CO3 (2), LTO/P123-LiLact (3), LTO/P123-Liacac (4), LTO/CTAB(EtOH)-LiAc (5), LTO/CTAB(H2O)-LiAc (6), LTO/CTAB(H2O)-Li2CO3 (7); на примере образца LTO/Р123-LiAc представлено разложение КР-спектра на компоненты.
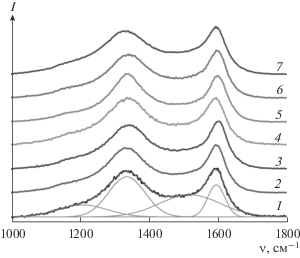
В целом, спектры КР композитов LTO/C, для синтеза которых использовался оксид титана, полученный в присутствии Pluronic123, мало отличаются между собой (рис. 2). По всей видимости, это обусловлено тем, что источником получаемого углеродного покрытия является преимущественно Р123, а не органические соли лития. Наибольшие различия наблюдаются в КР-спектрах для образцов, полученных с использованием оксида титана, осажденного в присутствии СТАВ и в дальнейшем отмытого водой или спиртом (рис. 2). В последнем случае степень отмывания оксида титана от цетилтриметиламмоний бромида максимальна, что согласуется с наименьшим содержанием углерода в образцах, полученных с использованием TiO2/CTAB(EtOH, 25°С). В результате, если при отмывке диоксида титана водой основным источником углерода является СТАВ, то при использовании спирта – анионы литиевых солей. Причем в последнем случае материалы LTO/C характеризуются наименьшим отношением I(sp2)/I(sp3). В остальных композитах степень графитизации больше 1 за исключением образцов, полученных с использованием Liacac и TiO(acac)2 (табл. 1). По всей видимости, высокое содержание кислорода в этих реагентах не позволяет получить углеродное покрытие с высокой долей проводящего углерода (sp2-гибридизация углерода).
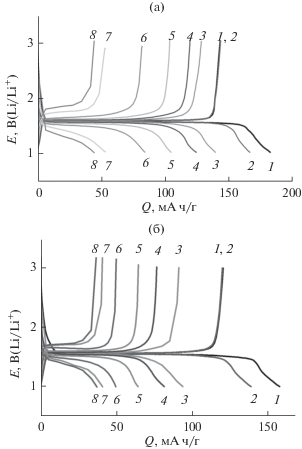
На зарядно-разрядных кривых полученных композитов Li4Ti5O12/C присутствует плато, соответствующее переходу Ti4+ ↔ Ti3+, при потенциале ~1.5 В (рис. 3). При малой скорости заряда/разряда (20 мА/г, ~С/8) значения разрядных емкостей LТО/C варьируются от 82 до 145 мА ч/г (табл. 1). При этом наибольшими величинами разрядной емкости характеризуются материалы, полученные с использованием Pluronic123. В частности, емкость Li4Ti5O12/C, полученного из лактата лития и TiO2/Р123, составляет 144 мА ч/г, что значительно превышает электрохимическую емкость образца сравнения – титаната лития, полученного твердофазным методом путем отжига оксида титана и карбоната лития на воздухе (100 мА ч/г) и даже несколько выше емкости титаната лития, полученного с помощью золь–гель-метода (140 мА ч/г). Более высокие значения емкости в случае использования ПАВ связаны с наличием углеродного покрытия и большей электропроводностью исследуемых материалов.
Рис. 3.
Зарядно-разрядные кривые для композитов LTO/Р123-LiLact (а) и LTO/CTAB(H2O, 550°С)-LiLact (б) при различных плотностях тока: 20 (1-й цикл) (1), 20 (2-й цикл) (2), 100 (3), 200 (4), 400 (5), 800 (6), 1600 (7), 3200 (8) мА/г.
Данные по циклированию некоторых образцов Li4Ti5O12/C токами различной плотности представлены на рис. 4, а также в табл. 1. В случае материалов, для синтеза которых использовался оксид титана, полученный в присутствии Pluronic123, уменьшение емкости титаната лития при увеличении плотности тока связано с кинетическими факторами. Деградация материала при этом мала (не более 1–1.5%), и после проведения циклирования большими токами значение емкости на малых токах восстанавливается практически до исходной величины. В то же время для образца сравнения эта величина составляет около 7%. Композиты, при синтезе которых использовался TiO2/CTAB, характеризуются еще большими значениями деградации, достигающими 15–19%.
Рис. 4.
Изменение разрядных емкостей в ходе циклирования для Li4Ti5O12, синтезированного с помощью золь–гель- (1), твердофазного (2) метода, и композитов LTO/C, полученных с использованием оксида титана, осажденного в присутствии Р123 (а): LTO/P123-LiLact (3), LTO/Р123-LiAc (4), LTO/P123-Li2CO3 (5), LTO/P123-Liacac (6), и СТАВ (б): LTO/CTAB(EtOH)-LiLact (7), LTO/CTAB(H2O)-LiAc (8), LTO/CTAB(H2O)-Li2CO3 (9) (плотность тока [мА/г] указана на рисунке).
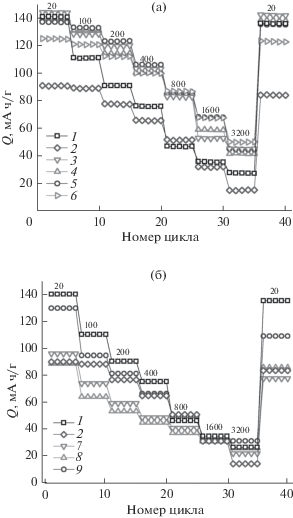
Данные электрохимического тестирования хорошо коррелируют с отношением I(sp2)/I(sp3) (табл. 1). Так, наименьшая доля фазы графита в углеродном покрытии наблюдается в случае материалов, для получения которых использовался TiO2, осажденный в присутствии цетилтриметиламмоний бромида и отмытый спиртом. Кроме того, эти композиты характеризуются минимальным содержанием углерода, вследствие чего они обладают наихудшими электрохимическими характеристиками. В целом, среди изученных композитов наибольшие разрядные емкости характерны для материалов, при получении которых использовался оксид TiO2/P123. Так, разрядная емкость LTO/Р123-LiLact составляет 119 и 82 мА ч/г при плотностях тока 200 и 800 мА/г. Наблюдаемый результат можно объяснить достаточно близким к оптимальному содержанием углерода (2.8%) в сочетании с наибольшей среди полученных материалов долей углерода в sp2-гибридизации (I(sp2)/I(sp3) = 1.25) и, соответственно, хорошей электропроводностью. Использование ацетилацетоната лития или оксиацетилацетоната титана приводит к повышенному содержанию углерода, что хоть и влечет за собой уменьшение размера частиц, но значительно повышает степень деградации в ходе циклирования за счет формирования на их поверхности низкопроводящего покрытия (SEI). При использовании в качестве источника углеродного покрытия органических солей лития наиболее высокие значения емкости получены для композита на основе LiLact.
ЗАКЛЮЧЕНИЕ
Проведено систематическое исследование влияния углеродного покрытия, источником которого служили различные литий- или титансодержащие реагенты, в частности, лактат, ацетат, ацетилацетонат лития или оксиацетилацетонат титана, а также ПАВ (Pluronic123 и цетилтриметиламмоний бромид), на электрохимические характеристик полученных композитов Li4Ti5O12/C.
Наилучшие электрохимические характеристики получены для материалов, при синтезе которых использовался P123, что определяется достаточно высокой электропроводностью полученного углеродного покрытия и близким к оптимальному содержанием углерода. Использование ацетилацетонатов лития или титана, а также цетилтриметиламмоний бромида в качестве источника углерода приводит к получению углеродного покрытия низкого качества, с меньшей долей углерода в sp2-гибридизации, а также значительной деградации полученных материалов при высоких скоростях циклирования.
Список литературы
Yi T.-F., Yang S.-Y., Xie Y. Recent Advances of Li4Ti5O12 as Promising Next Generation Anode Material for High Power Lithium-Ion Batteries // J. Mater. Chem. A. 2015. V. 3. P. 5750–5777. https://doi.org/10.1039/C4TA06882C
Yang Y., Qiao B., Yang X., Fang L., Pan C., Song W., Hou H., Ji X. Lithium Titanate Tailored by Cathodically Induced Graphene for an Ultrafast Lithium Ion Battery // Adv. Funct. Mater. 2014. V. 24. P. 4349–4356. https://doi.org/10.1002/adfm.201304263
Yaroslavtsev A.B., Stenina I.A., Kulova T.L., Skundin A.M., Desyatov A.V. Nanomaterials for Electrical Energy Storage // Comprehensive Nanoscience and Nanotechnology / Eds Andrews D. et al. V. 5. Application of Nanoscience / Ed. Bradshaw D.S. Amsterdam, Boston, Heidelberg, London, New York, Oxford, Paris, San Diego, San Francisco, Singapore, Sydney, Tokio: Elsevier. Academic Press, 2019. P. 165–206.
Wilkening M., Amade R., Iwaniak W., Heitjans P. Ultraslow Li Diffusion in Spinel-type Structured Li4Ti5O12 – a Comparison of Results from Solid State NMR and Impedance Spectroscopy // Phys. Chem. Chem. Phys. 2007. V. 9. P. 1239–1246. https://doi.org/10.1039/B616269J
Kashkooli A.G., Lui G., Farhad S., Lee D.U., Feng K., Yu A., Chen Z. Nano-Particle Size Effect on the Performance of Li4Ti5O12 Spinel // Electrochim. Acta. 2016. V. 196. P. 33–40. https://doi.org/10.1016/j.electacta.2016.02.153
Liu P., Zhu K., Bian K., Xu Y., Zhang F., Zhang W., Zhang J., Huang W. 3D Hierarchical Porous Sponge-Like V2O5 Micro/nano-Structures for High-Performance Li-Ion Batteries // J. Alloys Compd. 2018. V. 765. P. 901–906. https://doi.org/10.1016/j.jallcom.2018.06.314
Zhai J., Lei Z., Rooney D., Wang H., Sun K. Self-templated Fabrication of Micro/Nano Structured Iron Fluoride for High Performance Lithium-Ion Batteries // J. Power Sources. 2018. V. 396. P. 371–378. https://doi.org/10.1016/j.jpowsour.2018.06.048
Park J.S., Baek S.-H., Jeong Y.-I., Noh B.-Y., Kim J.H. Effects of a Dopant on the Electrochemical Properties of Li4Ti5O12 as a Lithium-Ion Battery Anode Material // J. Power Sources. 2013. V. 244. P. 527–531. https://doi.org/10.1016/j.jpowsour.2013.02.048
Fang M., Yao X., Li W., Li Y., Shui M., Shu J. The Investigation of Lithium Doping Perovskite Oxide LiMnO3 as Possible LIB Anode Material // Ceram. Int. 2018. V. 44. P. 8223–8231. https://doi.org/10.1016/j.ceramint.2018.02.002
Zhou T.P., Feng X.Y., Guo X., Wu W.W., Cheng S., Xiang H.F. Solid-state Synthesis and Electrochemical Performance of Ce-Doped Li4Ti5O12 Anode Materials for Lithium-ion Batteries // Electrochim. Acta 2015. V. 174. № 20. P. 369–375. https://doi.org/10.1016/j.electacta.2015.06.021
Novikova S., Yaroslavtsev S., Rusakov V., Kulova T., Skundin A., Yaroslavtsev A. LiFe1–x${\text{M}}_{x}^{{{\text{II}}}}$PO4/C (MII = = Co, Ni, Mg) as Cathode Materials for Lithium-Ion Batteries // Electrochim. Acta 2014. V. 122. P. 180–186. https://doi.org/10.1016/j.electacta.2013.08.118
Kulova T.L., Kreshchenova Y.M., Kuz’mina A.A., Skundin A.M., Stenina I.A., Yaroslavtsev A.B. New High-Capacity Anode Materials Based on Gallium-Doped Lithium Titanate // Mendeleev Commun. 2016. V. 26. № 4. P. 238–239. https://doi.org/10.1016/j.mencom.2016.05.005
Ren Y., Lu P., Huang X., Zhou S., Chen Y., Liu B., Chu F., Ding J. In-situ Synthesis of Nano-Li4Ti5O12/C Composite as an Anode Material for Li-Ion Batteries // Solid State Ionics. 2015. V. 274. P. 83–87. https://doi.org/10.1016/j.ssi.2015.02.016
Xu X., Ai Q., Pan L., Ma X., Zhai W., An Y., Hou G., Chen J., Zhang L., Si P., Lou J., Feng J., Ci L. Li7P3S11 Solid Electrolyte Coating Silicon for High-Performance Lithium-Ion Batteries // Electrochim. Acta. 2018. V. 276. P. 325–332. https://doi.org/10.1016/j.electacta.2018.04.208
Zuo D., Tian G., Li X., Chen D., Shu K. Recent Progress in Surface Coating of Cathode Materials for Lithium Ion Secondary Batteries // J. Alloys Compd. 2017. V. 706. P. 24–40. https://doi.org/10.1016/j.jallcom.2017.02.230
Zhang C., Zhang Y., Wang J., Wang D., Xia Y. Li4Ti5O12 Prepared by a Modified Citric Acid Sol–Gel Method for Lithium-Ion Battery // J. Power Sources. 2013. V. 236. P. 118–125. https://doi.org/10.1016/j.jpowsour.2013.01.135
Stenina I.A., Kulova T.L., Skundin A.M., Yaroslavtsev A.B. High Grain Boundary Density Li4Ti5O12/Anatase-TiO2 Nanocomposites as Anode Material for Li-Ion Batteries // Mater. Res. Bull. 2016. V. 75. P. 178–184. https://doi.org/10.1016/j.materresbull.2015.11.050
Yi T.-F., Yang S.-Y., Zhu Y.-R., Ye M.-F., Xie Y., Zhu R.-S. Enhanced Rate Performance of Li4Ti5O12 Anode Material by Ethanol-Assisted Hydrothermal Synthesis for Lithium-Ion Battery // Ceram. Int. 2014. V. 40. № 7. P. 9853–9858. https://doi.org/10.1016/j.ceramint.2014.02.077
Feng X., Zou H., Xiang H., Guo X., Zhou T., Wu Y., Xu W., Yan P., Wang C., Zhang J.-G., Yu Y. Ultrathin Li4Ti5O12 Nanosheets as Anode Materials for Lithium and Sodium Storage // ACS Appl. Mater. Interfaces. 2016. V. 8. № 26. P. 16718–16726. https://doi.org/10.1021/acsami.6b04752
Zukalová M., Fabián M., Klusáčková M., Klementová M., Lásková B.P., Danková Z., Senna M., Kavan L. Li Insertion into Li4Ti5O12 Spinel Prepared by Low Temperature Solid State Route: Charge Capability vs Surface Area // Electrochim. Acta. 2018. V. 265. P. 480–487. https://doi.org/10.1016/j.electacta.2018.01.171
Han S.-W., Ryu J.H., Jeong J., Yoon D.-H. Solid-State Synthesis of Li4Ti5O12 for High Power Lithium Ion Battery Applications // J. Alloys Compd. 2013. V. 570. P. 144–149. https://doi.org/10.1016/j.jallcom.2013.03.203
Zhang Y., Hu X., Xu Y., Chen C. Preparation and Electrochemical Properties of Li4Ti5O12/C Anode Material by Facile Solid-state Reaction // Solid State Ionics. 2015. V. 276. P. 18–25. https://doi.org/10.1016/j.ssi.2015.03.033
Shen L., Li H., Uchaker E., Zhang X., Cao G. General Strategy for Designing Core-Shell Nanostructured Materials for High-Power Lithium Ion Batteries // Nano Lett. 2012. V. 12. P. 5673–5678.
Li X., Hu H., Huang S., Yu G., Gao L., Liu H., Yu Y. Nano-Sized Li4Ti5O12 Anode Material with Excellent Performance Prepared by Solid State Reaction: the Effect of Precursor Size and Morphology // Electrochim. Acta. 2013. V. 112. P. 356–363. https://doi.org/10.1016/j.electacta.2013.08.162
Zhong J.B., Li J.Z., Feng F., Huang S.G., Zeng J. CTAB-Assisted Fabrication of TiO2 with Improved Photocatalytic Performance // Mater. Lett. 2013. V. 100. P. 195–197. https://doi.org/10.1016/j.matlet.2013.03.030
Tsai S.-H., Yang Y.-C. Synthesis of the Mesoporous TiO2 Array for Hydroxyapatite Precipitation // Surf. Coat. Technol. 2013. V. 231. P. 578–582. https://doi.org/10.1016/j.surfcoat.2012.11.017
Zheng Z., Wang Y., Zhang A., Zhang T., Cheng F., Tao Z., Chen J. Porous Li2FeSiO4/C Nanocomposite as the Cathode Material of Lithium-Ion Batteries // J. Power Sources. 2012. V. 198. P. 229–235. https://doi.org/10.1016/j.jpowsour.2011.09.066
Stenina I.A., Kulova T.L., Skundin A.M., Yaroslavtsev A.B. Effects of Carbon Coating from Sucrose and PVDF on Electrochemical Performance of Li4Ti5O12/C Composites in Different Potential Ranges // J. Solid State Electrochem. 2018. V. 22. P. 2631–2639. https://doi.org/10.1007/s10008-018-3978-z
Doeff M.M., Hu Y.Q., McLarnon F., Kostecki R. Effect of Surface Carbon Structure on the Electrochemical Performance of LiFePO4 // Electrochem. Solid-State Lett. 2003. V. 6. P. A207–A209. https://doi.org/10.1149/1.1601372
Vidano R.P., Fishbach D.B., Willis L.J., Loehr T.M. Observation of Raman Band Shifting with Excitation Wavelength for Carbons and Graphites // Solid State Commun. 1981. V. 39. № 2. P. 341–344 https://doi.org/10.1016/0038-1098(81)90686-4
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


