Неорганические материалы, 2019, T. 55, № 9, стр. 975-983
Исследование термодинамики и кинетики превращений γ-Al2O3 и АlООН в гидротермальных условиях
Г. П. Панасюк 1, *, И. В. Козерожец 1, Е. А. Семенов 1, М. Н. Данчевская 2, Л. А. Азарова 1, В. Н. Белан 1
1 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
2 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: panasyuk@igic.ras.ru
Поступила в редакцию 18.02.2019
После доработки 12.04.2019
Принята к публикации 22.04.2019
Аннотация
Исследована кинетика образования наноразмерного порошка бемита при гидротермальной обработке наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе НСl при 200, 170 и 150°С. Показано, что температурная зависимость константы скорости реакции описывается уравнением Аррениуса. Определена Еакт процесса, равная 84 кДж/моль. Термодинамика превращения наноразмерного порошка γ-Al2O3 в бемит при гидротермальной обработке при 150°С исследована методом ДСК. Определены теплоты испарения воды из двухфазной наноразмерной системы (γ-Al2O3/образующийся бемит), равные 8, 16 и 22 кДж/моль Н2О, что указывает на активную роль воды с низким значением теплоты испарения на начальных этапах гидротермальной обработки наноразмерного порошка γ-Al2O3. Заниженное значение теплового эффекта превращения наноразмерных порошков АlООН → γ-Al2O3 по отношению к табличному составляет 7 кДж/моль АlООН, что объясняется размером частиц и несовершенством структуры синтезированного бемита (АlООН).
ВВЕДЕНИЕ
Успехи, достигнутые в последнее время при получении нанокристаллов, определяют широкий фронт исследований по их применению [1–24]. Принципиально новым направлением является модифицирование свойств жидкостей путем добавления наноразмерных кристаллов металлов, оксидов и карбидов. Системы жидкость–наноразмерное твердое вещество называются нанофлюиды [7–24]. Они широко исследуются и уже сейчас находят широкое промышленное применение в холодильной технике, для охлаждения интегральных схем, в здравоохранении и других областях современной техники [12, 15–24]. Число работ по этому направлению растет экспоненциально, хотя доля работ российских исследователей незначительна. Характерно, что работы в этом направлении проводились и раньше, данные системы квалифицировались как микросуспензии, однако широкое исследование таких систем началось после разработки доступных методов получения наноразмерных частиц с низкой степенью агрегации.
Нанофлюиды пsроявляют свойства, отличные от свойств матричных жидкостей: плотность, вязкость, теплопроводность, скорость испарения [7–24]. Во многих случаях изменение свойств носит фундаментальный характер. В частности, изменение теплоты испарения воды при добавлении минимального количества наночастиц (порядка 0.01–1 мас. %) указывает на влияние микродобавок на изменение свойств воды, что однозначно не объяснено до настоящего времени [9–23]. Ранее этот эффект наблюдался в работах Дерягина, что позволило ему квалифицировать аномальную воду [25]. Однако более поздние работы показали, что существует не аномальная вода, а микрорастворы с содержанием растворенного вещества порядка 0.001 мас. %, которые модифицируют свойства воды или исходного матричного раствора [26]. Сейчас пристальное внимание направлено не на решение фундаментальных проблем, а на прикладные аспекты нанофлюидов, что связано с перспективой их широкого промышленного применения.
Свойства нанофлюидов коррелируют со свойствами систем адсорбированная или окклюдированная вода–мелкодисперсный оксид. В этом случае матричным веществом является наноразмерный оксид, который модифицирует адсорбированную воду, так же как вода модифицируется наноразмерными частицами в нанофлюидах [2, 3]. Такие системы часто встречаются при гидротермальной обработке гидроксидов и оксидов. Исследование таких систем позволяет получить как фундаментальные сведения о растворах с ультранизким содержанием компонентов, так и практические результаты по созданию новых оксидных систем и нанофлюидов.
Данная работа посвящена исследованию термодинамики и кинетики образования наноразмерного порошка бемита при гидротермальной обработке наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе НСl в диапазоне температур 150–200°С.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В данной работе использовался наноразмерный порошок γ-Al2O3, синтезированный по технологии, описанной в статье [1]. Гидротермальная обработка γ-Al2O3 проводилась в автоклавах объемом 18 см3 в тефлоновом вкладыше в 1.5%-ном растворе НСl. Герметизированные автоклавы помещались в разогретую электрическую печь и выдерживались на воздухе при постоянной температуре в течение разного времени. После охлаждения и разгерметизации автоклавов образцы извлекали из контейнеров, промывали дистиллированной водой, высушивали при 100°С и исследовали методами РФА на дифрактометре Bruker D8 Advance (CuKα-излучение) и ДСК на термоанализаторе SDT Q600 со скоростью нагрева 20°С/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для исследования кинетики процесса весовая доля AlOOH (Xα) вычислялась по дифрактограмме как соотношение интегральных интенсивностей пика бемита (в диапазоне 25°–29.5° с максимумом при 28°) к сумме интегральных интенсивностей рефлексов γ-Al2O3(в диапазоне 43°–47.5° с максимумом при 45.8°) и AlOOH по формуле
В табл. 1 представлены значения интегральных интенсивностей и весовая доля AlOOH при гидротермальной обработке синтезированного наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl в течение разного времени при температурах 150, 170 и 200°С.
Таблица 1.
Значения интегральных интенсивностей и весовая доля AlOOH при гидротермальной обработке синтезированного наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl в течение разного времени при температурах 150, 170 и 200°С
| Время, ч | Ig (2q = 45.875) | Ib (2q = 28.21) | Xα |
|---|---|---|---|
| 200°С | |||
| 0.5 | 516.6 | 87.4 | 0.10268 |
| 1 | 574 | 186 | 0.17978 |
| 1.5 | 311.3 | 298.4 | 0.39334 |
| 2 | 337.9 | 418.4 | 0.45579 |
| 3 | 164.2 | 443.5 | 0.64626 |
| 5 | 102.4 | 703.4 | 0.82289 |
| 6 | 0 | 1149.7 | 1 |
| 170°С | |||
| 2 | 2434.9 | 5.4 | 0.0015 |
| 2.5 | 601.2 | 51.7 | 0.05497 |
| 3 | 815.6 | 86.5 | 0.06693 |
| 4 | 643 | 236.5 | 0.19922 |
| 12 | 762.8 | 696.5 | 0.3818 |
| 24 | 0 | 1024.5 | 1 |
| 150°С | |||
| 4 | 315.5 | 17.6 | 0.03636 |
| 8 | 645.5 | 84 | 0.0809 |
| 12 | 413.3 | 118.9 | 0.16289 |
| 16 | 271.1 | 188.1 | 0.31941 |
| 20 | 335.9 | 350.6 | 0.41383 |
| 24 | 212.2 | 391.6 | 0.55521 |
| 48 | 127.4 | 304 | 0.61744 |
| 60 | 126.5 | 592.5 | 0.76008 |
| 96 | 0 | 1039.5 | 1 |
Все кривые на участке роста степени превращения бемита удовлетворительно аппроксимируются кинетическим уравнением Авраами–Ерофеева [27], которое в наиболее общей форме имеет вид
где n – параметр, величина которого определяется механизмом протекания реакции; К – эффективная константа скорости превращения.В билогарифмических координатах уравнение (1) принимает вид
а графическое изображение экспериментальных данных α и τ, представленных в координатах {$\ln \tau ;$ $\ln [ - \ln (1 - \alpha )]$} (рис. 1), является набором прямых линий с угловым коэффициентом, равным n. Из линейности кинетических кривых в логарифмических координатах (рис. 1) следует, что рассматриваемый процесс превращения удовлетворительно описывается данным кинетическим уравнением. Ниже приведены численные значения кинетических параметров образования наноразмерного порошка бемита при гидротермальной обработке синтезированного наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl в течение разного времени.
Рис. 1.
Кинетические кривые и кинетические параметры образования наноразмерного порошка бемита при гидротермальной обработке синтезированного наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl в течение разного времени при 200 (а), 170 (б), 150°С (в).
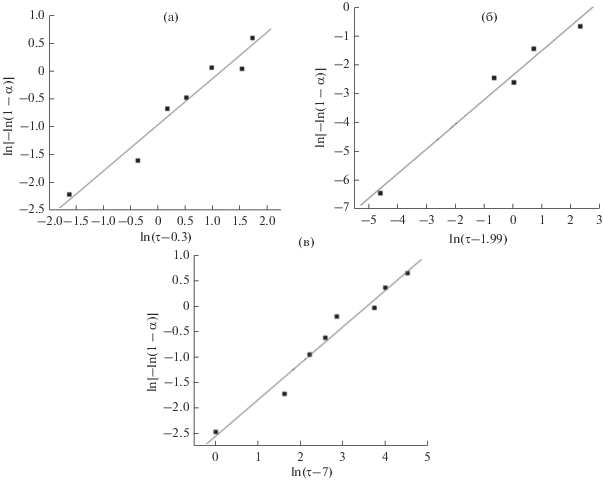
При 200°С:
при 170°С:
при 150°С:
Температурная зависимость константы скорости реакции, представленная на рис. 2 в координатах lnK–1/T, удовлетворяет уравнению Аррениуса:
Рис. 2.
Зависимость логарифма константы скорости реакции образования наноразмерного порошка бемита при гидротермальной обработке синтезированного наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl от обратной температуры в интервале 150–200°С.
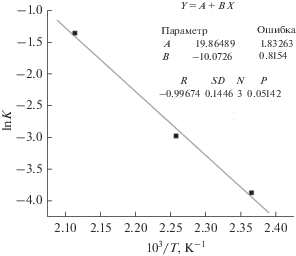
Зависимость логарифма константы скорости реакции от обратной температуры в интервале 150–200°С позволяет оценить энергию активации Eакт структурного превращения наноразмерного порошка γ-Al2O3 в наноразмерный порошок бемита, значение которой составило 84 кДж/моль.
Из литературных данных известно, что значение Eакт для термической обработки оксидов и гидроксидов алюминия микронного размера в зависимости от вводимых затравок колеблется в пределах 400–600 кДж/моль, в то время как для процессов, осуществляемых в гидротермальных условиях, это значение находится в интервале 80–200 кДж/моль [28–30].
Для исследования превращения наноразмерного порошка γ-Al2O3 в бемит при гидротермальной обработке в 1.5%-ном растворе НСl при 150°С был использован метод ДСК. Рассматривались изменения значения теплоты испарения воды, температуры и ΔН превращения бемита (AlOOH), полученного в результате гидротермальной обработки наноразмерного порошка γ- Al2O3.
При нагревании порошка γ-Al2O3 на кривых ДТА и ТГ отсутствуют тепловые эффекты. Потеря массы при прогреве до 1000°С составила 5.47%, что, возможно, связано с удалением летучих примесей и остатков органических соединений.
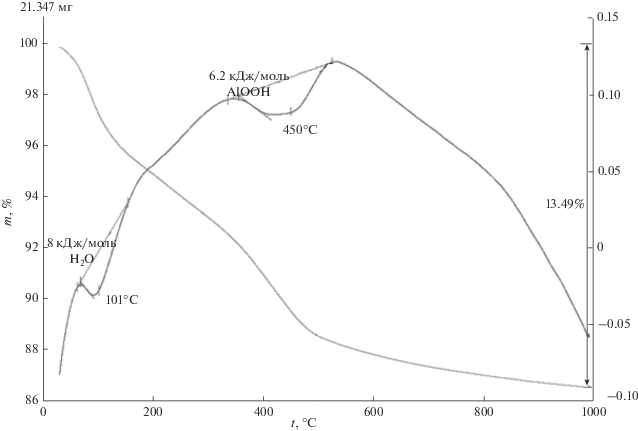
Для смеси фаз γ-Al2O3 и наноразмерного порошка бемита (AlOOH), полученного после гидротермальной обработки наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl при 150°С в течение 8 ч на кривых ДТА и ТГ отмечаются два эндотермических эффекта (рис. 3): при 101°С, соответствующий удалению поверхностно-связанной воды с тепловым эффектом ΔН = 8 кДж/моль H2O, и при 450°С, соответствующий дегидратации бемита (AlOOH) с образованием γ-Al2O3, ΔН = = 6.2 кДж/моль AlOOH. Оба тепловых эффекта значительно меньше табличных значений (ΔН испарения воды при 100°С равна 40.62 кДж/моль H2O [31]; ΔН превращения AlOOH → γ-Al2O3 равна 26.1 кДж/моль AlOOH [2, 3]).
Рис. 3.
Кривые ДТА и ТГ смеси фаз γ-Al2O3 и наноразмерного порошка бемита (AlOOH), полученного после гидротермальной обработки наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl при 150°С в течение 8 ч.
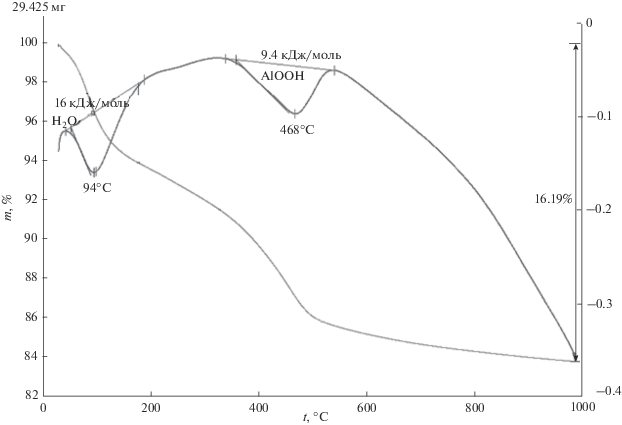
Для смеси фаз γ-Al2O3 и бемита, полученного после гидротермальной обработки наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl при 150°С в течение 12 ч, на кривых ДТА и ТГ также отмечаются два эндотермических эффекта (рис. 4): при 94°С, соответствующий удалению поверхностно-связанной воды с ΔН = 16 кДж/моль H2O, и при 468°С, соответствующий дегидратации бемита (AlOOH) с образованием γ-Al2O3, ΔН = = 9.4 кДж/моль AlOOH.
Рис. 4.
Кривые ДТА и ТГ смеси фаз γ-Al2O3 и наноразмерного порошка бемита (AlOOH), полученного после гидротермальной обработки наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl при 150°С в течение 12 ч.
При нагревании смеси фаз γ-Al2O3 и бемита, полученного после гидротермальной обработки наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl при 150°С в течение 16 ч, на кривых ДТА и ТГ также отмечаются два эндотермических эффекта (рис. 5): при 109°С, соответствующий удалению поверхностно-связанной воды с ΔН = = 22 кДж/моль H2O, и при 475°С, соответствующий дегидратации AlOOH с образованием γ-Al2O3, ΔН = = 10.6 кДж/моль AlOOH.
Рис. 5.
Кривые ДТА и ТГ смеси фаз γ-Al2O3 и наноразмерного порошка бемита (AlOOH), полученного после гидротермальной обработки наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl при 150°С в течение 16 ч.
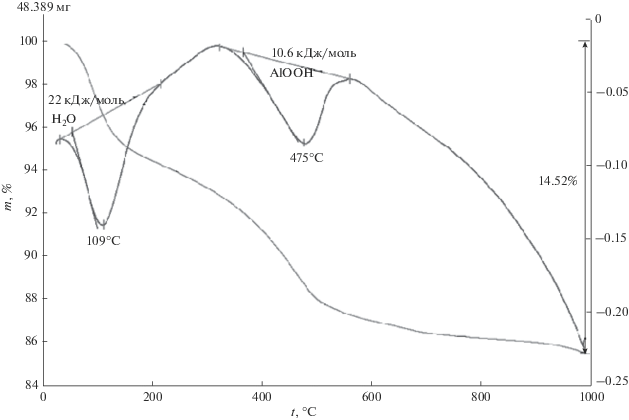
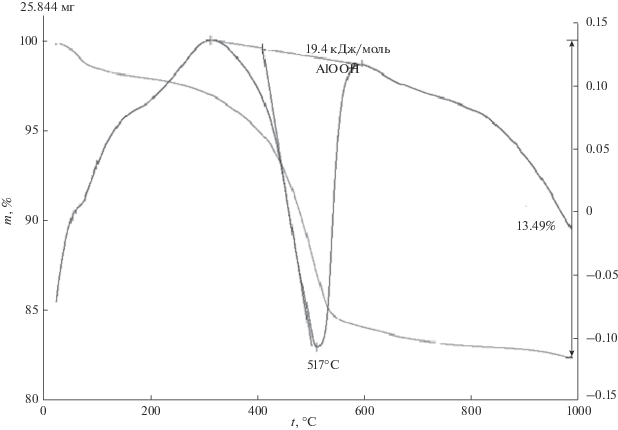
При нагревании наноразмерного порошка бемита, полученного после гидротермальной обработки наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl при 150°С в течение 96 ч, на кривых ДТА и ТГ отмечается один эндотермический эффект (рис. 6) при 517°С, соответствующий дегидратации AlOOH с образованием γ-Al2O3, ΔН = = 19.4 кДж/моль AlOOH.
Рис. 6.
Кривые ДТА и ТГ наноразмерного порошка бемита (AlOOH), полученного после гидротермальной обработки наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе HCl при 150°С в течение 96 ч.
Таким образом, на всех кривых ДТА и ТГ для смеси фаз γ-Al2O3 + образующийся AlOOH присутствуют два эдотермических эффекта, характерных для удаления поверхностно-связанной воды и дегидратации бемита.
Значения тепловых эффектов испарения воды из смеси наноразмерных порошков γ-Al2O3 + + AlOOH значительно ниже табличного значения теплоты испарения воды (40.62 кДж/моль Н2О) и равны: 8 кДж/моль Н2О (τ = 8 ч), 16 кДж/моль Н2О (τ = 12 ч), 22 кДж/моль Н2О (τ = 16 ч), что, по-видимому, определяется локализацией воды в структуре обрабатываемого материала и указывает на активную роль воды с низким значением теплоты испарения в процессе гидротермальной обработки наноразмерного порошка γ-Al2O3. Стоит отметить, что по окончании процесса превращения γ-Al2O3 в AlOOH при нагревании на кривых ДТА и ТГ не фиксируются эндотермические эффекты испарения воды, что косвенно указывает на его завершенность. Результаты, полученные для наноразмерных частиц оксидов и гидроксидов алюминия, коррелируют с результатами, полученными для микронных частиц [2, 3].
Значения тепловых эффектов дегидратации наноразмерного порошка AlOOH с образованием γ-Al2O3 на различных этапах гидротермальной обработки ниже табличных значений (26.1 кДж/моль AlOOH): 6.2 кДж/моль AlOOH для γ-Al2O3, обработанного в 1.5%-ном растворе HCl при 150°С, τ = 8 ч; 9.4 кДж/моль AlOOH при τ = 12 ч; 10.6 кДж/моль AlOOH при τ = 16 ч, что указывает на несовершенство структуры бемита. При увеличении времени гидротермальной обработки до τ = 96 ч значения тепловых эффектов дегидратации бемита увеличиваются до 19.4 кДж/моль AlOOH и происходит формирование совершенной структуры бемита.
Также стоит отметить, что смещение температуры максимума пика превращения AlOOH → γ-Al2O3 в область 517°С хорошо согласуется с данными [32] и обусловлено размером частиц бемита (AlOOH). Согласно данным [32], такое смещение указывает, что средний размер частиц бемита (AlOOH) составляет 20 нм.
ЗАКЛЮЧЕНИЕ
Исследована кинетика образования наноразмерного порошка бемита при гидротермальной обработке наноразмерного порошка γ-Al2O3 в 1.5%-ном растворе НСl при 200, 170 и 150°С. Показано, что температурная зависимость константы скорости реакции описывается уравнением Аррениуса, определена Еакт процесса, равная 84 кДж/моль.
Определены значения тепловых эффектов испарения воды из смеси наноразмерных порошков (γ-Al2O3 + образующийся AlOOH),которые значительно ниже табличного значения теплоты испарения воды (40.62 кДж/моль Н2О): 8, 16 и 22 кДж/моль Н2О при τ = 8, 12 и 16 ч соответственно, что указывает на активную роль воды с низким значением теплоты испарения на начальных этапах гидротермальной обработки.
Определены значения тепловых эффектов дегидратации наноразмерного порошка бемита (AlOOH) с образованием γ-Al2O3 на различных этапах гидротермальной обработки, которые равны 6.2, 9.4, 10.6 кДж/моль AlOOH и ниже табличного значения (26.1 кДж/моль AlOOH), что указывает на несовершенство структуры бемита.
Выявлено снижение теплового эффекта превращения АlООН → γ-Al2O3 по сравнению с табличным значением (26.1 кДж/моль AlOOH) на 7 кДж/моль АlООН, что объясняется несовершенством структуры и размером частиц синтезированного бемита (АlООН).
Список литературы
Panasyuk G.P., Kozerozhets I.V., Semenov E.A., Azarova L.A., Belan V.N., Danchevskaya M.N. A New Method for Producing a Nanosized γ-Al2O3 Powder // J. Inorg. Chem. 2018. V. 63. № 10. P. 1303–1308. https://doi.org/10.1134/S0036023618100157
Panasyuk G.P., Kozerozhets I.V., Voroshilov I.L., Belan V.N., Semenov E.A., Luchkov I.V. The Thermodynamic Properties and Role of Water Contained in Dispersed Oxides in Precursor-Boehmite Conversion, Based on the Example of Aluminum Hydroxide and Oxide Under Hydrothermal Conditions in Different Environments // J. Phys. Chem. A. 2015. V. 89. № 4. P. 592–597. https://doi.org/10.1134/S0036024415040196
Panasyuk G.P., Belan V.N., Voroshilov I.L., Kozerozhets I.V., Luchkov I.V., Kondakov D.F., Demina L.I. The Study of Hydrargillite and Gamma-Alumina Conversion Process in Boehmite in Different Hydrothermal Media // Theor. Found. Chem. Eng. 2013. V. 47. № 4. P. 415–421. https://doi.org/10.1134/S0040579513040143
Tso C.Y., Chao Christopher Y.H. Study of Enthalpy of Evaporation, Saturated Vapor Pressure and Evaporation Rate of Aqueous Nanofluids // Int. J. Heat Mass Transfer. 2015. V. 84. P. 931–941. https://doi.org/10.1016/j.ijheatmasstransfer.2015.01.090
Panasyuk G.P., Semenov E.A., Kozerozhets I.V., Yorov Kh.E., Azarova L.A., Khol’kin A.I. A New Method of Synthesis of Nanosized Metal Oxide Powders // Dokl. Chem. 2018. V. 482 Part 1. P. 201–203. https://doi.org/10.1134/S0012500818090033
Панасюк Г.П., Семенов Е.А., Козерожец И.В., Азарова Л.А., Белан В.Н., Данчевская М.Н., Никифорова Г.Е., Ворошилов И.Л., Першиков С.А. Новый метод получения наноразмерных порошков бемита (AlOOH) с низким содержанием примесей // ДАН. 2018. Т. 483. № 1. С. 55–58.
Chang Ho, Chang Yu-Chun. Fabrication of Al2O3 Nanofluid by a Plasma Arc Nanoparticles Synthesis System // J. Mater. Proc. Technol. 2008. V. 207. № 1–3. P. 193–199. https://doi.org/10.1016/j.jmatprotec.2007.12.070
Chen Ruey-Hung, Phuoc Tran X., Martello Donald. Effects of Nanoparticles on Nanofluid Droplet Evaporation // Int. J. Heat Mass Transfer. 2010. V. 53. № 19–20. P. 3677–3682. https://doi.org/10.1016/j.ijheatmasstransfer.2010.04.006
Tso C.Y., Fu S.C., Chao Christopher Y.H. A Semi-Analytical Model for the Thermal Conductivity of Nanofluids and Determination of the Nanolayer Thickness // Int. J. Heat Mass Transfer. 2014. V. 70 P. 202–214. https://doi.org/10.1016/j.ijheatmasstransfer.2013.10.077
Sefiane K., Bennacer R. Nanofluids Droplets Evaporation Kinetics and Wetting Dynamics on Rough Heated Substrates // Adv. Colloid Interface Sci. 2009. V. 147–48. P. 263–271. https://doi.org/10.1016/j.cis.2008.09.011
Phuoc Tran X., Howard Bret H., Chyu Minking K. Synthesis and Rheological Properties of Cation-Exchanged Laponite Suspensions // Colloids Surf. A: Physicochem. Eng. Aspects. 2009. V. 351. № 1–3. P. 71–77. https://doi.org/10.1016/j.colsurfa.2009.09.039
Sefiane K., Skilling J., MacGillivray J. Contact Line Motion and Dynamic Wetting of Nanofluid Solutions // Adv. Colloid Interface Sci. 2008. V. 138. № 2. P. 101–120. https://doi.org/10.1016/j.cis.2007.12.003
Wang X.W., Xu X.F., Choi S.U.S. Thermal Conductivity of Nanoparticle-Fluid Mixture // J. Thermophys. Heat Transfer. 1999. V. 13. № 4. P. 474–480. https://doi.org/10.2514/2.6486
Prasher R., Song D., Wang J., Phelan P. Measurements of Nanofluid Viscosity and Its Implications for Thermal Applications // Appl. Phys. Lett. 2006. V. 89. № 13. 133108. https://doi.org/10.1063/1.2356113
Duangthongsuk W., Wongwises S. Measurement of Temperature-Dependent Thermal Conductivity and Viscosity of TiO2–Water Nanofluids // Exp. Therm. Fluid Sci. 2009. V. 33. № 4. P. 706–714. https://doi.org/10.1016/j.expthermflusci.2009.01.005
Lee S., Choi S.U.S., Li S.A., Eastman J.A. Measuring Thermal Conductivity of Fluids Containing Oxide Nanoparticles // J. Heat Transfer. 1999. V. 121. № 2. P. 280–289. https://doi.org/10.1115/1.2825978
Das S.K., Putra N., Thiesen P., Roetzel W. Temperature Dependence of Thermal Conductivity Enhancement for Nanofluids // J. Heat Transfer. 2003. V. 125. № 4. P. 567–574. https://doi.org/10.1115/1.1561080
Murshed S.M.S., Leong K.C., Yang C. A Combined Model for the Effective Thermal Conductivity of Nanofluids // Appl. Therm. Eng. 2009. V. 29. № 11–12. P. 2477–2483. https://doi.org/10.1016/j.applthermaleng.2008.12.018
Hisatake K., Tanaka S., Aizawa Y. Evaporation rate of water in a vessel // J. Appl. Phys. 1993. V. 73. № 11. P. 7395–7401. https://doi.org/10.1063/1.354031
Madhusoodanan M.R., Sajith V., Sobhan C.B. Experimental Investigation of Phase Change Phenomena in Nanofluids // Proc. Therm. Eng. Heat Transfer Summer Conf. 08–12 jul 2007. P. 859–863.
Barbes B., Paramo R., Blanco E., Casanova C. Thermal Conductivity and Specific Heat Capacity Measurements of CuO Nanofluids // J. Therm. Anal. Calorim. 2014. V. 115. № 2. P. 1883–1891. https://doi.org/10.1007/s10973-013-3518-0
Mostafizur R.M., Bhuiyan M.H.U., Saidur R., Abdul Aziz A.R. Thermal Conductivity Variation for Methanol Based Nanofluids // Int. J. Heat Mass Transfer. 2014. V. 76. P. 350–356. https://doi.org/10.1016/j.ijheatmasstransfer.2014.04.040
Mostafizur R.M., Abdul Aziz A.R., Saidur R., Bhuiyan M.H.U., Mahbubul I.M. Effect of Temperature and Volume Fraction on Rheology of Methanol Based Nanofluids // Int. J. Heat. Mass. Transfer. 2014. V. 77. P. 765–769. https://doi.org/10.1016/j.ijheatmasstransfer.2014.05.055
Bhuiyan M.H.U., Saidur R., Amalina M.A., Mostafizur R.M. Measurement of Latent Heat of Vaporization of Nanofluids Using Calorimetric Technique // J. Therm. Anal. Calorim. 2015. V. 122. № 3. P. 1341–1346. https://doi.org/10.1007/s10973-015-4747-1
Lippincot E.R., Stromberg R.R., Grant W.H., Cessac G.L. Polywater // Science. 1969. V. 164(3887). P. 1482–1487. https://doi.org/10.1126/science.164.3887.1482
Derjaguin B.V., Churaev N.V. Nature of “Anomalous Water” // Nature. 1973. V. 244(5416). P. 430–431. https://doi.org/10.1038/244430a0
Усов Л.В. Оценочный расчет кинетических параметров кристаллизации корунда из бемита в гидротермальных условиях // Журн. неорган. xимии. 1996. Т. 41. № 9. С. 1447–1451.
Ивакин Ю.Д., Данчевская М.Н., Овчинникова О.Г., Муравьева Г.П., Крейсберг В.А. Кинетика и механизм формирования структуры легированного корунда в водном флюиде // Сверхкритические флюиды: теория и практика. 2008. Т. 3. № 4. С. 11–34.
Panasyuk G.P., Luchkov I.V., Kozerozhets I.V., Shabalin D.G., Belan V.N. Effect of Pre-Heat Treatment and Cobalt Doping of Hydrargillite on the Kinetics of the Hydrargillite-Corundum Transformation in Supercritical Water Fluid // Inorg. Mater. 2013. V. 49. № 9. P. 899–903. https://doi.org/10.1134/S0020168513090136
Madarasz J., Pocol G., Novak C., Cobos F.T., Gal S. Studies on Isothermal Kinetics of Some Reactions of Aluminum Oxides and Hydroxides // J. Therm. Anal. 1992. V. 38. P. 445–454. https://doi.org/10.1007/BF01915509
Ривкин С.Л., Александров А.А. Теплофизические свойства воды и водяного пара. М.: Энергия, 1980. 424 с.
Bokhimi X., Toledo-Antonio J.A., Guzman-Castillo M.L., Mar-Mar B., Hernandez-Beltran F., Navarrete J. Dependence of Boehmite Thermal Evolution on Its Atom Bond Lengths and Crystallite Size // J. Solid State Chem. 2001. V. 161. P. 319–326. https://doi.org/10.1006/jssc.2001.9320
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


