Неорганические материалы, 2020, T. 56, № 1, стр. 87-95
Синтез сегнетоэлектрика титаната натрия-висмута в гидротермальных условиях
Е. А. Решетникова 1, *, И. В. Лисневская 1, А. И. Терехин 1
1 Южный федеральный университет
344090 Ростов-на-Дону, ул. Зорге, 7, Россия
* E-mail: brightc@yandex.ru
Поступила в редакцию 09.12.2018
После доработки 25.04.2019
Принята к публикации 06.06.2019
Аннотация
Исследовано фазобразование в ходе синтеза титаната натрия-висмута (Na0.5Bi0.5TiO3, NBT) в гидротермальных условиях при температуре 230°С в течение 24 и 48 ч из оксида титана, гидроксида висмута, взятых в стехиометрических количествах, и раствора NaOH в диапазоне концентраций от 5 до 30 М. Обнаружено, что при концентрациях NaOH ≤ 10 М реагенты практически не взаимодействуют между собой; в концентрационном интервале NaOH 10–15 М в системе образуются двухфазные продукты, содержащие наряду с перовскитоподобной фазой титанат висмута Bi12TiO20. Однофазные продукты со структурой перовскита образуются в концентрационном интервале NaOH 18–20 М, но их состав сильно отклоняется от стехиометрического (Na0.61–0.69Bi0.39–0.31TiO2.89–2.81δ0.11–0.19, где δ – вакансии в кислородной подрешетке). В диапазоне концентраций NaOH 22–30 М происходит сначала частичный, а затем и полный переход Bi3+ в раствор. Увеличение времени синтеза благоприятствует стабилизации фазы перовскита. Однофазная керамика BNT имеет удельное электрическое сопротивление 1.3 × 109 Ом см, диэлектрическую проницаемость ε/ε0 = 360, тангенс угла диэлектрических потерь tgδ = 0.15, продольный коэффициент электромеханической связи Kр = 0.068, пьезомодули ‒d31 = 6.7 и d33 = 9 пКл/Н, пьезочувствительности –g31 = 2.07 и g33 = 2.84 мВ м/Н. Невысокие значения пьезопараметров, очевидно, связаны с дефектностью полученных фаз.
ВВЕДЕНИЕ
Среди пьезоэлектрических материалов, находящих широкое применение в целом ряде областей, таких как контроль промышленных процессов, системы производства полупроводников, бытовые электрические приборы, медицинские инструменты, системы контроля связи, различные измерительные приборы и др., безусловным лидером является пьезокерамика на основе цирконата-титаната свинца. Однако усиление ограничений и запретов на использование устройств, содержащих токсичные соединения свинца, вызывает необходимость фокусироваться на бессвинцовых пьезоматериалах. Их важнейшими представителями, которые интенсивно исследуется в настоящее время, являются ниобаты щелочных металлов, титанат-цирконат бария-кальция, а также титанат натрия-висмута.
Титанат натрия-висмута (Na0.5Bi0.5TiO3, NBT) впервые описан в 60-х годах ХХ века [1]. Bi0.5Na0.5TiO3 является релаксорным сегнетоэлектриком и имеет высокую точку Кюри tС = 320°С, ниже которой осуществляется переход из параэлектрической кубической фазы со структурой перовскита в полярную тетрагональную, а при 260°С – в полярную ромбоэдрическую (а = 3.891 Å, α = 89°3′). Несмотря на то что катионы натрия и висмута имеют разные заряды, они статистически размещены в позициях А, упорядочения не наблюдается. В чистом виде керамика BNT обладает высокой коэрцитивной силой (Ес = 73 кВ/см), низким пьезомодулем (d33 = 57–64 пКл/Н) и относительно большой проводимостью [2, 3], поэтому ее трудно наполяризовать. Вероятно, проблема заключается в том, что титанат натрия-висмута и твердые растворы на его основе получают преимущественно традиционным высокотемпературным твердофазным способом, что вызывает высокую летучесть соединений натрия и висмута, а значит, и нарушение стехиометрического состава образцов, что оказывает существенное влияние на электрические свойства керамики. Таким образом, актуальной задачей является разработка низкотемпературных методов получения BNT.
Интерес могут представлять различные гель-методы, топохимический подход, а также синтез Bi0.5Na0.5TiO3 в гидротермальных условиях. В случае BNT гидротермальный синтез может обладать целым рядом преимуществ. Как известно [4], метод основан на способности воды и водных растворов растворять при относительно невысоких температурах (до 500°С), но высоком давлении (3–80 МПа, иногда до 300 МПа) вещества, практически не растворимые в обычных условиях. Низкие температуры проведения реакций могут предотвратить проблемы, связанные со стехиометрией и появлением различного рода дефектов, что особенно важно при получении титаната натрия-висмута. Кроме того, к неоспоримым преимуществам метода можно отнести простоту эксперимента, высокую дисперсность получаемых порошков и высокую скорость реакции. Гидротермальный метод более экологичен и экономичен, чем многие другие методы синтеза, что связано в первую очередь с относительно низким энергопотреблением.
Основными параметрами гидротермального синтеза, определяющими как кинетику протекающих процессов, так и состав и свойства образующихся продуктов, являются начальное значение pH среды, продолжительность и температура синтеза, величина давления в системе. Анализ данных [5–11] показывает, что в случае Na0.5Bi0.5TiO3 перечисленные факторы играют существенную роль. Как правило, при синтезе BNT в гидротермальных условиях в качестве прекурсоров используют кристаллогидрат нитрата висмута Bi(NO3)3 ⋅ 5H2O, тетрабутоксититан Ti(OС4H9)4 [5, 7, 8, 10], реже – другие соединения титана (сульфат [6], хлорид [9], оксид [11]), кроме того, во всех случаях в систему вводят гидроксид натрия, который является не только поставщиком катионов Na+, но и минерализатором, позволяющим регулировать pH раствора; иногда помимо NaOH вводят растворимые соли натрия – карбонат [7] или нитрат [10].
Одним из основных критериев стабилизации синтезируемой фазы является щелочность среды, повышение которой также способствует улучшению окристаллизованности целевого продукта. Судя по литературным данным, порошки BNT с различной морфологией – от сферических [7] и кубических [5, 9, 10] частиц до нанопроволок [7, 9, 10] и иерархических микро/наноструктур [8] – образуются в довольно широком диапазоне концентраций щелочи: от 0.01–5 М [6, 7] до 10–12 М [9, 10] при температурах 160–220°С, однако они часто загрязнены примесными фазами. Так, в работах [5, 9] отмечается, что NBT образуется уже начиная с концентрации щелочи 2 М, при этом имеются признаки присутствия посторонних фаз, состав которых не обсуждается. Также, по данным [5], в образцах, полученных из растворов с концентрацией щелочи 14 М, содержится примесная фаза желтого цвета со структурой силленита, но авторы не приводят ее состав. В работе [10] показано, что чистая фаза BNT может быть получена при 120–170°С, при этом увеличение времени синтеза благоприятным образом сказывается на стабилизации целевой фазы, но, когда температура повышается до 180°С, на дифрактограммах продукта появляется посторонний рефлекс, который авторы приписывают слоистому перовскиту Bi4Ti3O12, однако другие характерные рефлексы этой фазы на приведенных в работе дифрактограммах не просматриваются, поэтому данная интерпретация выглядит неубедительно. В работе [11] целевая фаза образуется при концентрации NaOH 5 М, но она сильно загрязнена непрореагировавшими реагентами и побочной фазой состава Bi4Ti3O12. При концентрации NaOH 8 М образуется BNT, загрязненный примесной фазой, которую авторы определяют как Na0.5Bi4.5TiO15. При концентрациях выше 8 М формируется чистая фаза Na0.5Bi0.5TiO3, но увеличение концентрации NaOH более 20 М снова приводит к появлению посторонних фаз – TiO2, Bi2O3, Bi4Ti3O12. К сожалению, дифракционные данные [11] не позволяют тщательно проанализировать данную информацию, в частности, на дифрактограмме образца, полученного из 8 М раствора, примесная фаза представлена лишь одним весьма размытым пиком, по которому трудно сказать что-либо определенное о ее составе.
В большинстве обсуждаемых работ фаза BNT получена из систем, в которых исходное соотношение Bi : Ti составляет 0.5 : 1, т.е. совпадает с стехиометрическим, а содержание натрия многократно превышает таковое, что очевидно исходя из условий проведения гидротермального синтеза. При этом исходя из немногочисленных данных, содержащих информацию об элементном составе образцов, в итоговых продуктах соотношение Bi : Na : Ti несколько нарушается. Так, в титанате натрия-висмута, полученном в работе [5], содержание Bi и Na в расчете на 1 моль Ti составляет 0.51 и 0.42 моль соответственно. В работе [7] получен BNT с содержанием Na и Bi соответственно 0.31–0.33 и 0.42–0.45 моля (на 1 моль Ti). Авторам [11], как и [5], удалось получить фазу BNT с относительно небольшими отклонениями от стехиометрии (соотношение Bi : Na : Ti составляет 0.53 : 0.43 : 1), однако приведенные в работе количественные данные по содержанию кислорода в образцах некорректны. В большинстве же обсуждаемых работ данные об элементном составе продуктов синтеза отсутствуют.
Между тем существуют сведения о том, что отклонение титаната натрия-висмута от стехиометрического состава кардинальным образом влияет на электрические свойства данного материала и, как следствие, определяет эффективность его электрической поляризации. Так, в работе [12] сообщается о том, что даже небольшая нестехиометрия по натрию (±2 ат. %) приводит к резким изменениям величины и механизма проводимости BNT. Образцы с избыточным содержанием натрия демонстрируют высокий уровень проводимости ~2.2 мкСм/см (при 600°C) с энергией активации Ea < 1 эВ, тогда как Na-дефицитные составы являются диэлектриками с собственной электронной проводимостью ~1.6 мкСм/см (при 600°C) и Ea ~ 1.7 эВ. Таким образом, объемные электрические свойства NBT весьма чувствительны даже к небольшим отклонениям от стехиометрии в А-позициях, поэтому необходима разработка более точных химико-технологических регламентов, обеспечивающих получение керамики BNT строго заданного состава.
Целью настоящей работы является исследование фазообразования в ходе синтеза титаната натрия-висмута в гидротермальных условиях и выявление концентрационных и временных параметров, способствующих формированию BNT в виде однофазного продукта.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве исходных реагентов для синтеза Na0.5Bi0.5TiO3 использовались Bi2O3 (“ч. д. а.”), TiO2 (“ч. д. а.”), NaOH (“ч. д. а.”), а также концентрированная азотная кислота. Синтез проводили в толстостенном реакторе из нержавеющей стали, снабженном тефлоновой капсулой. Навеску оксида висмута растворяли в минимальном количестве азотной кислоты, раствор переносили в тефлоновую капсулу, добавляли стехиометрическое количество оксида титана и раствор NaOH заданной концентрации (5–30 М), содержание Na+ в котором в 9–50 раз превышало стехиометрическое значение. Загрузка автоклава составляла 60–80% от общего объема. Гидротермальный синтез проводи при температуре 230°С в течение 24 и 48 ч под давлением 3 МПа.
Состав продуктов синтеза контролировали методом рентгенофазового анализа (РФА) с помощью рентгеновского дифрактометра ARL X’TRA (CuKα-излучение). С целью определения средних размеров частиц и расчета параметров элементарных ячеек однофазных перовскитоподобных продуктов проводили съемку порошков BNT в смеси с крупнокристаллическим Al2O3 в качестве эталона и далее вели расчет размеров областей когерентного рассеяния по формуле Дебая–Шеррера в соответствии со стандартной методикой [13], а также проводили уточнение параметров ромбоэдрически искаженной структуры перовскита при помощи компьютерной программы CELREF [14].
Количественный элементный состав полученных порошков определяли методом рентгенофлуоресцентного анализа (РФлА) на двумерном микрорентгенофлуоресцентном спектрометре Bruker M4 Tornado (Germany) с пространственным разрешением до 25 мкм.
Из однофазных порошков BNT методом горячего прессования спекали керамические образцы при температуре 1000°С и давлении 60 МПа в течение 1 ч. После механической обработки и нанесения электродов вжиганием серебросодержащей пасты образцы поляризовали в среде хлороформа полем 2–3 кВ/мм в импульсном режиме в течение 2–3 мин.
Электрофизические свойства образцов измеряли и рассчитывали в соответствии с ГОСТ-12370-80. Измерения электрического сопротивления на постоянном токе проводили при помощи тераомметра Е6-13А. Электрическую емкость и тангенс угла диэлектрических потерь измеряли при помощи компьютеризированного измерительного комплекса “Цензурка М”. Резонансные характеристики изучали при помощи прибора для исследования амплитудно-частотных характеристик АЧХ1-48.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 приведены данные порошковой дифракции продуктов, полученных в гидротермальных условиях из растворов NaOH с концентрациями 5–30 М. Установлено, что когда концентрации гидроксида натрия невелики, ≤10 М (рис. 1, дифрактограммы 1, 2), фаза со структурой перовскита в системе вообще не образуется, а полученные продукты представляют собой смесь не вступивших в реакцию реагентов – оксидов титана и висмута (для удобства сопоставления дифрактограммы Bi2O3 и TiO2, заимствованные из базы данных ISDD, также приведены на рис. 1). Кроме рефлексов, соответствующих этим фазам, можно заметить пики при углах 2θ ≈ 24.6°, 30.4°, 32.8°, 41.5°, которые могут быть отнесены к соединению Bi12TiO20 со структурой силленита (его рентгеновский профиль из базы данных ISDD также приводится на рис. 1).
Рис. 1.
Порошковые дифрактограммы продуктов гидротермального синтеза BNT, полученных из растворов с различной концентрацией NaOH при 230°С, 24 ч: 1 – 5 М, 2 – 10 М, 3 – 15 М, 4 – 18 М, 5 – 20 М, 6 – 22 М, 7 – 25 М, 8 – 30 М.
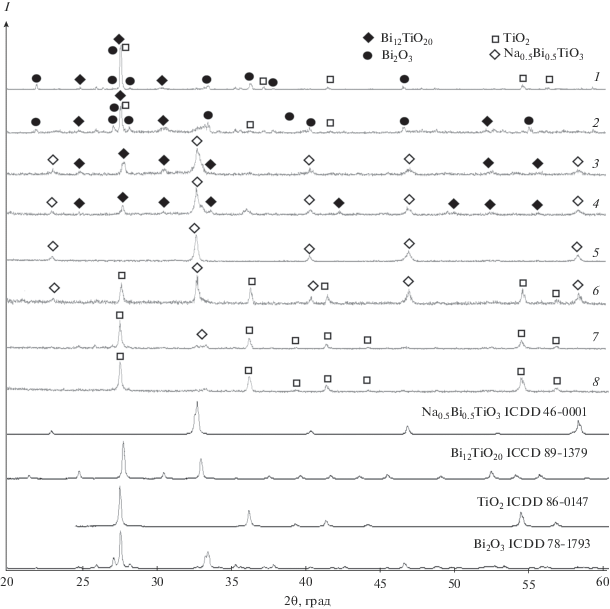
В диапазоне концентраций NaOH 15–18 М (рис. 1, дифрактограммы 3, 4) в системе формируется фаза со структурой перовскита, но продукты по‑прежнему не являются однофазными, что подтверждается наличием посторонних рефлексов, соответствующих титанату висмута Bi12TiO20. С ростом концентрации щелочи их интенсивность заметно уменьшается, и дифракционная картина продукта, соответствующего концентрации щелочи 20 М, представляет собой исключительно набор пиков чистой фазы NBT со структурой перовскита. Обращает на себя внимание тот факт, что рефлексы данной фазы не имеют расщеплений, характерных для ромбоэдрического искажения элементарной ячейки перовскита, что может быть связано с наноразмерным состоянием полученного порошка, средний размер частиц которого, оцененный по формуле Дебая–Шеррера, составляет ~60 нм.
Таким образом, увеличение рН среды способствует вступлению в реакцию оксида титана, подавляет образование титаната висмута Bi12TiO20 и приводит к смещению равновесий в системе в сторону формирования искомой фазы, как это и следует из суммарного уравнения процесса:
(1)
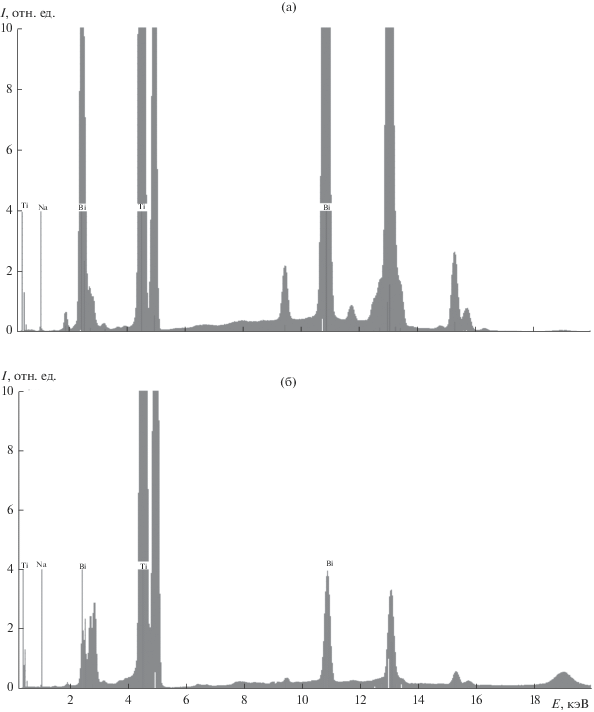
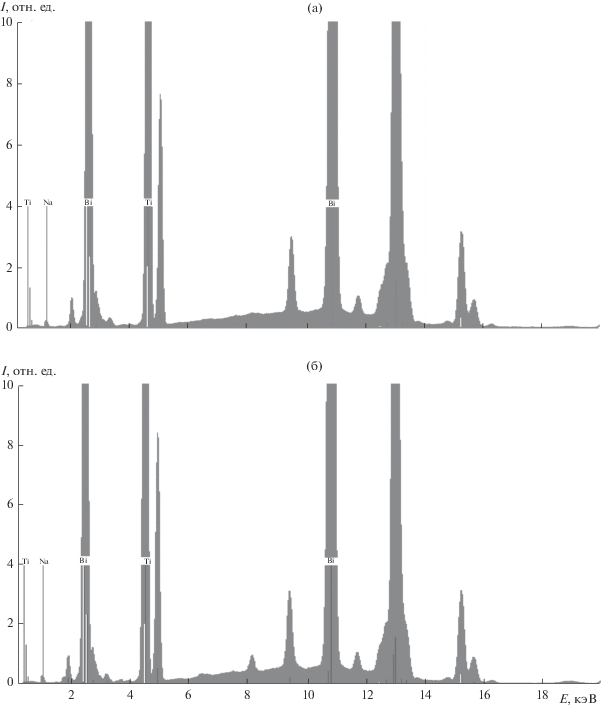
$\begin{gathered} \frac{1}{4}{\text{B}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} \cdot x{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{Ti}}{{{\text{O}}}_{{\text{2}}}} + \frac{1}{2}{\text{N}}{{{\text{a}}}^{ + }}~ + \\ + \,\,{\text{ }}\frac{1}{2}{\text{O}}{{{\text{H}}}^{ - }}~ \Leftrightarrow ... \Leftrightarrow {\text{N}}{{{\text{a}}}_{{0.{\text{5}}}}}{\text{B}}{{{\text{i}}}_{{0.{\text{5}}}}}{\text{Ti}}{{{\text{O}}}_{{\text{3}}}} + \frac{1}{4}\left( {x + {\text{1}}} \right){{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Дальнейшее, причем даже незначительное, увеличение щелочности среды (до 21–22 М) приводит к тому, что на дифрактограммах вновь появляются рефлексы, соответствующие оксиду титана (рис. 1, дифрактограммы 5–7), интенсивность которых по мере повышения рН возрастает, в то время как интенсивность рефлексов фазы со структурой перовскита уменьшается вплоть до того, что в растворе с концентрацией 30 М NaOH фаза перовскита вообще не образуется (рис. 1, дифрактограммa 8), а твердый продукт синтеза представляет собой чистый оксид титана со структурой рутила. Это подтверждается результатами РФлА (рис. 2 и табл. 1), согласно которым в составе продукта, полученного из 25 М раствора, содержание висмута ничтожно мало, а продукт, полученный из 30 М раствора NaOH, практически не содержит в своем составе висмута. Таким образом, можно заключить, что повышение щелочности среды в диапазоне концентраций NaOH 21–30 М приводит сначала к частичному, а затем и полному переходу висмута в раствор согласно уравнению реакции
(2)
$\begin{gathered} \frac{1}{2}{\text{B}}{{{\text{i}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} \cdot x{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{3O}}{{{\text{H}}}^{ - }}~ \Leftrightarrow {{\left[ {{\text{Bi}}{{{\left( {{\text{OH}}} \right)}}_{{\text{6}}}}} \right]}^{{{\text{3}} - }}} + \\ + \,\,\frac{1}{2}(x - {\text{3}}){{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Таблица 1.
Элементный состав (в ат. долях в пересчете на 1 ат. долю Ti) твердых продуктов гидротермального синтеза при температуре 230°С, полученных из растворов с различной концентрацией гидроксида натрия (по данным РФлА)
| NaOH, моль/л | 18 | 20 | 22 | 25 | 30 |
| Время, ч | 48 | 48 | 48 | 24 | 24 |
| Na | 0.73 | 0.83 | 1.07 | 0.21 | 0.0016 |
| Bi | 0.39 | 0.31 | 0.22 | 0.14 | 0.008 |
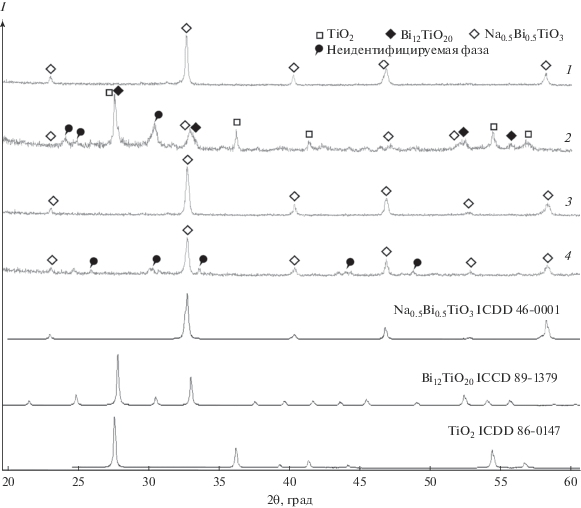
Увеличение продолжительности синтеза до 48 ч приводит к тому, что не только из раствора с концентрацией щелочи 20 М, но и из 18 М раствора NaOH образуется однофазный продукт со структурой перовскита, что подтверждается результатами РФА (рис. 3, дифрактограмма 1). Для системы с 22 М раствором NaOH, как можно видеть из дифрактограммы 2 (рис. 3), в результате 48-часовой выдержки интенсивность рефлексов перовскита возрастает, однако на дифрактограммах пики TiO2 по-прежнему доминируют, а также отчетливо видны рефлексы Bi12TiO20. Все это говорит о невысокой скорости установления равновесий в рассматриваемых системах (что может быть прежде всего связано с малой реакционной способностью оксида титана), а также о том, что увеличение времени выдержки систем в гидротермальных условиях способствует смещению равновесия (1) в сторону образования целевого продукта.
Рис. 3.
Порошковые дифрактограммы продуктов гидротермального синтеза BNT, полученных из растворов с концентрацией 18 М (1) и 22 М (2) NaOH при 230°С в течение 48 ч, и керамики BNT, полученной методом горячего прессования из прекурсорных фаз, синтезированных в гидротермальных условиях из растворов с концентрацией щелочи 18 М (3) и 20 М (4).
С целью определения состава однофазных продуктов со структурой перовскита, полученных из 18 и 20 М растворов NaOH, был проведен их элементный анализ, результаты которого приведены в табл. 1, а на рис. 4 представлены спектры РФлА указанных образцов. Можно видеть, что в обоих случаях состав перовскитоподобных фаз сильно отклоняется от стехиометрического, соответствующего формуле Na0.5Bi0.5TiO3. Во-первых, соотношение Bi : Ti заметно меньше, чем 0.5 : 1, а это означает, что и при концентрациях NaOH 18–20 М часть висмута переходит в раствор согласно уравнению (2); во-вторых, соотношение Na : Ti, напротив, заметно больше, чем 0.5 : 1, и оно растет с увеличением концентрации щелочи. Таким образом, состав перовскитоподобных продуктов, полученных из 18 и 20 М растворов NaOH, может быть описан соответственно формулами Na0.61Bi0.39TiO2.89δ0.11 и Na0.69Bi0.31TiO2.81δ0.19 (где δ – вакансии в кислородной подрешетке), при этом избыточный натрий в количествах 0.12 и 0.14 ат. долей, по-видимому, распределяется по границам зерен.
Итак, в случае титаната натрия-висмута применение гидротермального синтеза хотя и позволяет получать материалы со структурой перовскита в узком интервале рН, однако получение продукта стехиометрического состава затруднено, как и при синтезе BNT твердофазным способом. В последнем случае отклонения от стехиометрии возникают вследствие летучести соединений натрия и висмута в процессе высокотемпературного обжига, а в гидротермальных условиях они обусловлены прежде всего ненулевой растворимостью гидроксида висмута в щелочных растворах при повышенных давлениях.
Из полученных порошков методом горячего прессования были изготовлены керамические образцы, однако, по данным РФА (рис. 3, дифрактограммы 3, 4), образец, синтезированный из 20 М раствора NaOH, оказался загрязнен небольшим количеством примесных фаз (которые в связи с малой интенсивностью рефлексов трудно идентифицировать), а однофазной оказалась лишь керамика из порошка, изготовленного из 18 М раствора NaOH. На дифрактограмме 4 данного образца (рис. 3) просматриваются характерные расщепления рефлексов, свидетельствующие о ромбоэдрическом искажении элементарной ячейки перовскита с параметрами а = 3.893(7) Å, α = 89.60(7)°.
Керамика имела плотность 5.61 г/см3, удельное электрическое сопротивление R = 1.3 × 109 Ом см, диэлектрическую проницаемость ε/ε0 = 360, тангенс угла диэлектрических потерь tgδ = 0.15. Пьезоэлектрические характеристики оказались невелики, что, очевидно, связано с дефектностью полученного продукта: продольный коэффициент электромеханической связи Kр = 0.068, пьезомодули –d31 = 6.7 и d33 = 9 пКл/Н, пьезочувствительности –g31 = 2.07 и g33 = 2.84 мВ м/Н.
ЗАКЛЮЧЕНИЕ
Изучены процессы фазообразования в ходе синтеза титаната натрия‑висмута в гидротермальных условиях при температуре 230°С в течение 24 и 48 ч из оксида титана, гидроксида висмута, взятых в стехиометрических количествах, и раствора NaOH в концентрационном диапазоне 5–30 М. Показано, что при концентрациях гидроксида натрия ≤10 М реагенты практически не взаимодействуют между собой; в интервале концентраций 10–15 М в системе образуются двухфазные продукты, содержащие наряду с перовскитоподобной фазой титанат висмута Bi12TiO20; однофазные продукты со структурой перовскита образуются при концентрации NaOH 18–20 М, однако их состав сильно отклоняется от стехиометрического и соответствует формулам Na0.61Bi0.39TiO2.89δ0.11 и Na0.69Bi0.31TiO2.81δ0.19 (где δ – вакансии в кислородной подрешетке). В 22–30 М растворах NaOH происходит сначала частичный, а затем и полный переход Bi3+ в раствор, так что при концентрации NaOH 30 М твердые продукты представляют собой чистый TiO2. Однофазные керамические образцы, полученные методом горячего прессования, обладают относительно невысоким удельным электрическим сопротивлением и слабыми пьезосвойствами, что предположительно связано с дефектностью полученных фаз.
Список литературы
Смоленский Г.А., Исупов В.А., Аграновская А.И., Крайник Н.Н. Новые сегнетоэлектрики сложного состава // ФТТ. 1960. Т. 2. С. 2982–2985.
Смоленский Г.А., Боков В.А., Исупов В.А., Крайник Н.Н., Пасынков Р.Е., Шур М.С. Сегнетоэлектрики и антисегнетоэлектрики. Л.: Наука, 1971. 476 с.
Веневцев Ю.Н., Политова Е.Д., Иванов С.А. Сегнето- и антисегнетоэлектрики семейства титаната бария. М.: Химия, 1985. 256 с.
Aqueous Systems at Elevated Temperatures and Pressures: Physical Chemistry in Water, Steam and Hydrothermal Solutions / Eds. Fernandez–Prini R. et al. Academic Press, 2004. P. 747.
Jing X., Li Y., Yin Q. Hydrothermal Synthesis of Na0.5Bi0.5TiO3 Fine Powders // Mat. Sci. Eng. B. 2003. V. 99. P. 506–510.
Wang Y., Xu G., Yang L., Ren Z., Wei X., Weng W., Du P., Shen G., Han G. Hydrothermal Synthesis and Characterization of Na0.5Bi0.5TiO3 Microcubes // Ceram. Int. 2009. V. 35. P. 1657–1659.
Liu Y., Lu Y., Dai S. Hydrothermal Synthesis of Monosized Bi0.5Na0.5TiO3 Spherical Particles under Low Alkaline Solution Concentration // J. Alloy Compd. 2009. V. 484. P. 801–805.
Li J., Wang G., Wang H., Tang C., Wang Y., Liang C., Cai W., Zhang L. In situ Self-Assembly Synthesis and Photocatalytic Performance of Hierarchical Bi0.5Na0.5TiO3 micro/nanostructures // J. Mater. Chem. 2009. V. 19. P. 2253–2258.
Lu T., Dai J., Tian J., Song W., Liu X., Lai L., Chu H., Huang X., Liu X. Synthesis of Na0.5Bi0.5TiO3 Powders through Hydrothermal Method // J. Alloy Compd. 2010. V. 490. P. 232–235.
Jiang X., Lin M., Tu N., Chen C., Zhou S., Zhan H. Simple Hydrothermal Synthesis and Sintering of Na0.5Bi0.5TiO3 Nanowires // J. Alloy Compd. 2011. V. 509. P. 9346–9350.
Zhang H., Zhu M., Hou Y., Wang R., Yan H. Structural Modulation of Na0.5Bi0.5TiO3 in Hydrothermal Synthesis // Int. J. Appl. Ceram. Technol. 2016. V. 13. № 3. P. 569–578.
Li M., Zhang H., Cook S.N. et al. Dramatic Influence of A-Site Nonstoichiometry on the Electrical Conductivity and Conduction Mechanisms in the Perovskite Oxide Na0.5Bi0.5TiO3 // Chem. Mater. 2015. V. 27. № 2. P. 629–634.
Ковба Л.М., Трунов В.К. Рентгенофазовый анализ. М.: Изд-во МГУ, 1976. 160 с.
Laugier J., Bochu B. Программа уточнения параметров CELREF3. www.ccp14.ac.uk/ccp/web mirrors/ lmgp laugier bochu/
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы