Неорганические материалы, 2020, T. 56, № 11, стр. 1199-1207
Хемосорбция кислорода на поверхности нанокристалла In2O3 (011)
К. С. Курмангалеев 1, *, Т. Ю. Михайлова 2, Л. И. Трахтенберг 1, 3
1 Федеральный исследовательский центр химической физики им. Н.Н. Семенова
119991 Москва, ул. Косыгина, 4, Россия
2 Институт общей и неорганической химии им. Н.С. Курнакова Российской академии наук
119991 Москва, Ленинский пр., 31, Россия
3 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1–3, Россия
* E-mail: f7033@mail.ru
Поступила в редакцию 08.05.2020
После доработки 22.06.2020
Принята к публикации 25.06.2020
Аннотация
В рамках теории функционала плотности исследованы структурные и электронные свойства стехиометрической и дефектной поверхности In2O3 (011). Рассчитаны энергии образования нейтральных кислородных вакансий на поверхности нанокристалла. Проведен анализ адсорбции атома кислорода в основном (триплетном) состоянии на модельную дефектную поверхность с вакансией О4 в различных зарядовых состояниях. Показано, что наиболее энергетически выгодной оказывается адсорбция на вакансию $V_{{\text{O}}}^{{2 + }},$ при этом атом кислорода меняет триплетное состояние на синглетное. Изучена адсорбция молекулы кислорода из различных исходных геометрических конфигураций на нейтральные вакансии О1-6.
ВВЕДЕНИЕ
Область применения наноматериалов на основе оксида индия достаточно широка: солнечные ячейки [1], кондуктометрические сенсоры [2, 3], оптоэлектроника [4]. Как известно, использование материалов, состоящих из элементов наноразмерной величины, приводит к заметному увеличению роли удельной поверхности. Знание структуры и химии поверхности является основой для исследования влияния этих характеристик на эксплуатационные свойства различных оксидов.
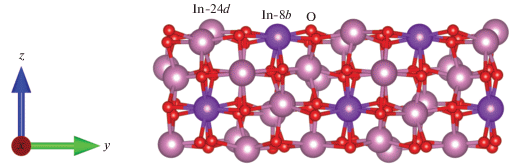
Адсорбция атомов и молекул, в частности кислорода, является первой стадией многих химических процессов. Поэтому для их исследования весьма важным становится изучение энергетических характеристик адсорбции частиц на стехиометрической или дефектной поверхности. Рассмотрим процессы адсорбции различных форм кислорода на наноструктурированной поверхности индия, которая во многих случаях интересна с практической точки зрения. Согласно данным рентгеноструктурного анализа, наночастицы оксида индия имеют кубическую структуру типа биксбиита (пр. гр. Ia$\bar {3},$ 206) [5]. Данная структура имеет два неэквивалентных атома индия: In-8b (1/4, 1/4, 1/4) и In-24d (u, 0, 1/4) по Вайкоффу, а также один атом кислорода с позицией по Вайкоффу O-48e (x, y, z), которые, согласно элементам симметрии пр. гр. Ia$\bar {3},$ образуют 80 атомов в одной элементарной ячейке [6]. Простые усечения такой структуры дают разнообразные кристаллографические плоскости, которые являются границами зерен [7, 8]. Эти плоскости характеризуются определенной концентрацией и конфигурацией поверхностных атомов, и каждой из них присущи свои особенности, связанные с электронным строением, каталитическими и адсорбционными свойствами.
Согласно расчетам поверхностной энергии [9], термодинамическая устойчивость кристаллографических плоскостей оксида индия убывает в следующей последовательности: (111) > (011) > > (211) > (001). Аналогичная последовательность (111) > (110) > (100) была установлена методами теории функционала плотности для других кристаллографических плоскостей кубического оксида индия [10].
Квантово-химическое исследование из первых принципов адсорбции молекулы кислорода на поверхности In2O3 (100) [11] (может оканчиваться либо плоскостью, в которой находятся лишь атомы кислорода (кислородная грань), либо плоскостью только с атомами индия (металлическая грань)) показало, что хемосорбция молекул кислорода не приводит к значительной поверхностной реконструкции. На металлической поверхности не наблюдается диссоциативная хемосорбция. Энергия адсорбции молекулы кислорода меняется в относительно малом диапазоне в зависимости от количества молекул на поверхности до тех пор, пока поверхность не становится полностью идентичной поверхности (100) с кислородной гранью.
Исследования адсорбции O2 на самой термодинамически устойчивой поверхности (111), которая является неполярной и получается простым сечением объемной решетки, показали, что она химически инертна к кислороду, т.е. молекула кислорода не образует устойчивых структур с данной поверхностью [9]. Однако при адсорбции на поверхностную кислородную вакансию выделяется энергия порядка 2.37 эВ и молекула образует адсорбат в виде ${\text{O}}_{2}^{{2 - }}$ [12].
Общей чертой всех предыдущих исследований поверхности для прозрачных проводящих оксидов является то, что молекула кислорода адсорбировалась либо на стехиометрическую поверхность, либо на поверхность с нейтральной вакансией. Вместе с тем, важны и заряженные состояния поверхностных вакансий, для которых также можно рассчитать энергии адсорбции частиц.
В данной работе представлены результаты моделирования адсорбции атомарной и молекулярной форм кислорода на стехиометрическую и дефектную поверхность (011) с кислородной вакансией в различных зарядовых состояниях. Поверхность (011) выбрана нами в качестве объекта исследования, поскольку она является одной из наиболее устойчивых поверхностей кубического оксида индия и ранее адсорбция кислорода на такую поверхность с дефектами не рассматривалась.
МОДЕЛЬ И МЕТОД
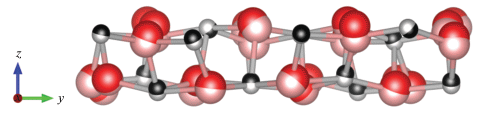
Поверхность (011) оксида индия по классификации Таскера [13] относится к первому типу со стехиометрическим расположением анионов и катионов в одном атомном слое. Эта поверхность может быть двух типов: либо плоскость, содержащая только катионы In-24d и анионы кислорода, либо плоскость, в которой наряду с анионами кислорода имеются катионы как In-24d, так и In-8b. В дальнейшем будем обозначать их (011)-d и (011)-b соответственно. Их различие хорошо видно на рис. 1.
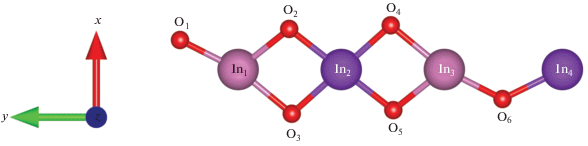
Верхний слой поверхности In2O3 (011)-b состоит из цепочек атомов индия и кислорода, элементарная повторяющаяся единица которой изображена на рис. 2.
Поскольку на границе кристалла нарушается периодичность, с очевидностью возникают ненасыщенные связи. Так, все атомы кислорода в цепочке O1-6 имеют в координационной сфере три ближайших соседа, тогда как внутри объема атом кислорода имеет координационное число, равное 4. Атомы индия – (In3, In4) и (In1, In2) – имеют координационные числа 4 и 5 соответственно, тогда как катион индия в объеме кристалла характеризуется координационным числом, равным 6. То же самое справедливо и для другой поверхности In2O3 – (011)-d (рис. 3).
Наши расчеты базируются на теории функционала плотности с использованием базиса плоских волн и выполнены с использованием кода самосогласованного расчета, встроенного в пакет Quantum Espresso [14]. Метод проекционных присоединенных волн (PAW-method) [15] применяется для описания взаимодействия между ионами и электронами. Обменно-корреляционная энергия оценивалась с использованием PBE-функционала [16]. Все результаты получены при T = 0 K. В расчетах используется модель плоской пластины, которая очевидно применима и при рассмотрении поверхности наночастицы. Выбор модели оправдан достаточно малым размером адсорбируемых частиц относительно размера наночастицы (d ~ 30–50 нм). Так как кривизна поверхности крупной наночастицы относительно мала, область, на которой протекает реакция, можно считать плоской.
Поверхность In2O3 (011) моделируется в виде плоской пластины объемом 10.1171 × 14.3077 × × 25.9428 Å3, которая состоит из 32 катионов индия и 48 анионов кислорода, составляющих четыре чередующихся слоя. На нее налагаются периодические граничные условия с вакуумным промежутком порядка 12 Å перпендикулярно этой поверхности, чтобы предотвратить эффективное взаимодействие между периодическими изображениями.
Энергия обрезки плоских волн, определяющая размер плосковолнового базисного набора, используемого для разложения псевдоволновой функции, составляла 680 эВ. Во всех проведенных расчетах использовалась схема k-сетки [17] и выбиралась плоская сетка с размерами 6 × 6 × 1. Все процессы оптимизации, т.е. поиска минимума энергии системы, проводились с помощью алгоритма Бройдена–Флетчера–Гольдфарба–Шанно, встроенного в Quantum Espresso, до тех пор, пока силы, действующие на ионы, не становились <0.03 эВ/Å.
Стандартная энтальпия образования оксида индия
(1)
$\Delta H_{f}^{0}({\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}) = \mu _{{{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}^{{bulk}} - 2\mu _{{{\text{In}}}}^{{{\text{In}}\,met}} - 3\mu _{{\text{O}}}^{{{{{\text{O}}}_{{\text{2}}}}}},$Для объемного оксида индия химический потенциал является постоянной величиной, определяемой выражением
(2)
$\mu _{{{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}^{{bulk}} = 2\mu _{{{\text{In}}}}^{{{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}} + 3\mu _{{\text{O}}}^{{{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}}.$Далее введем две переменные соответствующих химических элементов по отношению к их стандартным состояниям:
(3)
$\Delta {{\mu }_{{{\text{In}}}}} = \mu _{{{\text{In}}}}^{{{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}} - \mu _{{{\text{In}}}}^{{{\text{In}}\,met}}.$(4)
$\Delta {{\mu }_{{\text{O}}}} = \mu _{{\text{O}}}^{{{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}}} - \mu _{{\text{O}}}^{{{{{\text{O}}}_{2}}}}.$Необходимо отметить, что величины ΔμIn и ΔμO должны быть отрицательными, иначе кристаллический оксид индия распался бы на составные части. Энтальпия образования In2O3 имеет следующий вид:
(5)
$\Delta H_{f}^{0}({\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{3}}) = 2\Delta {{\mu }_{{{\text{In}}}}} + 3\Delta {{\mu }_{{\text{O}}}}.$Это дает доступный диапазон значений для химических потенциалов ΔμIn и ΔμO:
(6)
$\frac{1}{2}\Delta H_{f}^{0}({\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{3}}) < \Delta {{\mu }_{{{\text{In}}}}} < 0,$(7)
$\frac{1}{3}\Delta H_{f}^{0}({\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{3}}) < \Delta {{\mu }_{{\text{O}}}} < 0.$Рассчитанное значение энтальпии образования $\Delta H_{f}^{0}({\text{I}}{{{\text{n}}}_{2}}{{{\text{O}}}_{{\text{3}}}}),$ равное 10.93 эВ, близко к экспериментальному – 9.58 эВ [19].
Вероятность образования вакансий выражается через энергию их образования, которая для нейтральной вакансии определяется как
(8)
${{E}^{f}} = {{E}_{{slab}}}({{V}_{{\text{O}}}}) - {{E}_{{slab}}}({\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{3}}) + \mu _{{\text{O}}}^{{{\text{I}}{{{\text{n}}}_{{\text{2}}}}{{{\text{O}}}_{3}}}},$Поверхность, на которой протекают процессы адсорбции, называется адсорбентом. Адсорбат – это любая частица (молекула, атом), которая адсорбирована на этой поверхности. Энергия адсорбции определяется следующим выражением:
где Eslab/adsorbate – полная энергия пластины с адсорбированной на ней частицей, Eslab – полная энергия пластины и последний член соответствует полной энергии адсорбата. Таким образом, если значение энергии Eads отрицательно, то в результате адсорбции на поверхности образуется устойчивая структура и процесс является экзотермическим, в противном случае – эндотермическим. Моделирование молекулярной адсорбции (с нормальной и параллельной ориентацией О2 по отношению к поверхности) проводится в предположении основного триплетного состояния $^{3}\sum _{g}^{ - }$ и равновесной длины связи, rO–O ≈ 1.21 Å [20].РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рассматривается влияние релаксации на поверхностные слои стехиометрической пластины, моделирующей поверхность нанокристалла оксида индия, и пластины с поверхностными кислородными вакансиями в различных зарядовых состояниях. Представлены энергии образования нейтральных кислородных вакансий на поверхности, энергии адсорбции на эти вакансии молекулы кислорода, расположенной перпендикулярно и параллельно поверхности. Обсуждается влияние адсорбции молекулы кислорода на электронную плотность состояний пластины.
Атомная структура и релаксация поверхности. При создании пластины из объемной суперячейки нарушается симметрия, вводится вакуумная область с обеих сторон пластины, и, следовательно, на поверхностные атомы будут действовать нескомпенсированные силы межатомного взаимодействия. Один из способов уменьшить действие этих сил – провести релаксацию нескольких поверхностных слоев моделируемой пластины, зафиксировав атомы остальных слоев, которые будут описывать конфигурацию внутри оксида индия.
Во всех расчетах два нижних слоя фиксируются в соответствии с объемной структурой оксида индия, в то время как верхние слои релаксируют вместе с адсорбатом. Пластина с кристаллографической плоскостью (011) неполярна, т.е. в ней отсутствует суммарный дипольный момент. Кроме того, сечение не меняет объемную стехиометрию кристалла, поэтому должны наблюдаться лишь незначительные смещения атомов при релаксации двух верхних слоев.
Действительно, после релаксации все анионы кислорода смещаются в положительном направлении оси аппликат, аналогично ведут себя катионы индия во втором слое (рис. 4). Самое значительное смещение происходит не более чем на 4% по сравнению с наименьшим размером ячейки, в которой рассматривается пластина.
Рис. 4.
Относительные положения катионов индия и анионов кислорода в двух верхних слоях пластины (011) до релаксации (светлые) и после релаксации (темные); сферы, имеющие больший размер, соответствуют кислороду, меньшие – индию.
Энергия образования кислородных вакансий на поверхности. Рассмотрим решетку типа In2O3, построенную из металлических ионов с зарядом 3+ и ионов кислорода с зарядом 2–. Ионам In3+ и О2– соответствует замкнутая электронная оболочка с нулевой валентностью. При удалении нейтрального атома кислорода с поверхности идеальной решетки оксида индия получается нейтральная кислородная вакансия $V_{{\text{O}}}^{0},$ т.е. пустой кислородный узел с локализованными около него двумя электронами. Похожим образом, удаляя анионы кислорода, можно получить заряженные вакансии в кристаллической решетке оксида индия $V_{{\text{O}}}^{ + }$ и $V_{{\text{O}}}^{{2 + }}.$ Здесь рассматривается поверхность In2O3 (011)-b, с которой в соответствии с вышеописанной процедурой удаляется атом кислорода из позиции O4 (см. рис. 2). Исходя из размеров суперячейки концентрация дефектов составляет 2.66 × 1020 см–3.
После релаксации модели с нейтральной вакансией наблюдается следующая картина: окружающие вакансию катионы отдаляются от места локализации вакансии не более чем на 2.7% по сравнению с наименьшим характерным размером ячейки, в которой рассматривается пластина. В то же время анионы кислорода приближаются к нейтральной вакансии не более чем на 3.1%. Подобная ситуация складывается и для заряженных вакансий кислорода. Действительно, для однократно заряженной вакансии $V_{{\text{O}}}^{ + }$ смещение анионов кислорода происходит на 3.4%, а катионов индия на 2.8%. Что касается вакансии $V_{{\text{O}}}^{{2 + }},$ то смещение анионов кислорода здесь немного больше по сравнению с предыдущими случаями и составляет 3.6%, а катионов индия – 3.7%.
Рассчитанные значения полных энергий стехиометрической пластины, релаксированной пластины с различными нейтральными дефектами и химического потенциала кислорода позволили получить с использованием выражения (1) вероятность образования вакансий. Нейтральные дефекты образовывались поочередным удалением кислорода из позиций O1–6 (см. рис. 2). Соответствующие значения представлены в табл. 1. Видно, что с наибольшей вероятностью образуется вакансия типа О4.
Таблица 1.
Энергия образования кислородных вакансий на поверхности оксида индия (011)
| Вакансия VO | О1 | О2 | О3 | О4 | О5 | О6 |
|---|---|---|---|---|---|---|
| Энергия образования, эВ | 8.42 | 7.77 | 7.77 | 5.37 | 8.62 | 8.59 |
Адсорбция молекулы кислорода на стехиометрической поверхности. Согласно теоретическим исследованиям, при адсорбции атома и молекулы кислорода стабильных структур стехиометрической поверхности с этими частицами не наблюдается ни на поверхности (111), ни на рассматриваемой нами поверхности (011) [9].
Адсорбция атома и молекулы кислорода на дефектной поверхности. Поскольку наиболее вероятным для образования является кислородная вакансия О4, рассмотрим адсорбцию атома кислорода именно на эту вакансию в различных зарядовых состояниях и молекулы кислорода на все типы нейтральных вакансий О1–6 (см. рис. 2). Соответствующая молекула или атом размещались на расстоянии порядка 2 Å над поверхностью и далее проводились процессы оптимизации системы “пластина + атом (молекула)” при фиксированных положениях атомов двух нижних слоев.
Поскольку при адсорбции возможна диссоциация молекулы, в расчетах необходимо учитывать еще и спиновую поляризацию, т.к. продукты диссоциации могут иметь суммарный спин, отличный от нуля. Спиновая поляризация также должна учитываться в атомах и молекулах с неспаренными электронами, в частности, для атома и для молекулы кислорода в основном (триплетном) электронном состоянии.
Наличие поверхностного дефекта способствует адсорбции и атомарного, и молекулярного кислорода. Мы исследовали три типа вакансий О4 с различным зарядом. Энергия адсорбции атома кислорода на кислородной вакансии дана в табл. 2.
Уменьшающееся значение энергии адсорбции атома кислорода с величиной заряда кислородной вакансии O4 можно объяснить тем, что нейтральная вакансия на поверхности кристалла образует две локальные свободные валентности, которые в силу кулоновского отталкивания никогда не встретятся. Тогда при адсорбции атом кислорода будет образовывать прочную связь с нейтральной вакансией, встраиваясь в решетку, что и подтверждают выполненные расчеты энергии адсорбции и нулевое значение полной намагниченности. Поскольку на вакансии $V_{{\text{O}}}^{ + }$ имеется одна локальная свободная валентность поверхности, при образовании связи с атомом кислорода на одной из его p-орбиталей неспаренным будет оставаться один электрон, поэтому и полная намагниченность, согласно расчетам, имеет величину, приблизительно равную единице – 0.9μB/ячейку. Для вакансии $V_{{\text{O}}}^{{2 + }}$ энергия, выделяющаяся при адсорбции, составляет –5.851 эВ, и, встраиваясь на место кислородной вакансии, атом меняет триплетное состояние на синглетное.
Расчет энергии адсорбции молекулы кислорода на нейтральных вакансиях показал значительное влияние исходной геометрии расположения молекулы кислорода (см. рис. 5) относительно поверхности оксида индия. Соответствующие значения приведены в табл. 3.
Рис. 5.
Конфигурация молекулы кислорода на нейтральной вакансии после адсорбции в зависимости от первоначальной геометрии относительно поверхности: а и б соответствуют молекуле до оптимизации, располагающейся параллельно поверхности над вакансией О4 (вид сбоку и сверху соответственно); в и г – молекуле, располагающейся до оптимизации перпендикулярно поверхности (в обоих случаях молекулы располагались на расстоянии 2 Å от самого верхнего атома поверхности).
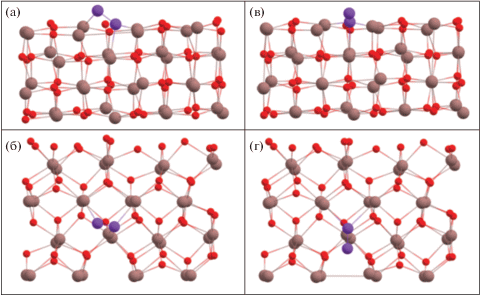
Таблица 3.
Энергии адсорбции Eads молекулы кислорода на нейтральных вакансиях VO, межатомное расстояние в адсорбированной молекуле rO–O, полный магнитный момент на ячейку Mtot и лёвдинские заряды q на атомах адсорбированной молекулы кислорода
| VO | Eads, эВ | rO–O, Å | Mtot, μB | q | Eads, эВ | rO–O, Å | Mtot, μB | q | ||
|---|---|---|---|---|---|---|---|---|---|---|
| горизонтальное | вертикальное | |||||||||
| О1 | –1.613 | 1.477 | –0.03 | –0.364 | –0.364 | –0.855 | 1.362 | 0.81 | –0.221 | –0.213 |
| О2 | –0.910 | 1.338 | 0.96 | –0.180 | –0.171 | –0.522 | 1.332 | 1.01 | –0.206 | –0.162 |
| О3 | –0.899 | 1.462 | 0.13 | –0.372 | –0.359 | –0.929 | 1.485 | 0.07 | –0.373 | –0.391 |
| О4 | –1.657 | 1.477 | 0.08 | –0.383 | –0.374 | –1.054 | 1.472 | –0.14 | –0.344 | –0.376 |
| О5 | –1.526 | 1.485 | 0.00 | –0.384 | –0.363 | –1.485 | 1.485 | 0.00 | –0.379 | –0.383 |
| О6 | –1.755 | 1.496 | 0.00 | –0.385 | –0.352 | –0.796 | 1.377 | 0.75 | –0.237 | –0.236 |
Очевидно, в результате адсорбции атома и молекулы кислорода на нейтральную вакансию происходит перераспределение электронной плотности с пластины оксида индия на кислородные формы. Это подтверждается изменением лёвдинских зарядов [21] на атомах адсорбата, а также изменением межатомного расстояния в адсорбированной молекуле кислорода, которое на различных кислородных вакансиях варьируется в пределах 1.332–1.496 Å. Это говорит о тенденции к образованию ионных форм молекулы кислорода ${\text{O}}_{{\text{2}}}^{ - }$ и ${\text{O}}_{{\text{2}}}^{{2 - }}$ с межатомным расстоянием порядка 1.33 и 1.49 Å соответственно [22]. Следовательно, в процессе адсорбции пластина действует в качестве донора электронов, а молекула кислорода ведет себя как акцептор, который и уменьшает поверхностную проводимость пластины.
Также в табл. 3 указаны полные магнитные моменты ячейки, при этом магнитный момент свободных атома и молекулы кислорода составляет 2μB.
Как известно, при расчетах в рамках теории функционала плотности с GGA или LDA возникает недооценка ширины запрещенной зоны. Действительно, рассчитанное нами фундаментальное значение ширины запрещенной зоны для пластины из четырех атомарных слоев с периодическими граничными условиями во всех трех направлениях системы координат составляет 1.18 эВ по сравнению с экспериментальным значением 2.7 эВ [23].
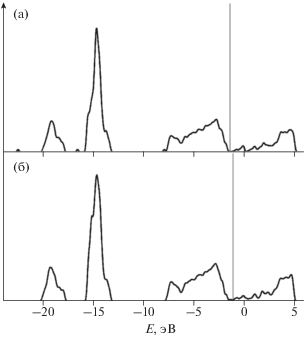
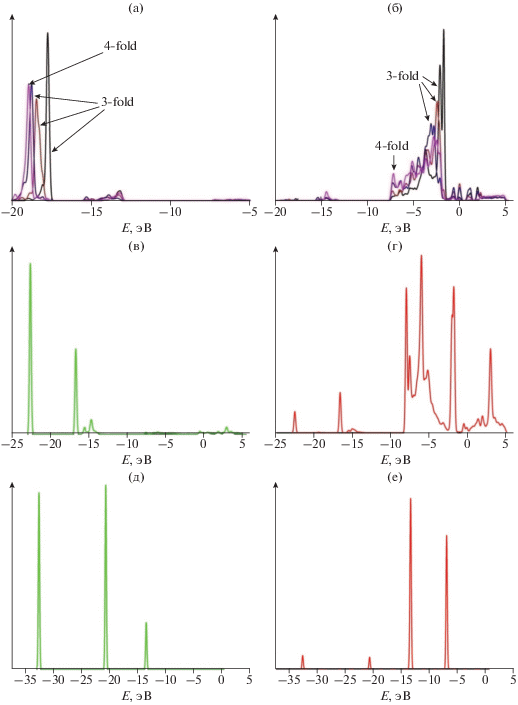
Электронная плотность состояний. Очевидно, значительный вклад в “вверх” валентной зоны дают p- и s-орбитали атомов индия, находящихся на поверхности пластины и имеющих в своем окружении три ближайших соседа. В частности, можно говорить о возможном смешивании этих орбиталей. Стоит отметить, что парциальные плотности d-орбиталей атома индия вносят вклад в общую электронную плотность глубоколежащих зон в области –15.6 и –13.0 эВ. Область пиков –20.18 и –17.6 эВ характеризуется возможной гибридизацией s-, p-орбиталей атома индия и s-орбиталей атома кислорода решетки (cм. рис. 6a, 6б). На рис. 7а возникают дополнительные небольшие пики по сравнению с полной плотностью электронных состояний пластины с нейтральной вакансией O4 (см. рис. 7б) в результате участия s- и p-орбиталей атома кислорода молекулы, адсорбирующейся из положения, перпендикулярного плоскости пластины, и находящейся над нейтральной вакансией O4 (см. рис. 6в, 6г). Кроме того, линейчатый спектр плотностей p-орбиталей атома кислорода свободной молекулы (рис. 6д, 6е) при адсорбции превращается в непрерывный и дает вклад как в валентную зону, так и в область дна зоны проводимости образца.
Рис. 6.
Парциальная плотность электронных состояний: a и б описывают вклады s- и p-орбиталей атомов кислорода с различными координационными числами в плотность состояний в стехиометрической пластине соответственно; в и г – парциальные электронные плотности s- и p-орбиталей атома, внедряющегося в пластину при адсорбции молекулы кислорода на нейтральную вакансию О4; д и е – парциальные электронные плотности s- и p-орбиталей атома в свободной молекуле кислорода соответственно.
ЗАКЛЮЧЕНИЕ
В рамках теории функционала плотности исследованы структурные и электронные свойства как стехиометрической, так и дефектной поверхности In2O3 (011). Рассчитаны энергии образования кислородных вакансий, согласно которым наиболее вероятным является образование вакансий О4. Проанализирована адсорбция атома кислорода в основном триплетном состоянии на вакансию О4 в различных зарядовых состояниях. Показано, что наибольшая энергия выделяется при адсорбции на вакансию $V_{{\text{O}}}^{{2 + }},$ причем атом кислорода, встраиваясь на место локализации вакансии, меняет триплетное состояние на синглетное.
Рассматривается ряд случаев с адсорбцией молекулы кислорода из различных геометрических конфигураций относительно плоскости пластины на нейтральные вакансии О1-6. Межъядерное расстояние в адсорбированной молекуле кислорода на различных кислородных вакансиях варьируется в пределах 1.332–1.496 Å, что говорит о тенденции к образованию ионных форм молекулы кислорода ${\text{O}}_{2}^{ - }$ и ${\text{O}}_{2}^{{2 - }}.$ Можно заключить, что в процессе адсорбции пластина действует в качестве донора электронов, а молекула кислорода ведет себя как электронный акцептор, который и уменьшает поверхностную проводимость пластины. Увеличение межъядерного расстояния в адсорбированной молекуле кислорода указывает на тенденцию к диссоциативной хемосорбции.
Список литературы
Chen P., Yin X., Que M., Liu X., Que W. Low Temperature Solution Processed Indium Oxide Thin Films with Reliable Photoelectrochemical Stability for Efficient and Stable Planar Perovskite Solar Cells // J. Mater. Chem. A. 2017. V. 5. P. 9641–9648.
Baratto C., Ferroni M., Faglia G., Sberveglieri G. Iron-Doped Indium Oxide by Modified RGTO Deposition for Ozone Sensing // Sens. Actuators, B. 2006. V. 118. № 1–2. P. 221–225.
Yamaura H., Jinkawa T., Tamaki J., Moriya K., Miura N., Yamazoe N. Indium Oxide Based Gas Sensor for Selective Detection of CO // Sens. Actuators, B. 1996. V. 36. № 1–3. P. 325–332.
Golan G., Axelevitch A., Gorenstein B., Peled A. Novel Type of Indium Oxide Thin Films Sputtering for Opto-Electronic Applications // Appl. Surf. Sci. 2007. V. 253. № 15. P. 6608–6611.
Fang Z., Assaaoudi H., Guthrie R.I.L., Kozinski J.A., Butler I.S. Continuous Synthesis of Tin and Indium Oxide Nanoparticles in Sub- and Supercritical Water // J. Am. Ceram. Soc. 2007. V. 90. № 8. P. 2367–2371.
Marezio M. Refinement of the Crystal Structure of In2O3 at Two Wavelengths // Acta Crystallogr. 1966. V. 20. № 6. P. 723–728.
Hao Y., Meng G., Ye C., Zhang L. Controlled Synthesis of In2O3 Octahedrons and Nanowires // Cryst. Growth Design. 2005. V. 5. № 4. P. 1617–1621.
hi M., Xu F., Yu K., Zhu Z., Fang J. Controllable Synthesis of In2O3 Nanocubes, Truncated Nanocubes, and Symmetric Multipods // J. Phys. Chem. C. 2007. V. 111. № 44. P. 16267–16271
Agoston P., Albe K. Thermodynamic Stability, Stoichiometry, and Electronic Structure of bcc-In2O3 Surfaces // Phys. Rev. B. 2011. V. 84. P. 045311.
Walsh A., Catlow C.R.A. Structure, Stability and Work Functions of the Low Index Surfaces of Pure Indium Oxide and Sn-Doped Indium Oxide (ITO) from Density Functional Theory // J. Mater. Chem. 2010. V. 20. № 46. P. 10438–10444.
Zhou C., Li J., Chen S., Wu J., Heier K.R., Cheng H. First-Principles Study on Water and Oxygen Adsorption on Surfaces of Indium Oxide and Indium Tin Oxide Nanoparticles // J. Phys. Chem. C. 2008. V. 112. № 36. P. 14015–14020.
Inerbaev T., Sahara R., Mizuseki H., Kawazoe Y., Nakamura T. Theoretical Modeling of Oxygen and Water Adsorption on Indium Oxide (111) Surface // ACS Symp. Ser. 2015. V. 1196. P. 137–149.
Tasker P.W. The Stability of Ionic Crystal Surfaces // J. Phys. C: Solid State Phys. 1979. V. 12. № 22. P. 4977–4984.
Giannozzi P., Baroni S., Bonini N., Calandra M., Car R., Cavazzoni C., Ceresoli D., Chiarotti G.L., Cococcioni M., Dabo I., Dal Corso A., Fabris S., Fratesi G., de Gironcoli S., Gebauer R., Gerstmann U., Gougoussis C., Kokalj A., Lazzeri M., Martin-Samos L., Marzari N., Mauri F., Mazzarello R., Paolini S., Pasquarello A., Paulatto L., Sbraccia C., Scandolo S., Sclauzero G., Seitsonen A. P., Smogunov A., Umari P., Wentzcovitch R.M. QUANTUM ESPRESSO: A Modular and Open-Source Software Project for Quantum Simulations of Materials // J. Phys.: Condens. Matter. 2009. V. 21. P. 395502. http://arxiv.org/abs/0906.2569
Kresse G., Joubert D. From Ultrasoft Pseudopotentials to the Projector Augmented-Wave Method // Phys. Rev. B. 1999. V. 59. P. 1758–1775.
Perdew P., Burke K., Ernzerhof M. Generalized Gradient Approximation Made Simple // Phys. Rev. Lett. 1996. V. 77. P. 3865–3868.
Monkhorst H.J., Pack J.D. Special Points for Brillouin-Zone Integrations // Phys. Rev. B: Solid State. 1976. V. 13. P. 5188–5192.
Smith J.F., Schneider V.L. Anisotropic thermal expansion of indium // J. Less-Common Mets. 1964. V. 7. № 1. P. 17–22.
Cordfunke E.H.P., Konings R.J.M., Ouweltjes W. The Standard Enthalpy of Formation of In2O3 // J. Chem. Thermodyn. 1991. V. 23. № 5. P. 451–454.
Huber K.P., Herzberg G. Molecular Spectra and Molecular Structure. V. 4. N.Y.: Van Nostrand, 1979. 716 p.
Löwdin P.O. On the Non-Orthogonality Problem // Adv. Quantum Chem. 1970. V. 5. P. 185–199.
Che M., Tench A.J. Characterization and Reactivity of Molecular-Oxygen Species on Oxide Surfaces // Adv. Catal. 1983. V. 32. P. 1–148.
Bourlange A., Payne D.J., Egdell R.G., Foord J.S., Edwards P.P., Jones M.O., Schertel A., Dobson P.J., Hutchison J.L. Growth of In2O3(100) on Y-stabilized ZrO2(100) by O-plasma Assisted Molecular Beam Epitaxy // Appl. Phys. Lett. 2008. V. 92. № 9. P. 092117–092120.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы