Неорганические материалы, 2020, T. 56, № 2, стр. 145-150
Фазовые равновесия в системе LiCl–LiVO3–V2O5
Б. Ю. Гаматаева 1, *, С. Н. Курбанова 1, А. М. Гасаналиев 1, Т. Ш. Гаматаев 1, Д. З. Маглаев 2, З. И. Салпагарова 3
1 Дагестанский государственный педагогический университет
367003 Махачкала, ул. Яракского, 57, Россия
2 Грозненский государственный нефтяной технический университет
364051 Грозный, пр. им. Х.А. Исаева, 100, Россия
3 Карачаево-черкесский государственный университет
369202 Карачаевск, ул. Ленина, 29, Россия
* E-mail: gamataeva.bariyat@mail.ru
Поступила в редакцию 09.07.2018
После доработки 16.04.2019
Принята к публикации 22.05.2019
Аннотация
Методами дифференциального термического, визуально-политермического и синхронного термического анализов впервые исследованы Т–х-диаграммы двух- (LiCl–V2O5) и трехкомпонентной (LiCl–LiVO3–V2O5) систем. Определены характеристики нонвариантных точек эвтектического и перитектического характера, построены диаграммы состояния систем.
ВВЕДЕНИЕ
Важной задачей для современной техники является получение новых неорганических материалов, в том числе моно- и полищелочных оксидных ванадиевых бронз. В решении этой проблемы большое значение имеют фазовые диаграммы, которые помогают в поиске расплавов с оптимальными физико-химическими свойствами для термо- и электрохимических синтезов [1].
Исследование физико-химических свойств ванадиевых бронз позволило не только определить химическую природу данного класса соединений, но также найти возможные области их практического использования. Ванадиевые бронзы могут образовываться в процессе приготовления контактной массы на основе V2O5 и солей щелочных металлов, которые нашли применение в качестве катализаторов окисления, как полупроводниковый материал для термисторов, переключателей, элементов памяти, дисплеев и т.д. [2].
Целью данной работы является исследование процессов фазообразования при кристаллизации из расплавов и в твердом состоянии в двух- (LiCl–V2O5) и трехкомпонентной (LiCl–LiVO3–V2O5) системах с помощью методов термического анализа и построение их Т–х-диаграмм.
Треугольник составов исследуемой трехкомпонентной системы LiCl–LiVO3–V2O5 включает в себя три двухкомпонентные системы. Характеристики нонвариантных точек (НВТ) этих систем представлены в табл. 1, из которой видно, что исследованные бинарные системы LiCl–LiVO3 [3], LiVO3–V2O5 [1, 2] характеризуются эвтектическим и перитектическим типами фазовых равновесий.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальные исследования проводили методами визуально-политермического и дифференциального термического анализов на установках в стандартном исполнении [4]. Найденные нонвариантные составы подтверждали методом синхронного термического анализа. Рентгенофазовый анализ (РФА) исходных солей и образующихся соединений проводили на дифрактометре ДРОН-2,0 (излучение СuKα, λ = 0.154 нм, никелевый фильтр) [5]. Образцы для РФА отжигали при температуре 150°С в течение 60 ч с последующей закалкой. Идентификацию фазовых составов проводили по таблицам Гиллера [6] и картотеке АSТМ [7]. Точность рентгенофазовых исследований 0.1 мас. %.
Исходные вещества LiCl (“ч. д. а.”), LiVO3 (“х. ч.”), V2O5 (“х. ч.”) были предварительно обезвожены при температурах 300–350°С. Температуры плавления соответствовали справочным данным [8]. Исследования проводили в стандартных платиновых тиглях. Индифферентным веществом являлся свежепрокаленный Al2O3 квалификации “х. ч.”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Система LiCl–V2O5. По данным термического анализа выявлено, что, согласно температурам первичной кристаллизации (рис. 1), ликвидус представлен следующими 9 отрезками: LiCl–е1, е1–р1, р1–D1, D1–е2, е2–D2, D2–е3, е3–р2, р2–р3, р3–V2O5. Они пересекаются в восьми НВТ с температурами плавления 504–650°C, образующих линии вторичной кристаллизации и солидус, из которых три эвтектики, три перитектики и две дистектики (табл. 2), что обусловлено образованием пяти новых фаз, составы и температуры которых отражены на Т–х-диаграмме (рис. 1). Новыми фазами, продуктами твердофазного взаимодействия компонентов при температурах 500–640°С, являются бинарные конгруэнтно- (2LiCl ∙ V2O5 (D1); LiCl ∙ V2O5 (D2)) и инконгруэнтно-плавящиеся (3LiCl ∙ V2O5 (S1); 2LiCl ∙ 3V2O5 (S2); LiCl ∙ 3V2O5 (S3)) соединения, представляющие собой оксидно-солевые комплексы (рис. 1, табл. 2). Идентификация всех новых фаз проведена с помощью РФА.
Рис. 1.
Т–х-диаграмма системы LiCl–V2O5: e, p и D – двойные эвтектика, перитектика и дистектика; S1–3 – бинарные инконгруэнтно-плавящиеся соединения.
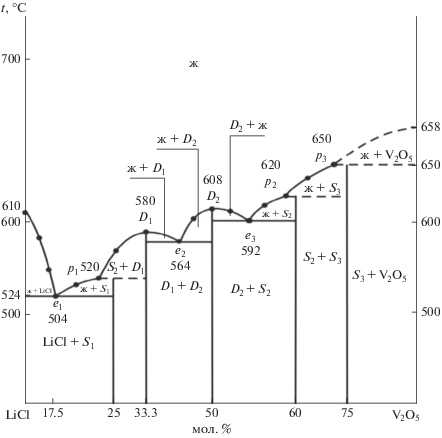
Таблица 2.
Характеристики НВТ системы LiCl–V2O5
| Обозначение | tпл, oC | LiCl, мол. % | Кристаллизующиеся фазы |
|---|---|---|---|
| е1 | 504 | 17.5 | LiCl + S1 |
| е2 | 564 | 37.5 | D1 + D2 |
| е3 | 592 | 47.5 | D2 + S2 |
| р1 | 520 | 22.5 | S1 + D1 |
| р2 | 620 | 60.0 | S2 + S3 |
| р3 | 650 | 70.0 | S3 + V2O5 |
| D1 | 580 | 32.5 | 2LiCl ∙ V2O5 |
| D2 | 608 | 45.0 | LiCl ∙ V2O5 |
Система LiCl–LiVO3–V2O5. Термический анализ фазовых равновесий в системе проведен при изучении составов, расположенных на одиннадцати внутренних разрезах (рис. 2). По данным температур первичной кристаллизации выявлены составы и температуры точек, соответствующих их пересечению с моновариантными линиями (вторичной кристаллизации), ограничивающими поверхности ликвидуса системы (табл. 3, рис. 2). На сложность топологии Т–х-диаграммы системы влияют новые бинарные и тройные соединения, образующиеся при твердофазном взаимодействии исходных компонентов (табл. 1–4, рис. 1, 2).
Рис. 2.
Проекция поверхности кристаллизации системы LiCl–LiVO3–V2O5 на треугольник составов: e и p – двойные эвтектика и перитектика, Е и Р – тройные эвтектика и перитектика, D, S1–4 и S5 – бинарные, тройные конгруэнтно- и инконгруэнтно-плавящиеся соединения.
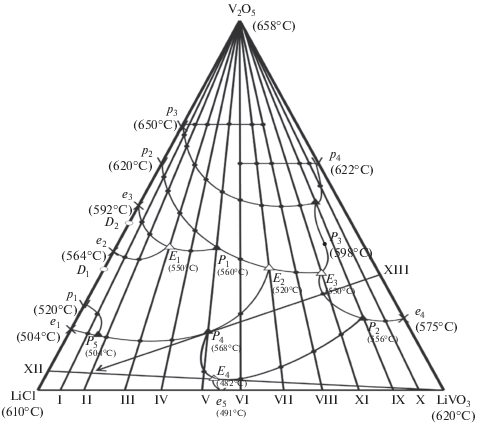
Таблица 3.
Характеристика точек пересечений внутренних разрезов системы LiCl–LiVO3–V2O5
| Разрез | Состав исходной двухкомпонентной смеси, мол. % | Третий компонент, мол. % | tпл,oC | Кристаллизующиеся фазы |
|---|---|---|---|---|
| I | 5LiVO3 + 95LiCl | 17.5 V2O5 | 504 | LiCl + S1 |
| 20 V2O5 | 510 | S1 + D1 | ||
| 37.5 V2O5 | 564 | D1 + D2 | ||
| 42.5 V2O5 | 575 | D2 + S2 | ||
| 65 V2O5 | 632 | S2 + S3 + V2O5 | ||
| 70 V2O5 | 638 | S3 + V2O5 | ||
| II | 10LiVO3 + 90LiCl | 20 V2O5 | 508 | LiCl + D1 |
| 40 V2O5 | 578 | D1 + D2 | ||
| 55 V2O5 | 608 | D2 + S2 | ||
| 67 V2O5 | 620 | S2 + S3 | ||
| 70 V2O5 | 632 | S3 + V2O5 | ||
| III | 20LiVO3 + 80LiCl | 17 V2O5 | 520 | LiCl + D1 |
| 35 V2O5 | 550 | D1 + D2 + S2 | ||
| 50 V2O5 | 594 | S2 + S3 | ||
| 60 V2O5 | 602 | S3 + α-V2O5 | ||
| 70 V2O5 | 632 | S3 + V2O5 | ||
| IV | 30LiVO3 + 70LiCl | 20 V2O5 | 562 | LiCl + D1 |
| 35 V2O5 | 556 | D1 + S2 | ||
| 45 V2O5 | 588 | S2 + S3 | ||
| 55 V2O5 | 594 | S3 + V2O5 | ||
| V | 40LiVO3 + 60LiCl | .5 V2O5 | 510 | LiCl + S5 |
| 20 V2O5 | 568 | LiCl + S5 + D1 | ||
| 35 V2O5 | 560 | D1 + S2 + S3 | ||
| 52 V2O5 | 576 | S3 + V2O5 | ||
| 70 V2O5 | 632 | α-V2O5 | ||
| VI | 50LiVO3 + 50LiCl | 20 V2O5 | 564 | S5 + LiVO3 |
| 30 V2O5 | 550 | S5 + D1 | ||
| 50 V2O5 | 584 | D1 + S3 | ||
| 60 V2O5 | 602 | S3 + β-V2O5 | ||
| VII | 60LiVO3 + 40LiCl | 10 V2O5 | 574 | S5 + LiVO3 |
| 30 V2O5 | 520 | S5 + D1 + S3 | ||
| 45 V2O5 | 545 | S2 + S3 | ||
| 60 V2O5 | 576 | S3 + β-V2O5 | ||
| 70 V2O5 | 597 | α-V2O5 | ||
| VIII | 70LiVO3 + 30LiCl | 10 V2O5 | 554 | LiVO3 + S5 |
| 27 V2O5 | 530 | S5 + S3 | ||
| 47 V2O5 | 566 | S3 + β-V2O5 | ||
| 60 V2O5 | 584 | β-V2O5 | ||
| 70 V2O5 | 602 | α-V2O5 | ||
| IX | 20LiCl + 80LiVO3 | 20 V2O5 | 556 | LiVO3 + S5 |
| 43 V2O5 | 598 | S3 + S4 + S5 | ||
| 60 V2O5 | 620 | S3 + S4 | ||
| 70 V2O5 | 631 | β-V2O5 | ||
| X | 10LiCl + 90LiVO3 | 20 V2O5 | 560 | LiVO3 + S4 |
| 47 V2O5 | 590 | S4 + β-V2O5 | ||
| 60 V2O5 | 620 | β-V2O5 | ||
| XI | 25LiCl + 75LiVO3 | 23 V2O5 | 566 | LiVO3 + S5 |
| 35 V2O5 | 600 | S5 + S4 + S3 | ||
| 45 V2O5 | 598 | S4 + S3 | ||
| XII | 5V2O5 + 95LiCl | 43 LiVO3 | 482 | LiCl + LiVO3 + S5 |
| XIII | 30V2O5 + 70LiVO3 | 23 LiCl | 550 | S5 + S4 |
| 51 LiCl | 538 | S5 + LiCl + D1 |
Таблица 4.
Характеристики НВТ системы LiCl–LiVO3–V2O5
| Обозначение | Характер плавления |
tпл, °С | Состав, мол. % | Кристаллизующиеся фазы |
||
|---|---|---|---|---|---|---|
| LiCl | LiVO3 | V2O5 | ||||
| E1 | Эвтектика | 550 | 51 | 13 | 36 | D1 + D2 + S2 |
| E2 | Эвтектика | 520 | 27 | 43 | 30 | S5 + S3 + D1 |
| E3 | Эвтектика | 530 | 25 | 46 | 29 | S5 + S4 + S3 |
| E4 | Эвтектика | 482 | 54 | 43 | 3 | LiCl + LiVO3 + S5 |
| P1 | Перитектика | 560 | 38 | 26 | 36 | D1 + S2 + S3 |
| P2 | Перитектика | 556 | 16 | 63 | 21 | LiVO3 + S4 + S5 |
| P3 | Перитектика | 698 | 12 | 46 | 42 | S4 + S3 + V2O5 |
| P4 | Перитектика | 568 | 46 | 34 | 20 | LiCl + S5 + D1 |
| P5 | Перитектика | 510 | 54 | 28 | 18 | LiCl + S1 + D1 |
ЗАКЛЮЧЕНИЕ
Поверхность ликвидуса системы LiCl–LiVO3–V2O5, т.е. процессы первичного фазообразования, характеризуется десятью полями кристаллизации, которые принадлежат трем исходным компонентам, шести бинарным (D1, D2, S1–S3, S4–2LiVO3 ∙ 3V2O5) и одному тройному (S5–LiCl ∙ ∙ 3LiVO3 ∙ V2O5, или Li4V5ClO14) соединениям (рис. 2). Состав тройного соединения выявлен методом Скрейнемакерса [9]. Линии вторичной кристаллизации соединяются в девяти НВТ, формирующих солидус системы, из которых четыре эвтектического и пять перитектического характера плавления (табл. 4).
Из расплавов данной системы при термо- и электрохимическом осаждении образуются литий-ванадиевые бронзы:
При электролизе расплавов бронза выделяется на катоде, а на аноде – хлор и кислород. Количественный состав и свойства бронзы регулируются соотношением исходных компонентов. При этом формирование новых нестехиометрических фаз типа бронз, являющихся твердыми растворами внедрения (в данном случае ионов лития) в структуру V2O5, происходит в областях кристаллизации инконгруэнтно-плавящихся соединений S1–S5 (рис. 1, 2, табл. 1–4) в температурном интервале 510–698°С.
Список литературы
Спицын В.И. Оксидные бронзы. М.: Наука, 1982. 192 с.
Фотиев А.А., Иванкин А.А. Ванадиевые соединения щелочных металлов и условия их образования. Свердловск: УрО АН СССР, 1970. Вып. 19. 153 с.
Гаркушин И.К., Губанова Т.В., Фролов Е.И. Фазовые равновесия с участием солей лития. Екатеринбург: УрО РАН, 2010. 121 с.
Егунов В.П. Введение в термический анализ. Самара: ПО “СамВен”, 1996. 270 с.
Трунов В.К., Ковба Л.М. Рентгенофазовый анализ. М.: Изд-во МГУ, 1976. 232 с.
Гиллер Р.А. Таблицы межплоскостных расстояний. М.: Недра, 1966. Т. 2. 362 с.
Index Pauder Difrection Fili, ASTM. N.Y., Pennsilvania, 1975.
Термические константы веществ. Справочник / Под ред. Глушко В.П. М.: ВИНИТИ, 1981. Вып. Х. Ч. 1. 300 с.
Скрейнемакерс Ф.А. Нонвариантные, моновариантные и дивариантные равновесия. М.: ИЛ, 1948. 215 с.
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы


