Неорганические материалы, 2020, T. 56, № 4, стр. 385-392
Синтез гетероструктур на основе Cu2O и их фотокаталитические свойства в реакции разложения воды
Д. С. Зимбовский 1, А. Н. Баранов 1, *
1 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
* E-mail: anb@inorg.chem.msu.ru
Поступила в редакцию 26.07.2019
После доработки 15.11.2019
Принята к публикации 19.11.2019
Аннотация
Исследована фотокаталитическая активность слоев Cu2O на проводящих подложках (медной фольге и FTO) в процессе разложения воды. Для получения слоя оксида меди(I) на медной фольге использовали анодное и химическое окисление фольги до гидроксида меди(II) с последующим термическим восстановлением, а также гидротермальное окисление медной фольги непосредственно до Cu2O в щелочном растворе. Структуру Cu2O/FTO получали электроосаждением слоя Cu2O из медно-лактатного раствора на подложки FTO. Фазовый состав и морфология полученных фотокатализаторов определены методами РФА и РЭМ. Наибольшую фотокаталитическую активность продемонстрировал образец, полученный анодным окислением медной пластины: j = 1.6 мА/см2, η = 2.0%. На основании полученных данных определены критерии, оказывающие влияние на фотокаталитическую активность образцов.
ВВЕДЕНИЕ
Гетероструктуры на основе Cu2O в последнее время привлекают интерес в качестве материала для фотокаталитического разложения воды. Процесс фоторазложения воды можно разбить на несколько этапов. Сначала полупроводник (в нашем случае Cu2O) поглощает квант света, в результате чего в нем происходит генерация электрон-дырочной пары. Далее происходят разделение носителей заряда и их миграция к поверхности полупроводника, где они вступают во взаимодействие с адсорбированными молекулами воды [1, 2]. Процесс разложения воды, состоящий из двух окислительно-восстановительных полуреакций, изображен на рис. 1 [3, 4].
Рис. 1.
Схема фотокаталитического процесса разложения воды (ЗП – зона проводимости, ВЗ – валентная зона) [3].

Исходя из предложенной схемы к материалам для фотокаталитического разложения воды предъявляется ряд требований [1]:
– эффективно поглощать падающее излучение,
– обладать оптимальной зонной структурой,
– в них должен осуществляться эффективный транспорт зарядов,
– обладать развитой поверхностью,
– быть стабильными в процессе фоторазложения воды,
– быть экологически безопасными и иметь низкую стоимость.
Оксид меди(I) соответствует большинству предъявляемых требований [5]. Он хорошо изучен, ширина запрещенной зоны составляет 2.2 эВ, что оптимально для поглощения и дальнейшего преобразования солнечной энергии в видимой области спектра солнечного света. Cu2O можно получать самыми разнообразными методами, кроме того, он является экологически безопасным и недорогим материалом. Основным недостатком данного материала является его деградация в процессе фотокатализа, так как потенциалы восстановления и окисления Cu2O до Cu и CuO соответственно расположены в пределах его запрещенной зоны [6–8]. Эта проблема может решаться путем нанесения дополнительных функциональных слоев, способных повышать эффективность разделения зарядов и увеличивать скорость целевой реакции (TiO2, Al:ZnO, RuOx, r-GO и т.д.) [7, 9].
Оксид меди(I) может выступать в качестве полупроводника p- или n-типа. Чаще всего проводимость p-типа Cu2O связывают с вакансиями меди, которые создают акцепторные уровни в запрещенной зоне полупроводника. Природа n-типа проводимости данного материала до сих пор является предметом дискуссий, существуют две основные версии: образование атомов меди в междоузлиях кристаллической решетки или дефекты замещения (CuO) [10]. Тип проводимости (p или n) пленок оксида меди(I) зависит от метода получения. Пленки n-типа получают в процессе электроосаждения из раствора ацетата меди с уксусной кислотой (или ацетатом натрия) при pH < 7.2 (в большинстве работ 4.9) [11] либо инверсией типа проводимости слоя p-Cu2O при электрохимической обработке в растворе ацетата меди и уксусной кислоты [12].
Описаны подходы к получению пленок p-Cu2O на медной фольге или осаждению пленок оксида меди(I) из растворов либо газовой фазы на прозрачные проводящие подложки типа FTO или ITO [13, 14]. Так, например, в работе [13] синтезированы образцы Cu2O/Cu, представляющие собой пористый слой оксида меди(I) на поверхности медной подложки. Данный композит демонстрирует самые высокие на сегодняшний день значения фототока –3.3 мА/см2 при –0.6 В (Ag/AgCl) для структур, состоящих из пленки оксида меди и подложки без нанесения дополнительных слоев.
Одной из важных проблем при сравнении активности фотокатализаторов является большое разнообразие в аппаратуре, в большинстве случаях собственного изготовления, применяемой при соответствующих измерениях. Используют различные источники освещения, электрохимические ячейки различной конфигурации, измерения проводят в различных условиях и т.д. Например, в работе [4] для источников освещения обозначена только электрическая мощность лампы, в этом случае непонятно, какая часть светового потока попадает на фотокатализатор. Таким образом, апробирование разных методов синтеза фотокатализаторов в одинаковых условиях и измерение их свойств обеспечивают наиболее объективное сравнение материалов, полученных разными способами.
В настоящей работе были использованы четыре метода синтеза гетероструктур Cu2O на проводящих подложках: окисление металлической меди (химическим, электрохимическим и гидротермальным способами) и осаждение из растворов на FTO – и в одинаковых условиях проведены измерения их фотокаталитической активности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
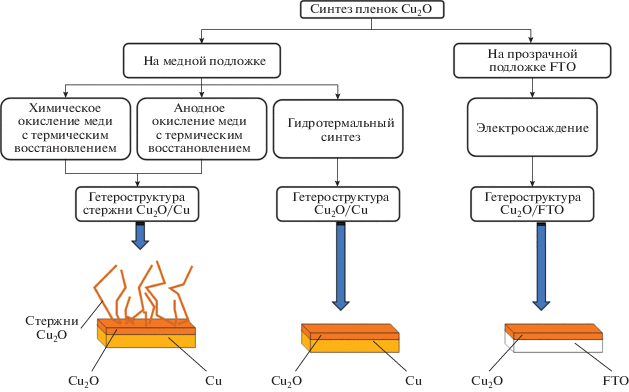
В данной работе все слои Cu2O были получены методами, которые можно разделить на две группы: получение фотокатализатора на медной подложке (анодное и химическое окисление медной фольги с последующим термическим восстановлением в инертной атмосфере, гидротермальная обработка медной подложки) и электроосаждение на прозрачную проводящую подложку FTO (рис. 2). Согласно данным [5, 15, 16], в аналогичных условиях образуются только пленки с p-типом проводимости.
В качестве подложек использовали медные пластины (марка М1, чистота 99.9%). Пластины предварительно очищали в УЗ-ванне в течение 5 мин последовательно в следующих растворах: смесь изопропилового спирта и ацетона (1 : 1), 10%-ный раствор соляной кислоты, дистиллированная вода.
Анодное окисление меди проводили при комнатной температуре с использованием двухэлектродной электрохимической ячейки. В качестве анода выступала медная пластина, катода – сетка из нержавеющей стали. Синтез осуществляли в 3 М растворе NaOH (“ч. д. а.”) в гальваностатическом режиме при плотности тока 5 мА/см2 в течение 7 мин. Химическое окисление медной пластины проводили в растворе 2.5 M NaOH (“ч. д. а.”) и 0.125 M (NH4)2S2O8 (“ч. д. а.”) в течение 30 мин. Дальнейшее термическое восстановление образцов вели с использованием трубчатой печи (NaberthemR 50/250/12) в инертной атмосфере (Ar) в течение 1 ч при температуре 500°С (подробное описание в работе [17]). Полученные образцы далее обозначаются индексами AO-TR (для образца, полученного анодным окислением с отжигом) и CO-TR (для образца, полученного химическим окислением с отжигом).
Гидротермальный синтез, как описано в работе [18], проводили в растворе NaOH (“ч. д. а.”) с концентрацией 0.3 моль/л (объем растворителя 35 мл) при температуре 180°С в течение 1 ч, степень заполнения ячейки составляла 70% (далее образец HT).
Для получения гетероструктур Cu2O/FTO в качестве подложек использовали стекла, покрытые слоем допированного фтором оксида олова, которые предварительно очищали с использованием ПАВ и УЗ-ванн в течение 10 мин в изопропиловом спирте и дистиллированной воде. Далее подложки помещали в раствор “пиранья” (10 мл 30%-ной H2O2 и 30 мл конц. H2SO4) на 10 мин, затем промывали в дистиллированной воде, сушили и облучали с помощью УФ-лампы. Электроосаждение проводили в трехэлектродной электрохимической ячейке. В качестве рабочего электрода выступала подложка FTO, противоэлектрода – титановая пластина, покрытая слоем платины, электрода сравнения – хлорсеребряный электрод (3.5 М KCl). Осаждение вели из раствора 0.4 М CuSO4 и 3 М молочной кислоты при pH 11, t = 45°С, в потенциостатическом режиме E = –0.4 В до значения величины плотности прошедшего заряда 1 Кл/см2 (далее образец ED).
Морфологию полученных образцов исследовали с использованием растрового электронного микроскопа (РЭМ) высокого разрешения Supra 50 VP (LEO) и на просвечивающем электронном микроскопе (ПЭМ) LEO 912ab.
Фазовый состав полученных гетероструктур определяли методом рентгеновской дифрактометрии с помощью рентгеновского дифрактометра с вращающимся анодом RigakuD/MAX 2500 (CuKα-излучение, λ = 1.54178 Å).
Фотокаталитическую активность определяли с использованием трехэлектродной ячейки, изображенной на рис. 3. В качестве рабочего электрода выступали полученные подложки, противоэлектрода – титановая пластина, покрытая слоем платины, электрода сравнения – хлорсеребряный электрод (3.5 М KCl). Электроды погружали в 0.5 М раствор Na2SO4, предварительно продутый током аргона в течение 30 мин. В качестве источника излучения использовали белый светодиод 6300 К мощностью 20 Вт с коллиматорной линзой. Мощность падающего на систему светового потока составила 1 солнце (100 мВт/см2) (калибровка с помощью стандартного кремниевого элемента Oriel PV Reference Cell System model 91150V). Фототок измеряли c разверткой потенциала от 0 до ‒0.6 В со скоростью 10 мВ/с в режиме прерывания света (2 с свет включен, 2 с выключен и т.д.). Прерывание светового потока позволяет получать ступенчатый график, где нижняя часть соответствует фототоку, протекающему по цепи при освещении светом, а верхняя часть – при его отсутствии (темновой ток). В качестве критериев эффективности фотокаталитической активности образцов использовали максимальное значение плотности фототока, протекающего в цепи под действием света j (мА/см2), и квантовую эффективность процесса η (%), рассчитываемую по формуле [2]
где I – плотность фототока (мА/см2), ERHE – внешнее приложенное напряжение (В) относительно водородного электрода, P – мощность излучения (мВт/см2).РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Используемые в данной работе способы синтеза гетероструктур являются относительно простыми и легко масштабируемыми, позволяют получать фотоэлектроды с различной морфологией поверхности и на разных подложках. Причем с помощью первой группы методов (рис. 2) можно получать пленки Cu2O непосредственно на медной фольге путем ее анодного или химического окисления, что позволяет достичь хорошего контакта на межфазной границе, тем самым снижая омические потери. В случае анодного и химического окисления фольги с последующим термическим восстановлением даже удается получить морфологически сложные структуры с более развитой поверхностью. К недостаткам данных методов можно отнести их двухстадийность: вторая стадия требует создания восстановительной атмосферы при термическом отжиге, что несколько осложняет процесс получения. Гидротермальная обработка медной фольги в щелочном растворе является простым одностадийным методом синтеза гетероструктур Cu2O/Cu, но получаемые пленки обладают гораздо менее развитой поверхностью по сравнению с двумя предыдущими способами. В отличие от всех предыдущих методов электроосаждением можно получать пленки оксида меди(I) на поверхности прозрачных проводящих подложек FTO, что позволяет фотокатализатору работать при облучении светом со всех направлений. Однако следует отметить более высокую стоимость этих подложек по сравнению с медными пластинами.
По результатам РФА (рис. 4), во всех случаях состав образующейся пленки соответствует кубической фазе Cu2O (JCPDS № 78-2076). На рентгенограммах также присутствуют пики от подложек – меди или FTO.
Согласно данным РЭМ и ПЭМ, предложенные методы синтеза пленок Cu2O позволяют получать гетероструктуры с различной морфологией и размерами кристаллитов (рис. 5). При анодном и химическом окислении меди с термическим восстановлением пленки (образцы AO-TR и CO-TR соответственно) представляют собой массив деформированных наностержней длиной L ~ 3–9 мкм, диаметром d ~ 200–400 нм (рис. 5а, 5б), обладающих поликристаллической структурой (рис. 5в). В случае химического окисления образуются структуры, представляющие собой сростки химически модифицированных наностержней. После гидротермальной обработки медной фольги в щелочном растворе (образец HT) поверхность подложки покрывает сплошная пленка, состоящая из кристаллитов со средним размером ~2 мкм (рис. 5г). Электроосаждение на подложку FTO позволяет получать прозрачные фотоэлектроды состава Cu2O/FTO (образец ED). Пленка, выращенная данным методом, представляет собой сплошной текстурированный по направлению к вертикали слой толщиной 2 мкм со средним размером кристаллитов ~20 нм (рис. 5д, 5е).
Рис. 5.
РЭМ-изображения поверхности образцов: AO-TR (а), CO-TR (б), HT (г), ED (д) и скола образца ED (е); в – ПЭМ-изображение стержня Cu2O.

Исходя из геометрических соображений была проведена оценка площади полученных фотоэлектродов: удельная площадь поверхности изменялась от ~25 (AO-TR) до 1 мм2 (ED) на 1 мм2 фотокатализатора.
Все полученные образцы демонстрировали хорошую фотокаталитическую активность в процессе разложения воды. Графики зависимости плотности фототока образцов от приложенного напряжения представлены на рис. 6. Полученные кривые плотности фототока имеют ступенчатый характер. Резкое падение тока (образование ступени) связано с облучением светом поверхности фотокатализатора и генерацией носителей заряда. Далее величина фототока выходит на постоянное значение и спустя 2 с свет прерывается, в результате чего происходит резкое уменьшение фототока с выходом на постоянное значение в течение 2 с (темновой ток). Катодное смещение величины фототока при облучении однозначно указывает на p-тип проводимости полученных материалов [19]. Максимальная плотность фототока для каждого фотокатализатора определяется при E = –0.6 В, т.к. при данном потенциале удается достичь наибольшего показателя фотоактивности без электрохимического разрушения светопоглощающего слоя. Активность фотоэлектродов увеличивается в ряду: ED (–0.4 мА/см2) < HT (–0.7 мА/см2) < CO-TR (–1.4 мА/см2) < AO-TR (–1.6 мА/см2) при EAg/AgCl = –0.6 В. Квантовые эффективности процессов, рассчитанные по формуле (1), составили 0.5, 0.9, 1.7 и 2.0% соответственно. Как видно из рис. 6, образец AO-TR демонстрирует один из самых высоких показателей плотности фототока для гетероструктур на основе пленок Cu2O без нанесения дополнительных функциональных слоев.
Рис. 6.
Зависимости плотности фототока от приложенного напряжения для образцов: AO-TR (а), CO-TR (б), HT (в), ED (г).

Различие в фотоэффективности полученных образцов связано с различными морфологией, площадью поверхности, материалами подложки и степенью кристалличности пленки. Высокая фотоактивность образца AO-TR объясняется тем, что пленка оксида представляет собой микростержни с небольшим диаметром и высокой удельной площадью. Так как генерируемые заряды в оксиде меди(I) имеют малую длину свободного пробега (менее 200 нм) [20], небольшая толщина стержней повышает вероятность достижения зарядами поверхности образца и в дальнейшем реализации электрохимического взаимодействия. Также высокое значение удельной площади данных образцов повышает количество активных центров на поверхности и позволяет эффективно поглощать падающее излучение. Уменьшение фототока для образца CO-TR по сравнению с AO-TR связано с образованием агрегатов стержней на поверхности, что уменьшает удельную площадь поверхности и снижает общую эффективность процесса выделения водорода. Образцы, полученные методом гидротермальной обработки и электроосаждения, также имеют относительно небольшую поверхность и демонстрируют более низкие величины фотокаталитической активности.
Вклад в величину фототока вносит и материал подложки фотоэлектрода. Медная фольга является хорошим проводником и позволяет эффективно отводить генерированные заряды от светопоглощающего слоя. Кроме того, свет, проникший через оксидный слой, отражается от поверхности подложки и далее может быть поглощен слоем Cu2O (в случае FTO большая часть квантов света проходит насквозь). Данный параметр коррелирует с полученными данными: наибольшей фотокаталитической активностью обладают образцы, полученные на медной подложке: AO-TR, CO-TR, HT.
На фотоактивность получаемых гетероструктур влияет также степень кристалличности образующейся пленки. Хорошо закристаллизованные образцы (рис. 4) получены термической обработкой (AO-TR и CO-TR) и гидротермальным синтезом (HT), в результате чего обладают меньшим количеством дефектов, что уменьшает вероятность захвата электронов и процесса электрон-дырочной рекомбинации и увеличивает эффективность данного фотокатализатора.
ЗАКЛЮЧЕНИЕ
В работе предложены и реализованы четыре подхода к созданию гетероструктур Cu2O на проводящих подложках: методами окисления металлической меди (химическим, электрохимическим и гидротермальным) и методом осаждения из растворов на FTO.
Все гетероструктуры Cu2O/Cu и Cu2O/FTO, синтезированные различными химическими методами, проявляют фотокаталитическую активность в электрохимической реакции разложения воды в пределах от 0.4 (ED) до 1.6 мА/см2 (AO-TR). Максимальная величина фотоактивности образца AO-TR (с эффективностью η = 2.0%) достигается за счет максимальной удельной площади фотокатализатора, оптимального соотношения размеров кристаллитов к длине свободного пробега электронов, высокой степени кристалличности и использования медной фольги в качестве подложки.
Список литературы
Karol R., Grätzel M. Photoelectrochemical Hydrogen Production. N.Y.: Springer, 2012. 321 p. https://doi.org/10.1007/978-1-4614-1380-6
Chen Z., Dinh H.N., Miller E. Photoelectrochemical Water Splitting – Standards, Experimental Methods, and Protocols. N.Y.: Springer, 2013. 130 p. https://doi.org/10.1007/978-1-4614-8298-7
Козлова Е.А., Пармон В.Н. Гетерогенные полупроводниковые фотокатализаторы процессов получения водорода из водных растворов доноров электронов // Успехи химии. 2017. Т. 86. № 9. С. 870–906. https://doi.org/10.1070/RCR4739
Fajrina N., Tahir M.A. Critical Review in Strategies to Improve Photocatalytic Water Splitting towards Hydrogen Production // Int. J. Hydrogen Energy. 2018. V. 44. № 2. P. 540–577. https://doi.org/10.1016/j.ijhydene.2018.10.200
Brandt I.S., Tumelero M.A., Pelegrini S., Zangari G., Pasa A.A. Electrodeposition of Cu2O: Growth, Properties, and Applications // J. Solid State Electrochem. 2017. V. 21. № 7. P. 1999–2020. https://doi.org/10.1007/s10008-017-3660-x
Zhou B., Liu Z., Wang H., Yang Y., Su W. Experimental Study on Photocatalytic Activity of Cu2O/Cu Nanocomposites under Visible Light // Catal. Lett. 2009. V. 132. № 1–2. P. 75–80. https://doi.org/10.1007/s10562-009-0063-3
Wick R., Tilley S.D. Photovoltaic and Photoelectrochemical Solar Energy Conversion with Cu2O // J. Phys. Chem. C. 2015. V. 119. № 47. P. 26243–26257. https://doi.org/10.1021/acs.jpcc.5b08397
Sullivan I., Zoellner B., Maggard P.A. Copper(I)-Based p-Type Oxides for Photoelectrochemical and Photovoltaic Solar Energy Conversion // Chem. Mater. 2016. V. 28. № 17. P. 5999–6016. https://doi.org/10.1021/acs.chemmater.6b00926
Momeni M.M., Ghayeb Y., Menati M. Fabrication, Characterization and Photoelectrochemical Properties of Cuprous Oxide-Reduced Graphene Oxide Photocatalysts for Hydrogen Generation // J. Mater. Sci. – Mater. Electron. 2018. V. 29. № 5. P. 4136–4146. https://doi.org/10.1007/s10854-017-8358-4
Han J., Chang J., Wei R., Ning X., Li J., Li Z., Guo H., Yang Y. Mechanistic Investigation on Tuning the Conductivity Type of Cuprous Oxide (Cu2O) Thin Films via Deposition Potential // Int. J. Hydrogen Energy. 2018. V. 43, № 30. P. 13764–13777. https://doi.org/10.1016/j.ijhydene.2018.02.121
Kalubowila K.D.R.N., Jayathileka K.M.D.C., Kumara L.S.R., Ohara K., Kohara S., Sakata O., Gune-wardene M.S., Jayasundara J.M.D.R., Dissanayake D.P., Jayanetti J.K.D.S. Effect of Bath pH on Electronic and Morphological Properties of Electrodeposited Cu2O Thin Films // J. Electrochem. Soc. 2019. V. 166. № 4. P. 113–119. https://doi.org/10.1149/2.0551904jes
Liau L.C.K., Lin Y.C., Peng Y.J. Fabrication Pathways of p–n Cu2O Homojunction Films by Electrochemical Deposition Processing // J. Phys. Chem. C. 2013. V. 117. № 50. P. 26426–26431. https://doi.org/10.1021/jp405715c
Shahbazi P., Kiani A. Fabricated Cu2O Porous Foam Using Electrodeposition and Thermal Oxidation as a Photocatalyst under Visible Light toward Hydrogen Evolution from Water // Int. J. Hydrogen Energy. 2016. V. 41. № 39. P. 17247–17256. https://doi.org/10.1016/j.ijhydene.2016.07.080
Yang C., Tran P.D., Boix P.P., Bassi P.S., Yantara N., Wong L.H., Barber J. Engineering a Cu2O/NiO/ Cu2MoS4 Hybrid Photocathode for H2 Generation in Water // Nanoscale. 2014. V. 6. № 12. P. 6506–6510. https://doi.org/10.1039/C4NR00386A
Li C., Li Y., Delaunay J.J. A Novel Method to Synthesize Highly Photoactive Cu2O Microcrystalline Films for Use in Photoelectrochemical Cells // ACS Appl. Mater. Interfaces. 2014. V. 6. № 1. P. 480–486. https://doi.org/10.1021/am404527q
Zimbovskii D.S., Baranov A.N. One-Step Hydrothermal Surface Oxidation of Copper Foil for Photocatalytic Water Splitting // IOP Conf. Ser. Mater. Sci. Eng. IOP Publishing. 2019. V. 525. P. 12018. https://doi.org/10.1088/1757-899X/525/1/012018
Зимбовский Д.С., Чурагулов Б.Р. Пленки Cu2O и CuO, полученные химическим и анодным окислением на поверхности медной фольги // Неорган. материалы. 2018. Т. 54. № 7. С. 694–702. https://doi.org/10.7868/S0002337X18070072
Зимбовский Д.С., Чурагулов Б.Р., Баранов А.Н. Гидротермальный синтез пленок Cu2O на поверхности металлической меди в растворе NaOH // Неорган. материалы. 2019. Т. 55. № 6. С. 623–627. https://doi.org/10.1134/S0002337X19060174
Tawfik W.Z., Hassan M.A., Johar M.A., Ryu S.W., Lee J.K. Highly Conversion Efficiency of Solar Water Splitting over p-Cu2O/ZnO Photocatalyst Grown on a Metallic Substrate // J. Catal. 2019. V. 374. P. 276–283. https://doi.org/10.1016/j.jcat.2019.04.045
Luo J., Steier L., Son M.K., Schreier M., Mayer M.T., Grätzel M. Cu2O Nanowire Photocathodes for Efficient and Durable Solar Water Splitting // Nano Lett. 2016. V. 16. № 3. P. 1848–1857. https://doi.org/10.1021/acs.nanolett.5b04929
Дополнительные материалы отсутствуют.
Инструменты
Неорганические материалы